6.4 : 열의 수량화
열 에너지
현미경으로, 열 에너지는 원자와 분자의 임의의 움직임과 관련된 운동 에너지입니다. 온도는 열 에너지의 양에 따라 달라 지는 "뜨거운" 또는 "감기"의 정량적 척도입니다. 물체의 원자와 분자가 빠르게 이동하거나 진동할 때, 그들은 더 높은 평균 운동 에너지 (KE) (또는 더 높은 열 에너지를) 가지고, 개체는 "뜨거운"으로 인식, 또는 더 높은 온도에있는 것으로 설명된다. 원자와 분자가 느리게 움직일 때, 그들은 더 낮은 평균 KE (또는 낮은 열 에너지를 가지고), 개체는 "감기"로 인식된다, 또는 낮은 온도에있는 것으로 설명된다.
화학 반응이나 위상 변화(예: 용융 또는 기화)가 발생하지 않는다고 가정하면, 물질 샘플에서 열 에너지의 양을 늘리면 온도가 상승하는 동시에 물질 샘플에서 열 에너지의 양을 줄이면 온도가 저하됩니다.
열
열(q)은다른 온도에서 두 몸 사이의 열 에너지의 전송이다. 열 흐름은 한 신체의 열 에너지를 증가시키고 다른 신체의 열 에너지를 감소시킵니다. 열은 뜨겁고 차가운 것(즉, 한 방향만)으로 자발적으로 흐르며 두 물질이 동일한 온도에 들 때까지 계속됩니다. 열의 변화는 온도 변화를 통해 측정됩니다.
열, 작업 및 에너지의 SI 단위는 줄입니다. 줄(J)은 1뉴턴의 힘이 물체를 1미터 움직일 때 사용되는 에너지의 양으로 정의된다. 그것은 영국의 물리학자 제임스 프레스콧 줄의 명예에 지명된다. 1개의 줄은 1kg m2/s2에해당하며, 이는 뉴턴 미터라고도 합니다. 1킬로줄(kJ)은 1000줄입니다. 그 정의를 표준화하기 위해, 하나의 칼로리는 4.184 줄과 동일하게 설정되었습니다.
열 에너지 전송
물질의 본체의열용량(C)은열량(q)이 1도 C(또는 이에 상응하는 1켈빈)의 온도 변화(ΔT)를경험할 때 흡수 또는 방출된다:
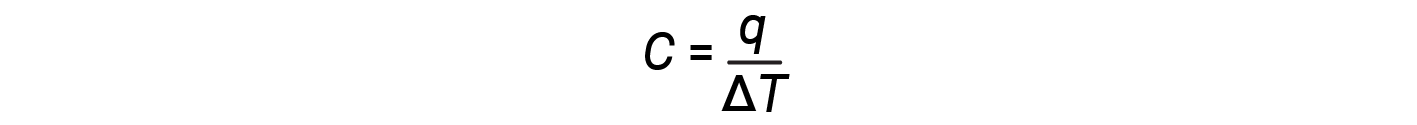
열 용량은 열을 흡수하거나 방출하는 물질의 유형과 양 모두에 의해 결정됩니다. 따라서 열 용량은 광범위한 특성입니다 - 그 값은 물질의 양에 비례합니다. 예를 들어, 두 주철 프라이팬의 열 용량을 고려한다. 큰 팬의 열 용량은 모두 동일한 재료로 만들어졌지만 큰 팬의 질량이 작은 팬의 질량보다 5 배 더 크기 때문에 작은 팬의 열 용량보다 5 배 더 큽니다. 질량이 많을수록 더 큰 팬에 더 많은 원자가 존재하므로 모든 원자가 더 빨리 진동할 수 있도록 더 많은 에너지가 필요합니다. 작은 주철 프라이팬의 열 용량은 팬의 온도를 50.0 °C (ΔT)로높이기 위해 18,140 J의 에너지(q)가필요하다는 것을 관찰함으로써 발견됩니다.

더 큰 주철 프라이팬은 동일한 물질로 만들어졌지만 온도를 50.0 °C (ΔT)까지높이기 위해 90,700 J의 에너지(q)가필요합니다. 더 큰 팬은 (비례적으로) 더 큰 열 용량을 가지는데, 이는 더 큰 양의 재료가 동일한 온도 변화를 산출하기 위해 (비례적으로) 더 많은 양의 에너지를 필요로 하기 때문입니다.

일반적으로 "특정 열"이라고 불리는 물질의 특정 열 용량(c)은1 섭씨 (또는 1 켈빈)에 의해 물질의 1 그램의 온도를 높이는 데 필요한 열의 양입니다.

특정 열 용량은 열을 흡수하거나 방출하는 물질의 종류에 만 의존합니다. 그것은 집약적 인 속성입니다 - 그래서 물질의 양에 의존하지 않습니다. 예를 들어, 작은 주철 프라이팬은 질량이 808g입니다. 철의 특정 열 (팬을 만드는 데 사용되는 재료)는 다음과 같은 것입니다.

큰 프라이팬은 4040g의 질량을 가지고 있습니다. 이 팬의 데이터를 사용하여 철의 특정 열을 계산할 수도 있습니다.

큰 팬은 작은 팬보다 더 거대하지만 둘 다 동일한 재료로 만들어졌기 때문에 특정 열 (건설 재료, 철재)에 대해 동일한 값을 산출합니다. 특정 열은 질량당 온도 단위로 측정되며 두 가지 광범위한 특성(열 및 질량)의 비율에서 파생되는 집중적인 특성입니다. 또한 집중적인 특성인 어금니 열 용량은 특정 물질의 두더지당 열 용량이며 J/mol⋅°C 단위를 가지고 있습니다.
물은 상대적으로 높은 특정 열(액체의 경우 약 4.2 J/g⋅°C, 고체의 경우 2.09 J/g⋅°C)를 가지고 있습니다. 대부분의 금속은 특정 열이 훨씬 낮습니다(일반적으로 J/g⋅°C 미만). 물질 및 특정열(c)의질량(m)을아는 것은 열이 얻어지거나 손실되기 전과 후에 온도 변화(ΔT)를측정하여 물질을 입력하거나 방치하여 열, q,입력 또는 물질의 양을 결정할 수 있습니다.
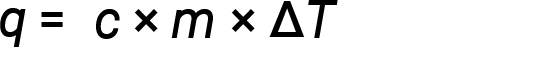
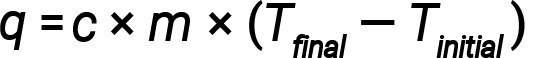
물질이 열 에너지를 얻는다면, 온도가 상승하면 최종 온도가 초기 온도보다 높으며 T최종 - T초기는 긍정적 인 값을 가지며 q의 값은 긍정적입니다. 물질이 열 에너지를 잃는 경우, 그 온도가 감소, 최종 온도는 초기 온도보다 낮은, T최종 - T초기는 음수 값을 가지고, Q의 값은 음수이다.
열, 특정 열, 질량 및 온도 변화 사이의 관계를 사용하여 다른 세 가지가 알려지거나 추론될 수 있는 경우 이러한 수량(열뿐만 아니라)을 결정할 수 있습니다.
이 텍스트는 OpenStax 화학 2e, 섹션 5.1에서 적응: 에너지 기본 및 OpenStax 화학 2e, 섹션 5.3: Enthalpy.
장에서 6:

Now Playing
6.4 : 열의 수량화
열화학
53.8K Views

6.1 : 에너지 기초
열화학
36.9K Views

6.2 : 열역학 제1법칙
열화학
31.4K Views

6.3 : 내부에너지
열화학
28.7K Views

6.5 : 일의 수량화
열화학
19.0K Views

6.6 : 엔탈피
열화학
34.7K Views

6.7 : 열화학 반응식
열화학
28.2K Views

6.8 : 일정 압력 열 계량법
열화학
84.6K Views

6.9 : 일정 부피 열 계량법
열화학
26.8K Views

6.10 : 헤스의 법칙
열화학
44.4K Views

6.11 : 표준 생성 엔탈피
열화학
41.0K Views

6.12 : 반응 엔탈피
열화학
31.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유