Brønsted-Lowry 산과 물 사이의 반응은 산 이온화라고합니다. 예를 들어, 수소 불소가 물에 용해되고 이온화되면 양성자는 수소 불소 분자에서 물 분자로 옮겨져 하이드로늄 이온과 불소 이온을 산출합니다.
종의 기본 이온화는 물 분자에서 양성자를 받아 들일 때 발생합니다. 아래 예에서, 피리딘 분자, C5NH5는물에 용해될 때 염기 이온화를 거쳐 수산화및 피리디늄 이온을 산출합니다.
선행 이온화 반응은 물이 (수소 불소와의 반응에서와 같이) 및 산 (암모니아와의 반응에서와 같이) 염기로 기능할 수 있음을 시사한다. 양성자를 기증하거나 받아들일 수 있는 종은 수륙양용, 또는 보다 일반적으로, amphoteric, Brønsted-Lowry 하나 이외의 정의당 산 및 염기에 사용될 수 있는 용어라고 합니다. 아래 방정식은 두 개의 수륙 양용 종, 중탄산염 이온 및 물에 대한 두 가지 가능한 산염 염기 반응을 보여줍니다.
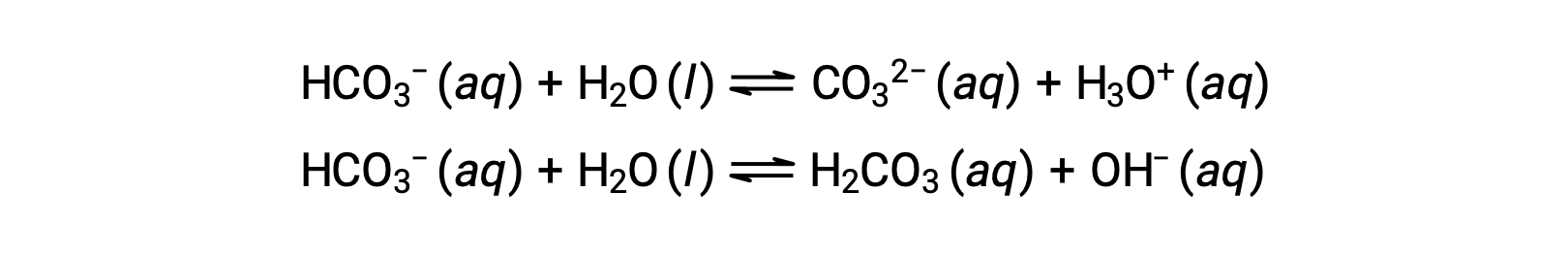
제1 방정식은 염분으로서 물을 가진 산으로서의 중탄산염의 반응을 나타내며, 두 번째는 산으로서 물을 가진 염기로서 중탄산염의 반응을 나타낸다. 중탄산염이 물에 첨가되면, 이러한 평형은 동시에 확립되고 결과 용액의 조성물은 적절한 평형 계산을 통해 결정될 수 있다. 액체 상태에서, 수륙 양용 물질의 분자는 아래 방정식에서 물에 대해 설명된 대로 서로 반응할 수 있습니다:
분자와 같은 분자가 항복 이온에 반응하는 과정은 자가화라고합니다. 액체 물은 매우 약간의 정도로 자가화를 겪는다; 25°C에서 10억 개의 물 분자 중 약 2개가 이온화됩니다. 물 자가화 공정의 정도는 평형 상수의 가치에 반영되며, 물에 대한 이온 제품 상수, KW:
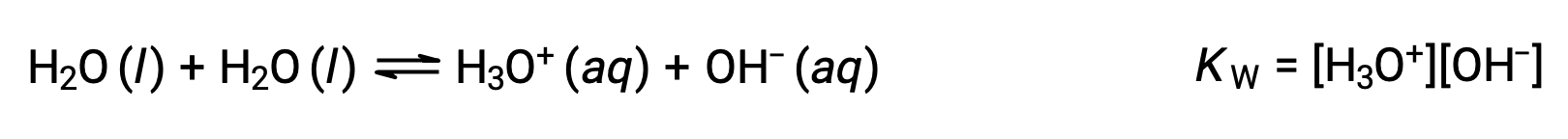
순수한 물의 약간의 이온화는 평형 상수의 작은 값에 반영된다; 25 °C에서 KW의 값은 1.0 × 10-14입니다.
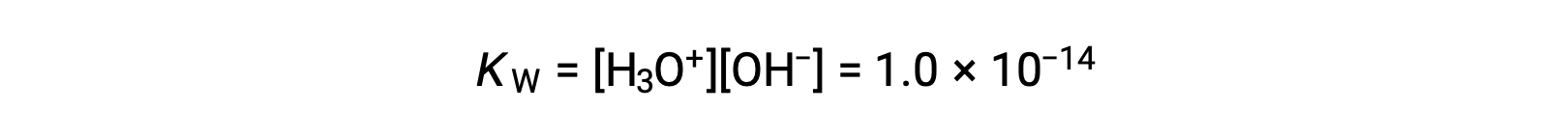
이 과정은 내열성이므로 이온화의 정도와 수산화수소 이온의 생성 된 농도는 온도와 함께 증가합니다. 예를 들어, 100°C에서 KW의 값은 약 5.6×10-13이며,25°C에서 값보다 약 50배 더 크다.
물의 자가화는 동일한 수산화수와 수산화 이온을 산출합니다. 따라서, 25 °C에서 순수한 물에 :
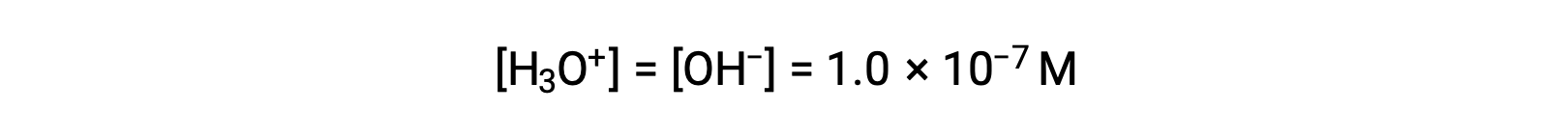
용액에서 이러한 이온의 농도는 종종 솔루션의 특성과 다른 솔루트의 화학 적 행동의 중요한 결정요인이며, 특정 어휘는 상대적인 관점에서 이러한 농도를 설명하기 위해 개발되었다. 용액은 수산화수소 및 수산화 이온의 동등한 농도를 포함하는 경우 중립적이다; 산성 수산화 이온보다 하이드로늄 이온의 더 큰 농도를 포함하는 경우; 그리고 수산화 이온보다 수산화수소 이온의 농도가 적으면 기본.
산성, 기본 및 중립 솔루션에 대한 관계 요약
| 분류 | 상대 이온 농도 | 25 °C에서 pH |
| 산 성 | [H3O+] > [OH- -] | pH & 7 |
| 중립 | [H3O+] = [OH- -] | pH = 7 |
| 기본 | [H3O+] & [OH- ] | pH > 7 |
이 텍스트는 Openstax, 화학 2e, 섹션 14.1: Brønsted-Lowry 산 및 기지,및 섹션 14.2: pH 및 pOH에서적용됩니다.
장에서 15:

Now Playing
15.3 : 물: 브뢴스테드-로리 산 염기
산과 염기
48.7K Views

15.1 : 브뢴스테드-로리 산 염기
산과 염기
88.3K Views

15.2 : 산/염기 세기와 해리상수
산과 염기
59.1K Views

15.4 : pH 척도
산과 염기
66.8K Views

15.5 : 짝산-염기쌍의 상대적 세기
산과 염기
44.5K Views

15.6 : 강산 용액과 강염기 용액
산과 염기
30.7K Views

15.7 : 약산 용액
산과 염기
36.9K Views

15.8 : 약염기 용액
산과 염기
22.0K Views

15.9 : 산 혼합
산과 염기
19.3K Views

15.10 : 산과 염기로서의 이온
산과 염기
22.8K Views

15.11 : 염용액의 pH 계산
산과 염기
42.7K Views

15.12 : 다양성자 산
산과 염기
28.3K Views

15.13 : 산 세기와 분자 구조
산과 염기
30.2K Views

15.14 : 루이스 산 염기
산과 염기
42.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유