Brønsted-Lowry 산 염기 화학은 양성자의 전달; 따라서, 논리는 컨쥬게이트 산염염 쌍의 상대적 강점 사이의 관계를 시사한다. 산 또는 염기의 강도는 산 또는 염기 이온화 반응의 정도를 나타내는 상수, Ka 또는 Kb에서정량화된다. 컨쥬게이트 산염기쌍HA/A-를위해, 이온화 평형 방정식 및 이온화 상수식은
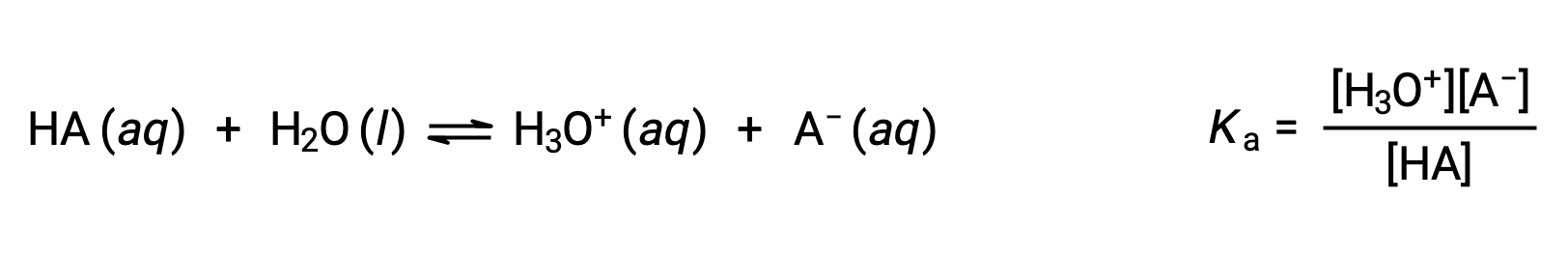
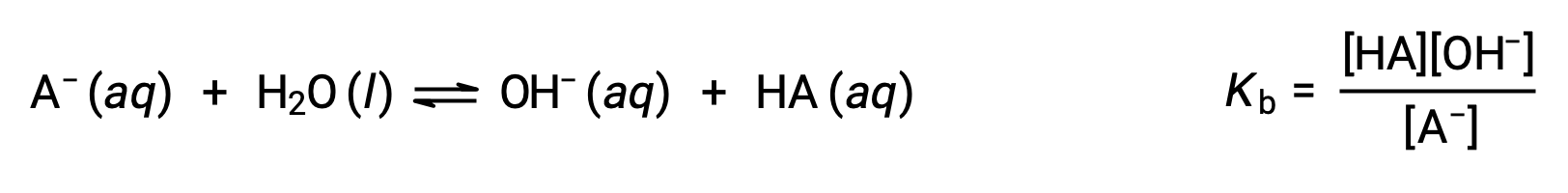
이 두 화학 방정식을 추가하면 물에 대한 자가화를 위한 방정식이 생성됩니다.
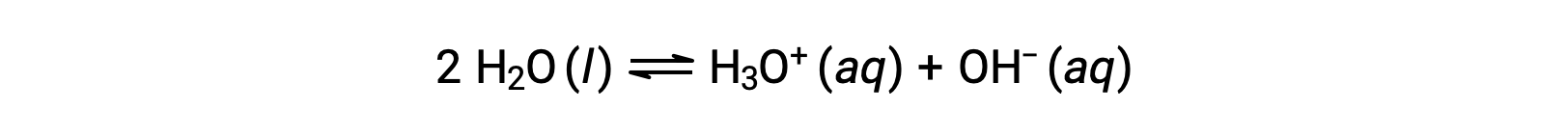
앞서 설명한 바와 같이, 합산된 반응에 대한 평형 상수는 추가된 반응에 대한 평형 상수의 수학적 제품과 동일하므로
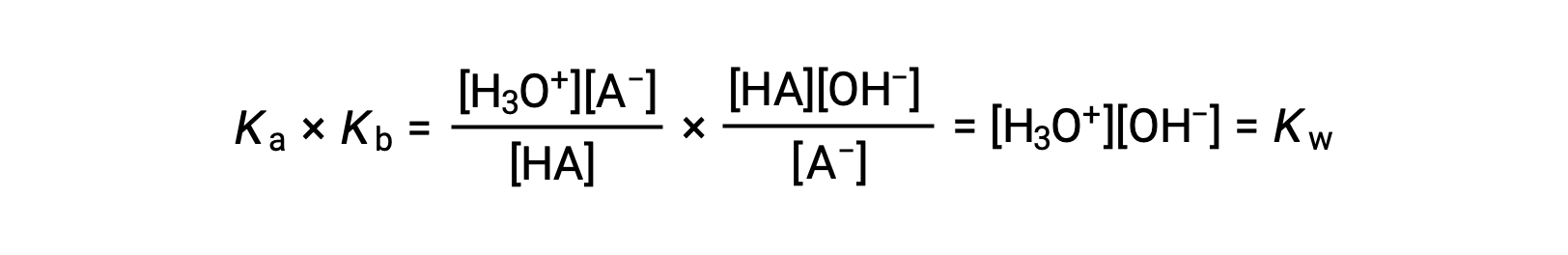
이 방정식은 모든 컨쥬게이트 산염 염기 쌍에 대한 이온화 상수 사이의 관계를 명시, 즉, 그들의 수학 제품은 물의 이온 제품, KW와동일하다. 이 방정식을 재배열하면 컨쥬게이트 산염 염기 쌍의 강점 간의 상호 관계가 분명해집니다.
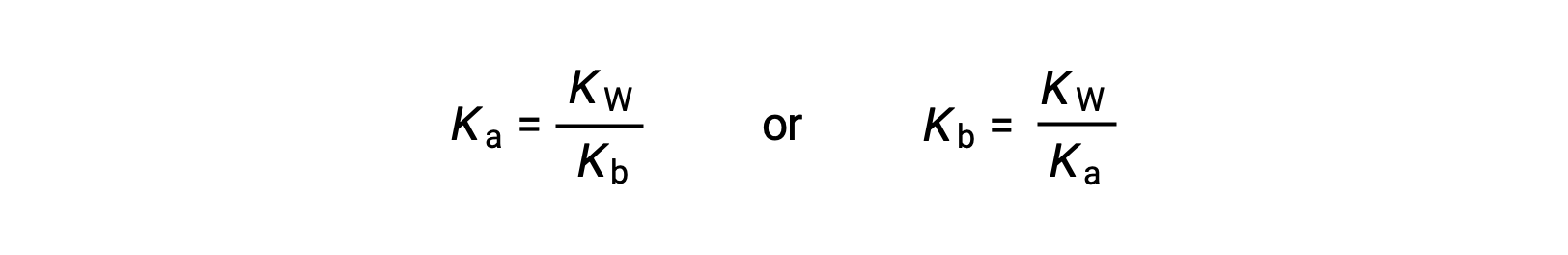
Ka와 Kb 사이의 역 비례 관계는 산또는 염기, 약한 컨쥬게이트 파트너를 의미한다.
방정식의 양쪽의 음수 로그를 복용, K는 × Kb = KW 수익률
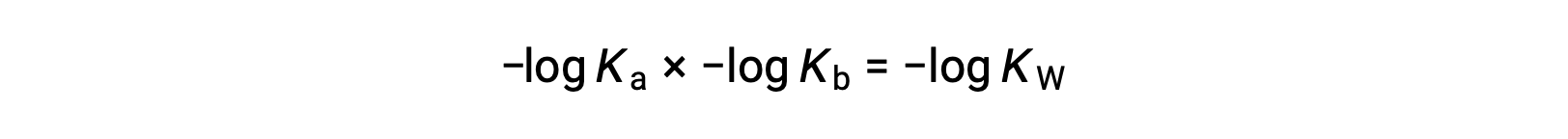
다음
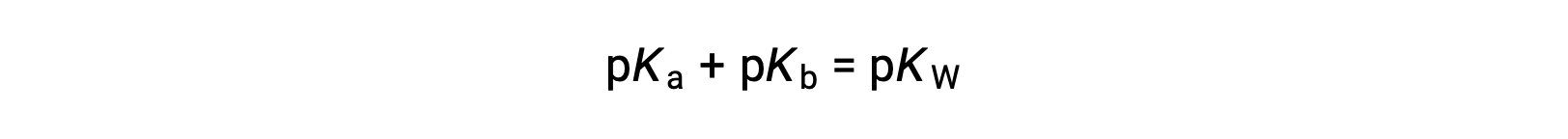
pKW는 25°C에서 14이므로 이 방정식은
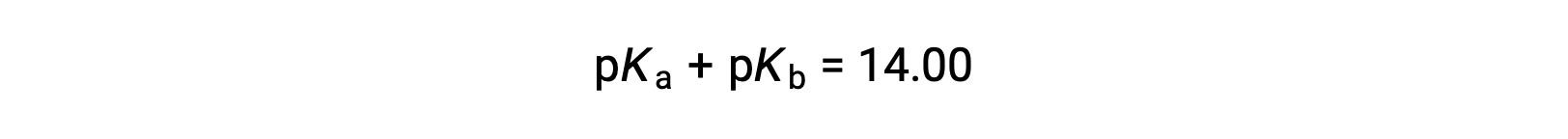
pKa 와 pKb는 또한 각각 산및 염기의 강도를 나타낸다. pH 및 pOH와 마찬가지로, 값이 높을수록 pKa 또는 pKb,산 또는 염기의 약해지는 것이 각각 된다.
| 산 | 기본 |
| 과염소산 (HClO4)* | 과염소산 염 이온 (ClO4-)** |
| 황산 (H2SO4)* | 황산수소 이온 (HSO4−)** |
| 수소 요오드 (HI)* | 요오디드 이온 (I-)** |
| 수소 브로마이드 (HBr)* | 브로마이드 이온 (Br−)** |
| 염화수소(HCl) * | 염화물 이온 (Cl−)** |
| 질산 (HNO3)* | 질산염 이온 (NO3-)** |
| 하이드로늄 이온 (H3O+) | 물 (H2O) |
| 황산수소 이온 (HSO4-) | 황산이온 (SO42−) |
| 인산 (H3PO4) | 디수소 인산염 이온 (H2PO4- ) |
| 수소 불소 (HF) | 불소 이온 (F-) |
| 아산화질소 (HNO2) | 아질산 이온 (NO2- ) |
| 아세트산 (CH3CO2H) | 아세테이트 이온 (CH3CO2-) |
| 탄산산 (H2CO3) | 수소 탄산 이온 (HCO3-) |
| 황화수소 (H2S) | 황화수소 이온 (HS-) |
| 암모늄 이온 (NH4+) | 암모니아 (NH3) |
| 시안화 수소 (HCN) | 시안이데 이온 (CN-) |
| 수소 탄산 이온 (HCO3-) | 카보네이트 이온 (CO32−) |
| 물 (H2O) | 수산화 이온 (OH-) |
| 황화수소 이온 (HS−)† | 황화물 이온 (S2− )‡ |
| 에탄올(C2H5OH)† | 에산화사이드 이온 (C2H5O− )‡ |
| 암모니아 (NH3)† | 아미드 이온 (NH2−)‡ |
| 수소 (H2)† | 하이드라이드 이온 (H−)‡ |
| 메탄 (CH4)† | 메타히드 이온 (CH3−)‡ |
| *물에 완전한 산 이온화를 겪습니다. | |
| † 물 에서 산 이온화를 받지 않습니다. | |
| **물에서 기본 이온화를 받지 않습니다. | |
| ‡ 물 속에서 완전한 기본 이온화를 겪습니다. | |
표시된 컨쥬게이트 산-염기 쌍의 목록은 물과 비교하여 각 종의 상대적 강도를 나타내도록 배치되어 있습니다. 산성 기둥에서 물 아래에 나열된 종은 물보다 약한 산입니다. 이 종은 물에서 산 이온화를 겪지 않습니다; 그들은 브뢰른스테드 로리 산이 아닙니다. 물 위에 나열된 모든 종은 더 강한 산이며, 수성 용액에 용해될 때 양성자를 물로 어느 정도 옮겨 하이드로늄 이온을 생성합니다. 물 위의 종하지만 하이드로늄 이온 아래 종은 약한 산이다, 부분 산 이온화를 겪고, 하이드로늄 이온 위의 사람들은 수성 용액에서 완전히 이온화 되는 강한 산이다.
Tags
Copyright © 2025 MyJoVE Corporation. 판권 소유