15.6 : 강산 용액과 강염기 용액
강한 산은 수성 용액에서 완전히 해리되고 초기 산 농도와 동일한 하이드로늄 이온의 농도를 생성하는 화합물입니다. 예를 들어, 0.20 M 하이드로브롬산은 물 속에서 완전히 해리되고 0.20 M의 하이드로늄 이온과 0.20 M의 브로마이드 이온을 생성한다.

한편, 강한 염기는 수성 용액에서 완전히 해리되고 수산화 이온을 생성하는 화합물이다. 예를 들어, 그룹 1 금속 수산화물인 0.015 M KOH는 완전히 해리되고 0.015 M의OH및 0.015 M의 K+를생성한다.
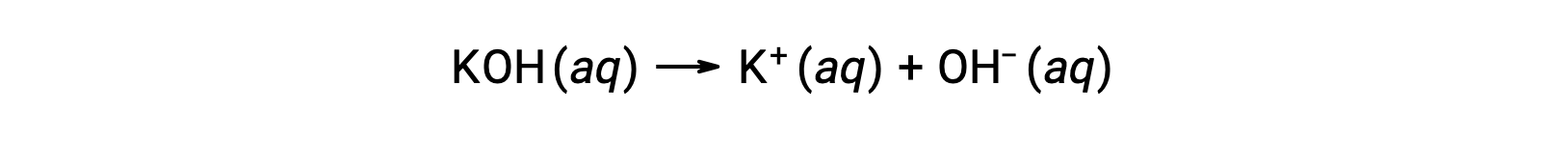
그룹 2 금속 수산화제는 수산화 바륨 [Ba(OH)2]및 수산화스트 [Sr(OH)2]와같이 강한 염기이며 2개의 수산화 이온을 가지고 있다. 이로 인해 동일한 농도에서 NaOH 또는 KOH에 비해 보다 기본적인 해결책을 생성하게 됩니다. 예를 들어 0.015 M Ba(OH)2는 0.015 M Ba+ 및 0.030 M 수산화를 생성합니다.
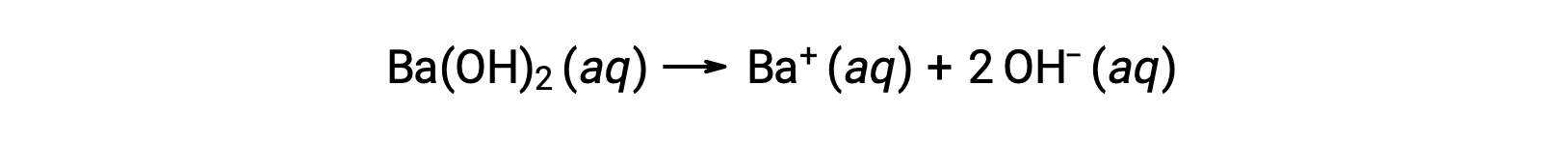
강한 산과 염기가 완전히 해리됨에 따라, 어금니 비율은 하이드로늄 및 수산화 농도를 결정하는 데 사용될 수 있으며, 이는 차례로 용액의 pH 또는 pOH를 계산하는 데 사용할 수 있습니다. 예를 들어 0.030 M HCl 용액은 0.03 M 하이드로늄 이온을 생성합니다. 따라서이 솔루션의 pH는

동일한 솔루션의 pOH는 수식을 사용하여 결정할 수 있습니다.
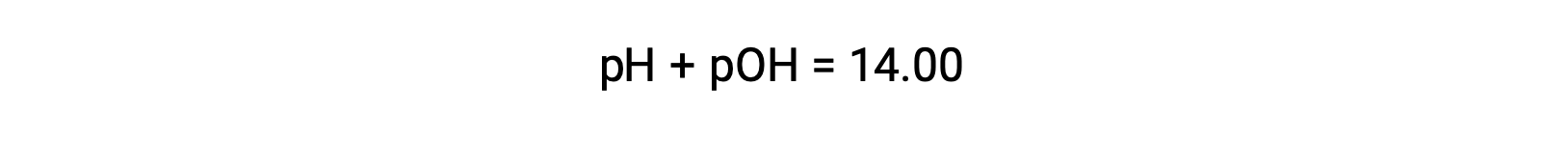
용액의 pH가 1.52이기 때문에, 그 pOH는

유사하게, 강한 염기에서 생성된 수산화 이온의 농도는 방정식을 사용하여 용액의 pOH를 결정하는 데 사용될 수 있다.
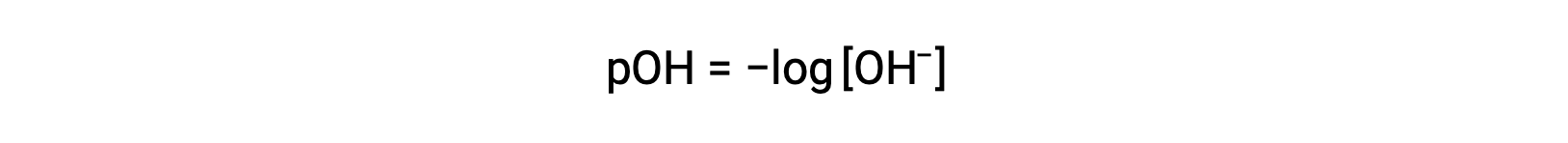
상기 방정식은 또한 pOH가 공지될 때 수산화이온 농도를 결정하는 데 사용될 수 있다. 예를 들어 솔루션의 pOH가 3.00인 경우
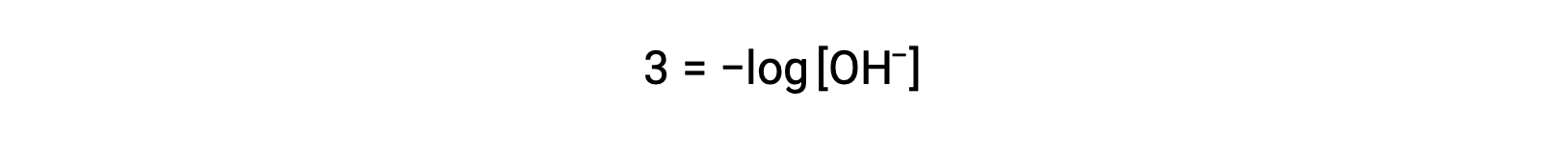
양측의 곱셈 -1제공
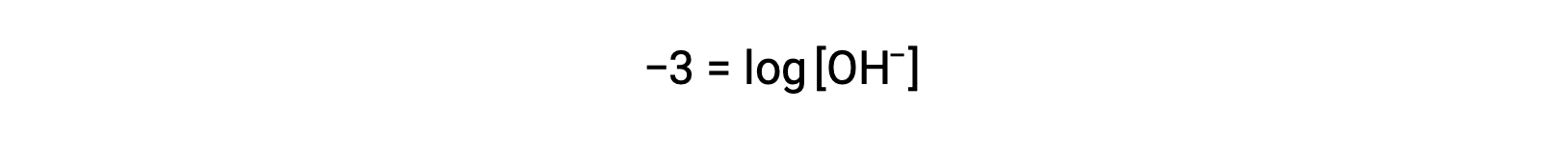
이제 양측의 안티로그를 가져 가라.
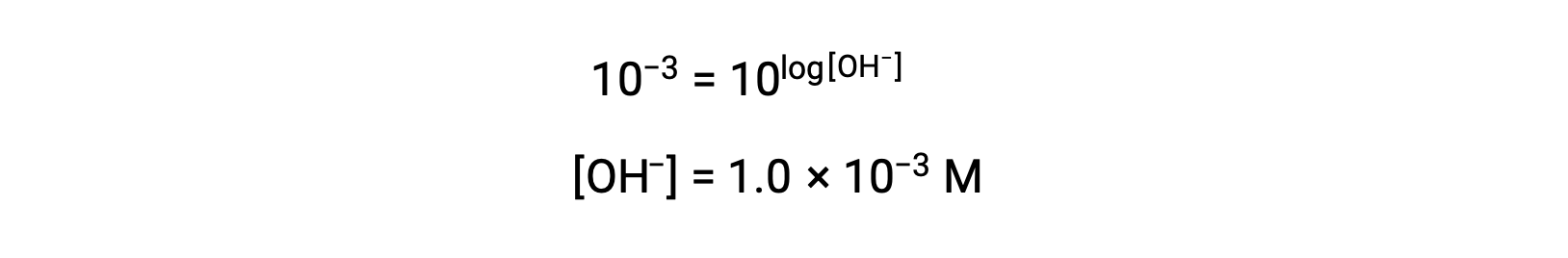
따라서, pOH 3을 가진 용액의 하이드로늄 이온 농도는 1.0 ×10-3M이다. 유사한 방법은 pH가 공지되는 경우 용액의 하이드로늄 이온 농도를 결정하는 데 사용될 수 있다.
장에서 15:

Now Playing
15.6 : 강산 용액과 강염기 용액
산과 염기
30.9K Views

15.1 : 브뢴스테드-로리 산 염기
산과 염기
89.6K Views

15.2 : 산/염기 세기와 해리상수
산과 염기
59.6K Views

15.3 : 물: 브뢴스테드-로리 산 염기
산과 염기
49.2K Views

15.4 : pH 척도
산과 염기
67.5K Views

15.5 : 짝산-염기쌍의 상대적 세기
산과 염기
44.8K Views

15.7 : 약산 용액
산과 염기
37.1K Views

15.8 : 약염기 용액
산과 염기
22.1K Views

15.9 : 산 혼합
산과 염기
19.4K Views

15.10 : 산과 염기로서의 이온
산과 염기
23.0K Views

15.11 : 염용액의 pH 계산
산과 염기
43.0K Views

15.12 : 다양성자 산
산과 염기
28.5K Views

15.13 : 산 세기와 분자 구조
산과 염기
30.4K Views

15.14 : 루이스 산 염기
산과 염기
42.8K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유