16.3 : 핸더슨-하셀바흐 식
약한 산의 용액에 대한 이온화 상수 발현은 다음과 같이 기록할 수 있습니다.
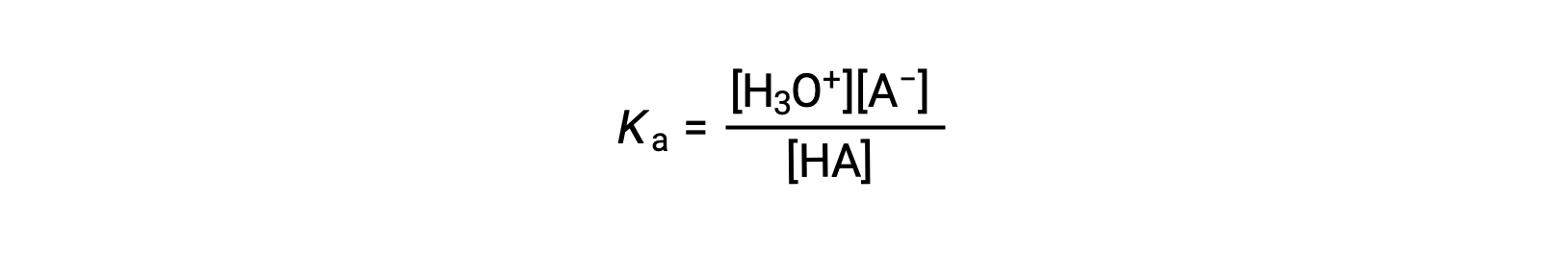
[H3O+] 수율에 대한 해결하기 위해 재배열 :
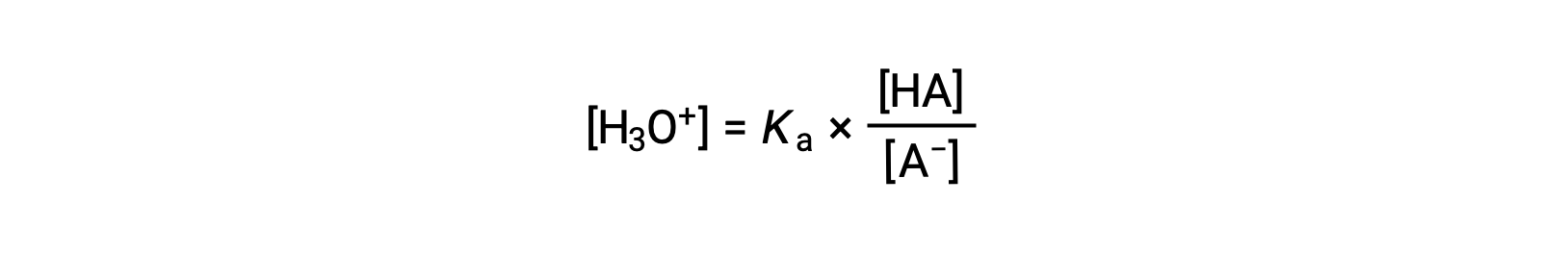
이 방정식의 양쪽의 음의 logarithm을 복용하면
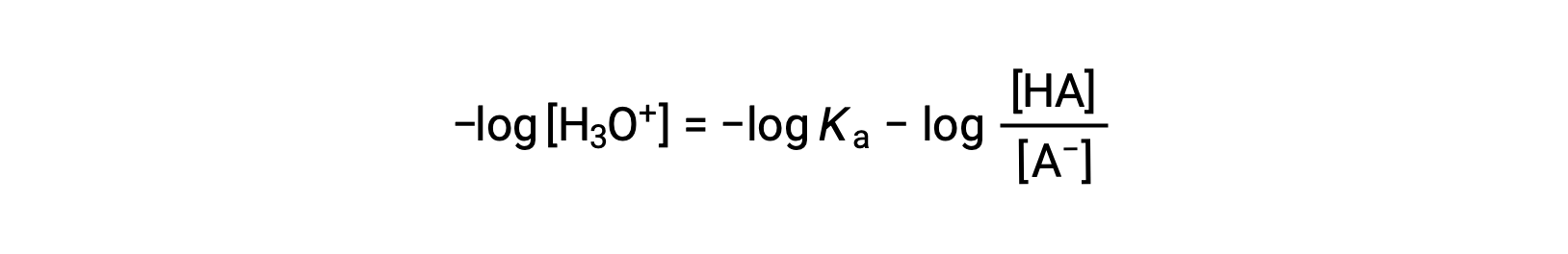
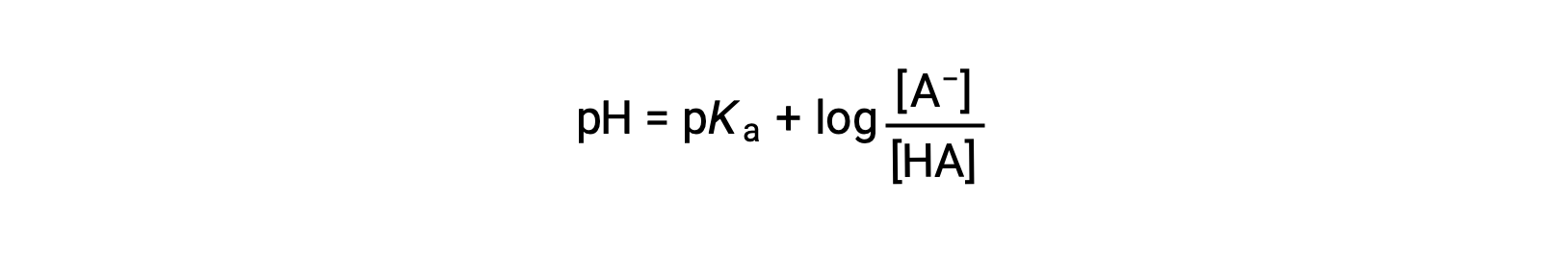
여기서 pKa는 약한 산의 이온화 상수의 로가릿의 음수이다(pKa = 로그 Ka). 이 방정식은 pH, 약한 산의 이온화 상수, 및 완충액에서 약한 공주산염염 쌍의 농도에 관한 것이다. 과학자들은 종종 헨더슨-하셀발치 방정식이라고 불리는 이 표현을 사용하여 버퍼 솔루션의 pH를 계산합니다. 이 방정식을 사용하려면 "x가 작습니다" 가정은 유효해야 합니다.
로렌스 조셉 헨더슨과 칼 앨버트 하셀발치
로렌스 조셉 헨더슨 (1878-1942)은 미국의 의사, 생화학자 및 생리학자였으며, 그의 많은 추구 중 몇 가지만 이름을 지은 것입니다. 그는 하버드대학에서 의학 학위를 취득한 후 2년 동안 독일스트라스부르에서 공부한 후 하버드에서 강사 직책을 맡게 되었습니다. 그는 결국 하버드 대학에서 교수가되었고 그곳에서 평생 을 일했습니다. 그는 인간의 혈액에서 산염-염기 균형혈액에 용해된 이산화탄소에 의해 형성된 완충시스템에 의해 조절된다는 것을 발견했다. 그는 1908년에 혈액의 탄산산-탄산완충제 시스템을 설명하기 위해 방정식을 썼습니다. 헨더슨은 광범위하게 지식이 있었다. 혈액의 생리학에 대한 그의 중요한 연구 이외에, 그는 또한 유기체의 적응과 그들의 환경, 사회학 및 대학 교육에 그들의 적합에 썼습니다. 그는 또한 하버드 비즈니스 스쿨에 피로 연구소를 설립, 이는 산업, 운동, 영양에 작업에 특정 초점으로 인간의 생리학을 검사.
1916년 덴마크 의사이자 화학자인 칼 알버트 하셀발치(1874-1962)는 1904년 크리스찬 보어(Christian Bohr)와 논문에서 저술을 공유하여 혈액에 헤모글로빈이 산소와 결합하는 능력이 혈액의 산성과 이산화탄소 의 농도와 반비례한다는 것을 보여주었습니다. pH 규모는 또 다른 데인, 쇠렌센에 의해 1909년에 소개되고, 1912년에, Hasselbalch는 혈액의 pH의 측정을 간행했습니다. 1916년 하셀발치는 pH의 로그자리움 척도와 일치하는 로그와트믹 용어로 헨더슨의 방정식을 표현하여 헨더슨-하셀발치 방정식이 탄생했습니다.
Copyright © 2025 MyJoVE Corporation. 판권 소유