버퍼는 완충 용량까지 강한 산 또는 염기를 첨가한 후 용액의 pH의 급격한 낙하 또는 증가를 방지할 수 있습니다. 그러나, 이러한 강한 산 또는 염기의 첨가는 용액의 약간의 pH 변화를 초래한다. 작은 pH 변화는 완충 성분, 즉 약한 산 및 그 컨쥬게이트 염기 또는 그 반대의 의 농도의 결과로 발생하는 변화를 결정함으로써 계산될 수 있다. 이러한 stoichiometric 계산을 사용하여 얻은 농도는 헨더슨-하셀발트 방정식 또는 ICE 테이블을 사용하여 솔루션의 최종 pH를 결정하는 데 사용할 수 있습니다.
예를 들어, 완충된 용액에는 포믹산과 나트륨 포메이트의 0.65 몰이 들어 있습니다. 약산과 그 공수기의 농도가 동일하기 때문에, 용액의 pH는 이 경우 3.74인 약한 산의 pK와 동일하다. 0.05 mol HNO3가 이 용액에 첨가되면, 포믹산 및 나트륨 포메이트의 농도의 결과변화는 아래 표에 나와 있는 바와 같이 stoichiometric 계산에 의해 결정될 수 있다.
| H+ (아크) | HCOO- (아크) | HCOOH(아크) | |
| 추가 하기 전 (M) | ~0.00 몰 | 0.65 몰 | 0.65 몰 |
| 추가(M) | 0.050 몰 | - | - |
| 추가 후(M) | ~0.00 몰 | 0.60 몰 | 0.70 몰 |
용액의 최종 pH는 포믹산과 나트륨 포메이트의 변화된 농도를 헨더슨-하셀발트 방정식에 연결하여 결정될 수 있다.
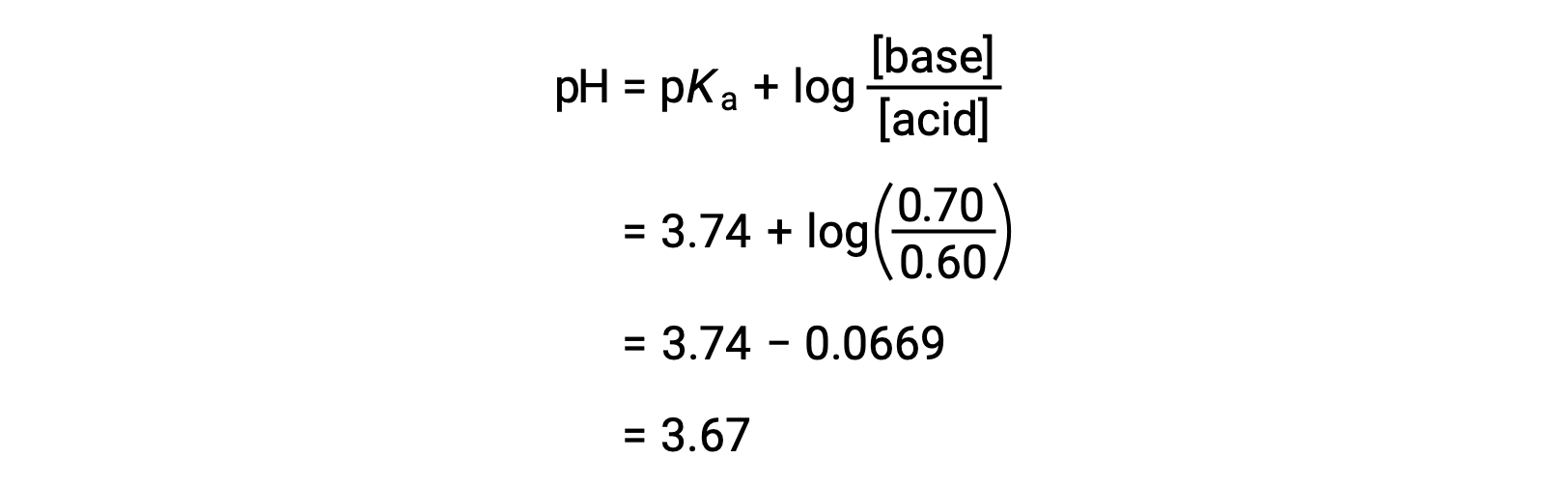
따라서, HNO3의 0.05 몰을 첨가하면 용액의 pH를 3.74에서 3.67로 감소시킨다.
마찬가지로, 0.10 mol NaOH가 동일한 용액에 첨가되면, 포믹산 및 나트륨 포메이트의 농도의 결과변화는 아래 표에 나와 있는 바와 같이 금식측정 계산에 의해 결정될 수 있다.
| OH- (아크) | HCOOH(아크) | HCOO- (아크) | H2O(l) | |
| 추가 하기 전 (M) | ~0.00 몰 | 0.65 몰 | 0.65 몰 | - |
| 추가(M) | 0.10 몰 | - | - | - |
| 추가 후(M) | ~0.00 몰 | 0.55 몰 | 0.75 몰 | - |
용액의 최종 pH는 포믹산과 나트륨 포민의 변화된 농도를 헨더슨-하셀발트 방정식으로 연결하여 결정될 수 있다.
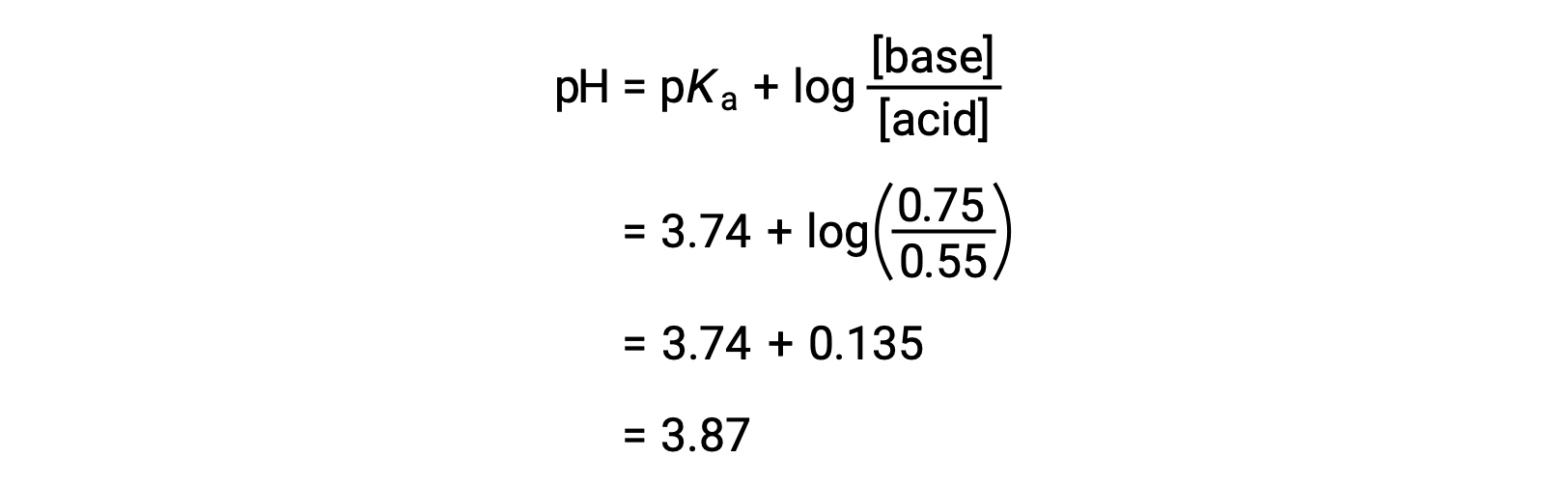
따라서, 0.10 mol NaOH의 첨가는 용액의 pH를 3.74에서 3.87로 증가시킨다.
Copyright © 2025 MyJoVE Corporation. 판권 소유