전기 화학은 전기 및 화학 반응의 상호 변환에 관여하는 과학입니다. 이러한 반응은 감소 산화, 또는 레독스 반응이라고합니다. 이러한 중요한 반응은 하나 이상의 반응 요소에 대한 산화 상태의 변화에 의해 정의되며 반응종 간의 전자 전달과 관련된 반응의 하위 집합을 포함한다. 산업 규모의 야금 공정에서 부터 전기 자동차의 견고하고 충전식 배터리에 이르기까지 백독스 화학 및 다중 기술의 기본 원칙에 대한 충분한 통찰력을 얻을 수 있도록 분야로서의 전기 화학은 진화했습니다. 전자의 전달을 관련시키는 반응이 전기화학의 연구에 필수적이기 때문에, 레독스 화학의 간략한 검토는 다음을 포함한다.
산화 번호
정의에 따르면, 레독스 반응은 하나 또는 다중 반응제에 대한 산화 번호 또는 산화 상태의 변화를 포함한다. 요소의 산화 수는 원자의 전자 환경이 순수 원소의 원자에 비해 어떻게 다른지에 대한 평가입니다. 이 정의에 따르면 요소의 원자는 산화 수0을 전달합니다. 원자의 경우, 산화 번호는 화합물이 이온인이라면 화합물내의 원자의 전하와 동일하다. 따라서, 분자내의 모든 원자에 대한 산화 수의 합은 분자의 전하와 동일하다.
이온 화합물
간단한 이온 화합물은 원소가 이온 요금과 동일한 산화 번호를 가지고 있기 때문에이 형식주의의 가장 간단한 예입니다. 염화 나트륨, NaCl, Na+ 양이온 및 Cl- 음이온으로 구성되어 있으며 나트륨과 염소에 대한 산화 번호가 각각 +1 및 -1입니다. 칼슘 불소, CaF2는칼슘과 불소에 대한 산화 번호,+2 및 -1 - 음이온Ca 2 + 양이온 및F로 구성됩니다.
공유 화합물
동연 화합물은 형식주의의 사용에 더 도전. 물은 극지 공유 O-H 채권을 통해 O 원자에 결합 된 두 H 원자로 구성된 공유 화합물입니다. O-H 결합을 만드는 공유 전자는 더 많은 전기 음성 O 원자에 더 강하게 끌린다. 따라서 산소는 원소 산소의 O 원자에 비해 부분음전하를 얻습니다. 그 결과, 물 분자의 H 원자는 수소 가스의 수소 원자에 비해 부분적인 양성 전하를 나타낸다. 각 물 분자에 대한 부분 음성 및 양전하의 합계는 0이며 물 분자를 중성화합니다.
물의 O-H 결합 내에서 공유 전자의 편광이 완료되면 - 결과는 H에서 O로 전자의 완전한 전송이 될 것이며, 물은 O2- 음이온과 H+ 양이온으로 구성된 이온 화합물이 될 것입니다. 그래서, 물에 산소와 수소에 대한 산화 번호는 각각 -2 및 +1입니다. 탄소 테트라클로라이드에 이 같은 논리를 적용, CCl4,탄소에 대한 +4의 산화 번호를 산출하고 염소에 대한 -1. 질산염 이온에서, NO3-질소의 산화 수는 +5이며 산소의 경우 -2이며 분자에 -1 전하와 동일하게 합산됩니다.
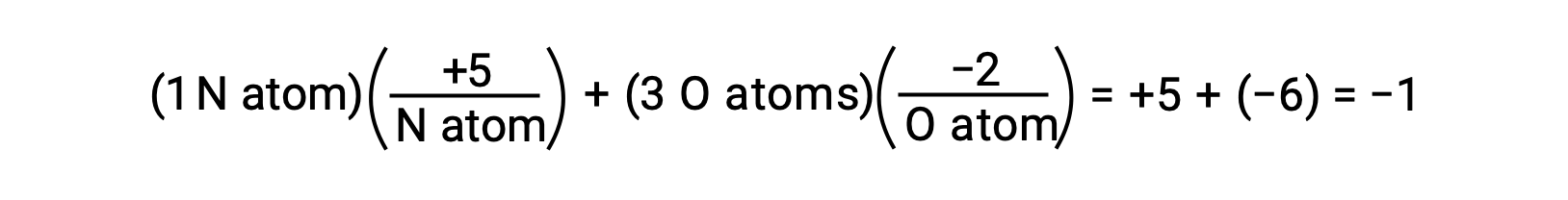
레독스 방정식 균형
아래에 표시된 불균형 방정식은 염화나트륨의 분해를 설명합니다.
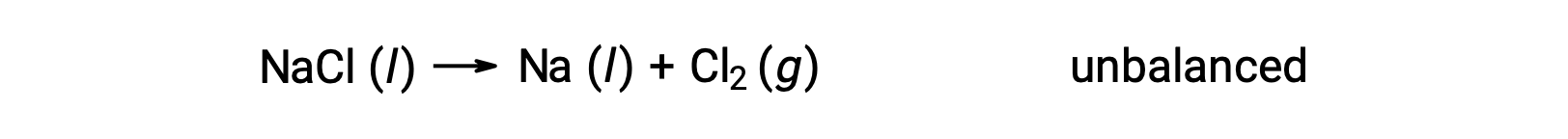
이러한 반응은 나에 대한 산화 수가 +1에서 0으로 감소하고 Cl의 경우 -1에서 0으로 증가함에 따라 (산화를 통해)에 대한 기준과 일치한다. 수학식 케이스는 NaCl 및 Na에 대해 2의 stoichiometric 계수를 추가하여 쉽게 균형을 이루수 있습니다.
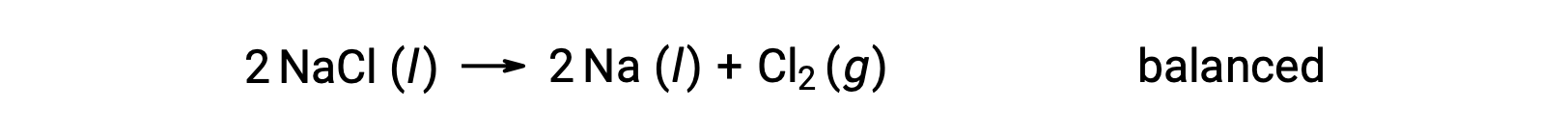
수성 솔루션에서 발생하는 Redox 반응은 일반적으로 전기 화학에서 발생하며, 많은 사람들이 물 이나 이온, H+ (aq)및 OH− (aq),반응제 또는 제품으로 관련시킵니다.
이러한 경우, 레독스 반응을 나타내는 방정식은 검사에 의해서만 균형을 맞추는 것이 매우 어려울 수 있으며 반반응 방법으로 알려진 체계적인 접근 방식을 사용하는 것이 도움이 된다. 이 방법은 다음과 같은 단계를 포함합니다.
- 방정식을 구성 요소 골격 산화 및 감소 반 반응으로 분할합니다.
- O 및 H 이외의 모든 요소에 대해 각 반 반응의 균형을 조정합니다.
- 방정식에 필요에 따라 물 분자를 추가하여 O 원자에 대한 각 반 반응의 균형을 조정합니다.
- 방정식에 필요한 대로 양성자를 추가하여 H 원자에 대한 각 반 반응의 균형을 잡습니다.
- 마지막으로 필요에 따라 전자를 추가하여 요소의 전하를 균형 조정합니다.
- 산화 반반응에서 잃어버린 전자의 수를 반반응으로 균등화하는 데 필요한 정수에 의한 반반응을 곱하여 반반응감소에서 얻은 전자의 수에 대해.
- 반 반응을 모두 추가하고 방정식의 양쪽에 공통 종을 취소하여 더 단순화하십시오.
- 반응이 알칼리성 매체에서 발생하는 경우, OH- 이온을 양성자를 중화하고 단순화하기 위해 7 단계에서 얻은 방정식에 이온을 추가하고 단순화하십시오.
- 방정식을 확인하여 원자의 요금이 균형을 이루고 있는지 확인합니다.
이 텍스트는 오픈 탁스, 화학 2e, 제 17 장에서 적응: 소개, 그리고 오픈 탁스, 화학 2e, 섹션17.2: Redox 화학의 검토.
Copyright © 2025 MyJoVE Corporation. 판권 소유