JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
의 형광 라벨링 Drosophila 심장 구조
요약
여기 우리는 유충과 성인에서 심장 튜브의 다양한 요소의 형광 라벨을위한 기본 프로토콜을 설명 Drosophila melanogaster. 이러한 표본은 형광등이나 공촛점 현미경을 통해 이미지에 적합합니다. 이 기술은 강력한 모델 유기체에서 마음의 기능의 세부 구조 분석을 수 있습니다.
초록
프로토콜
당신이 시작하기 전에
- 다음과 같은 솔루션을 준비 :
- 편안한 버퍼 (10 MM EGTA을 포함 인공 Drosophila hemolymph (ADH) ( "Drosophila에서 뛰는 심장을 떠올리"참조))
- 정착액 (1X PBS 4 %의 포름 알데히드)
- PBSTx (PBS는 0.1 % 트리톤 - X - 100을 포함)
- PBSTx에 적절하게 희석 주와 종 특정 찬란 분류 이차 항체
- 다음과 같은 심장병 튜브 (성인 파리 및 / 또는 애벌레의) 노출 Drosophila를 해부하다
- 반 그대로 Drosophila의 심장 준비 "Drosophila에서 뛰는 심장을 떠올리"에서 프로토콜, 또는
- 다음과 같은 수정 Drosophila 애벌레 NMJ 해부 프로토콜 1 : 사용 애벌레 해부 동안 ADH를 산소와 복부 정중선에서 약간 뒷부분 핀을 치환. 유충은 복부 정중선을 따라 절단됩니다. 전에 고정 어떤 조직을 제거하지 마십시오.
형광 스테 이닝
- 모든 마음은 리드미컬 산소 ADH에 뛰는 것을 확인하십시오. 빨리 버퍼 휴식과 ADH를 교체하십시오. 수축을 저해되도록 각 심장병 튜브를 검사합니다.
- 정착액으로 편안한 버퍼를 교체하여 마음을 고쳐. 부드러운 잡고 20 분 실온에서 알을 품다. (애벌레 준비 흔들어 어느 단계에서 필요하지 않습니다, 그리고 심장 조직 무결성에 해로운 것으로 간주됩니다.)
- 지속 잡고 실온에서 PBSTx와 십분 표본 세 번 씻으십시오.
- 성인, 신중하게 어떤 것이 더 남아 타원형 이하 반올림되어 같은 복부 표피의 복부 가장자리를 다시 잘라. 또한 복부와 흉부 사이에 싱글 컷, 신중하게 그리고 깔끔하게 별도의 신체 세그먼트 모두와 함께 심장의 앞쪽에 영역에 최소한의 손상을 보장합니다. 애벌레의 마음을 위해, 신중하게 잘 집게를 사용하여 지방 시신을 제거합니다. 애벌레 마음이 특히 연약하고 다른 근육이나 결합 조직에서 거의 지원을했기 때문에 지방 제거가 극단주의와 함께 실행해야합니다. 이것은 심장 손상을 수 있으므로 tracheal 가지를 제거하지 마십시오.
- PBSTx에 희석 일차 항체의 50-100 μl를 포함 우물과 96 잘 접시로, 중앙에 위치한 심장 튜브와 접촉을 피하기 위해, 가장자리에 의해 복부 표피의 손질 등의 지역을 전송합니다. 물론 당 더 이상 12 이상의 표본을 넣으십시오. 지속적인 교반과 함께 2 시간 동안 실온에서 알을 품다. 부화도 4 밤새 할 수 있습니다 ° C.
- 기본 항체 솔루션을 제거합니다. 지속 잡고 상온 100 μl PBSTx와 십분 마음을 세 번 씻으십시오.
- 최종 세척 버퍼의 제거에 따라, Alexa594 - phalloidin (1:1000)와 보충 PBSTx에서 이차 항체 100 μl를 추가합니다. 상온에서 지속적으로 흔들어 한 시간 동안 부화. 표백 형광단을 방지하기 위해 적용 샘플을 보관.
- 보조 부화 후, 지속적인 흔들림과 함께 실온에서 PBSTx 100 μl와 십분 마음을 세 번 씻으십시오. 세척 단계에 걸쳐 적용 샘플을 보관.
- 트리톤 - X - 100의 제거를위한 10 분 동안 PBS 100 μl의 마음에게 마지막 시간을 씻어. 표본은 설치하기 전에 며칠 동안 4 ° C에서 어둠에 저장할 수 있습니다.
성인 하츠 장착
- Vectashield 설치 매체의 10 μl와 현미경 슬라이드에 두 18 X 18mm 커버 전표를 준수합니다. coverslips는 ~ 10~15밀리미터 분리 간격해야합니다. 두 coverslips 사이에 매체를 장착의 작은 제 3 방울을 넣으십시오.
- 삼분의 일 coverslip의 중심에 Vectashield 20 μl를 놓습니다.
- 조심스럽게 표피의 극단적인 가장자리 PBS 세척 솔루션의 마음을 각각 제거하고 부드럽게 세 번째 coverslip에 장착 매체의 드롭에 그들 가슴 쪽을 놓으십시오. coverslip에 드롭 당 채 5 마음을 놓으십시오.
- 모든 마음은 아래로 향하게 수 있도록하기 위해 현미경으로 확인합니다.
- 조심스럽게 마음을 포함하는 coverslip을 반전하고 신속하게 coverslips의 쌍을 포함하는 등 그 coverslip 쌍 사이의 Vectashield의 비말과 심장 튜브의 퓨즈로 비말. 슬라이드에 배치 "다리"가 coverslips에 의해 형성되어야합니다. 마음은 coverslip과 현미경 슬라이드 사이에 일시 중지됩니다.
- 그 마음은 지금 상승세를 직면하기 위해 현미경으로 확인합니다.
- 매니큐어 그들의 가장자리에 coverslips을 수정.
- 마음은 이제 형광등이나 공촛점 현미경을 통해 몇 군데 준비하고 있습니다.
애벌레 하트 장착
- 현미경 슬라이드에 한 방울 (~ 20 μl) Vectashield를 놓습니다.
- 조심스럽게 텅스텐 바늘을 사용하여 다운 Vectashield과 동양들을 등의 측면 두개의 애벌레 표본까지 전송할 수 있습니다.
- 개별적으로 설치 매체의 표본을 드래그 병렬로 각각 정렬합니다.
- 표본의 측면에 반대에 coverslip 놓으십시오. 포셉를 사용하여 사후 coverslip에 한쪽을 세우고 있으므로 다리를 형성 앞쪽에 coverslip에 아래로 낮추는 방법으로 먼저, 상단에 삼분의 일 coverslip을 놓으십시오. 모세관 세력은 애벌레 마음의 적절한 정렬을하는 데 도움이 앞쪽이 후부에서 Vectashield의 흐름을 발생합니다.
- 매니큐어와, 그들의 가장자리에서, 장소에있는 모든 coverslips를 수정하고 조심스럽게 20-30 μl Vectashield와 coverslips 사이의 공간을 채우십시오.
- 4 매니큐어 및 저장과 인감 ° C 또는 -20 ° C.에 장기 저장을 위해
대표 결과
제대로 실행되면, 모든 구성 요소와 지느러미 선박의 관련 조직은 그대로 유지하고 쉽게 시각되어야합니다. 배경 형광을 최소화해야합니다. 잘 성인, 복부 세로 근육 계층 얼룩과 상당한 신호 (그림 1 및 그림 2)을 생산하고 있습니다. 기본 원형 cardiomyocytes 그러나, overlying 복부 레이어의 같은 강한 신호로 생성하지 않는 경향이 있습니다. 성인 심장의 앞쪽에 "원뿔 회의소"의 myocytes는 수축성 물질의 상당한 금액을 포함하고, 그 결과,이 지역은 심장 튜브의 나머지 부분에 가장 강력한 상대으로 나타납니다. 애벌레 심장은 성인 수축성 cardiomyocytes (그림 3)의 비슷한 나선형 myofibrillar 배치를 보여줍니다.
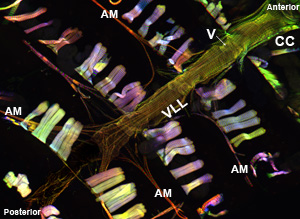
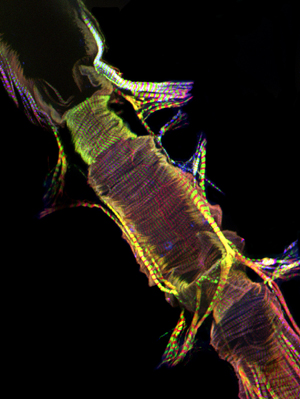
그림 1 : 탑. 마이 오신 - GFP를 표현 성인 Drosophila melanogaster의 전체 심장병 튜브를 보여주는 형광 현미경. 이미지가 Apotome 슬라이딩 모듈이 장착된 자이스 혈구 영상기 Z1 형광 현미경으로 찍은. 마이 오신 - GFP는 녹색으로 표시됩니다, 굴지이 AlexaFluor ® 594 phalloidin (적색)과 α - actinin 물들일있다는 반 α - actinin 항체 (파란색)으로 표시됩니다. 예비 절차가 잘 보존된 구조 심장 샘플 복구를 허용합니다. CC = 원뿔 챔버, AM = alary 근육, V = 내부 밸브; VLL = 복부 세로 근육 층. 바텀. 단지 수축성 cardiomyocytes의 나선형 myofibril 배치를 보여주는 배면의 길이 레이어 아래의 중심부에 3 복부 세그먼트를 통해 CC에서 성인 심장병 튜브의 영역입니다. 하시기 바랍니다 여기를 클릭 그림 1A의 더 큰 버전을 위해, 그리고 여기에 그림 1B의 큰 버전에 대한
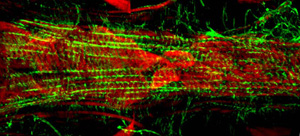
그림 2 : AlexaFluor ® 594 phalloidin (적색)과 안티 Pericardin (콜라겐 유형 IV) (녹색) 항체 물들일 성인 심장의 앞쪽에 부분을 대표 공촛점 스택. Pericardin 가능성이 복부 근육 계층의 길이 방향 중심 myofibrils에서 발생, 복부 표면을 따라 마음으로 연결됩니다. 하시기 바랍니다 여기를 클릭 그림 2의 더 큰 버전을 위해.

그림 3 : 무대 세 Drosophila의 유충의 적절한 마음의 세그먼트 A7의 형광 현미경. 이미지가 Apotome 슬라이딩 모듈이 장착된 자이스 혈구 영상기 Z1 형광 현미경으로 찍은. 굴지이 AlexaFluor ® 594 phalloidin (녹색)과 α - actinin과 함께 표시됩니다은 안티 - α - actinin 항체 (적색) 물들일 것입니다. 하시기 바랍니다 여기를 클릭 그림 3의 더 큰 버전을 위해.
토론
여기서 우리는 Drosophila melanogaster의 지느러미 선박 및 형광 또는 공촛점 현미경을 통해 이미지를위한 관련 조직을 준비하고 얼룩을위한 유용한 프로토콜을 제시한다. 우리도 세련되고 일반적으로 애벌레와 어른 Drosophila의 심장 튜브의 현장 이미지에 잘 해결을 허용 효과적으로 얼룩을 위해 우리가 실험실에서 고용 단계 간결한 계정을 제공합니다. 기타 약식 형태로 2, 3, 4?...
감사의 말
저자는이 원고의 준비에 관한 중요 읽고 도움이 제안 SI 번스타인 (샌디에고 주립 대학)을 주셔서 감사합니다. 이 작품은 SI 번스타인, SDSU,와 R. Bodmer, BIMR에 NIH 교부금에 의해 지원되었다;와 미국 심장 협회의 미국 서부 제휴에서 G. 포글러와 A. Cammarato에 박사후 교제로.
자료
| Name | Company | Catalog Number | Comments | |
| Ethylene glycol-bis (2-amino-ethylether) -N,N,N’,N’-tetra-acetic acid (EGTA) | Reagent | Sigma-Aldrich | E4378 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Reagent | Polysciences, Inc. | 50-00-0 | |
| Triton-X-100 | Reagent | Sigma-Aldrich | 9002-93-1 | |
| Alexa Fluor® 594 phalloidin | Reagent | Invitrogen | A12381 | |
| Vectashield® Mounting Medium for Fluorescence with DAPI | Reagent | Vector Laboratories | H-1200 | |
| Tungsten pins | Reagent | Fine Science Tools | 26002-10 | |
| Pin holder | Reagent | Fine Science Tools | 26018-17 |
참고문헌
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. , (2009).
- Molina, M. R., Cripps, R. M. Ostia, the inflow tracts of the Drosophila heart, develop from a genetically distinct subset of cardial cells. Mech Dev. 1, 51-59 (2001).
- Dulcis, D., Levine, R. B. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster. J Neurosci. 2, 271-280 (2005).
- Zeitouni, B. Signalling pathways involved in adult heart formation revealed by gene expression profiling in Drosophila. PLoS Genet. 10, 1907-1921 (2007).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological change. J. Morphol. 2, 351-399 (1936).
- Miller, A. . The internal anatomy and histology of the imago of Drosophila melanogaster. , (1950).
- Rizki, T. M. The circulatory system and associated cells and tissues. , (1978).
- Cammarato, A. Myosin transducer mutations differentially affect motor function, myofibril structure, and the performance of skeletal and cardiac muscles. Mol Biol Cell. 2, 553-562 (2008).
- Taghli-Lamallem, O. Dystrophin deficiency in Drosophila reduces lifespan and causes a dilated cardiomyopathy phenotype. Aging Cell. 2, 237-249 (2008).
- Kelso, R. J. a database documenting a GFP protein-trap insertion screen in Drosophila melanogaster. Nucleic Acids Res. 32, D418-D420 (2004).
- Dietzl, G. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 7150, 151-156 (2007).
- Mery, A. The Drosophila muscle LIM protein, Mlp84B, is essential for cardiac function. J Exp Biol. 211, 15-23 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유