JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 Cremaster 근육의 국소 빈혈 reperfusion의 - 상해에서 백혈구 - 내피 상호 작용의 실시간 디지털 이미징 (IRI)
요약
cremasteric microcirculation의 postcapillary venules 디지털 intravital epifluorescence 현미경은 백혈구 - 내피 상호 작용에 대한 통찰력을 얻을 수있는 편리한 방법입니다 생체내에서 평형으로 뻗은 줄이있는 근육 조직의 국소 빈혈 reperfusion - 상해 (IRI) 인치 우리는 여기서 안전하게 기술을 수행하고 응용 프로그램과 한계를 논의하기 위해 상세한 프로토콜을 제공합니다.
초록
돌이킬 방지에 필수적인 반면 국소 빈혈 - reperfusion 상해 (IRI)는 같은 대뇌 뇌졸중, 심근 경색, 장내 국소 빈혈뿐만 아니라 이전에 허혈성 조직 이식과 심장 혈관 수술 1. Reperfusion 다음과 같은 병적인 조건의 큰 배열에 연루되어 조직 부상이 영향을받는 조직의 과도한 염증을 elicits. 반응성 산소 종, 보완 시스템의 활성화의 생산 및 microvascular 투자율 증가 인접, leukocytes의 활성화가 reperfusion 동안 염증성 조직 손상의 병적인 폭포의 주요 배우 중 하나이다. 2, 3 백혈구 활성화 구성된 다단계 프로세스입니다 , 압연 확고한 접착력과 윤회와 같은 보완 요인, chemokines, 또는 혈소판 - 활성 요소로 chemoattractants에 대한 응답으로 유착 분자 사이의 복잡한 상호 작용에 의해 매개된다. 4 <P 클래스 = "jove_content"> postcapillary venules에서 백혈구 구름은 주로 자신의 카운터 리간드, 내피로 leukocytes의 확고한 유착 세포 접착 분자 (ICAM)과 혈관 세포에 바인딩을 통해 selectin 조절과 함께 selectins 5의 상호 작용에 의해 매개되는 동안 유착 분자 (VCAM). 6, 7
백혈구 - 내피 상호 작용의 생체내 관찰에 대한 골드 표준 먼저 1968 년 설명한 intravital 현미경의 기법이다 8.
IRI (국소 빈혈 reperfusion-상해)의 다양한 모델이 여러 장기에 대한 설명되어 있지만, 9-12 오직 소수 이미지 품질을 높은 수준에서 microvascular 침대에 백혈구 모집의 직접적인 시각화에 적합 8.
우리는 여기서 cremasteric microcirculation에 postcapillary venule의 디지털 intravital epifluorescence 현미경을 촉진질적 및 양적 줄무늬가 근육 조직에서 IRI - 연구 백혈구 모집을 분석하고 기술을 달성을위한 상세한 매뉴얼을 제공하는 편리한 방법으로 쥐 13. 우리는 더 이상 일반적인 함정을 설명하며 독자가 진정으로 감사 있도록하고, 안전하게 방법을 수행해야합니다 유용한 팁을 제공합니다.
단계 프로토콜에 의해 단계에서 우리는 시간의 긴 기간 동안 동물이 단단히 anesthetized 유지하는 데 충분한 감시하에 호흡 조절 마취를 시작하는 방법을 묘사. 그러면 뛰어난 광학 해상도 얇은 평면 시트로 cremasteric 준비를 설명하고 잘 우리의 실험실에 설립되었습니다 IRI에서 백혈구 이미징을위한 프로토콜을 제공합니다.
프로토콜
1. 마취 및 모니터링
- 동물 실험을 수행하기 전에 해당 국가 및 기관의 윤리는 제자리에 있어야합니다. 180g - 120에서 체중과 윤리위원회 마취 수컷 Sprague Dawley 쥐처럼의 승인을 따라. isoflurane 기화기를 통해 플렉시 글라스 상자에 3 시리즈의 % isoflurane과 쥐의 내부 배치 - 2을 제공합니다.
- 마자 마취의 적절한 수준이 달성되면 (발가락이나 꼬리 공략하기 위해 반응의 부족) 쥐가 가중치와 복부 자궁 지역에 면도있다.
- 37시 체온을 유지하기 위해 가열 패드에 지느러미 드러누움에서 쥐를 놓고 ° C와 실리콘 마스크를 사용하여이 시리즈의 %로 isoflurane 적용됩니다.
다음과 같은 준비 단계를 최고의 수술 현미경을 사용하여 달성된다.
- 기도의 준비를 위해, 경동맥과 경정맥 정맥은 지역 O에 2cm 가로 피부 절개를 수행F suprasternal 노치와 laterally 침샘을 동원.
- 이제 복부 목 근육에 직면하고 있습니다. 중간선에서 그들을 조심스럽게 분리하고 호흡 관을 찾으십시오. 호흡 관 2 센티미터 그리고 그것을 인상을 줄 수있는만큼 그 아래 마이크로 포셉 배치 - 1을 폭로.
- 지금은기도의 복부 측면을 통해 약 절반을 그어. 를 통해 먼길을 삭감하라고 할 경우, 기관의 절단 끝이 가슴에 다시 풀 수 있으며 작동 시키기는 힘들하지 않도록주의하십시오.
- 이전에 동물의 호흡에 연결되었습니다 호흡 관의 아래 부분에 tracheal 튜브로 사용 Abbocath 튜브 (14G)를 넣습니다. 팁 : 회사 자석 클램프에 고정뿐만 아니라 튜브 주위 기관의 suturing이 자리에 tracheal 튜브를 유지하는 데 필수적입니다. 일반적으로 우리가 Terylene 5 / 0 봉합사를 사용하지만 유사한 봉합 재료를 사용할 수 있습니다.
- 갯벌 볼륨, 4.5-5 ML; FiO 2 45 심호흡 / 분 - 호흡이 후 (주파수, 35 볼륨을 조절할 수 있습니다 , 0.35-0.50;. Isoflurane 1.5-2 권의 %) 14 무기폐은 H 2의 10mm에 5의 최종 내쉬는 숨의 압력 긍정을 유지함으로써 예방할 수 O. 15
- 경동맥 canulation 들어, 오른쪽 sternohyoid 근육은 경동맥을 찾기 위해 무딘 절개로 구분됩니다.
- 경동맥에서 조심스럽게 미주 신경을 분리하고 혈액이 심장에서 흐르는 중지 직각 마이크로 포셉에서 동맥을 탑재합니다.
- 경동맥 아래에 봉합의 같은 길이의 두 조각을 전달합니다. 심장에 대한 참고 자료를수록 말초 봉합은 근위 봉합은 경동맥 주위에 느슨하게 묶여있다 반면 머리 지역에서 흐르는 피가 윗니와 아랫니가 맞물리다하기 위해 긴밀하게 연결되어있다.
- 마이크로 가위를 사용하여 작은 커팅은 두 ligatures 사이 경동맥으로 이루어집니다.
- 압력 변환기에 연결되어 정상적인 생리 식염수로 가득 폴리에틸렌 카테터 (0.28 mm 내경)을 넣습니다.
- 엎드려서동맥에 카테터 더 마이크로 포셉 및 스레드를 ove. 그러면 동맥과 카테터 주변의 근위 봉합사를 조입니다. 팁 : 두 번째 근위 봉합의 응용은 마이크로 집게를 제거 후 출혈을 방지한다.
- 경동맥 주위의 말초 봉합사 및 추가 정박지를위한 카테터를 매다.
- 모니터링 심장 박동과 동맥 압력에 의해 지속적으로 마취를 모니터링합니다. 혈액 가스 분석기를 사용하여 간헐 동맥혈 가스 분석을 수행합니다. 16 심장 박동수 300 BPM이나 초과한 360 BPM보다 낮을뿐만 아니라, 이상 5 분 80 mmHg 이하로 떨어지는 비열한 동맥 압력이 제외 기준입니다. 17, 18은 혈액을 유지 생리적 한계 이내 산도 (7.35-7.45). 실험으로 인해 비정상적인 모니터링 속도로 종료되어야 경우에는 목의 전위 또는 exanguation하여 동물을 혹평하다.
형광 염료 또는 다른 약물 O의 정맥 신청F의 관심은 다음을 수행합니다 :
- 수술 현미경으로 왼쪽 경정맥 혈관의 영역을 집중.
- 각 손에 집게로 경정맥 정맥을 표시하는 방법으로 얇은 근막 찢어. 직각 마이크로 포셉에 정맥를 탑재합니다. 혈액 흐름이 멈출 것입니다.
- 포셉 사용, 봉합의 같은 길이의 두 조각이 경동맥 canulation으로 조화된 경정맥 혈관하에 전달됩니다. 단단히 말초 봉합과 경정맥 혈관 주위에 느슨하게 근위 봉합을 묶어.
- 경정맥 정맥에 작은 상처를 만들고 식염수에 플러시되었습니다 폴리에틸렌 카테터 (0.28 mm 내경)을 삽입합니다. 절개와 canulation은 경동맥보다 더 까다로운와 시간이 소요 될 수 있다고 표시한다.
- 심장 방향으로 카테터를 실과 정맥 및 카테터 주위 심장에 가장 가까운 봉합사를 조입니다.
- 부합하는 제품 명백 후 카테터 주위 말초 끈을 묶을. 팁 : 보의 추가 고정테이프 번째 카테터는 dislodgment하지 못할 수도 있습니다.
- intraluminal 응고를 방지하기 위해 자주 카테터를 씻어.
2. Cremaster 근육의 작성
- cremasteric 이미징을 위해 2cm 두께 - 우리는 1.5 알루미늄 단계를 사용합니다. 단계는 급속히 따라서 cremasteric 조직의 온도 제어를 경감 가열 패드의 원하는 온도를 채택. 이것은 염증 연구에 대한 중요합니다. cremasteric 온도 조절이 더 어렵지만 또는 플렉시 글라스 플랫폼을 사용할 수 있습니다. 무대 중앙에 음낭를 놓습니다.
- 초기 절개는 미세 가위를 사용하여 subdermal 공간의 팽창주의이어서 아주 말초 결국에는 음낭 위의 피부와 외부 정액의 근막에서 이루어집니다. 악기와 기본 조직을 만지는 피하십시오.
- 즉시 조직이 노출되면 그것은 미리 온수로 moistened있다 (37 ° C) 인산은 생리 식염수로 Wi 버퍼회 칼슘과 마그네슘. 모든 노출된 조직에 정기적으로 해결책을 적용합니다.
- 외부 정액의 근막과 cremaster 근육 사이의 결합 조직은 신중하게 조직을 둘러싼에서 cremaster 근육을 풀어 제거됩니다.
- cremaster 근육의 외부 표면은 다음 조심스럽게 결합 조직에서 벗어날 것입니다. 연속 superfusion는 절개를 hydrates 동안 결합 조직은 가시성 및 제거를 촉진.
- 아래로 개최 cremaster의 자루의 말초 끝부분을 치료하고 약간 자루의 끝부분을 연장.
- 복부 측면에 자루의 말초 끝을 절개와 미세 가위를 사용하여 proximally 절개를 연장하다. 조심스럽게 열 소작을 이용한 절개 라인을 따라 혈관을 피가 부식. 추가 염증성 자극을 제한하는 불필요한 소작을 피하십시오. 팁 :. 준비 주변 근처 혈류 역학이 조직의 손상에 의해 변경되고 따라서 19을 최소화하는 방법SE는 데이터 수집에 영향 준비의 중심 근처에 혈관이 영상을 위해 사용해야합니다.
- 오픈 cremaster하지만 여전히 고환 밑에 epididymis에 얇은 인대로 연결된 알루미늄 받침대에 평평하게 자리잡고 있습니다. 한쪽 고환을 반영하는 것은 epididymis에 연결하는 작은 동맥과 정맥 포함하여이 인대를 제공합니다. 혈관을 폐쇄하고 고환과 cremasteric 조직 간의 결합 인대를 절단하는 마이크로 가위를 고용하는 소작을 사용합니다.
- 부드럽게 사타구니 운하에 격리된 고환을 뒤로 밀어. 다른 저자 관련 사타구니 유행 패드와 함께 근위 봉합사 (orchiectomy) 이후 고환을 잘라 내다. 우리 모두 추가 수술 자극을 피하기 위해 노력 IRI 유도된 백혈구 활성화와 같은 민감한 모델 20 그러므로 우리가 보통 아니다 testis을 절제 삼가해 cremaster 근육의 충분한 노출을 얻을 필요.
- 첫 번째 이외에고정 봉합 네 가지 조직의 가장자리 (각 측면에 두)과 조심스럽게 알루미늄 무대에서 반경 cremasteric 조직을 확산하기 위해 테이프로 스레드를 첨부해 주시기 바랍니다. 알루미늄 무대와 사타구니 운하의 외부 입구 사이의 간격을두면 국소 빈혈에 대한 후속 cremasteric 클리핑을 단순화합니다.
- 장소 폴리에틸렌 카테터의 두 끝을 (0.28 mm 내경)은 superfusion 설치를위한 cremasteric 조직을 닫습니다. 루멘은 최종 유체 챔버에서 공기 방울을 피하기 위해 공기 무료입니다 있는지 확인합니다.
- 주사기를 사용하여 cremaster 근육 주위 석유 젤리 (바셀린)의 라인을 그립니다. 라인은 보험에 사용되는 커버 슬립의 크기를 확장해야합니다.
- 유체 챔버를 만들려면 cremasteric 조직 위에 사각형 커버 슬립을 (32 × 32mm)에 배치하고 단단히 바셀린 라인에 가장자리를 첨부해 주시기 바랍니다.
- 경우 cremasteric 조직은 특정 약물, 주변 독감의 지속적인 교체로 superfused되지 않습니다ID는 중요하지 않은 것입니다. 인산염의 단일 응용 프로그램이 칼슘 만든 챔버로 마그네슘과 생리 식염수를 버퍼 것은 그때 충분히있을 수 있습니다. 마약 현지 자극은 그러나 시간당 3 ML의 비율로 마이크로 관류 펌프를 통해 지속적으로 수행되어야한다.
- cremasteric 조직은 이제 미세한 이미징을위한 준비가되었습니다.
3. Intravital 설정
기본 intravital 설정은 다를 수 있습니다. epifluorescence 이미징의 경우 실험은 어두운 방에서 수행되어야한다.
- 동물은 에피 조명을위한 LED가 발광 소스를 470 nm의 장착된 intravital epifluorescence 현미경의 무대로 전송됩니다. 약 800 ×의 배율을 달성하기 위해 물 침지 목표를 (20 × / 1.0) 사용합니다. 고해상도 디지털 카메라 및 오프라인 평가를위한 개인용 컴퓨터에 저장하는 기록의 수단을 이용하여 기록었습니다.
- 백혈구 라벨 들어, rhodamine 투입정맥 0.4 MG / kg 체중의 농도에서 경정맥 카테터를 통해 6G.
- 관찰을위한 postcapillary venule를 선택합니다. 선박의 크기는 20-60 μm의 제품과 혈류 사이에 이르기까지 다양해야하는 것은 충분해야합니다. 조직의 사전 활성화의 영향을 최소화하기 위해 백혈구 롤링 <20 cells/30 초 자기편 세포의 수를
- 가능하면 최대 3 postcapillary venules는 관찰에 사용될 수 있지만 그들은 다른 시간 지점에 혈관을 혼동하지 않도록 cremasteric 조직의 해당 섹션에 위치한다.
4. 국소 빈혈 reperfusion의 - 상해 (IIR)
- 조직이 30 분 동안 안정화하자.
- 백혈구 압연과 준수를위한 기저 값을 설정하는 데 30 초 녹음을 수행합니다. 이상 적으로는, 세포를 확인하기 위해 총 세 기저 녹음에 생성숫자와 표준 편차를 얻을 수 있습니다.
- 부드럽게 응용 프로그램 집게를 사용하여 노출된 cremasteric 조직의 매우 근위 끝에 주위 Biemer 선박 클립을 넣으십시오. 스테이 시스는 즉시 발생해야하며 관찰된 혈관 섹션에 epifluorescence 현미경에 의한 시각이 될 수 있습니다.
- 시간 코스의 다양한 요구 손상의 수준에 따라 이용하실 수 있습니다. 다른 작가에 의해 설명된대로 우리는 국소 빈혈 시간 30 분 적용합니다. 21-23는 나중에 혈관 클램프를 제거합니다. 혈류가 다른 15 분 동안 안정화하도록 허용합니다.
- 삼십초 기간의 후속 녹음이 reperfusion 기간 (예 : 삼십초 매 15 분)에 걸쳐 만들 수 있습니다. 오프라인 분석을 위해 디지털 녹음을 저장합니다.
- 실험 종료 들어, 쥐 같은 두개골의 바닥에 가위 칼날의 무딘 가장자리와 같은 둔탁한을 눌러 충분한 마취하에 자궁 전위에 의해 euthanized있다. 기타와손으로은 꼬리 기지를 빠르게 두개골로부터 경추 사이로 절단 분리를 일으키는, 뽑아됩니다.
5. 오프라인 비디오 재생 분석
- 오프라인 비디오 재생 분석의 경우는 독특한 사진과 슬로우 모션의 비디오 시퀀스 관찰의 선택을 허용 소프트웨어를 사용하는 도움이됩니다. 적절하게 명암과 밝기를 조정합니다. 우리는 길이 측정 및 디지털 배율을 허용 현미경 제조 업체에서 제공하는 소프트웨어를 사용합니다.
- 백혈구 압연의 부량 들어, 모든 레코드의 일관성 즉 세로로 혈관을 교차하는 가상 선을 정의합니다. 수동으로 30 초 내에 라인을 통과 압연 leukocytes의 개수를 세어보세요.
- 자기편 leukocytes의 부량 들어, 모든 레코드의 일관성이 200 μm의 선박 섹션을 정의할 23 - 30 초 동안 정적 유지 명확하게 보이는 leukocytes의 개수를 세어보세요 -. 따라서 defin가에드처럼 자기편. 24
6. 대표 결과
cremaster 근육의 IRI는 평균 동맥 압력 (MAP), 심장 박동과 혈액 산도에 영향을 미치지 않습니다
상기 설치 (그림 1)를 사용, 우리는 두 시간 프로토콜을 통해 IRI의 microcirculation을 조사 있지만 최대 6 시간이 훨씬 오래 관찰 시간은 가능합니다. 그림 2에 표시된 바와 같이 평균 동맥 혈압과 심장 박동이 조사 기간에 걸쳐 안정적인 유지로 cremaster 근육의 IRI는 쥐 순환에 아무런 상당한 macrohemodynamic 영향을 미치지 않습니다. 아울러 우리는 생리적 한계 내에서 원거리 그 혈액 pH는 동맥의 자주 측정하여 항상성를 모니터링하고 더 큰 인터 그룹의 차이를 보여주었다 없습니다.
IRI는 cremasteric 순환에 백혈구의 구름을 유도
백혈구 내피 상호 작용이 핵심이다급성 염증의 이벤트입니다. intravital 현미경에 의해 우리는 cremaster 근육의 IRI (그림 3A) 이전의 데이터를 21, 25 조화된의 압연 leukocytes의 수가 시간이 종속적인 증가를 발견. 롤링은 137.63 최대 ± reperfusion 시간 120 분 후에 기본적인 가치의 22.55 %로 두 시간 관측 시간의 경과에 장착 후 (137.63 ± 22.55 대 99.43 ± 기본적인 가치의 14.04 %) 사기 조작 동물에 비해 통계적 중요성에 도달했습니다.
IRI는 cremasteric 순환의 백혈구 유착을 유도
백혈구 - 내피 상호 작용에 대한 평가를 위해 우리는 200 μm의 선박 섹션에서 백혈구 유착을 분석했다. IRI는 60 분 후에 동물을 운영 상당히 사기의 가치를 초과 자기편 leukocytes의 수가 증가를 유도 (118.33 ± 6.83 대 96.27 ± 기본적인 가치의 5.78 %)과 추가 ascereperfusion 120 분 (그림 3B)에 의해 nded.
요약 생체내 모델에서 설명한는 IRI 반면 동물의 생존과 순환의 안정성에 급성 백혈구 활성화의 일관성있는 데이터의 적합성 공급하고 있습니다.
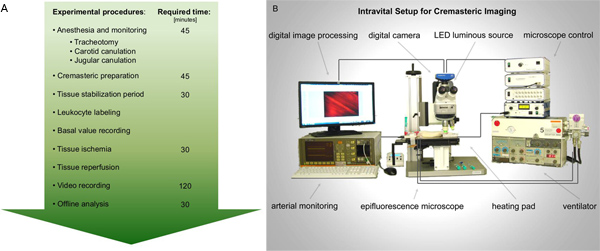
1 그림. 쥐 cremaster 근육의 국소 빈혈 reperfusion - 상해에서 intravital epifluorescence 현미경 성능 A. 흐름 차트. 마취 및 모니터링을위한 필수 준비 다음이, 쥐 cremaster 근육은 이미징을위한 노출됩니다. 백혈구 활성의 기록은 조직의 국소 빈혈 전후 이동합니다. 후속 비디오 분석은 최상의 오프라인 수행됩니다. B.이 제안된 intravital 설치에 대한 설계도를 그림. 큰 그림을 보려면 여기를 누르십시오 .
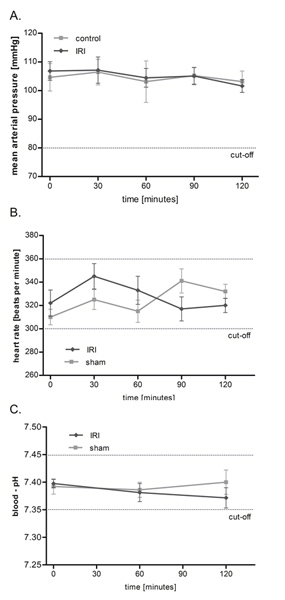
그림 2. cremaster 근육의 IRI는 평균 동맥 압력 (MAP), 심장 박동과 혈액 산도에 영향을주지 않습니다. 동맥 압력 ()와 심장 박동수 (B)를 평균의 오른쪽 canulation 후 압력 변환기를 통해 실험을하는 동안 30 분 간격으로 관측되었다 경동맥. 동맥 혈액 산도 (C)의 측정은 0, 60 이후 공연, 120 분이 었지. 값은 평균 ± 6 개의 쥐의 SEM이며 상당한 간 그룹의 차이없이 생리적 수준에서 원거리. 큰 그림을 보려면 여기를 누르십시오 .
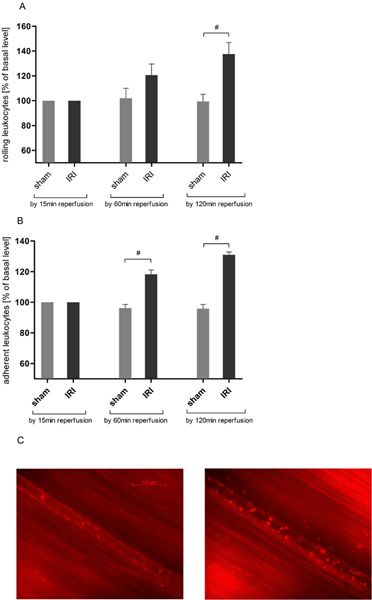
그림 3. IRI는 백혈구 증가cremasteric 유통 인 - 내피는 상호 작용. intravital epifluorescence 현미경은 조직의 국소 빈혈 30 분 후에 120 분 프로토콜을 통해 reperfusion 상해에있는 백혈구 - 내피 상호 작용을 결정하는 데 사용되었다 rhodamine 6G (0.4 밀리그램 / kg 체중)으로 leukocytes의 레이블링 후에. 기록은 대략의 배율 × 800 버렸지만. 백혈구 롤링 국소 빈혈을 받다 않았 cremasteric 조직에서 실험을하는 동안 안정적으로 남아있는 반면, A. IRI가 크게 reperfusion 120 분 cremaster 근육의 postcapillary venules의 압연 leukocytes의 수가 증가하게됩니다. 값 의미하고 ± 6 관찰된 쥐의 SEM합니다. # P <0.05 unpaired t 테스트를 사용합니다. B. 자기편 leukocytes의 수가 크게 cremasteric의 국소 빈혈의 30 분, 조직 reperfusion의 후속 60분 후 무작위로 선택된 200μm postcapillary 선박 섹션에서 증가하고 있습니다. 결과도 MO를 얻을두 시간 reperfusion 기간이 지나면 발음 있구만. 값 의미하고 ± 6 관찰된 쥐의 SEM합니다. # P <0.05 postcapillary venule의 C. 대표 사진 전에 국소 빈혈 (왼쪽)에 적용됩니다. unpaired t 테스트를 사용하고 IRI (오른쪽) 후 120분가. 큰 그림을 보려면 여기를 누르십시오 .
토론
백혈구 - 내피 상호 작용, 반응성 산소 종의 생산과 보완 시스템의 활성화 IRI 유발 조직의 기능 장애의 주요 기능입니다. 영향을받는 조직 중 26 microcirculation가 염증 발병에 대한 통합 사이트로 간주됩니다. 이외에도 이러한 흐름 챔버 assays 27, 28 등 전직 생체내 실험에서 더 나아가 생체내 관련에서 평가하는 intravital 이미징 잘 창업 모델을 제공할 의무이다. IRI는 여러...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
이 작품은 SU Eisenhardt로 "도이치 Forschungsgemeinschaft"(EI 866/1-1)의 교부금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 장비의 명칭 : | 회사명 : (주) | 카탈로그 번호 : | 의견 : |
| Forene 백퍼센트 (V / V) | 대수도 원장 | B506 | API isoflurane |
| Terylene 봉합사 | Serag Weissner | OC108000 | |
| Portex 파인 Polythene 튜빙을 내경 | 의료 스미스 (Smiths) | 800/100/100 | 0.28 mm 내경 |
| 0,9 % 생리 식염수 | Fresinus Kabi | 808,771 | |
| 변경 - 어 - 팁 디럭스 소작 키트 | Bovie 의료 | DEL1 | |
| Abbocath-T 14G | Venisystems | G713- A01 | 렌즈 튜브로 사용 |
| 서보 환풍기 900C | Maquet | 동물 ventialtor로 사용 | |
| 논리 압력 변환기 | 의료 스미스 (Smiths) | MX1960 | |
| Sirecust 404 모니터 | 지멘스 | ||
| ABL 700 Benchtop 분석기 | 라디오 미터 | 혈액 가스 측정을위한 | |
| 생리대 | Effenberger | 8319 | |
| 알루미늄 무대 | Alfun | AW7022 | |
| 외과 현미경 OPMI 6-SDFC | 칼 자이스 혈구 | ||
| Microsurgical 악기 연구소의동부 표준시 | S & T | 767 | |
| Biemer 용기 클립 | Diener | 64.562 | |
| 포셉 적용 | Diener | 64.568 | Biemer 용기 클립을위한 |
| Rhodamine 6G | 시그마 - 올드 리치 | R4127 | |
| 바셀린 하얀 DAB | Winthrop | 2,726,853 | |
| 안경을 커버 | 32x32 mm | ||
| Intravital 설치 | |||
| Zeis Axio 범위-1 MAT | 칼 Zeis | 490,036 | epifluorescence 현미경 |
| 470 nm의은 LED가 | 칼 Zeis | 423,052 | 형광 광원 |
| Colibri 2 시스템 | 칼 Zeis | 423,052 | |
| W 플랜 - 고차 색지움 20x / 1,0 DIC | 칼 Zeis | 421,452 | 물 침지 목표 |
| AxioCam MRM 목사 3 파이어 와이어 | 칼 Zeis | 426,509 | 고해상도 디지털 카메라 |
| Axio LE 비전 소프트웨어 | 칼 Zeis | 410,130 | 오프라인 분석을 위해 사용 |
참고문헌
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유