Method Article
벤치 탑 생물 반응기의 운전
요약
발효조는 했나 보지 세포의 배양 수율과 생산성을 향상하는 데 사용됩니다. 쉐이크 플라스크에서 여러 미생물이나 동물 세포 배양 후보를 심사 한 후, 다음 논리적 단계는 발효기로 선택한 문화의 바이오 매스를 증가시키는 것이다. 이 동영상은 일반적인 벤치 탑 생물 반응기 시스템의 설치 및 운영을 보여줍니다.
초록
발효 시스템은 세포 배양의 다양한 유형에 대한 최적의 성장 환경을 제공하는 데 사용된다. 정중 온도, pH, 특히 용존 산소 농도를 제어하는 발효조 의해 수득 능력은 효율적인 대규모 성장 및 발효 제품의 발현에 필수적인 만든다. 이 동영상은 간단히 쉐이크 플라스크에 발효기의 장점을 설명한다. 또한 일반적인 벤치 탑 발효 시스템의 주요 구성 요소를 식별하고 그 프로브의 용기 및 교정의 설정에 기본 교육을 제공 할 것입니다. 뷰어는 살균 과정을 친숙하고 문화와 용기에 성장 배지에 접종하는 방법이 표시됩니다. 작업, 샘플링, 수확의 기본 개념은 입증 될 것입니다. 간단한 데이터 분석 및 시스템 정리도 논의 될 것이다.
서문
기본 발효 기술은 문화를 성장을위한 간단한 쉐이크 플라스크 기술의 확장입니다. 그것은 더 완전하고 정량적 인 방법에 살고있는 문화에 대한 성장 환경을 제어하는 욕망 성장했다. 일괄 문화 쉐이크 플라스크는 일반적으로 온도의 부정확 한 제어에 의해 제한됩니다. 배양 통 또는 따뜻한 방에서 온도 균일 성이 때때로 5 ° C를 방황하거나 의도 된 설정 값에서 더 높은 변수입니다. 쉐이크 플라스크는 일반적으로 고정 된 속도로 교반되어 있기 때문에, 산소 섭취량 및 가스 교환이 제한됩니다. 가능한 주위 산소가 고갈되면, 대부분의 문화가 번창하고 실패합니다. 쉐이크 플라스크에 pH 조절이 없습니다. 배양 피드 스톡에 의해 제한되지 않으면 많은 경우에, 그것은 문화 손해의 키워드로 산성이되어 호흡이 크게 저하. 대부분의 쉐이크 플라스크 문화는 그들이 inoculatio 또는 문화의 시작 부분에 한 번만 공급하는 것을 의미 '배치'으로 실행됩니다N. 이 초기 탄소원가 소비 된 후, 배양 성장 멈춘다. 어떤 경우에는 그 대사 시프트 및 배양액에서 다른 대사 물질을 소비하기 시작할 때로 얻어진 매스 또는 단백질의 특성을 변화있다. 쉐이크 플라스크는 37 ° C에서 따뜻한 문화 환경, 24 시간 당 볼륨의 일반적으로 10 %에서 미디어 증발 손실에 일반적으로 적용됩니다 이 손실은 문화의 밀도를 변화시키고 시스템의 장기 운전을 금지한다. 마지막으로, 사용자는 교반 후 미디어에서 발포가 발생할 수있다. 문화 위의 빈 공간에있는 거품의 발생은 가스 교환 및 추가 뒷무릎 관절의 성장을 제한합니다.
기본 발효 시스템은 이러한 제한을 모두 해결하기 위해 설계되었습니다. 주의 깊은 온도 제어는 임펠러 교반 및 가열 재킷을 이용하여 발효 용기에 달성된다. 일반적으로이 재킷의 가열과 냉각의 용기와 피드백 제어에 삽입 된 센서설정 값 주위에 0.1 ° C ± 온도 제어의 결과. 벤치 탑 발효조는 일반적으로 펌프를 통해 액체 시약의 추가를 통해 pH를 제어 할 수 있습니다. pH 값을 연속적으로 세포의 성장을위한 최적의 환경을 유지하기위한 노력으로 모니터링된다. 적절한 통기가 상기 혼합 임펠러 또는 직접 문화에 공기 또는 산소 보충 가스의 주입에 의해 유지된다. 전단에 민감한 문화와 산소 보충 가스는 문화의 산소 수준의 유지 보수를위한 기본 메커니즘입니다. 솔루션에있는 산소의 측정은 일반적으로 동요 플라스크에 사용하기에 일반적으로 사용할 수없는 폴라 프로브에 의해 달성된다. 연속적 또는 주기적으로 선형 또는 지수 방식으로 성장을 유지하도록 용기에 피드를 추가하는 것도 가능하다. 출구 가스 응축기 따라서 배양 부피와 밀도를 보존 응축 배기 가스 흐름에 대한 증기 차가운 표면을 제공한다. 소포제, 계면 활성제의 정기적 인 추가 작동된다표면에 거품을 줄이고 가스 교환을 허용하는 문화의 전도도에 의해.
용기는 모든 프로브, 피팅, 임펠러, 수확 파이프 및 튜브, 조립 및 표준 오토 클레이브 멸균. 최종 프로브 교정 및 운영 환경 안정화 한 후, 배양 용기에 추가됩니다. 시스템은 쉐이크 플라스크 법에보다 정확하고 정량적 방식으로 배양을 특성화하는데 사용될 수있다. 온도, pH, 산소 함량, 사료 소비량, 액체 증발 및 발포 수준의 엄격한 제어는 모두 더 높은 바이오 매스와 잘 단백질 수율에 기여한다.
프로토콜
- 용기의 설치와 작동을 시작합니다. 기존 발효기 (그림 1)를 설치해야하는 다음과 같은 구성 요소가 있습니다 :
- 산도 프로브 - 라이브 문화의 pH를 측정. 설치하기 전에 프로브를 보정하고 용기와 소독. headplate에 프로브를 설치합니다.
- PO이 프로브 - 발효 동안 용기 중의 용존 산소 함량의 측정. headplate에 설치합니다.
- 문화를 샘플링 수확 파이프. headplate이 높이 조절 구성 요소를 설치합니다.
- 가스 분출는 - 용기의 하단에 위치하며 배양에 가스 주입을 제공한다. 발효기에 가스 소스에 분출을 걸고 headplate에 탑재합니다.
- 임펠러 샤프트와 임펠러 - 임펠러 문화를 혼란스럽게하고 용기있는 문화의 균일 성을 유지하기 위해 중요합니다.
- 배기 가스 응축기 - 배기 경로를 냉각하여 용기 내의 증발 손실을 억제하기위한.
- pH 조절이나 사료 첨가 용 시약 펌프 라인.
- 혈관을 청소하고 물과 비누로 headplate. 부드러운 브러시가 용기와 headplate 세정하는 것이 좋습니다. 염소 표백제 클리너 용기를 세척하는 데 사용될 수 없다.
- 미디어 불안정성 가열하지 않으면 깨끗한 용기에 추가한다. 최대 작동 볼륨에 도달 할 때까지 만 추가 할 수 있습니다. 이 경우, 최대 작동 볼륨은 5 L 총 볼륨 용기 3.3 L입니다.
- O-링 씰이 제대로 장착되었는지 확인 혈관 headplate를 탑재합니다.
- 배기 가스 응축기를 설치.
- 그 10mm 포트에 소포제 프로브를 설치합니다.
- 그 10mm 포트에 수확 관을 설치합니다. 그것의 위에 튜브의 조각을 넣어를 클램프.
- 살포 입구에 튜브와 0.20 μm의 필터를 설치 한 다음이를 클램프.
- 산도 프로브를 보정 :
- 2 작은 비커에 참조 버퍼, 세척 병, 그리고 예비 워싱턴 수집쉬 비커.
- 발효기에 산도 프로브까지를 연결하고 발효기를 켭니다.
- pH를 매개 변수로 이동하고 메뉴 버튼을 사용하여 '칼'옵션으로 스크롤하고 Enter 키를 '입력'.
- 2 점 교정을위한 '2 '를 선택합니다.
- 프로브 팁을 세척하고 낮은 레퍼런스 버퍼에 잠수함. 발효기에 값이 안정됩니다. +를 사용하여 - 키의 pH 기준 버퍼의 값과 일치하도록 표시된 값을 조정합니다. 이 깜박임이 중지되면, 키를 눌러 '입력'.
- 오프 프로브를 세척하고 두 번째 레퍼런스 버퍼에 삽입합니다. 값이 안정화 후 표시된 값이 높은 기준 버퍼 값과 일치하도록 키패드를 사용하는 것을 허용한다. 눌러 확인 '입력'.
- 오프 프로브 팁을 세척하고 발효기에서 분리합니다. 연결에 보호 캡을 넣고 headplate에 설치합니다.
- PO 2 프로브 팁을 열고 저기를 확인하기 위해 확인끝을 커버하기에 충분한 전해질이다. 그렇지 않은 경우, 저수지 일부를 추가하고 위로를 다시 닫습니다.
- headplate에 PO 2 프로브를 설치하고 오토 클레이브 캡의 전기 연결을 보호하기 위해 장착되어 있는지 확인합니다. 그것은 살균 후 보정됩니다.
- 딥 튜브와 에어 필터와 시약의 공급에 대한 병을 얻습니다. 딥 튜브 포트에 펌프 튜브를 추가하고 발효기에 입구 포트에 다른 쪽 끝을 연결합니다.
- 사용하지 않는 모든 포트에두고 튜브는 오프 튜브 클램프.
- 배기 콘덴서에 0.45 ㎛의 필터를 설치. 이 필터는 선박이 오토 클레이브에 압력을 가하지 않도록한다.
- 미디어의 수준 이하로 내려 가지 모두 튜브가 나오는 용지를 방지하기 위해 오프 고정되어 있는지 확인합니다.
- 121 ° C, 액체 사이클에서 30 분 - 25의 오토 클레이브에 용기를 넣어. 주의 :이 나오는 경우는 매우 뜨겁습니다.
- 발효기의 기초에 용기를 설치합니다.
- 산도를 연결케이블을 조사.
- PO 2 프로브 케이블을 연결합니다.
- 가스 부가 로터 미터에 스파 저를 위로 훅.
- 멸균 딥 튜브를 병에 1 M 수산화 나트륨 시약을 추가하고 기본 펌프 헤드 스핀들 펌프 헤드를 설치한다.
- headplate의 보호관에 온도 센서를 넣어. 이 보호관의 바닥에 길을 모두가는 있는지 확인합니다.
- 혈관 임펠러 커플 링에 교반 팔을 낮 춥니 다.
- 발효기가 켜져 있는지 확인합니다.
- 물이 발효조에 사용할 수 있는지 확인합니다.
- 발효기에 공기 공급 장치의 전원을 켭니다.
- 온도 매개 변수로 이동하고 37 ℃로 온도를 설정 온도 제어를 시작하는 '입력'버튼을 누릅니다. 배는 15 분 이하로 가열한다.
- 분 이하 당 미디어의 1 배 볼륨으로 가스 흐름을 켭니다. 이 설정의 경우, 가스 흐름은 3 L / 분이다. 거품은 하단에 표시됩니다.
- 교반 P로 이동합니다arameter 300 rpm으로 설정합니다. 눌러 교반을 켜 '입력'.
- 온도가 37 ° C에 도달하면, pH를 매개 변수로 스크롤 6.8로 설정합니다. '입력'버튼을 눌러 pH 조절을 켜십시오.
- 실행을위한 1,000 RPM의 최대 속도로 교반을 설정합니다.
- PO 2 프로브가 적절한 값을 표시하는 데 적절 편광되어 있는지 확인합니다. 2 시간 후, PO 2 매개 변수로 스크롤하고 '보정 기능'을 선택하고 1 점 교정을 선택하려면 '메뉴'버튼을 사용합니다.
- 15 분 후, 100 및 언론에 값을 설정하기 위해 커서를 사용 '입력합니다.' 이 PO 2를 보정합니다.
- 교반으로 이동하여 300 rpm으로 설정합니다.
- '메뉴'버튼을 사용하여,의 교반 메뉴 '에서'에 '폭포'를 켭니다. 이렇게 기포를 잘게 나누어 성장 수요가 증가함에 따라 용액에 더 많은 산소를 강제하기위한 노력으로 교반 속도를 증가시킬 것이다.
- PO 2 매개 변수로 이동하고 값을 30으로 설정합니다. PO 2 시작 '입력'버튼을 누릅니다.
- PC에 제어 소프트웨어 패키지를 시작합니다.
- 프로브를 보정되면, 교반 300 rpm에서 안정되어 온도가 37 ° C에 있고 pH가 6.8 부근에 있습니다, 그것은 접종하는 시간이다. 알코올을 사용하여, 접종에 사용될 포트 살균.
- 주사기로 접종을 그리고 살균 포트에 추가 할 수 있습니다. 포트를 닫습니다.
- 로그 북 접종의 시간을 표시합니다.
- 그것은 멸균시에 샘플을 채취하는 것도 중요하다. 알코올로 수확 파이프 튜브의 단부를 살균.
- 수확 포트를 덮고있는 클램프를 열고 샘플을 그리는 주사기를 사용합니다. 이 파이프에 앉아 되었기 때문에 첫 번째 샘플은 일반적으로 폐기된다.
- 다른 샘플을 뽑아 다른 주사기를 사용합니다.
- 세 번째 주사기, 많은 죽은 볼륨을 제거하기 위해 파이프를 통해 다시 공기를 밀어줄에서와 라인을 클램프.
- 세포 밀도 및 산도를 결정하고 값을 기록한다. 미생물 배양, 그것은 값마다 시간을 기록하는 데 유용합니다. 간격은 문화에 따라 다릅니다.
- 성장이 완료된 후에 수확 방법은 문화권의 의도에 따라 달라집니다. 이 경우, 배양보기 셀 밀도 및 습윤 세포 중량 가능한 산도 또는 측정 용 끝점 값을 수신 할 최종 시간을 샘플링. 표백제 나 다른 항균제와 지정된 "킬 탱크"내용의 배치 headplate를 엽니 다.
결과
생물 반응기는 IRIS 소프트웨어와 함께 또는없이 실행할 수 있습니다. 그러나 데이터를 캡처,이 소프트웨어를 사용하는 것이 가장 좋은 방법입니다. 박테리아를 첨가하기 전에, pH와 산소 센서는 임펠러 속도 세트와 설정 온도를 보정해야합니다. 도 2에서, 바이오 리액터 실행에 대한 데이터가 출력되게된다. 온도는 30 ° C, 200 rpm에서 임펠러 속도로 설정했다. 매개 변수는 각 실험에 대해 서로 다른 경우가 있습니다 만, 박테리아를 첨가하기 전에, 시스템이 정상 상태에 있어야합니다. 도 3에서, 세균 배양의 첨가와 산소 농도의 변화가 도시된다. 이 실험의 세트 포인트는 37 ° C, 70 %에서 200 rpm으로, O 2의 활동가입니다. 시간 19:20, 공급 펌프는 즉시 O 2 수준에 드롭의 원인 0.1 OD에서 세균 씨앗 문화를 제공합니다. 생물 반응기는 공기의 흐름과 임펠러 속도의 증가와 변화하는 O 2 수준에 응답합니다. 티증가에 대한 자신이 설정 지점은 계단식 (스텝 35)에 설정되어 있습니다. 반응 pH는 pH가 시간이 지남에 따라 pH가 라인 변동 (도 4)에 의해 설명되는 것과 같이 증가 후 감소함에 따라, 실시간으로 모니터링 하였다. 전체 실행을 분석 할 수 있으며, 매개 변수는 다음 실험을 위해 조정.

그림 1. 표지와 연결되어있는 모든 부품과 벤치 탑 생물 반응기는.이 그림은 실행의 시작 부분에서 교반 탱크 반응기를 보여줍니다. 반응기의 부분은 표시 및 센서, 임펠러, 온도 게이지, 공급 및 샘플링 병, 배기 포트, 공기 압력 게이지, 난방 재킷, 콘덴서 타워 및 제어 패널을 포함한다.

그림 2. 생물 반응기 강도의 화면 이미지실행의 시작 부분에 tware. 교반 탱크 실행의 시작에서, 온도는 30 ° C (노란 선)으로 설정하고, 200 분당 회전 수 (빨간 선), 6.5 (녹색 선)에서의 pH 및 PO 2의 임펠러 속도 57.2 % (블루 라인)에서. 큰 그림을 보려면 여기를 클릭하십시오 .
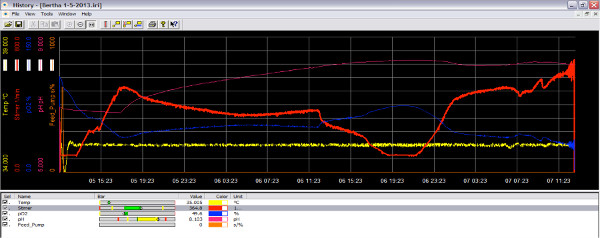
그림 3. 산소와 같은 주행중 생물 반응기 소프트웨어의 화면 이미지는 배양 활성 성장 단계에있을 때, 산소를 소비하고, 반응기 내의 산소의 양을 (청색 선) 감소된다. 감소한다. 임펠러의 속도를 향상시켜, 더 많은 산소는 문화 (레드 라인)에 추가 할 수 있습니다. 큰 그림을 보려면 여기를 클릭하십시오 .

그림 4. 문화의 시간에 따른 pH 변화를 보여주는 생물 반응기 소프트웨어.의 pH의 화면 이미지가 지속적으로 감시하고, 시간이 지남에 따라 그것은 젖산이 생성 될 때 감소하고 기본이 생물 반응기 (파란색 선)에 추가로 증가한다. 큰 그림을 보려면 여기를 클릭하십시오 .
토론
교반 탱크 생물 반응기는 생명 공학 업계의 표준이며, 40 년 이상 1 사용되고있다. 작은 교반 탱크 스케일 업, 스케일 다운, 변형 최적화, 특성, 및 프로세스 개발을위한 중요했다. 또한 개별화 약 2의 개발에 중요한 역할을 할 수있다. 그것은 모니터링 및 실행을 통하여 최적화 될 수 있기 때문에 소규모 생물 반응기는 세포 성장을위한 인 시츄 상태에서 가장 유사한. 대부분의 경우, 초기 실험은 쉐이크 플라스크를 사용하여 수행됩니다 만, 작은 규모의 생물 반응기의 조건은 쉐이크 플라스크에서 크게 다르다. 한 실험에서 우리는 발견 E.의 최적 성장을위한 조건 대장균과 쉐이크 플라스크에 녹색 형광 단백질 (GFP)의 생산은 교반 탱크 (게시되지 않은 데이터)를 번역하지 않았다.
큰 규모의 성장 세포의 다른 방법은 롤러 병, 하나의 U 포함SE는 각각의 방법은 50에서 5,000 L.하기 위해 노력하고 볼륨과 플랫폼 생물 반응기 3 큰 단일 사용 생물 반응기를 흔들 스케일 업에 대한 도전을 제공하지만, 생산 장소를 발견했다. 플랫폼 생물 반응기를 흔들 단일 사용은 교반 탱크와 유사하며, 규제 환경을 제공합니다. 그것은 세포 침전을 방지하고 산소를 제공하는 웨이브를 발생시키는 것으로 인한 요동을 발생하는 혼합 교반 탱크에서 다르다. 이 방법은 유체 역학 교반 탱크 상이한 최대 볼륨이 차이는 세포 성장 및 제품 생산에 영향을 미칠 수 1000 L.에 한정되어있다. 다른 하나의 사용 시스템, 인프라 및 연관된 오버 헤드가 최소 플랫폼을 제공하는 일회용 반응기로 교반 탱크를 결합하고, 높은 처리량 능력을 생물학적 공정 4.
벤치 탑 생물 반응기의 새로운 사용자는 문제의 pH, PO 2 템의 초기 설정 값을 결정이있을 수 있습니다perature하지만, 발표 된 연구는 이러한 정보 5, 6, 7, 8, 9에 대해 참조 될 수있다. 특히 세균 배양으로, 그것은 통 플라스크와 같은 설정 값의 온도와 같은 속도로 교반을 시작하는 것이 좋습니다. 이전 쉐이크 플라스크 실행에서 배양 pH는 또한 출발점으로 사용될 수있다. PO 2 값의 설정은 더 어렵습니다 일반적으로 실험적으로 결정된다. 그러나, 50 % PO 2로 시작하는 것은 권장 출발점입니다.
공개
저자 A. 마그노는이 문서에서 사용되는 시약 및 악기를 생산 ATR 생명 공학의 직원입니다.
감사의 말
이 프로젝트는 존스 홉킨스 대학, 게이트웨이 과학 이니셔티브를 통해 사무장의 사무실에 의해 부분적으로 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| LB broth | Sigma | L3022 | |
| ampicillin | Sigma | A1593-25G | |
| LB broth | Sigma | L3022 | |
| antifoam 204 | Sigma | A8311 | |
| 1 M Sodium Hydroxide | Sigma | 38215-1EA-R | |
| Reference Buffer, pH 4.00 | Sigma | B5020 | |
| Reference Buffer, pH 7.00 | Sigma | B4770 | |
| pO2 probe electrolyte | Broadley James | AS-3140-C30-0025 | |
| 0.45 micron filter | Cole Parmer | EW-02915-22 | |
| 0.22 micron filter | Cole Parmer | EW-29950-40 | |
| Luer Lock syringe, 10 mL | Cole Parmer | EW-07940-12 | |
| Minifors Bioreactor | Infors HT | B-Pack 5.0 | |
| Air Admiral air pump | Cole Parmer | EW-79202-00 | |
| 1175 PD Chilling circulator | VWR | 13721-204 |
참고문헌
- Shuler, M., Kargi, F. . Bioprocess Engineering Basic Concepts. , (2002).
- Hambor, J. Bioreactor Design and Bioprocess Controls for Industrialized Cell Processing. BioProcess International. 10 (6), 22-33 (2012).
- Julien, C., Whitford, W. Bioreactor, Monitoring, Modeling and Simulation. BioProcess International. 5 (01), S10-S17 (2007).
- Fike, R. Nutrient Supplementation Strategies for Biopharmaceutical Production. Part 1: Identifying a Formulation. BioProcess International. 7 (11), 46-52 (2009).
- Jana, S., Deb, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Appl Microbiol Biotechnol. 67, 289-298 (2005).
- Wang, Z., Ly, M., Zhang, F., Zhong, W., Suen, A., Hickey, A. M., Dordick, J. S., Linhardt, R. J. E. coli K5 fermentation and the preparation of heparosan, a bioengineered heparin precursor. Biotechnol. Bioeng. 107, 964-973 (2010).
- Baltz, R. H., Demain, A. L., Davies, J. E. . Manual of Industrial Microbiology and Biotechnology. , (2010).
- Infors, H. T. . Minifors operating Manual and user guide. , .
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유