Method Article
이중 색깔 시간 게이트 자극 방출 고갈 (STED) Nanoscopy에 의한 면역 시냅스의 시각화
요약
여기에서 우리는 두 가지 색상 STED의 nanoscopy에 의해 유리에 효과적으로 요약 NK 세포의 세포 독성 면역 시냅스 이미징을위한 프로토콜을 보여줍니다. 이 방법을 사용하여 우리는 시냅스 단백질과 세포 골격의 하위 100 nm의 분해능을 얻을 수 있습니다.
초록
자연 살해 세포는 바이러스 성 감염이나 종양 형성 세포를 용해하기 위해 단단히 규제, 미세 조정 면역 시냅스 (IS)를 형성. 액틴 동적 재구성은 NK 세포의 기능 및 IS의 형성에 중요하다. 시냅스에서 F - 굴지의 영상은 전통적 그러나 빛의 회절 한계는 약 200 nm의, 공 초점을 포함하여, 형광 현미경의 해상도를 제한, 공 초점 현미경을 이용하고있다. 이미징 기술에서의 최근 진보는 subdiffraction 한정 초해 촬상의 개발을 가능하게했다. IS에서 F-액틴 구조를 시각화하기 위해 우리는 유리에 수용체를 활성화에 NK 세포를 부착하여 NK 세포의 세포 독성 시냅스를 요점을 되풀이하다. 우리는 다음 두 가지 색 자극 방출 고갈 현미경 (STED)를 사용하여 그 이미지 단백질. 이 시냅스에서 <80 nm의 해상도가 발생합니다. 여기서 우리는 샘플 준비 및 이중 코르를 사용하여 이미지의 취득 단계를 설명또는 NK에 F-액틴을 시각화하는 STED의 nanoscopy입니다. 우리는 또한 라이카 SP8 소프트웨어 및 시간 게이트 STED를 사용하여 샘플 수집의 최적화를 보여줍니다. 마지막으로, 우리는 이미지의 사후 처리 컨볼 루션에 대한 호이겐스 소프트웨어를 사용합니다.
서문
면역 시냅스 단백질 및 세포 골격 성분을 신호의 복잡한 환경이다. 세포 용해 시냅스는 원래 중앙 분비 도메인 1-4을 둘러싼 말라 접착 분자의 반지와 같은 구조 "황소의 눈"을 가진 것으로 설명했다. 그러나, 우리는 지금이 기능 5-11 연속 동적 골격 재구성을 요구하는 활성 신호의 미세한 영역으로 구성되어 있음을 알고있다. 시냅스에 대해 우리가 가지고있는 정보의 대부분은 현미경에서 파생되었으며, 면역 최첨단 이미징 기술의 초기 채택하고있다.
하나는 이러한 새로운 기술은 초 고해상도 현미경입니다. 통상적 인 광 현미경 공간적 약 200 nm에서의 촛점을 포함한 모든 형광 현미경 해상도의 하한을 설정한다 광의 회절 장벽에 의해 제한된다. 최근 몇 년 동안, 몇 가지 기술이 발전한되었습니다해상도 회절 장벽 그 이하 D. 이러한 자극 방출 고갈 현미경 (STED), 구조화 된 조명 현미경 (SIM), 확률 론적으로 해결 현미경 (STORM), 및 광활성 광학 현미경 (PALM) 등이 있습니다. 이 기술은 다른 곳에서 자세히 12-15 리뷰되었지만, 아래에 설명되어 있습니다. Subdiffraction 제한된 해상도는 각 시스템에 고유 한 방법으로 생성됩니다. 초 해상 기술의 선택은, 그러므로, 또한 실험 및 실험 시스템에 의해 결정되어야한다.
STED 수퍼 해상도 subdiffraction 제한된 형광 현미경 16-18의 결과, 다음의 여진 또한 각 형광체의 주위에 선택적으로 "침묵"형광 고강도 토로 이달 공핍 빔을 이용하여 달성된다. STED의 장점 중 하나는 이미지 수집이 빠른이며 비교적 작은 후 처리가 필요하다는 것입니다. 염료의 선택은 사양에 의해 결정되는 동안상업적으로 사용 가능한 시스템에서 592 nm에서 위치한 고갈 빔의 TRAL 위치는 여러 가지 상업적으로 이용 가능한 염료는 두 개의 형광 물질의 조합을 가능하게하는 것을 사용할 수 있습니다. 또, GFP 등의 일반적으로 사용되는 형광 리포터 19,20 생균 실험이 가능하게 묘화 될 수있다.
우리는 이전의 탈과립 (21, 22)에 대한 NK 세포에 의해 이용되는 F-액틴 hypodensity의 영역을 식별하고 정량화 STED를 사용했습니다. 우리는 STED 인해 형광체 및 XY 축 해상도가 뛰어난 개선 상대적으로 유연한 가용성 면역 시냅스 이미징을위한 좋은 선택이다 것을 제안한다. 또,이 실험에 이용 시판 STED 시스템에서 고속 (12,000 Hz에서) 공진 스캐너의 사용은 샘플에 대한 피해를 최소화하는 이미지의 신속한 획득을 허용한다. 염료의 선택에 제한 유연성, STED (12)의 단점으로 간주됩니다그러나 이중 색상 STED는 여러 가지 상업적으로 이용 가능한 형광 상대적으로 간단합니다. STED는 두 개의 채널로 제한하는 동안, 추가 구조는 약 200 나노 미터 (E. 메이스, 게시되지 않은 관찰의 해상도 공 촛점 군데 할 수 있도록 레이저 스캐닝 공 초점 현미경 STED의 통합은 또한, STED와 함께 추가 공 촛점 이미징 수 있습니다 ). 우리는 면역 세포를 묘화 STED의 사용을 설명하지만,이 기술은 신경 세포를 포함한 세포 유형의 다양한 셀 구조의 다양한 23-26 시각화를 위해 적용된다.
SIM은 subdiffraction 제한 이미지를 생성하는 다른 방법을 사용합니다. 알려진주기적인 여진 패턴을 시각화함으로써 정보는 수학적 변환 27 다음 연구되고 알려지지 구조에 대해 얻을 수있다. 이것은 ~ 100 nm의 횡 방향 (28, 29)에 해상도의 증가를 얻을 수 있습니다. SIM의 장점은 내가의 모든 표준 공 촛점 염료 및 프로브와 호환 그러나 단점은 이미지를 획득하기가 훨씬 느린 이들은 긴 후 처리 (12)를 필요로한다는 것입니다. 이것은 또한 라이브 셀 이미징에 대한 사용을 제한합니다.
마지막으로, 수퍼 - 해상도 이미지는 형광체의 확률 광 스위칭함으로써 발생 될 수있다. 이 방법은 사진 활성화 현지화 현미경 (PALM)과 확률 적 광학 재건 현미경 (STORM)에 이용된다. 여러 카메라의 프레임을 스캔하고 시간이 지남에 "온"과 "오프"설정되어 무작위로 활성화 분자를 로컬 화하여, 20 ~ 30 nm의 해상도를 가진 이미지는 축적 된 프레임 30-32에서 생성됩니다. 이 해상도에 대한 트레이드 오프는 이미지를 수집하는 데 필요한 시간입니다.
여기에 우리가 자세히 보여, 준비하고 STED 듀얼 컬러 샘플 이미징을위한 프로토콜입니다. 이 시스템에서, 여자는 펄스, 조정 가능한, 흰색 빛의 레이저입니다. 때문에 자연펄스 여기 빔의 검출 시간 게이팅을 가능하게하고 더 해상도는 증가됩니다. 또한, 시스템은 이와 같이 낮은 레이저 전력 요건을 허용 가돌리늄 하이브리드 종래 광전자 증 배관 튜브보다 더 민감하다 (HYD) 검출기가 장착되어있다. STED 대한 공핍 빔 연속적인가되어 두 색상 STED 가능 염료의 선택을 지시 할 것이다 592 nm의,에 동조된다. 일반적으로 사용되는 염료의 조합은 일반적으로 (예 : 알렉사 플 루어 488, 오레곤 녹색, 녹색 DyLights, 또는 Chromeo를 488)을 488 nm의에 의해 흥분 하나 (예 : 태평양 오렌지 또는 호라이즌 V500)을 458 nm의에 의해 흥분 하나 있습니다. 두 염료의 검출이 비슷한 범위에있을 것입니다 (모두가 고갈 레이저에 의해 액세스 할 수있는) 동안 따라서, 여기에서는 서로 다른 파장으로 발생합니다. 조정 가능한 백색광 레이저 조정할 수있는 검출기로, 스펙트럼 중복을 제거하면서 신호를 극대화하는 것은 매우 쉽게 구성되어 있습니다. 따라서, 우리는 combinat 좋은 성공이 있었다이러한 태평양 오렌지와 (여기에 사용) 알렉사 형석 488으로 상업적으로 이용 가능한 염료의 이온. 우리의 프로토콜은 사람들에게 제공하고 그 실험실의 역사 초점을 나타내는 인간 NK 세포의 평가를 설명한다. 즉, 우리는 정기적으로 우리의 실험적인 작업 21,33에 적용한 하나로서 우리는 특히이 예에서 NK92 세포주를 활용하고 있습니다.
프로토콜
1. 항체와 코트 커버 슬립
- Prewarm (37 ° C에서) RPMI 10 % FCS 미디어 30 ㎖ 및 BD Cytofix / Cytoperm 1 ㎖를.
- 인산염 완충 생리 식염수 (PBS)의 정제 된 항체의 5 ㎍ / ㎖의 용액을 준비합니다. NK92 세포주, 항 CD18의 사용 및 안티 NKP30의 활성화를 위해 좋습니다.
- PAP 펜을 사용 # 1.5 coverslip에 각 조건에 대한 표시 한 약 한푼 크기의 원. 이중 스테인드 흠,, 두 개의 단일 스테인드 조건 : 듀얼 컬러 실험, 네 가지 조건이 있어야합니다. 각 지역에서 항체 용액 200 μl를 분배하고, 30 분 동안 37 ° C에서 알을 품다.
- 부드럽게 실온에서 50 ML 원뿔 튜브에 PBS의 각 50 ㎖에 침지 커버 슬립을 씻으십시오. 세탁 전에 세포 치료가 커버 슬립에 항체 건조를 방지하기 위해주의해야한다의 추가에 즉시 발생한다.
2. 커버에 NK 세포를 활성화전표, 수정 및 투과
- 조건 당 5 × 5 NK92 세포를 분리. 원심 분리기 및 뜨는 캔트. 단계 1.1에서 10 ㎖ 예비 가온 미디어에 한 번 씻으십시오. 원심 분리기 및 뜨는 캔트.
- 2.5 × 10 6 / ml의 농도 단계 1.1에서 예비 가온 미디어에 Resuspend 세포.
- 부드럽게 섹션 1.2.1에서 생성 영역의 중심에 200 μl를 가만히 따르다. 5 % CO 2에서 20 분 동안 37 ° C에서 알을 품다. (참고 :이 시간은 그 생물학적 기능에 따라 확장 또는 감소시킬 수있다 NK 세포 과립 편광를 들어, 20 분은 충분합니다.).
- 세포의 배양 후, 부드럽게 50 ML 원뿔 튜브에 실내 온도 PBS 50 ㎖에 각각 침지의 coverslips을 씻어.
- 철저하게 단계 1.1와 소용돌이에서 데워진 수정 / 파마 액 1 ㎖에 트리톤 (Triton) X-100의 1 μl를 추가합니다. 세포에 수정 / 파마 버퍼 (단계 2.3) 200 μl를 추가하여 수정하고 투과. 10m 품다실온에서 어둠 속에서.
3. 얼룩 세포
- 버퍼를 염색 준비 인산염은 식염수 (PBS), 1 % BSA, 0.1 % 사포닌을 버퍼.
- 1 차 항체 솔루션을 준비합니다 200 μL 염색 완충액 (단계 3.1 참조). (주 : 항체를 사용하기 전에 적정해야한다). 코트 커버 슬립 (단계 1.2)를 사용하는 동일한 종에서 발생하는 일차 항체의 사용을 피하십시오. 또한 STED 이미징 Strepatividin - 바이오틴 결합을 피하십시오.
- 2.3.1 다음, 부드럽게 버퍼를 염색 50 ㎖에 커버 슬립을 씻어. 여분의 버퍼를 제거하기 위해 면봉으로 PAP 펜 영역의 가장자리를 가볍게 두 드리십시오. 3.1.1 절에서 만든 항체 솔루션을 적용합니다. 실온에서 어둠 속에서 30 분 알을 품다. (권장 : 습도를 유지하기 위해 축축한 종이 타월로 슬라이드 상자에 커버 슬립을 품어).
- 에서 이차 항체의 솔루션을 준비합니다 200 μL 염색버퍼. 추천 형광 알렉사 플 루어 488, 태평양 오렌지 및 V500입니다. 일반적으로, 1:200 희석 STED 영상에 적합합니다.
- 부드럽게 버퍼를 염색 50 ㎖에 커버 슬립을 씻어. 여분의 버퍼를 제거하기 위해 면봉으로 PAP 펜 영역의 가장자리를 가볍게 두 드리십시오. 차 항체 솔루션을 적용합니다. 실온에서 어둠 속에서 30 분 알을 품다.
- 그 외 단백질을 세척 및 염색을 반복합니다. Phalloidin의 함께 F-액틴을 검출하는 경우, 이것은 일반적으로 1:200 희석에서, 이차 항체와 함께 포함될 수있다.
4. 슬라이드에 마운트 Coverslips는
- 설치 매체를 준비합니다. 참고 : 머리말이나 머리말 금이 바람직하다. 이 STED와 호환되지 않습니다으로 VECTASHIELD은 피해야한다. Phalloidin의가 사용되는 경우 2,2-thiodioethanol은 피해야한다. MOWIOL이 허용됩니다.
- 슬라이드에 장착 매체의 약 10 ~ 20 μl를 놓습니다. 반전의 coverslip (셀 쪽 아래)과에주의하면서 조심스럽게 커버 슬립을 탑재기포의 도입을 피하기. 24 시간 (최대 coverslip에) 이전 이미지에 대한 슬라이드를 품어.
- 매니큐어의 coverslip의 가장자리를 밀봉.
5. 실험 설정
- 필요한 레이저와 소프트웨어를 시작합니다. 100 % 전력으로 STED 고갈 레이저를 시작합니다. 상용 시스템의 경우 종종 자동화 된 절차 STED 레이저를 맞 춥니 다.
- 접안 렌즈를 사용하는 현미경에, 하나의 스테인드 컨트롤로 시작, 샘플 초점을 맞 춥니 다.
6. 설정의 최적화
- 첫번째 채널을 스캔, 레이저 전력, 여기 빔의 위치 및 검출 범위를 최적화. 가능하면> (100)의 이득을 피하십시오. 설정을 최적화하는 공 초점에서 이미지를 캡처합니다. 라인 및 / 또는 프레임 평균 해상도를 증가 할 것이다. 픽셀의 채도를 확인합니다. 참고 : STED의 응용 프로그램이 방출의 강도를 줄일 수와 같은 일부 채도가 공 초점에서 수락 가능하다. STED를 들어, 최적의 픽셀 크기가 30 나노 미터 이하로하는 방법지금까지 더 나은 해상도가 작은 픽셀 크기를 얻을 수있다. 묘화되는 관심 영역의 사이즈는 화소 사이즈의 하한을 지시 할 것이다. 작은 픽셀 크기는 광표백을 증가시킬 수있다.
- 50 % 고갈 레이저 파워로 시작하는 STED 고갈 빔과 캡처 이미지를 적용합니다. 해상도의 향상을 볼 수있는 경우, 더 많은 공핍 레이저 전력이 적용될 수있다. 이 단계에서, 그것은 여기 레이저 파워 라인 평균 및 / 또는 게인을 조정해야 할 수도 있습니다.
- 배경 (최소 0.3 NSEC)을 줄이기 위해 시간 게이팅을 적용합니다. 공 촛점 이상 해상도의 개선을 볼 수있을 때까지 설정을 조정합니다. 해상도는 전체 폭의 절반 최대 (FWHM)을 추정하여 근사 할 수있다. 이것은 그 구조를 가로 질러 라인 프로파일을 그려서 만든 가우스 피크의 최대 강도의 절반의 거리를 나타내고, 해상도를 추정 널리 사용되는 방법이다.
- 첫 번째 채널이 만족되면, 그 자체의 두 번째 순서를 시작스캔 미미한. 일반적으로, 먼저 긴 파장의 형광을 검사하는 것이 좋습니다. 제 2 채널에서 6.1 단계를 반복합니다.
- 모두 스캔 시퀀스를 하나의 스테인드 컨트롤 이미징에 의해 스펙트럼 중첩의 부족을 확인합니다. 마일드 스펙트럼 오버랩 소프트웨어 스펙트럼 않은 믹싱 기능을 이용하여 보정 될 수있다, 그러나 가능한 한 피해야한다.
7. 이미지 획득
- 이미지를 수집. 양적 이미징의 경우, 적어도 20 개의 이미지 / 조건을 얻기 위해 권장합니다. 정확한 숫자는, 그러나, 표본의 크기 계산과 같은 통계적 접근과 협력의 실험 질문에 따라 정의되어야한다. 실험을 저장합니다.
8. 컨볼 루션
- 디컨 볼 루션 소프트웨어 또는 일괄 처리 프로세서 파일 열기. 소프트웨어를 사용하여 각 채널에 대한 매개 변수를 확인합니다. 각 채널의 여기 및 발광 스펙트럼, STED 고갈 방출, 및 이미징 방향을 확인기 (또는 아래로 이미지가 3 차원 인 경우) 특히.
- 디컨 볼 루션 마법사를 사용하여 Deconvolve. 기본 설정은 그러나 잡음 비율 (SNTR)에 신호를 형광에서 형광으로 다양하고 각 채널을 개별적으로 각각의 실험에 대해 결정해야합니다, 일반적으로 충분하다.
결과
분명히, 최고 해상도의 영상의 기본 목표는 기존의 공 초점 현미경에 비해 개선 될 것입니다. 그러나 차선의 해결책으로 이어질 수있는 몇 가지 일반적인 함정이 있습니다. 다음은 각 실험을 개별적으로 최적화 할 것을 요구하고 있습니다. 우리의 대표적인 실험에서, 우리는 유리에 결합 된 항체에 의해 활성화 된 NK 세포에 F-액틴 네트워크 이미징된다. 다음과 같이 일반적인 원인 (과에 대한 수정) 공 초점에 STED의 개선 된 해상도의 부족은 다음과 같습니다 :
- F-액틴 필라멘트의 가난한 해상도로 나타낸 바와 같이에서 샘플링 (그림 1a).이, 입상 및 픽셀 정보의 손실로 이어질 수 있습니다. 증가 라인이나 프레임의 평균은 종종이 문제를 해결 할 수 있습니다.
- 표백 및 / 또는 오버 샘플링 (그림 1b).이 과도한 라인 평균의 결과로 긴 픽셀의 정지 시간으로 인해 발생할 수 있습니다. 또는, 과다 사용으로 포함한 이전 취득 이미지의 오버 스캔의 결과 일 수있다공핍 레이저. 이것은 일반적으로 불투명 또는 뿌연 이미지가 발생합니다. 이렇게 획득 전에 단지 최소한의 관심 분야를 스캔하거나, 가능하다면, 레이저 스캔 속도를 증가시킴으로써 보정 될 수있다. 문제가 계속되면 고갈 레이저 출력이 감소 될 수있다.
올바른 픽셀 드웰 시간의 균형, 여기 레이저 전력 및 공핍 레이저 파워, 향상된 해상도 및 충분한 정보 화상을 달성하여 (도 1C)를 생성 할 수있다. 해상도는 상기 컨볼 루션 (도 1D)의 사용에 의해 개선 될 수있다. 인수가 최적화 될 때, 디컨 볼 루션은 모두 질적 및 양적으로 해상도를 향상하고 하위 100 nm의 해상도는 일상적으로 달성해야한다.
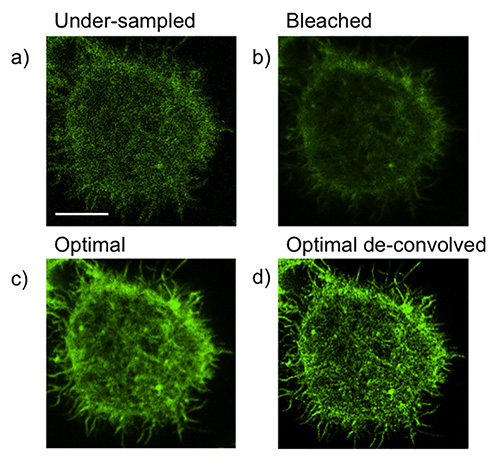
수집 및 STED 이미징의 일반적인 함정의 그림 1. 최적화. NK92 세포는, 다음 고정 20 분 동안 안티 CD18 및-NKP30 코팅 유리 활성화 permeabilized 및 Phalloidin의 알렉사 플 루어 488와 F-액틴을 위해 염색 하였다.) 예 때문에 아래의 샘플링. b)에 의한 최적의 조건을 컨볼 루션과 해상도에 큰 개선으로 이어질 표백 / 오버 샘플링 C) 조건에 최적화 된 D)에 해상도의 손실의 예에 영상 정보의 손실. 스케일 바 = 5 μm의.
토론
공 촛점을 통해 해상도 개선은 제어 할 수없는 요인에 따라 다소 의존한다. 이러한 요인 커버 슬립 두께와 설치 미디어 불일치에 대한 약간의 수차 (가) 있습니다. 그것은 가능한 일관으로서 촬상 방에 온도와 습도를 유지하는 것이 중요하고, STED 빔은 대략 매 60 분을 재편성한다. 절차에서 언급 한 바와 같이이 STED와 호환되지 않습니다으로, VECTASHIELD 설치 매체의 사용은 피해야합니다. 또한 어떤 사람은 항상 # 1.5 커버 전표를 사용하며, 사용 가능한 경우, 특정 두께로 확인 된 그들을를 사용합니다.
여기에 설명 된 방법 중 하나를 수정 STED 빔보다 더 긴 파장에서 방출 형광 물질을 사용하여 공 초점에있는 이미지 추가 채널이다. 이러한 방식으로, 네 개의 채널 (공 초점 두, STED에서는 2 개)까지 1 캔 이미지. 이 접근법을 복용하는 경우, 그러나, 형광체와 함께 채널 ESTED 빔의 응용 프로그램이 이러한 채널에서 광자를 소모하므로 STED 고갈 레이저 위 mitting 먼저 몇 군데해야합니다. 이 기술 장점 중 하나는 수명이 짧은 (34) 광자에서 방출을 제거하여 공 초점의 해상도를 향상시킬 수있는 시간 게이팅의 응용 프로그램입니다. 그 부근의 이미지를 작성할 때 특히, 시간 게이팅, 펄스 여기 STED에 해당하는 방출 검출기의 타이밍의 사용은 반사 오프 coverslip에 유리에서 배경 형광을 감소합니다. 심지어 STED에 적합하지 실험에서, 펄스 여기 소스를 사용하는 경우, 타임 게이팅은 공 초점의 해상도를 향상시키기위한 유용한 도구가 될 수 있습니다.
STED에서 해상도를 향상시키기 위해 이용 될 수있는 다양한 변형이있다. 하나이 또한 시료에 도달하는 빛의 양이 감소 되더라도, 표준 1 에어리 부에서 핀 홀의 크기를 감소시키는 것이다. 이는 라스베가스를 증가시킴으로써 보상 될 수있다어 전원 또는 이득. 또 분해능을 향상 각 광자에 대해 수집되는 정보의 양을 증가하는 라인 평균을 증가시키는 것이다. 다시, 그러나, 이것은 샘플의 광표백의 비용에있을 수 있으므로 밸런스 해상도 및 표백 사이 쳤다 될 필요가있을 것이다. 마찬가지로, GFP와 같은 형광 단백질의 사용은 표백을 피하기 위해주의 최적화가 필요합니다. 이것은 필요한 경우 STED 레이저 파워를 감소시킴으로써 달성 될 수있다. 긴 시간의 가볼만한 곳으로는 큰 광자 복구 할 수 및 표백을 줄일 수 있습니다. 광표백에 대한 수정은 라이브 STED를 분석 할 때 고려되어야한다.
물론, STED에서 3 차원 영상도 가능하고, 또한 기존의 공 초점 영상을 통해 개선을 제공 할 것입니다. 치료는 z 축에 여러 개의 평면을 이미징하는 동안 발생하는 편차를 보정하기 위해 이동해야하지만 이것은, 그것이 디컨 볼 루션과 결합 할 경우 더욱 그렇다. 만약 호이겐스 소프트웨어를 사용하여deconvolve,이 보정은 "이미지 안정 '기능을 사용하여 얻을 수있다. 이 방법을 사용하여, Z-축에서의 해상도를 향상시킬 것이다. 이것은 또한 상대적으로 가난한 z 축 해상도가 가난한 축 해상도를 가지고, 심지어 이상 단지 자체를 STED 기존의 공 촛점 이미징, 이상 큰 개선이다. STED 여러 스택을 획득하는 동안, 치료는 샘플의 표백을 피하기 위해 촬영되어야 필요 하나이를 위해 라인 평균화 또는 레이저 전력 강도를 감소시킬 수있는 경우. 다시, STED에 적합하지 않은 다른 형광 물질을 이미징하는 경우, 우선 순차 주사에서 공핍 빔의 응용 프로그램이 채널로부터 방출을 방지 할 수 있음에 유의해야한다. 따라서, 혼합 STED / 공 초점 방식은 (592 나노 미터보다 큰 파장에서 방출 채널에서 공 초점 주사를 사용하는 경우는) 불행하게도 3D에 적합하지 않을 것입니다.
요약하면, 우리로 인해 응용 프로그램의 상대적 용이성 방식으로 STED를 선택했다표준 공 촛점 이미징을 통해 해상도 lication 및 개선. 면역 시냅스 이미징의 경우, 우리는 200 nm의를 통해 해결을 할 수 없습니다 F-액틴 구조의 세부 정보를 볼 수있는 효과적이고 가치있는 기술을 입증했다. 이러한 세부 사항의 많은 미묘한 보이지만, 그들은 NK 세포의 기능에 지대한 영향을 가질 수 있습니다. 따라서, 우리는 인간의 건강을 유지하기위한 중요한 정보를 도출에 최신 나노 이미징 기술을 적용하고있다.
공개
저자는 더 경쟁 재정적 이익이 없다는 것을 선언합니다. 이 문서의 일부 출판 비용은 라이카 마이크로 시스템즈에 의해 defrayed했다
감사의 말
우리는 기술 지원을 제프 다니엘스 감사합니다. 이 작품은 JSO에 R01 AI067946에 의해 투자되었다
자료
| Name | Company | Catalog Number | Comments |
| #1.5 cover slips | VWR | 48393-172 | |
| BD Cytofix/Cytoperm | BD Biosciences | 554722 | |
| Bovine serum albumin | Sigma | A2153 | |
| Cotton tipped applicator | Fisher Scientific | S450941 | |
| Falcon centrifuge tubes (50 ml) | VWR | 352070 | |
| Fetal calf serum (FCS) (500 ml) | Atlantic Biologicals | S11050 | |
| Goat anti-rabbit Pacific Orange | Life Technologies | P31584 | |
| Laboratory tissue wipers | VWR | 82003-820 | |
| Nail polish | VWR | 100491-940 | |
| NK-92 cells | ATCC | CRL-2407 | |
| Phalloidin Alexa Fluor 488 | Life Technologies | A12379 | |
| Phosphate buffered saline | Life Technologies | 14190250 | |
| Prolong anti-fade reagent | Life Technologies | P7481 | |
| Purified anti-CD18 | Biolegend | 301202 | |
| Purified anti-NKp30 | Biolegend | 325202 | |
| Purified anti-perforin | Biolegend | 308102 | |
| RPMI 1640 medium (500 ml) | Life Technologies | 11875-093 | |
| Saponin from Quillaja bark | Sigma | S4521 | |
| Super PAP pen | Life Technologies | 008899 | |
| Triton X-100 | Electron Microscopy Sciences | 22142 | |
| Huygens deconvolution software | SVI | Contact company | |
| Leica SP8 TCS STED microscope | Leica Microsystems | contact company |
참고문헌
- Stinchcombe, J. C., Bossi, G., Booth, S., Griffiths, G. M. The immunological synapse of CTL contains a secretory domain and membrane bridges. Immunity. 15 (5), 751-761 (2001).
- Grakoui, A., Bromley, S. K., Sumen, C., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Orange, J. S., Harris, K. E., Andzelm, M. M., Valter, M. M., Geha, R. S., Strominger, J. L. The mature activating natural killer cell immunologic synapse is formed in distinct stages. Proc. Natl. Acad. Sci. U.S.A. 100 (24), 14151-14156 (2003).
- Treanor, B., Lanigan, P. M., Kumar, S., et al. Microclusters of inhibitory killer immunoglobulin-like receptor signaling at natural killer cell immunological synapses. J. Cell Biol. 174 (1), 153-161 (2006).
- Abeyweera, T. P., Merino, E., Huse, M. Inhibitory signaling blocks activating receptor clustering and induces cytoskeletal retraction in natural killer cells. J. Cell Biol. 192 (4), 675-690 (2011).
- Beemiller, P., Jacobelli, J., Krummel, M. F. Integration of the movement of signaling microclusters with cellular motility in immunological synapses. Nat. Immunol. 13 (8), 787-795 (2012).
- Campi, G., Varma, R., Dustin, M. L. Actin and agonist MHC-peptide complex-dependent T cell receptor microclusters as scaffolds for signaling. J. Exp. Med. 202 (8), 1031-1036 (2005).
- Mossman, K. D., Campi, G., Groves, J. T., Dustin, M. L. Altered TCR signaling from geometrically repatterned immunological synapses. Science. 310 (5751), 1191-1193 (2005).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25 (1), 117-127 (2006).
- Yokosuka, T., Sakata-Sogawa, K., Kobayashi, W., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol. 6 (12), 1253-1262 (2005).
- Toomre, D., Bewersdorf, J. A new wave of cellular imaging. Annu. Rev. Cell. Dev. Biol. 26, 285-314 (2010).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. J. Cell Biol. 190 (2), 165-175 (2010).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Mace, E. M., Orange, J. S. New views of the human NK cell immunological synapse: recent advances enabled by super- and high-resolution imaging techniques. Front. Immunol. 3, 421 (2012).
- Hell, S. W., Wichmann, J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt. Lett. 19 (11), 780-782 (1994).
- Klar, T. A., Hell, S. W. Subdiffraction resolution in far-field fluorescence microscopy. Opt. Lett. 24 (14), 954-956 (1999).
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proc. Natl. Acad. Sci. U.S.A. 97 (15), 8206-8210 (2000).
- Rankin, B. R., Moneron, G., Wurm, C. A., et al. Nanoscopy in a living multicellular organism expressing GFP. Biophys. J. 100 (12), 63-65 (2011).
- Willig, K. I., Kellner, R. R., Medda, R., Hein, B., Jakobs, S., Hell, S. W. Nanoscale resolution in GFP-based microscopy. Nat. Methods. 3 (9), 721-723 (2006).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), (2011).
- Mace, E. M., Orange, J. S. Dual channel STED nanoscopy of lytic granules on actin filaments in natural killer cells. Commun. Integr. Biol. 5 (2), 184-186 (2012).
- Singh, H., Lu, R., Rodriguez, P. F., et al. Visualization and quantification of cardiac mitochondrial protein clusters with STED microscopy. Mitochondrion. 12 (2), 230-236 (2012).
- Tonnesen, J., Nagerl UV, . Superresolution imaging for neuroscience. Exp. Neurol. 242, 33-40 (2013).
- Kempf, C., Staudt, T., Bingen, P., et al. Tissue multicolor STED nanoscopy of presynaptic proteins in the calyx of held. PLoS One. 8 (4), (2013).
- Jans, D. C., Wurm, C. A., Riedel, D., et al. STED super-resolution microscopy reveals an array of MINOS clusters along human mitochondria. Proc. Natl. Acad. Sci. U.S.A. 110 (22), 8936-8941 (2013).
- Gustafsson, M. G. Surpassing the lateral resolution limit by a factor of two using structured illumination microscopy. J. Microsc. 198 (2), 82-87 (2000).
- Gustafsson, M. G., Shao, L., Carlton, P. M., et al. Three-dimensional resolution doubling in wide-field fluorescence microscopy by structured illumination). Biophys. J. 94 (12), 4957-4970 (2008).
- Schermelleh, L., Carlton, P. M., Haase, S., et al. Subdiffraction multicolor imaging of the nuclear periphery with 3D structured illumination microscopy. Science. 320 (5881), 1332-1336 (2008).
- Betzig, E., Patterson, G. H., Sougrat, R., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 13 (5793), 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys. J. 91 (11), 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy. Nat. Methods. 3 (10), 793-795 (2006).
- Banerjee, P. P., Pandey, R., Zheng, R., Suhoski, ., Monaco-Shawver, L., Orange, J. S. Cdc42-interacting protein-4 functionally links actin and microtubule networks at the cytolytic NK cell immunological. J. Exp. Med. 204 (10), 2305-2320 (2007).
- Vicidomini, G., Moneron, G., Han, K. Y., et al. Sharper low-power STED nanoscopy by time gating. Nat. Methods. 8 (7), 571-573 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유