Method Article
마우스 림프종 모델의 모니터링 종양의 진행과 치료 효과에 대한 생물 발광 기반 종양 정량 방법
* 이 저자들은 동등하게 기여했습니다
요약
생물 발광 영상은 종양과 전이를 지역화 잘 알려진 도구이지만, 이러한 이미지의 정량화는 종종 복잡한 계산 및 특정 장비를 필요로한다. 우리는 더 계산을 요구하지 않으며, 종양 부담과 치료 반응이 마우스 모델에서 관찰 할 수 있도록 정확한 획득 상태에 기초하여, 사용하기 쉬운 luminoscore 방법을 설명한다.
초록
Although bioluminescence imaging (BLI) shows promise for monitoring tumor burden in animal models of cancer, these analyses remain mostly qualitative. Here we describe a method for bioluminescence imaging to obtain a semi-quantitative analysis of tumor burden and treatment response. This method is based on the calculation of a luminoscore, a value that allows comparisons of two animals from the same or different experiments. Current BLI instruments enable the calculation of this luminoscore, which relies mainly on the acquisition conditions (back and front acquisitions) and the drawing of the region of interest (manual markup around the mouse). Using two previously described mouse lymphoma models based on cell engraftment, we show that the luminoscore method can serve as a noninvasive way to verify successful tumor cell inoculation, monitor tumor burden, and evaluate the effects of in situ cancer treatment (CpG-DNA). Finally, we show that this method suits different experimental designs. We suggest that this method be used for early estimates of treatment response in preclinical small-animal studies.
서문
초기 종양 세포 검출 도전 남아 암 치료 효능을 향상시키기위한 중요한 것이다. 생체 내 생물 발광 영상 (BLI)을 널리 작은 동물에서 종양을 모니터링하는 데 매우 중요한 비 침습적 광학 기술이다. 반딧불 루시 페라 제 발현 세포는 일반적으로 같은 실험 1, 2에 사용됩니다. 이 시게나 제는 D-루시페린 분자 산소와 산화하지만이 보조 인자를 필요로 - 마그네슘 2+ 및 아데노신 트리 포스페이트 3. 반딧불 루시 페라 제는 레 닐라 루시퍼 라제 (4)의 양자 수율이 높기 때문에보다 생체 내 이미징을위한 더 적합하다.
산화 된 기판 - oxyluciferin는 - 자연의 기본 상태로 돌아 광자를 방출하고 비활성화됩니다. 방출 된 광자는 530 nm의 주위에 최대 파장을 가지고있다. 고감도 카메라는 작은 동물의 내부에서 발광 된 광자를 검출하고 POSS 확인 화상을 제공 할 수있다종양 세포의 위치를 ible.
광자 계수에 의해 정확하게 종양 부담을 정량화 할 수있는 능력은 치료 효과를 정량화를위한 강력하고 중요한 도구 역할을 할 수있다. 치료 효과가 빨리 검출 될 수 있기 때문에,이 감도는 가능한 치료 효과가되는 정확한 순간을 결정하도록 할 수있다.
총 방출되는 광자의 절대 정량은 매우 복잡하다. 수집 된 광자의 수는 종양의 깊이 및 광자를 통해 출사되는 기관에 의존한다. 조직의 흡수 계수에 기초하여 보정 계수 5를 산출 할 수 있지만, 종양 세포 수의 절대 정량 각각의 종양 세포에 의해 방출되는 광자의 수를 알고 필요. 또한, 많은 리포터 유전자 (예., 형광 단백질)의 같은 루시 페라 제 표현, 심지어 단일 클론 (6)에서 파생 된 세포 집단에서 균일하지 않다. 루시퍼의 수세포 ASE 단백질은 정확하게 계산 될 수 없다. 표준화 된 실험 조건의 설립 따라서 신뢰할 수있는 반 정량 분석을위한 중요한 나타납니다.
우리는 두 개의 서로 다른 마우스 림프종 모델 7, 8, 9에 luminoscore 방법을 적용 하였다. 이 모델에서, 종양 세포 동계 눈에 대하여 각각, 주 인공 림프종 (안구 내) 모델 및 피하 림프종 (SCL) 모델을 얻기 피하 주입된다. 이러한 소성을 각 모델에서 치료 이레위한 안구 내 종양 접종 후, 반응계 내에서 투여되는 종양은 SCL에 대한 최대 직경이 0.5 내지 0.7 cm에 도달 할 때.
우리는 반응계의 CpG 치료의 효과를 모니터링하는 방법 luminoscore 사용 이전 7,10,11 효과적인 것으로 나타났다. 된 CpG 차례로 다수 CE 표현 세포 내 수용체 올리고 뉴클레오티드 서열 및 TLR9의 리간드수지상 세포, B 림프구, 단핵구, 자연 살해 세포를 포함한 면역계의 LLS. 의 CpG-DNA가 된 CpG (CG) 면역 모티브를 포함하는 20 메르의 DNA 서열이다; 제어부 (ODN 제어)는 면역 CG 서열 (GC) 반전되는 점을 제외하고는 같은 20 량체의 DNA 서열이다. 우리가 공부하는 쥐 림프종에 TLR9 참여는 세포 사멸 (10) 유도 면역 시스템 (12)을 활성화하여 크게 종양 부담 7,11을 줄일 수 있습니다.
여기에서 우리는 종양 부담과 생물 발광 영상을 통해 치료 반응을 정량화하기위한 표준화 된 방법을 설명합니다. 이 방법의 신뢰성, 재현성이 아닌 사용자 의존성 및 통계적 유의성을 최적화하기 위해, 획득에서 분석 촬상 과정의 다양한 측면에 의존한다. 생물 발광 정량 인덱스는 각 마우스에 기인한다; 우리는 luminoscore 호출이 값뿐만 아니라, 동물뿐만 알 사이에 비교 될 수있다실험 사이에 그렇게.
본 연구에서 우리는 생물 발광 이미징 절차뿐만 아니라 luminoscore 법에 의한 화상 정량화에 초점을 맞춘다. 우리는 사출 검증 종양 부담을 모니터링 및 시츄 암 치료에서의 효능을 평가하기위한 본 방법의 효과를 나타낸다. 이러한 점 각각은 luminoscore 방법의 적응성을 강조하기 위해 상이한 마우스 모델을 이용한 실험 결과로부터 대표적인 도시된다.
프로토콜
마우스와 관련된 모든 절차는 유럽 연합 (EU) 지침, 동물 실험을위한 프랑스 규정 (교육부 농업 법 제 2001-464 2001 년 5 월) 및 연구소 국립 드 라 상테 등 드 라 공들인 MEDICALE (INSERM)위원회의 가이드 라인에 대한 준수 동물 연구가 및 관련 지역위원회에 의해 승인되었다 (찰스 다윈 윤리위원회 동물 실험, 파리, 프랑스, 허가 번호 : P3 / 2009 / 004).
1. 셀 준비
- 마우스 B 성장 10 % 소 태아 혈청, 100 μg의 / ㎖ 페니실린, 100 μg의 / ㎖ 스트렙토 마이신, 10 mM의 피루브산 나트륨, 50 μM 2- 머 캅토 에탄올, 0.50 보충 된 RPMI-1640 루타 매체 림프종 세포주 A20.IIA-luc2 ㎎을 / B를 하이 그로 마이신 ㎖로
- 37 ° C, 5 % CO 2에서 세포 배양을 유지하고 매체마다 2 ~ 3 일 변경합니다. 수확 매체를 변경 한 후 피펫으로 일일 세포 현탁액을 5 ml.
- (300)에 회전 세포5; 10 분간 g, 3 mL의 멸균 인산 완충 식염수 (PBS)으로 세포를 일시. 세포를 씻어 두 번이 단계를 반복합니다.
- Malassez 계산 챔버를로드하기 전에 30 ㎕의 트리 판 블루 라벨과 세포 현탁액의 15 μl를 섞는다. 식으로 세포 농도를 계산 : 농도 (세포 / ㎖) = 계산 그리드 * 3 * 1000 세포의 수.
- 10 분 동안 300 XG에 세포를 한 번 더 회전. 피펫으로 상층 액을 제거합니다. C 단계 1.4에서 계산 된 농도)를, 세포의 수는 N = C * 3이다.
- 다음 식에 5 × 107 세포 / ml의 농도로 세포 현탁액 A를 받아야 멸균 PBS 1X의 체적을 계산한다 : PBS 양 (㎖) = N / (5 × 7). 이전 문장에서 계산 멸균 PBS 1X의 부피) (단계 150)에서 세포 펠렛을 중지. 5 × 106 세포 : 세포 현탁액 A는 생체 주입 부피합니다 (SCL 모델에서 사용되는 100 μL 인에스).
- 피펫 (10) 세포 현탁액 (A)의 μL 및 ml의 당 5 × 10 6 세포에서 세포 현탁액 (B)의 100 μl를 얻기 위해 1.5 ML 튜브에 멸균 PBS의 90 μl를 추가합니다. 세포 현탁액의 B는 안구 내 모델에서 사용되는 (1 × 104 세포를 생체 내 주사 부피 2 μL 임).
2. 루시페린
- 50 ㎖의 튜브에 멸균 PBS 1X 30 ml의 D-루시페린 칼륨 염 분말 1 g을 희석 및 응집체를 용해 초간 흔들.
참고 : 루시페린이 빛에 민감한 때문에, 어두운 1.5 ml의 마이크로 원심 튜브에 500 μL 씩 준비를합니다. - -20 ° C에서 분취 량을 저장합니다.
주 : 분취 액을 몇 달 동안 저장 될 수있다.
해동 후, 분취 량 + 4 ° C에서 하루 이상 보관해서는 안된다. 냉동 - 해동 사이클은 4 ℃에서 보관하는 것이 바람직하다. - 복강 각 촬상 ASSA위한 D-루시페린 칼륨 염 용액 100 μl를 주입와이.
주 :이 용액 150 ㎎ / ㎏의 투여 량에 대해 마우스 당 3.3 mg의에 해당한다.
3. 마취 혼합물과 마취
- 멸균 PBS 1 배에서 케타민 120 ㎎ / ㎏과 자일 라진 (6) ㎎ / ㎏을 혼합하여 마취 솔루션을 준비합니다.
- 복강 25 G 바늘 각각의 영상 분석을위한 마취 혼합물의 60 μl를 주입한다. 합니다 (안구 내 또는 SCL 모델) 수술, 깊은 마취를 획득하기 위해 상기 혼합물을 80 μL를 주입. 그 새장에 다시 마우스를 넣습니다.
- 마우스가 움직이지 나타나면, 그 케이지에서 제거하고 부드럽게 손가락으로 마우스의 다리를 짠다. 마우스가 탈출 반사와 반응하면 몇 분을 기다립니다. 만족스러운 마취를 확인 마우스가 반응하지 않을 때까지 작업을 반복합니다.
- 온난화 판이나 온난화 빛 아래 마우스를 놓습니다.
- 이미징 분석 또는 SCL 수술 마취 동안 눈의 건조를 방지하기 위해 눈 연고를 적용합니다. 적용원발성 안구 내 림프종 모델에 대한 수술 후 눈 연고.
4. 수술 및 세포 접종
참고 : 동물 바이오 안전성 수준이 시설에서 1 형 미생물 학적 안전 캐비닛에, 온난화 판이나 온난화 빛 아래 모든 수술 절차를 수행합니다. 이 절에서 사용되는 모든 수술 도구를 사용하기 전에 멸균 하였다.
- 피하 림프종 모델 :
- 25 G 바늘을 1 mL의 주사기 단계 1.6에서 얻은 세포 현탁액 100 ㎕를 준비한다. 천천히 주입 부위에 손가락의 측면에 마우스 피부를 압착. 정확히 피부 배에 바늘을 삽입합니다. 피하 주사를 보장하기 위해, 깊은 조직에 바늘을 놓지 마십시오.
- 피하 지방 세포에 주입한다. 약간의 액체 공 주입이 제대로 수행되었는지 확인하기 위해 피부 아래에 표시할지 여부를 관찰한다.
- 25 G 바늘을 1 mL의 주사기 단계 1.6에서 얻은 세포 현탁액 100 ㎕를 준비한다. 천천히 주입 부위에 손가락의 측면에 마우스 피부를 압착. 정확히 피부 배에 바늘을 삽입합니다. 피하 주사를 보장하기 위해, 깊은 조직에 바늘을 놓지 마십시오.
- 원발성 안구 내 림프종 모델 :
참고 :이 proce을틀리면 운영자 1 운영자 2 여기에 언급이 연산자를 필요로한다.- 결막의 제거 :
- 운영자 1 위를 해부 현미경으로 마우스를 가지고있다. 부드럽게 눈의 각 측면에서 손가락으로 눌러 선택을 취소합니다. 이 위치를 유지합니다.
- 해부 현미경을 통해 운영자 2리터의 OOK 있습니다. 그립 한 손에 펜치의 작은 쌍 결막; 다른 손으로, 수술 가위의 작은 쌍 바로 펜치 아래 결막을 잘라.
- 이 운영자 1 분리 단계 4.2.1.1에서 누르면 마우스의 눈)
- 세포 주입 :
- 10 μl의 무딘 정밀 주사기를 준비합니다. 그것을 통해 멸균 탈 이온수를 펌핑하여 세척 할 것. 주사기에 기포가 없는지 확인하기 위해 두 번 또는 세 번 반복합니다. 그런 다음 주입 세포 현탁액의 2 μl를 준비합니다.
- 에의 손가락으로 부드럽게 조작이 눌러이눈의 각 측면에서 전자 손을 취소합니다. 이 위치를 유지합니다.
- 운영자 1 그립을 한 손에 펜치의 작은 쌍의 눈의 가장자리를 가지고 조직을 스트레칭 부드럽게 뒤로 당겨.
- 해부 현미경을 통해 운영자 2리터의 OOK 있습니다. 다른 한편으로, 32 G 바늘 마우스의 안구 하부에 작은 구멍을 만든다.
- 운영자 2 바늘을 내려 놓고 있고 (같은 손으로) 정밀 주사기를 선택하고 단계 4.2.2.4에서 만든 구멍에 바늘을 삽입합니다.
- 다른 손으로 주사기의 플런저에 운영자 1 푸시 있습니다.
- 주사기의 세포 현탁액 올바르게 안구의 내부에 주입 된 해부 현미경 조작이 V erify 유무 (액체의 흐름을 쉽게 관측).
- 운영자 2 r에 가져 가십시오에게 정밀 주사기를 가지고있다.
- 조작 한 R은의 가장자리 elease 유무imal의 눈) 단계 4.2.2.3에서 파지
- 운영자 2 r에 elease이 단계 4.2.2.2에서 누르면 눈의 측면)
- 바로 눈 연고를 적용합니다.
참고 : 모든 단계가 올바르게 수행 된 경우, 마우스가이 절차를 수행하는 동안 전혀 피하지 않아야합니다.
- 결막의 제거 :
5. 생물 발광 영상 - 데이 0
참고 : 마우스에 주입 모든 제품 주입하기 전에 RT에 있어야합니다. 종양 후 세포를 접종되었으며, 동물이 여전히 마취하는 동안, 이미징을위한 다음 단계로 진행합니다.
- 이미 저를 켜고 수집 소프트웨어를 엽니 다. 은 "초기화"버튼을 클릭하여 카메라, 스테이지 및 렌즈를 초기화합니다. 초기화가 완료로 10 ~ 15 분 소요됩니다.
- 25 G 바늘 복강 D-루시페린 칼륨 염 용액 100 ㎕를 주입한다. 정맥 주사를 투여하지 마십시오. intravenou 경우의 투여가 어떤 이유로 필요한 상기 D-루시페린 나트륨 염 D-루시페린 칼륨 염 대신 사용되어야한다.
주 : 루시페린이 농도에서 과잉 반응이고; 따라서, 생물 발광 신호는 3 분 내지 7 이후 정체기에 도달하고 30 분 동안 지속. - 10 분은 D-루시페린 주입 (13) 후, 이미 저에 주제 마우스를 놓습니다. 자연 위치, 가능한 한 평면 위치에서 카메라를 향해 그 뒷면에 마우스를 놓습니다. 이 위치는 자연과 쉽게 재현 할 수 있습니다.
- 자동 노출 기능을 체크하고, 자동 노출 기능, 동물의 뒷면 (후방) 이미지를 획득하는 획득을 클릭합니다.
주 : 자동 노출 기능은 1 초 노출 이미지를 계산하여 노출 시간을 최적화합니다. 마우스의 생물 발광 신호가 마이너스 또는 매우 낮은 경우 최적의 노출 시간이 될 수도자동으로 20 분으로 설정. 이 경우, 8 내지 10 분의 노출 시간은 절충 될 수있다. 노출 시간을 수동으로 설정 될 수 있으나, 이미지들은 포화 픽셀을 포함 할 수 없습니다. - 카메라에 마우스의 전면을 노출하는 마우스를 뒤집습니다. 그들은 가슴을 차단하지 않도록 마우스를 평평하고 전방 사지를 확산하려고합니다.
- 동물의 전면 이미지를 획득. 자동 노출 확인란이 여전히 체크되어 있는지 확인하고 "획득"버튼을 다시 클릭합니다.
참고 : 전면 이미지가 다시 이미지 전에 취득하고 그 반대의 경우도 마찬가지 할 수 있습니다. 전방 및 후방 화상의 노광 시간은, 마우스의 각면의 상대 강도에 따라 다를 수있다. 자동 노출 기능을 사용할 때 자동으로 계산됩니다. 정량화는 광자 플럭스 (초당 광자)를 사용하여 노출 시간에 의존하지 않는다. - 온난 작은지면에 마우스를 놓습니다전자하거나 마취에서 회복하고 새장에 다시 배치 될 때까지 온난화 빛 아래.
6. 생물 발광 영상 - 0 일 후
- ) 단계 5.1에서와 같이 카메라, 스테이지 및 렌즈를 초기화, 이미 저를 켭니다.
- 케타민 (120 ㎎ / ㎏) / 자일 라진 (6 ㎎ / ㎏)의 혼합물 60 μL (단계 3.5-3.1 참조)의 복강 내 주사하여 마우스를 마취.
참고 : 마취의이 방법은 5 일마다 촬영을 할 수 있습니다. 일일 이미징, 마취제 및 마취제이 함께 사용하기에 적합한 생물 발광 이미지 센서가 필요로 이소 플루 란을 사용하는 방법을 수행한다. - 단계 5.5) 및 5.6)에서와 같이 자동 노출 기능을 사용하여 동물의 전후 이미지를 획득. 단계 5.7)에서와 같이 마우스를 처리합니다.
7. 생물 발광 정량 및 이미지 분석
참고 : luminoscore 방법은 이미지 analysi을 기반으로에스. 이미지가 상기 단계에있어서 취득한 후에 정량 언제든지 수행 할 수있는 각각의 시간 지점에 각 쥐에 luminoscore을 연결 (취득 직후에 포함).
- '보기'메뉴를 클릭하여 "도구 팔레트"를 표시하고 아직 표시되지 않은 경우 다음 "도구 팔레트"를 클릭합니다. 도구 팔레트의 "ROI 도구 '탭을 클릭합니다. "형상"버튼을 선택하고 "자유 그리기"를 선택합니다.
- 수동으로 정면에서 마우스의 가장자리를 따라 마우스 주위의 관심 (ROI)의 영역을 표시합니다. 컴퓨터 마우스 오른쪽 클릭으로 윤곽을 닫습니다.
- "보기"메뉴와 "ROI 측정"을 클릭합니다. "래디언스 (광자)"있는지를 확인하십시오 "ROI 측정"창 왼쪽 하단에 메뉴를 스크롤 "측정 유형"으로 선택되어 있습니다. 그렇지 않은 경우를 선택합니다. 그런 다음 광자 플라이를 측정UX은 "총 플럭스 [P / S]"상자의 값을 기록하여 (산도 / s) 등이 있습니다.
참고 : 래디언스 또는 투자 수익 (ROI) 면적을 기준으로 다른 장치를 사용하지 마십시오. - 반복 다시보기 7.2) 및 7.3) 단계를 반복합니다.
- 전면 및 후면보기에서 얻은 두 개의 광자 플럭스 값을 합계. 결과는 luminoscore이다.
- (14) (예를 들어, 비 - 파라 메트릭 양측 맨 - 휘트니 시험)에 적절한 테스트 통계를 사용하여 각 그룹에 대한 값을 비교한다.
결과
Luminoscore 방법은 종양 세포 주입을 확인하는 역할을 할 수 있습니다
주사 부위는 사출 시각적 확인을 허용하지 않는 경우 종양 세포의 작은 수의 주입을 포함하는 모델이나, 상기 분사의 품질을 보장하는 것은 매우 어려울 수있다. luminoscore 방법은 절차의 품질을 확인하고 쉽고 즉시 모든 것을 잘 갔다 확인하는 빠르고 편리한 도구 역할을한다. 두 모델에서 종양이 주입 (그림 1A) 후 10 분 빠르면 감지 할 수 있습니다. 이미지가 혼자 종양 세포가 올바른 위치에 존재를 확인하기에 충분할. 그럼에도 불구하고, 이미지를 정량화하는 것은 주입의 이질성의 아이디어를 제공합니다. 도트 플롯 (그림 1B)를 명확하게받은 동물의 차이 (검은 점)를 표시하고 다시하지 않았다ceive (레드 라인) 주사. 흥미롭게도, SCL 모델에서 얻어진 신호는, 안구 내 모델에 비해 100 배 이상; 이 발견은 분사 셀의 개수 (5 × 106 1 × 104 세포에 각각)과 일치한다.
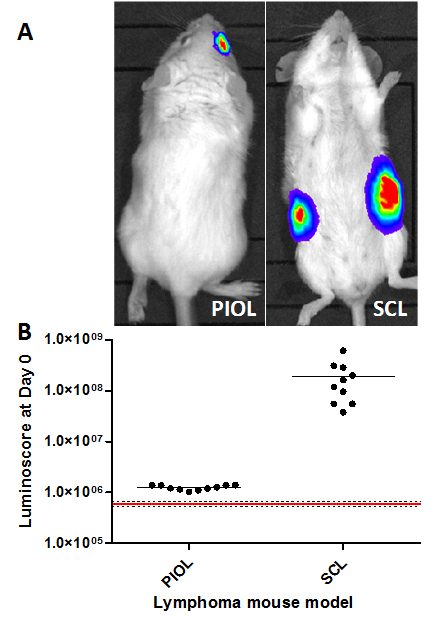
다른 마우스 림프종 모델에서의 주입도 1 검증. luminoscores 다른 림프종 모델에서 종양 세포 접종 후 10 분을 측정 하였다. (A) 두 모델의 대표적인 이미지. (B) Luminoscore를 다른 모델의 각 동물. 적색 선은 종양 세포 접종 전에 동물들 (10)에서 측정 된 평균 배경 잡음에 대응하고; 점선 평균 +/- 표준 편차이다. 각 모델의 경우, 모든 동물을 배경 잡음으로부터 구별 될 수있다. 안구 내 모델에서, 1 × 104 세포 INOC 있었다오른쪽 눈의 유리체에 ulated 및 SCL 모델, 피하 마우스의 각 측면에 5 × 10 6 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
종양 부담 및 치료 반응을 모니터링
luminoscore은 종양의 성장 및 치료 효능을 연구하기위한 강력한 도구입니다. 2A 컨트롤에서 종양 성장의 모니터링의 대표 이미지를 보여줍니다과의 CpG는 원발성 안구 내 림프종 환자 그룹을 처리 그림. 마우스를 1 × 104 종양 세포를 각각 접종하고, 처리는 화상을 충분한 시간 (이십팔일) 후에 전이가 대조군에 나타나기 시작 보여 주 7. 동일계 투여 하였다. 기본 종양 치료에 민감하지 않은 것으로 보입니다 만, 더 적은을전이가 된 CpG 처리 군 (표 1)에서 관찰되었다. 각각의 그룹 (도 2B)에서, 종양 부하의 정량 분석의 CpG를 처리하고 이십팔일 (비모수 양측 맨 - 휘트니 시험 p = 0.0079 후 대조군 사이에 유의 한 차이를 생산 종양 발생 둔화 것을 보여준다 ). 그럼에도 불구하고, 암은 여전히 치료 마우스에서 성장하고, 그 중 어느 것도 (데이터는 도시되지 않음) 생존 없다. 이 발견은 이전 보고서와 일치한다 :의 CpG 차 안구 종양 (10)에 유의 한 영향을주지 않습니다. 우리는 ODN과의 CpG 그룹 사이에 여기에있는 중요한 효과는 전이 성장 억제에서 비롯됩니다.
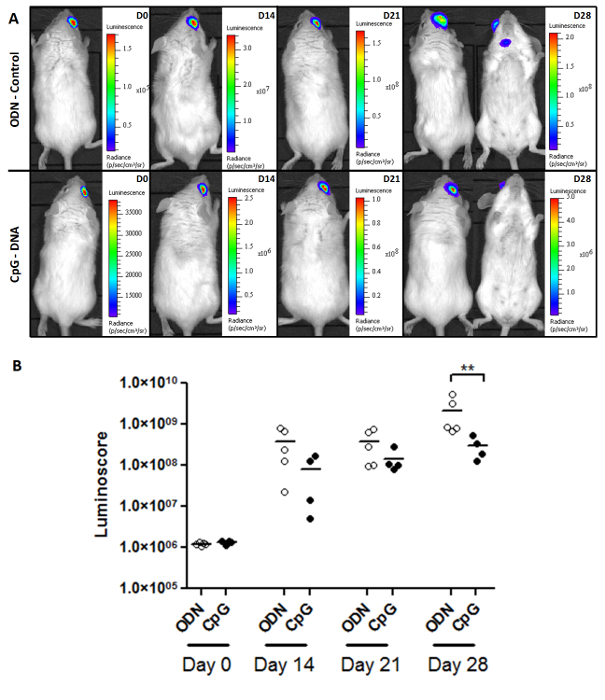
그림 2. 모니터링 종양 부담과 치료 응답. (A) 두 군의 대표적인 이미지 (ODN - 제어 된 CpG가 처리) O-F 마우스를 원발성 안구 내 림프종은 베어링. luminoscore와 (B) 모니터링 종양 부담을. 도트 플롯 보듯 luminoscore에서의 CpG의 효과가 두 그룹의 28 일째에 유의하고,이 방법은 가능한 종양 부담을 모니터링하고 CpG-의 약간이지만 유의 (p = 0.0079)의 효과를 측정하기 위해 만든 혼자 이미지에서 검출되지 않은 수 DNA가. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 여러 떼 | 쥐 | 전이의 존재 | 위치 | 광자 플럭스 (PH / s의) |
| 의 CpG | 1 | 아니 | 엑스 | 엑스 |
| 이 | 예 | 아이 배수 lymp 노드 | 9.32E + 05 | |
| 삼 | 아니 | 엑스 | 엑스 | |
| 4 | 아니 | 엑스 | 엑스 | |
| (5) | 예 | 눈 배수 lymp 노드를 | 2.21E + 07 | |
| ODN | 1 | 예 | 눈 배수 lymp 노드를 | 1.06E + 07 |
| 이 | 예 | 눈 배수 lymp 노드를 | 7.25E + 07 | |
| 삼 | 예 | 눈 배수 lymp 노드 + 반대측을 | 7.64E + 08 | |
| 4 | 예 | 눈 배수 lymp 노드 + 반대측을 | 1.74E + 09 | |
| (5) | 예 | 눈 배수 lymp 노드 + 반대측을 | 9.76E + 07 |
표 1. T그는 Luminoscore 방법은 다른 접근 방법에 적용 할 수 있습니다
luminoscore 방법은 마우스 모델의 한 형태에 한정되지 않는다.이 다른 마우스 모델에 적용 할 수도 3도. SCL 모델에서 두 종양 마우스 양쪽에 그래프트된다. 치료는 0 일째에 편면에 동일계 투여하고, 반대측 종양은 대조군 (도 3a)로서 기능한다. 따라서, 두 ROI는 마우스 당 그려진 : 각면 (그림 3C) 하나. 처리 및 제어 측면에 luminoscore의 비율은 각 종양의 상대적 과정을 설명합니다. 치료 투여 한 경우의 비율은 0 일째에 1로 설정 하였다. 우리는 십삼일 치료 투여 후이 비율의 유의 한 감소를 관찰 (그림 3D 비 - 파라 메트릭 양측 맨 - 휘트니 테스트 p = 0.004). 이 감소는 처리 측 종양 밝혀대표 생물 발광 이미지 (그림 3B)에 나타낸 바와 같이, 재 흡수되고있다.
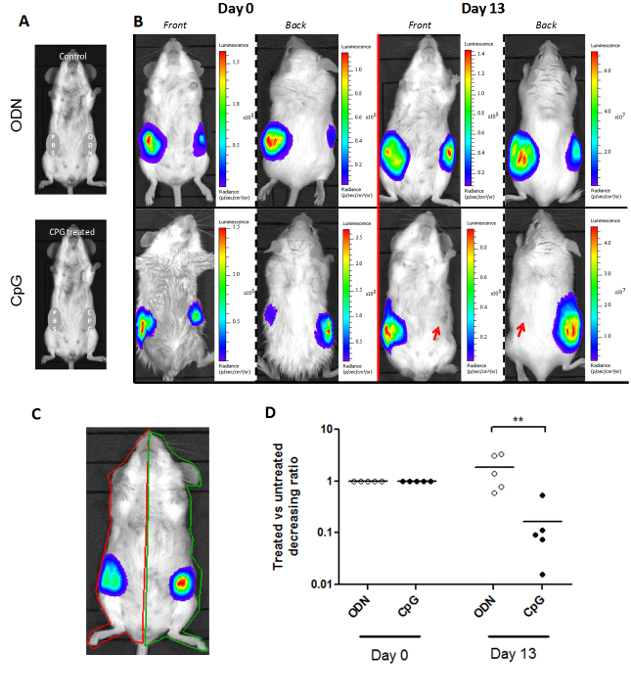
그림 두 차 종양 사이트와 모델에 Luminoscore 방법 3. 적응. (A)는 SCL 분석의 실험 디자인. 생쥐들은 각각의 측면에서 두 가지 주요 종양 내 주사 하였다. 한쪽 하나의 CpG-DNA 또는 ODN 제어 및 PBS와 다른 쪽의 제어 역할을 함께 주입된다. (B)는 제 0 일과 13 처리에서의 CpG 처리 및 제어 쥐의 대표적인 이미지를 투여 한 하루에 0 종양의 성장은 마우스의 CpG 처리 측에 억제되었다. (다) 수동 두 가지 기본 종양 사이트 동물마다 관심의 영역을 표시했다. (D) 소비재 처리 또는의 luminoscores의 비율 ODN 제어 측과 PBS 제어 측 지표 인 그같은 동물 내의 각 종양의 상대적 성장을 반영한다. 이 비율은 일 13 일 일 0에서 1로 설정하고,의 CpG-처리 군의 비율이 유의하게 감소했다 (p는 0.004 =)의 CpG-DNA의 현장 관리에 의해 종양 성장 억제를 공개. 여기를 클릭하세요하여 볼 수 있습니다 이 그림의 더 큰 버전.
토론
이 제한은 어떤 광학 이미징 양상에 고유 있지만 기관과 조직에 의한 광 흡수는 생물 발광 영상의 제한 남아있다. 우리의 접근 방식의 맥락에서, luminoscore의 해부학 적 구조의 효과를 연구 한 다음 비교를 허용하는 특정 모델 (위치 및 마우스 가닥)에서 수행되는 것을 제공 낮은 가변성을 가질 것으로 기대된다. 생물 발광이 여기 광이 필요하지 않기 때문에 형광보다 더 생체 이미징 전신하도록 구성된다.
공간 해상도는 생물 발광 영상의 한계, 그리고 생물 발광의 광자를 방출하는 기관의 정확한 위치는 어려운 남아있다. 그러나 모델의 좋은 지식은 종양 사이트의 질적 위치에 도움이 될 수 있습니다. 이 생물 발광 기반 방법의 유일한 출력은 luminoscore입니다. 위치는 luminoscore에 영향을주지 않는 가출의 수동 마크 업 지역 때문에t (ROI)은 전체 마우스를 다룹니다. 마지막으로, 반딧불 루시 페라 제는 산소를 필요로한다. 따라서, 생물 발광 영상은 일반적으로 괴사 성 종양을 과소 평가. 다시 한번, 모델의이 양태의 양호한 기술이 요구된다.
본 연구에서는 (7,9,11 이미 입증 된)하지만 생물 발광 데이터 세트의 비교를 가능하게하는 방법을 설명하기 위해 항암 약물 등의 CpG의 효능을 평가하는 것을 목표로하지 않는다. 우리는 참으로 다른 시간에 다른 장소에서 다른 분석을 비교 획득 프로토콜을 표준화하는 데 도움을주기위한 것 종양 부담을 정량화하는 방법을 설명하고 그 컴퓨터의 계산을 필요로하지 않습니다. 정확한 재현성 광자 플럭스 정량을 위해, 촬상 소자는 수제 장치 용 광 기준으로 교정하거나해야 상업용 장치 공급자가 권장.
우리의 프로토콜은 몇 가지 중요한 페이지에 세심한주의가 필요합니다oints (ⅰ) 우선, 마우스를 마취의 품질이 특히 긴 노출 시간을 갖는 경우에, 선명한 화상을 얻기 위해 중요하다. (ⅱ) 정량화 수단은 항상 래디언스 각 마우스의 표면 영역에 따라 서로 다른 마우스를 비교 무관 할 수 있으므로 광자 플럭스이어야한다. 이러한 바이어스 luminoscore을 때문에 (Ⅲ) 생물 발광 이미지는 포화 픽셀을 포함 할 수 없습니다. (ⅳ) 위로와 전면 인수는 종양 부위 (즉, 앞의 인수는 반드시 종양의 뒤쪽에서 광자를 검출 할 수 있음)에서 방출되는 모든 광자를 수집해야합니다. 다양한 다른 ROI 도면은 luminoscore 방법의 개발 과정에서 시험 하였다. 오직 수동 마크 업 (데이타 미기재) 유의 될 가능성이 만족스러운 결과를 얻었다.
이노우에 등. 75 밀리그램의 루시페린 도즈 추천 / 13 kg이다. 150 밀리그램의 투여 량을 사용하여 / 애프터 대신 촬상의 타이밍 kg의루시페린 관리는 변경되지 않습니다 그리고 우리는 고원 긴 노출 취득에 걸쳐 지속 있는지 확인합니다. 루시페린은 인수 과정 전반에 걸쳐 과잉 반응해야합니다. 우리는 동물 당 두 개의 ROI를 그린 SCL 모델 켰을 모델에 따라 관심 영역이 적응 될 수있다. SCL 모델에서 치료를 주입 종양 변동을 제한하는 그것의 최대 직경 0.5 cm에 도달 할 때 생착의. 마우스에 따라 종양 다르게 성장 있습니다. 표준화와 마우스를 비교하기 위해, 우리는 두 측면 종양의 상대적 성장을 보여 처리 및 비 처리 측 사이의 비율을 사용하기로 결정했다.
신호가 긍정적 인 것으로 예상 주입 된 마우스에서 관찰되지 않으면 (ⅰ)이 세포의 수가 매우 적고 신호가 검출 한계 미만이고; 또는 (ⅱ) 마우스는 산소가 부족하고 즉각적인 치료를 필요로한다.
양적 bioluminesc의 여러줬어 다양한 저자에 의해 기술 분석은 방출 생물 발광 광자 5,15의 절대 정량에 접근하는 복잡한 계산 및 기기 (예를 들면, 3D 생물 발광 단층 촬영)이 필요합니다. 2 차원 이미지 센서와 생물 발광, 특히 종양 모델에서 재현 생물 발광을 정량화하는 방법에 대한 합의가 없다. 우리의 목표는 사용자가 의존성을 제한하는 화상 획득 프로토콜을 표준화 하였다.
종양 접종 후 현장에서의 CpG의 주입은 두 모델에서 종양 부담을 감소시켰다. luminoscore 방법은 종양 면역의 다른 모델에서 종양 부담을 감시하는 도구로서 기능 할 수있다. 종양 부담을 모니터링 종양 미세 환경을 방해하지 않고 종양 성장을 전이 메커니즘에 대한 우리의 이해를 향상시킬 수있는 비 침습적 방법을 제공한다. 수행 및이 방법으로 치료에 반응하지 않는 동물의 식별은의의 검증에 의해 강화된다실험의 시작시 uccessful 종양 세포 주입.
우리는 여기서 A20.IIA-luc2 셀을 사용하여 SCL 모델에서 luminoscore 방법의 적응성을 보였다. 그러나,이 방법은 다른 세포주들이 루시퍼 라제를 발현, 또는 설치하여 다른 종양 모델에 적응 될 수있는 T 세포 연구 (종양 특이 적 세포 독성 T 세포, 조절 T 세포 등)과 관련된다. 희귀 질환의 유전자 요법의 맥락에서 생체 내 유전자 전달의 모니터링도 luminoscore 방법을 사용하여 수행 될 수있다.
마지막으로 데이터는 생물 발광 기반 luminoscore 방법, 실험 사이의 비교를 가능하게 특정 실험 요구에 유연성과 적응성을 제공하며, 비 침습적 종 전임상 연구를위한 유용한 도구임을 보여줍니다.
공개
The authors have nothing to disclose.
감사의 말
우리는 프란체스코 회의 수도자 연구 센터 (CEF, 파리, 프랑스), Genethon (에브리, 프랑스)와 Genopole (CERFE, 에브리, 프랑스)의 동물 시설 감사합니다. 우리는 원고의 그녀의주의 읽기 조 앤 칸 (Cahn) 감사합니다. 이 연구는 연구소 국립 드 라 상테 엣 드 라 Rechercher MEDICALE, 파리 데카르트 대학, 피에르 & 마리 퀴리 대학, 협회 라 공들인 CONTRE 제작 : 암, 튀니지 방향 제너럴 드 라 공들인 과학원을 부어, 프랑스 - 튀니지 CMCU에 의해 지원되었다 프로젝트 및 Incitatives 드 Genopole (ATIGE) 자금 Thématiques 작업. JC는 생명 과학 박사 학교의 프론티어에 의해 그리고 INCA (연구소 국립 뒤 암)에서 화목에 의해 지원되었다. RBA는 DGRS - INSERM과 CMCU에서 보조금을받는 사람이었다. SD는 연구소 국립 뒤 암에서 교부금을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| CpG 1826 | Invivogen | Sequence: 5_-TCCATGACGTTCCTGACGTT Catalog number: tlrl-1826 | |
| ODN 1826 control | Invivogen | Sequence: 5_-TCCATGAGCTTCCTGAGCTT Catalog number: tlrl-1826c | |
| D-luciferin potassium salt | Interchim | Catalog number: FP-M1224D | |
| Ketamin | Virbac, France | ||
| Xylazin | Bayer Healthcare | Rompun 2% | |
| A20.IIA-luc2 cell line | A20.IIA transfected with pGL4.50[luc2/CMV/hygro]7 (Promega E1310) | ||
| Mice | Balb/cByj | Six-weeks old females from Charles River | |
| IVIS lumina Biolumienscence imager | Perkin Elmer | ||
| Living Image software | Perkin Elmer | Used for measuring photon flux on images and drawing ROIs | |
| R software (opensource) | R-project | Used for statistic tests | |
| Hamilton Precision Serynge 10 µl | Hamilton | Product number 7642-01100 | |
| Eye ointment | Lacrinorm | ||
| Dissecting microscope | ZEISS | Stemi 305 |
참고문헌
- Rehemtulla, A., et al. Rapid and Quantitative Assessment of Cancer Treatment Response Using In Vivo Bioluminescence Imaging. Neoplasia. 2 (6), 491-495 (2000).
- Edinger, M., et al. Advancing animal models of neoplasia through in vivo bioluminescence imaging. European Journal of Cancer. 38 (16), 2128-2136 (2002).
- Hastings, J. W., Gibson, Q. H. The Role of Oxygen in the Photoexcited Luminescence of Bacterial Luciferase. Journal of Biological Chemistry. 242 (4), 720-726 (1967).
- Inouye, S., Shimomura, O. The Use of Renilla Luciferase, Oplophorus Luciferase, and Apoaequorin as Bioluminescent Reporter Protein in the Presence of Coelenterazine Analogues as Substrate. Biochemical and Biophysical Research Communications. 233 (2), 349-353 (1997).
- Pesnel, S., et al. Quantitation in Bioluminescence Imaging by Correction of Tissue Absorption for Experimental Oncology. Molecular Imaging and Biology. 13 (4), 646-652 (2010).
- Corre, G., et al. Stochastic Fluctuations and Distributed Control of Gene Expression Impact Cellular Memory. PLoS ONE. 9 (12), (2014).
- Ben Abdelwahed, R., et al. Lymphoma B-cell responsiveness to CpG-DNA depends on the tumor microenvironment. Journal of Experimental & Clinical Cancer Research CR. 32 (1), 18 (2013).
- Abdelwahed, R. B., et al. Preclinical Study of Ublituximab, a Glycoengineered Anti-Human CD20 Antibody, in Murine Models of Primary Cerebral and Intraocular B-Cell Lymphomas. Investigative Ophthalmology & Visual Science. 54 (5), 3657-3665 (2013).
- Donnou, S., Galand, C., Touitou, V., Sautès-Fridman, C., Fabry, Z., Fisson, S. Murine Models of B-Cell Lymphomas: Promising Tools for Designing Cancer Therapies. Advances in Hematology. 2012, (2012).
- Qi, X. -. F., et al. CpG oligodeoxynucleotide induces apoptosis and cell cycle arrest in A20 lymphoma cells via TLR9-mediated pathways. Molecular Immunology. 54 (3-4), 327-337 (2013).
- Houot, R., Levy, R. T-cell modulation combined with intratumoral CpG cures lymphoma in a mouse model without the need for chemotherapy. Blood. 113 (15), 3546-3552 (2009).
- Krieg, A. M. Toll-like receptor 9 (TLR9) agonists in the treatment of cancer. Oncogene. 27 (2), 161-167 (2008).
- Inoue, Y., Kiryu, S., Watanabe, M., Tojo, A., Ohtomo, K. Timing of Imaging after D-Luciferin Injection Affects the Longitudinal Assessment of Tumor Growth Using In Vivo Bioluminescence Imaging. International Journal of Biomedical Imaging. 2010, (2010).
- Mann, H. B., Whitney, D. R. On a Test of Whether one of Two Random Variables is Stochastically Larger than the Other. Annals of Mathematical Statistics. 18 (1), 50-60 (1947).
- Darne, C., Lu, Y., Sevick-Muraca, E. M. Small animal fluorescence and bioluminescence tomography: a review of approaches, algorithms and technology update. Physics in Medicine and Biology. 59 (1), 1 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유