Method Article
다층 피질 칼슘
요약
여기서는 자유롭게 움직이는 마우스에서 여러 피질 층에 걸쳐 세포 - 해상도로 대규모 Ca 2+ 영상을 수행하는 절차를 제시합니다. 이식 프리즘 프로브와 결합 된 소형 헤드 장착 현미경을 사용하여 수백 개의 활성 세포를 동시에 관찰 할 수 있습니다.
초록
생체 내 회로 및 세포 수준의 기능 영상은 뇌의 활동을 이해하는 데 중요한 도구입니다. 2 광자 현미경으로 마우스 피질 뉴런의 고해상도 이미징은 피질 구조, 기능 및 소성에 대한 독특한 통찰력을 제공합니다. 그러나 이러한 연구는 고착 된 동물에 국한되어 연구 할 수있는 행동의 복잡성을 크게 줄입니다. 이 논문에서는 자유롭게 행동하는 마우스에서 여러 피질 층에 걸쳐 세포 - 해상도로 만성 형광 현미경 검사를 수행하는 절차를 설명합니다. 우리는 이식 프리즘 프로브와 결합 된 소형 소형 형광 현미경을 사용하여 며칠 동안 새로운 대상 탐사 작업에 종사하는 마우스가 체세포 감각 피질의 여러 층에 걸쳐 수백 개의 뉴런의 칼슘 동역학을 동시에 시각화하고 기록했습니다. 이 기술은 다른 동물의 다른 뇌 영역에 적용되어 다른 행동 paradigms.
서문
피질은 주의력, 감각인지 및 하향식인지 조절 1 , 2 , 3 에서 동기 부여, 보상 및 중독 경로 4 , 5에 이르기까지 많은 복잡한 정신 및 행동 기능에서 필수적인 요소입니다. 기능의 기초가되는 전산 과정을 이해하는 것은 많은 정신 및 행동 장애에 대한 임상 적 이해를 향상시키는 중요한 목표입니다.
대뇌 피질 신경 회로 장애 또는 비 적응이 정신 분열병 6 , 자폐증 7 또는 강박 장애 8 과 같은 조건의 특징 인 인식 및 행동 이상을 일으킬 수 있다는 생각을 중심으로 정신과 질환 센터의 많은 현재 이론이 있습니다. 따라서, 공동에서 인구 수준의 신경 활동 데이터를 얻는 것동시 행동 정보의 적절한 컨텍스트 내에서 회로는 매우 중요하며 이상적으로는 미세한 신경 회로 해부를위한 특정 세포 유형을 목표로 할 수 있습니다.
이식 형 그라디언트 굴절률 (GRIN) 마이크로 렌즈와 함께 소형화 된 현미경은 피질 14 , 15 , 16을 포함한 가능한 뇌 영역 9 , 10 , 11 , 12 , 13 의 다양성에서 자유롭게 움직이는 조건에서 뉴런 앙상블에 대한 광학 액세스를 가능하게합니다. 유 전적으로 코딩 된 칼슘 지시약과 결합 된 이동 현미경 검사 시스템을 사용하면 많은 뇌 영역에서 며칠에서 수주에 걸쳐 수백 개의 뉴런을 포괄하는 동일한 세포 집단의 일관된 영상을 얻을 수 있으며,바이러스 벡터 또는 형질 전환 기술을 사용하여 특정 세포 유형을 유 전적으로 표적으로한다.
피질은 서로 다른 기능을 지원하고 피질 층 17 , 18 , 19 내의 세포의 위치에 따라 다른 뇌 영역에 연결하는 것으로 알려져 있으므로 깨어있는 행동 대상에서 동시에 다층 신경 활동을 얻는 데 관심이 있습니다. 여기서 우리는 피질 ( 그림 1 )의 다층보기를 제공하는 이식 프리즘 프로브와 쌍을 이루는 소형 형광 현미경 20을 사용하여 며칠 동안 자유롭게 행동하는 마우스에서 형광으로 표시된 수백 개의 뉴런을 이미지화하는 방법을 보여줍니다.
프리즘 프로브는 두 개의 분리 된 GRIN 렌즈로 구성됩니다 : 프리즘과 원통형 릴레이 렌즈 ( 그림 1 ). 현미경으로부터의 빛은 형광으로 표지 된프로브의 프리즘 부분의 빗변으로부터 반사 된 후, 프리즘 프로브의 촬상면을 따라 위치 된 셀을 포함한다. 세포로부터 방출 된 빛은 프리즘의 빗변으로부터 반사되어 현미경의 목적을 통해 수집되어 현미경의 센서에 도달합니다. 이 절차에 사용 된 프리즘 프로브는 표준 stereotaxic 장비와 함께 사용하기 쉽게되어 있습니다.
소형 형광 현미경 (20 )은 세포가 Ca 2+에 민감한 유 전적으로 코드화 된 형광 지시약으로 특이 적으로 표지 된 후, 단일 세포 분해능을 갖는 연결 집단에서 활동 전위에 의해 유발 된 Ca 2+ 과도 현상을 검출한다. 이 프로토콜에서 우리는 바이러스 벡터 (AAV1.CaMKII.GCaMP6f.WPRE.SV40)에 인코딩 된 칼슘 2 + 표시기를 삽입하고, 프리즘 프로브를 삽입하고, 현미경을 설치 한 다음 somatosensory (S1 뒷다리) 신경 활동 데이터 동물 폭로d를 자유 탐사 중에 새로운 물체 표면으로 이동시킵니다 ( 그림 2 ).
프로토콜
동물 실험과 관련된 절차는 캘리포니아 주 NASA Ames Research Center의 LifeSource Biomedical Services에서 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받았습니다.
1. 수술 전 준비
- 핫 비드 살균 장치에서 수술 절차에 사용할 도구를 소독하고 70 % 에탄올로 수술 부위를 닦습니다. stereotaxic 무대 위에 놓인 난방 패드를 켜고 37 ° C에서 유지하십시오.
- isoflurane (유도 5 %, 유지 보수 1 ~ 2 %, 0.6 ~ 0.8 L / min O 2 )을 사용하여 동물을 마취. 마취 깊이를 평가하기 위해 발가락 핀치 반사가 없는지 확인하십시오.
- 귀와 치아 바가 장착 된 stereotaxic 프레임에 동물을 탑재하십시오.
- 동물의 눈에 안과 용 연고를 바르고 건조하고 강한 수술 광선으로부터 보호하기 위해 어두운 종이로 덮으십시오.
- 동물에게 ketoprofen (2.5mg / kg) 또는 carprofen (2.5 mg / kg)
2. 바이러스 주입 수술
- 눈과 귀 사이의 두피를 잘라내어 면도하고 70 % 에탄올과 베타 딘 3 개의 교체 면봉으로 피부를 소독하십시오.
- 눈 사이에서 시작하여 멸균 수술 용 날로 1.5 cm 로스트로 필달을 연장하면서 두피에 절개를하여 두개골을 노출시킵니다. 두개골을 노출하기 위해 피부를 열고 면봉과 메스를 사용하여 원하는 주사 부위 주변의 골막을 제거하십시오. 멸균 PBS로 두개골을 씻어. 면봉으로 두개골을 깨끗이 닦습니다.
- 두개골을 수평으로 놓고 마커로 바이러스 주입에 대한 stereotaxic 좌표를 표시하십시오. 고속 마이크로 드릴 (약 7,000-10,000 rpm으로 설정)에 0.5mm 버를 사용하여 두개골에 작은 구멍을 만듭니다. 시추하는 동안 약간의 압력을 가하고 간헐적으로 뼈의 먼지를 닦아내고 뇌 표면이 다시 쌓일 때까지 뇌 조직이 과열되는 것을 막기 위해 멸균 된 PBS로이 부위를 습윤시 키십시오통증. 구멍이 뚫려있는 곳에 두뇌를 촉촉하게 유지하십시오.
- 마이크로 주사기에서 바이러스 ( 예 : AAV1.CaMKII.GCaMP6f.WPRE.SV40)를 가져 오는 데 26G 바늘을 사용하고 주사를 위해 35G 바늘로 바꿉니다. stereotaxic 장치의 매니퓰레이터 팔에 바이러스와 함께로드 된 microsyringe을 첨부하십시오.
- 주사기를 주사 부위 구멍에 가깝게 가져 와서 바늘의 각도를 조절하여 뇌 표면과 90 ° 각도로 맞 춥니 다. 경막을 뚫고 경막을 관통 할 때까지 바늘을 내립니다. 원하는 깊이 (z)에 도달 할 때까지 10 μm / s 단위로 바늘을 낮추십시오. stereotaxic 팔을 사용하여 바늘 위치를 고정.
- 25 nL / min에서 250 nL의 바이러스를 주입하도록 마이크로 시린지 펌프를 설정하십시오.
- 중요한 단계 : 주사 할 바이러스 양은 적정 및 희석에 의존하기 때문에 미리 세포를 희석하기위한 최적의 부피 및 농도 기준을 설정하기 위해 희석 실험을 실시하십시오.실험에서.
- 일부 바이러스가 주사 부위에서 분출되는 경우 주사를 일시 중지하고 뇌 조직이 바이러스 방울을 흡수 할 때까지 기다리십시오. 총 부피가 주입 된 후 5 ~ 7 분 동안 기다렸다가 바늘을 집어 넣으십시오. 빠른 녹색과 같은 염료가 바이러스 용액에 추가되어 뇌 표면에서 바이러스가 빠져 나오는 경우 주입 속도를 제어 할 수 있습니다.
- 피질의 여러 층에 라벨을 붙이려면 필요한 경우 여러 번의 주입을 사용하십시오. 복부 - 대부분의 사이트에서 시작, 주사 후 5 ~ 7 분 기다리고, 주사를 위해 다음 등 지 점 ( 예 : -1.0 mm AP, 1.5 mm ± ML 및 400 및 600 μm에서 주사)으로 바늘을 당깁니다. DV). 최종 주사 후 10 분을 기다렸다가 바늘을 당기고 stereotaxic setup에서 제거하십시오.
- 이중 배럴 주사기 에서 생체 내 생체 적합성 투명 엘라스토머 접착제를 소량 섞습니다 (예를 들면 Kwik-Sil) 그리고 두개골의 구멍을 덮으십시오. 엘라스토머 접착제 층 위에 시아 노 아크릴 레이트 접착제를 바르고 경화시킵니다.
- 두피를 봉합하고 동물이 보행하기 전까지 따뜻한 복구 케이지에서 마취로부터 회복 할 수있게하십시오. 동물을 집에 넣기 전에 ketoprofen (2.5 mg / kg) 또는 carprofen (2.5 mg / kg)을 피하 투여하십시오. 단독 수술 후 피험자를 수용하여 수술 부위를 보호하고 24 시간 후 복용량을 반복합니다.
- Microsyringe를 제거한 후 보관하기 전에 증류수로 7 ~ 10 회 26 G와 35 G 바늘을 씻어냅니다.
3. 프리즘 프로브 임플란트 수술
- 1-2 주 후에 바이러스 주입, 프리즘 프로브 삽입 수술을 준비하십시오. 프리즘 프로브를 70 % 에탄올로 소독하고 렌즈 종이로 닦으십시오. 렌즈 홀더 공구에 프리즘 프로브를 삽입하고 스크루 드라이버로 육각 나사를 조입니다. 현미경을베이스 홀더 (자석은 그 자리에 그것을 잡을 것이다).
- 수술 전 준비 섹션에서 설명한대로 동물을 준비하십시오.
- 눈과 귀 사이를 가볍게 깎아 내고 70 % 에탄올과 베타 딘의 교체 용 면봉으로 피부를 소독하십시오.
- 한 쌍의 멸균 가위로 피부를 절개하여 두개골을 노출시키고 피부 플랩과 밑에있는 골막을 제거하십시오. 면봉으로 두개골을 말리고 닦으십시오. 주변 근육 조직을 충분히 제거하여 깨끗하고 건조하며 넓은 뼈 기초를 만들어 다음 단계를 준비하십시오.
- 대퇴 반구에서 두개골 나사를 이식하여 임플란트를 안정적이고 안전하게 만듭니다. 이것은 5 절의 실험 영상 세션을 위해 동물을 준비하기 위해 깨어 난 머리 고정 용 헤드 바를 이식하도록 선택할 때도 유용 할 수 있습니다.
- 두개골의 수평을 맞추고 렌즈 삽입을위한 AP와 ML 좌표를 마커로 표시하십시오. 미세 드릴에 0.5mm 버를 사용하여 원형 craniotomy를 열고 th전자 craniotomy 직경은 프리즘 직경 즉 ,이 경우 1.0 mm보다 큽니다. 간헐적으로 일시 중지하면서 천천히 닦고 멸균 된 PBS로 두개골을 씻어 내고 면봉으로 흡입합니다. 생성 된 뼈 먼지를 제거하십시오.
- 중요한 단계 : 프리즘을 피질에 삽입하면 평평한 가장자리 (이미징 표면)가 바이러스 주입 사이트를 마주보고 150-200 μm 반경 이내에 있도록 두 절개술을 삽입하십시오.
- 해골이 완전히 엷어지기 직전에 굴착을 중지하십시오. 혈관은 얇은 뼈를 통해보아야합니다. 미세한 45 ° 겸자로 뼈 플러그를 부드럽게 제거하십시오.
- # 5 포 셉와 dura을 제거합니다.
- 중대한 단계 : 일단 뇌 조직이 노출되면 항상 조직을 촉촉하게 유지하십시오. craniotomy 이상의 무균 식염수에 담근 면봉을 놓습니다. 이것은 또한 조직에 압력을 유지합니다.
- 뇌 조직 du의 압력을 완화하기 위해프리즘 프로브의 링 삽입은 미리 삽입 관을 만듭니다. stereotaxic 장치의 전극 홀더 팔에 직선형 해부 나이프를 부착하고 나이프 블레이드가 두개골의 곡률에 직각이 각도 (이 경우 각도 10 °)와 각도에서 stereotaxic 장치에 장착 바이러스 주입 칼럼에 평행 한 평면.
- 조심스럽게이 경우 앞쪽 내측 가장자리를 따라 craniotomy 위의 칼을 위치시키고 후방을 향한 절삭 날 ( 그림 1 )이있는 바이러스 주입 사이트에 ~ 200μm 측면. 나이프 팁이 피아에 닿으면 Z 축을 제로화하고 프리즘 프로브가 삽입 될 깊이까지 서서히 낮 춥니 다 (10 μm / s 단위로). 그런 다음 프리즘의 리딩 에지에 대한 경로를 만들기 위해 1mm 뒤쪽으로 칼을 움직입니다. 멸균 된 생리 식염수로 절개를하는 동안 발생할 수있는 출혈을 일시 중지하고 제어하십시오.
- 나이프가이 위치에 오면 멸균 된 생리 식염수로 부위를 플러시하고 출혈이 진정 될 때까지 기다리십시오. 그런 다음 천천히 stereotaxic 팔 micromanipulator를 사용하여 10 μm의 / s의 증분, 그리고 절개에 멸균 식염수에 흠뻑 gelfoam 스폰지의 조각을 놓으십시오 칼을 철회.
- 이전 단계에서 나이프와 동일한 각도로 stereotaxic 조작 팔에 렌즈 홀더 (프리즘 프로브와 현미경 포함)를 부착합니다. 프리즘의 편평한면이 절개 위에 있고 바이러스 주입 칼럼과 평행하도록 프리즘을 정렬하십시오. 이 단계는 stereotaxic 팔 위치의 일부 미세 조정을 요구할 수 있습니다. 빠른 결과를 얻으려면 두개골에 가까이 있어야 정렬을 조정할 수 있습니다.
- 프리즘이 올바른 각도에있게되면 뇌 표면에서 시작하여이 프로브의 최종 z가 1.1mm가되도록 뇌에서 점차적으로 10um 씩 증가시킵니다. 뇌 조직은 프리즘 주위로 확장되며 생성 된 모든 압력은 시각적으로 배후에 있습니다.평면에 있어야하며 시야에 영향을 미치지 않습니다. USB3 포트를 통해 설치된 수집 소프트웨어가있는 컴퓨터에 현미경을 연결하고 LED를 켜서 필드 형광을 시각화합니다.
- 25G 바늘을 사용하여 엘라스토머 접착제의 매우 얇은 보호 층에서 craniotomy의 프리즘 주변에 노출 된 조직을 덮으십시오.
- 엘라스토머 접착제가 경화 된 후 (일반적으로 약 3-5 분) 25G 바늘을 사용하여 시아 노 아크릴 레이트 접착제를 도포하여 프리즘 렌즈의 유리를 인접한 두개골에 부착하여 엘라스토머 접착제 층 위에 올려 놓고 렌즈가 내부로 이동하는 것을 방지하십시오 개두술. 더 나은 접착을 위해 프리즘 프로브 커프의 가장자리를 포함하십시오. 주입 된 프리즘 프로브의 윗면에 접착제가 묻지 않도록하십시오. 일단 cyanoacrylate 접착제가 치유되면 렌즈 홀더를 풀고 조심스럽게 현미경을 제거하십시오. 그런 다음 stereotaxic manipulator arm을 천천히 후퇴시켜 프리즘 프로브를 안전하게 이식합니다.
- 치과 용 아크릴 또는시아 노 아크릴 레이트 접착제는 임플란트 주위에 노출 된 모든 두개골 표면을 감싸고, 주변 수축 된 근육 조직에는 접촉하지는 않습니다. 이 두개골 캡으로 두개골의 넓은 부분을 덮으면 나중에베이스 플레이트 부착에 도움이됩니다. 임플란트 부위 주변의 피부는 두개골 주위에서 자체적으로 치유되어야합니다.
- 중요한 단계 : 접착제가 주변 피부 또는 근육 조직에 닿지 않도록하고 두개골 캡에 피부를 삼키지 마십시오. 그렇게하면 피부를 자극 할 수 있으며 과도한 긁힘과 임플란트 손상을 초래할 수 있습니다.
- 선택 사항 : 깨어있는 머리 고정형 설정을 사용하여 잠시 마취 나 동물을 마비시키기보다는 실험적 이미징 세션에서 동물의베이스 플레이트에 현미경을 부착하거나 분리하려는 경우, 깨어있는 머리와 호환되는 머리핀을 머리에 삽입하십시오. 선택 고정 설정 (이 프로토콜에서 설명되지 않음).
- 실리콘에서 촉매와 염기를 섞는다.e 접착 주사기에 넣고 프로브 렌즈 상단을 덮도록 프리즘 프로브 커프 내부에 엘라스토머 한 방울을 넣어 손상이나 먼지가 침전되지 않도록하십시오.
- stereotaxic 프레임에서 동물을 제거하고 따뜻한 챔버에서 마취에서 회복을 허용합니다. 피하에 ketoprofen (2.5 mg / kg) 또는 carprofen (2.5 mg / kg)을 투여하고 동물이 깨끗한 홈 케이지로 되돌아 간다. 24 시간 후에 임플란트를 보호하고 복용량을 반복하기 위해 모든 피험자를 단독으로 수용합니다.
4. 소형 현미경 설치용베이스 플레이트 부착물
- 프리즘 프로브를 이식 한 후 1 주에서 10 일 사이에 임플란트 된 프리즘 프로브를 통해 조직에서 바이러스 발현을 확인하고 세포 활성을 보이는 경우에는 두개골에베이스 플레이트를 부착하십시오. 현미경은 라이브 이미징 중에베이스 플레이트에 고정됩니다.
- 베이스 플레이트 부착을위한 동물 준비를위한 수술 전 절차에 설명 된 단계를 따르십시오..
- 주입 된 프리즘 프로브 렌즈 상단 표면에 실리콘 접착 캡을 제거하십시오. 렌즈 탐침 표면을 검사하고 렌즈 표면과 70 % 에탄올로 파편을 부드럽게 닦아서 이미징 표면이 깨끗한 지 확인하십시오.
- 현미경을 DAQ 박스에 연결하고 USB3 포트를 통해 PC에 연결하십시오.
- 컴퓨터에서 수집 소프트웨어를 열고 USB3 포트를 통해 현미경을 연결하십시오. 신경 활동을 검사하고,이 피사체의 향후 녹음을 위해 시야 설정을 측정하고 문서화하기 위해 수집 소프트웨어를 사용하십시오.
- 현미경에베이스 플레이트를 부착하고베이스 플레이트 고정 나사를 고정시켜베이스 플레이트를 제 위치에 고정시키고 현미경 몸체에 의한 정위 마이크로 조작기 팔에 현미경 그리퍼에 현미경을 고정시킵니다. stereotaxic micromanipulator 팔에 장착 할 수 뉴 포트로드에 그리퍼를 연결합니다.
- s를 사용하여 프리즘 프로브 렌즈 위에 현미경을 놓습니다.tereotaxic micromanipuator 팔. 동물 무대의 측면과 후면에서 프리즘 렌즈를 보면서 방향을 육안으로 검사합니다. 현미경 대물 렌즈와 프리즘 탐침 렌즈의 광축을 정렬해야합니다.
- 소프트웨어를 통해 현미경 LED를 켭니다. 획득 소프트웨어에서 주입 된 프리즘 프로브 렌즈의 윗면에 초점을 맞춤으로써 현미경 정렬의 품질을 평가하십시오. 올바르게 정렬되면 프리즘 프로브 렌즈 윗면의 모서리가 날카로 와야합니다.
- stereotaxic 조작 팔을 사용하여 이식 프리즘 프로브 위의 현미경의 물리적 거리를 조정하여 조직 내부의 원하는 초점면을 얻습니다. 현미경 대물 렌즈와 이식 GRIN 렌즈 사이의 광학적으로 최적화 된 거리는 ~ 500μm입니다.
- 일단 원하는 이미징 비행기가 캡처되면 참조 형광 이미지를 저장하십시오.
중요한 점 :이 점에서 현미경의 위치를 조정하지 마십시오. 그러면 현 위치가 변경됩니다.조직 내의 영상화면의 온 - 오프 (on-on).
참고 : 다음 단계에서 접착제를 사용하여 두개의 캡과 관련하여베이스 플레이트의 위치를 영구적으로 고정하십시오. 접착제는 다음 날 또는 2 일 동안 약간의 체적 수축을 겪을 수 있으며, 이로 인해 조직의 초점면이 바뀔 수 있습니다. 사전에 접착제 믹스 및 체외 에서의 거리에 대한 수축량을 측정 한 다음 접착제 적용 단계로 진행하기 전에 현미경 +베이스 플레이트의 최종 Z 위치를 그 양만큼 백업하여 이것을 고려해야합니다. - 치과 용 아크릴 또는 시아 노 아크릴 레이트를 사용하여 동물의 두개골을 덮고있는 아크릴 캡에베이스 플레이트를 영구적으로 부착하여 아크릴 또는 접착제로 틈을 메우십시오. 치과 용 아크릴 / 시아 노 아크릴 레이트를 점차적으로 적용하고 여러 단계로 경화하면 이전에 언급 한 수축이 현미경의 이미지 평면의 최종 위치에 미치는 영향을 최소화 할 수 있습니다.
- 중요한 단계 : 치과를 적용하는 동안주의하십시오.아크릴 / 시아 노 아크릴 레이트를 사용하여 물질이 현미경의 대물 렌즈, 고정 나사 또는 현미경 본체에 닿지 않도록하여 계측기의 적절한 작동을 방해합니다.
- 중요 단계 : 접착제를 적용하는 동안 현미경을 밀지 마십시오. 현미경 또는베이스 플레이트에 가해지는 압력은 프리즘 프로브 렌즈에 대한 현미경 대물 렌즈의 움직임을 야기 할 수 있으며, 이는 신속한 재조정을 필요로하는 조직 내의 초점 평면의 오정렬 또는 변화를 야기 할 수있다.
- 치과 용 아크릴 / 시아 노 아크릴 레이트가 한 쌍의 집게 또는 주사기 팁으로 아크릴을 두드려 경화 및 경화되었는지 확인하십시오. 수집 소프트웨어를 사용하여 최종 참조 형광 이미지를 얻습니다.
- 그리퍼에서 현미경을 릴리스하고 현미경에서 그리퍼를 철회. 시아 노 아크릴 레이트 또는 다른 투명 접착제가 사용 된 경우 검은 색 매니큐어 또는 흑색 치과 용 시멘트로 덮어머리 뚜껑에 빛이 누출되어 실험 중 수집 된 이미지를 오염시킬 수 있습니다.
- 이 시점에서 필요한 경우 현미경을 제거하십시오. 베이스 플레이트에서 현미경을 분리 할 때는 고정 나사를 시계 반대 방향으로 약 1/2 돌리면서베이스 플레이트 고정 나사를 풉니 다. 다른 손으로베이스 플레이트와 아크릴 캡을지지하면서 현미경 몸체를 집어 넣고 똑바로 위로 당깁니다. 저장 용기에 넣어 교체하십시오.
- 주입 된 프리즘 프로브를베이스 플레이트 커버로 보호하십시오. 이렇게하면 렌즈 표면에 먼지 입자가 침전하는 것을 방지 할 수 있으며베이스 플레이트를 설치 한 후 청소하는 것이 까다로울 수 있습니다.
- 베이스 플레이트에베이스 플레이트 덮개를 부착하고 고정 나사를 시계 방향으로 약 1/2 정도 돌리거나 고정 나사가베이스 플레이트 덮개와 수평이 될 때까지 돌리십시오. 너무 세게 조이지 마십시오.
- 마취에서 동물을 제거하고 보행까지 따뜻한 회복 챔버에서 모니터. 돌아 가기 th그것의 가정 새장에 동물. 임플란트를 보호하기 위해 모든 동물을 단독으로 이식 된베이스 플레이트와 함께 보관합니다.
5. 자유롭게 움직이는 마우스에 여러 피질 층 이미징
- 행동기구 ( 예 : Phenotyper, Noldus)를 세척 및 소독하고 10 % 표 백제 용액으로 닦아서 준비하십시오.
- 현미경을 DAQ 박스에 연결하고 컴퓨터에 연결하고 수집 소프트웨어를 실행하십시오.
- 수집 컴퓨터에서 충분한 파일 저장 공간을 확인하고 칼슘 이미징 영화를위한 공간을 만듭니다. 현미경과 컴퓨터 사이의 높은 데이터 전송 속도를 수용하고 레코딩 중 데이터 손실을 방지하려면 외장 하드 드라이브에 쓰는 대신 소프트웨어에서 로컬 하드 디스크로 직접 저장하십시오.
- 현미경을 첨부 유도 챔버에서 isoflurane (산소 5 %)로 동물을 마취. 또는 동물을 부드럽게 문질러 주거나 깨어있는 머리에 고정 된 설정을 사용하십시오.마취가 선택의 행동 패러다임을 방해하는 것으로 알려져 있다면 헤드 바를 착용하십시오.
- 베이스 플레이트 고정 나사를 시계 반대 방향으로 돌리고베이스 플레이트 덮개를 들어 올려베이스 플레이트 덮개를 분리하십시오.
- 현미경을 동물의 바닥 판에 넣으십시오. 현미경은베이스 플레이트에있는 자석의 도움으로 제자리에 고정되어야합니다. 약간의 저항이 느껴질 때까지베이스 플레이트 고정 나사를 전진시킵니다.
- 중요 단계 : 현미경 하우징이 손상되지 않도록베이스 플레이트 고정 나사를 과도하게 조이지 마십시오.
- 소프트웨어에서 형광 스냅 샷을 수집하여 조직의 이미징 비행기를 확인하고, 현미경 터렛 세트 나사를 느슨하게하여 조직의 초점 평면을 조정하고, 미세 초점을 조정하기 위해 현미경 터렛을 회전시킨 다음 터렛을 다시 조입니다 하우징 고정 나사.
- 중요 단계 : 먼저 고정 나사를 풀지 않고 터렛을 돌리십시오.포탑 고정 나사를 과도하게 조이지 마십시오.
- 종단 연구를 수행하는 경우 실제 터렛 위치로 돌아가 동일한 시야를 캡처합니다. 하드웨어에서 동일한 시야로 빠르게 돌아 가기 위해 동일한 현미경으로 이미징 된 각 동물에 대해 터렛 턴 수 또는 포탑의 물리적 위치를 기록하십시오.
- 현미경이있는 동물을 습관 또는 행동 챔버에 놓고 적응시키고, 해당되는 경우 마취를 기다립니다.
- 중요한 단계 : 실험 세션을 시작하기 전에 현미경을 착용하는 것이 정상적인 행동을 방해하지 않을 때까지 여러 세션 동안 더미 현미경을 사용하여 현미경의 무게를 지탱하도록 동물을 훈련시킵니다. 깨어있는 구속을위한 정기적 인 취급과 훈련은 동물에게 과도한 스트레스를 예방합니다.
- 데이터를 수집하는 데 사용할 수집 설정을 선택하십시오. 이것은 프라임을 포함합니다.데이터 포착 속도 ( 예 : 20fps, 1의 게인 및 50 %의 LED 전력). 좋은 SNR을 보장하기 위해 설정을 선택할 때 이미지 히스토그램을 확인하십시오.
참고 : 형광 수집을위한 개구 수는 1mm 프리즘 프로브의 경우 0.35이고 1mm 스트레이트 프로브의 경우 0.5입니다. - 행동 소프트웨어를 실행하고 원하는 이미징 기록 사이클 ( 예 : 4X 5 분 ON 2 분 OFF)에서 현미경을 트리거하도록 프로그램하십시오. Noldus IO 박스의 TTL 포트를 RJ45-BNC 케이블을 통해 DAQ 박스의 TRIG 포트에 연결하십시오.
- 아직 거기 있지 않다면 행동 경기장에 동물을 넣고 실험을 시작하십시오.
- 원하는 데이터를 얻은 후 유도 챔버에서 isoflurane (산소 중 5 %)로 동물을 다시 마취 시키거나 동물을 천천히 깨우십시오.
- 베이스 플레이트 고정 나사를 풀고 현미경을 부드럽게 당겨베이스 플레이트에서 현미경을 분리합니다. 밑판 덮개를 다시 끼 우고 가볍게 조이십시오.나사를 조인다.
- 다음 녹음 세션 때까지 동물을 집에 넣으십시오. 후속 이미징 세션의 가이드로 참조 형광 이미지를 사용하여 동일한 시야로 돌아갑니다.
6. 대규모 칼슘 2 + 이미징 데이터 평가
- 데이터에서 시야 내의 세포 위치와 Ca 2+ 역학을 추출하기 위해 다양한 데이터 분석 플랫폼을 사용할 수 있습니다. 대규모 Ca 2+ 이미징 영화를 처리하기 위해 특별히 설계된 데이터 분석 플랫폼 인 Mosaic이이 연구에 사용되었습니다.
- 결함이있는 픽셀을 수정하고 전처리 단계에서 원시 동영상의 개별 프레임을 보간합니다. 공간 1,440 x 1,080 픽셀의 시야에서 720 x 540 픽셀로 이미지를 축소하여 데이터 풋 프린트를 줄입니다.
- 현미경 이미지 센서와 관련하여 뇌의 모션 아티팩트를 보정하려면 엄격한 ImageJ 기반 이미지를 사용하여 동영상을 등록하십시오.gistration 알고리즘 (TurboReg).
- 개별 뉴런을 식별하기 위해 형광의 상대적인 변화로 이미지를 재 표현합니다. ΔF / F 0 = FF 0 / F 0 여기서 F 0 은 전체 영화를 평균하여 얻은 평균 이미지입니다.
- 설정된 셀 정렬 알고리즘을 사용하여 개별 셀에 해당하는 공간 필터를 식별합니다. 여기서 우리는 개별 및 개별 구성 요소 분석을 사용하여 개별 뉴런을 식별했습니다.
참고 : 추적에서 이벤트의 피크 진폭이 데이터 세트에서 추적의 기준선보다 8 표준 편차 이상이고 추가 위치 분석을 위해 셀 위치와 Ca 2+ 역학 데이터를 내보낼 때 이벤트가 지정되었습니다.
결과
여기에 설명 된 프로토콜은 프리즘 프로브 ( 그림 1 )를 사용하여 자유롭게 행동하는 마우스에서 수 개의 대뇌 피질 뉴런에서 세로 다층 칼슘 2+ 영상을 수행하는 효과적이고 효율적인 방법을 설명합니다. 다층 피질 이미징에 대한 이전의 접근법은 머리 고정 동물 22 , 23 , 24 , 25 , 26 , 27 로 주로 제한되어왔다. 자유롭게 행동하는 맥락에서이 수준의 데이터를 얻기 위해, 소형화 된 현미경 플랫폼이 행동 유연성을 위해 사용되었습니다. 유 전적으로 암호화 된 칼슘 지시약 (GCaMP6f)을 사용하여 특정 세포 집단 (CAMKII + 피질 세포)을 표적으로 삼았다. 만성 다층 시야를 제공하기 위해 프리즘 프로브를 선택했습니다.
표지 된 세포에 광학적으로 접근 할 수 있도록 프리즘 프로브를 만성적으로 이식하기 전에 적절한 칼슘 지시약을 코딩하는 바이러스 벡터를 피질 ( 그림 2 , 1 단계)에 주입했습니다 ( 그림 2 , 2 단계). 영상 세션 동안 현미경의 위치에 대한 안전하고 임시 도킹 역할을하는베이스 플레이트는 동물의 머리 위에 설치되었으며 ( 그림 2 , 3 단계), 깨어있는 행동 실험에서 여러 세포 층에 걸쳐 대뇌 피질의 활동을 시각화 할 수있었습니다 설치 ( 그림 2 , 4 단계).
원하는 세포 집단이 표적화되도록하기 위해 대표적인 마우스의 사후 뇌관 절 두뇌 단면을 프리즘 프로브 영역과 GCaMP6f 실험실에 상대적으로 표시된 시야와 함께 그림 3 에 표시했습니다somatosensory cortex의 Layer 2/3과 5에서 eled 뉴런.
깨어있는 행동을하는 시스템에서 체세포 감각 피질 뉴런의 활동은 마우스가 오픈 필드 (Day 1), 개체 익숙 함 (Day 2-4) 및 소설 개체 (Day 5)의 세 가지 환경에 노출되었을 때 기록되었습니다 그림 4 ). 1 일에 마우스는 어떤 물건도없는 행동 경기장에 배치되었습니다. 날 2-4에서 마우스는 같은 두 개의 텍스처가 다른 대상 (젤 패드와 나무 블록)으로 경기장에 배치되었습니다. 5 일째, 대상 중 하나가 새로운 대상으로 교체되었습니다. 동물은 매일 20 분 동안 5 일 동안 이미지화되었습니다.
칼슘 2 + 이미지 데이터 분석 소프트웨어를 사용하여 세포 추출 후, 세포 위치에 해당하는 공간 필터를 현미경 기록 데이터의 평균 형광 강도 투영에 중첩시켰다( 그림 5) . 흰 점선은 레이어 2/3과 5 셀을 구분합니다. 각각의 층에서 5 개의 세포로부터의 상응하는 칼슘 2+ 흔적은 두 가지 상이한 행동 문맥 - 개체 익숙 함 및 새로운 대상 노출에서 세포의 발화 패턴을 나타낸다. 레이어 2/3 세포는 마우스가 새로운 대상에 노출 된 날의 레이어 5 세포에 비해 더 활동적이었습니다. 이것은 1, 4 및 5 일에 모든 이미징 된 셀의 threshold 된 발화 활동을 보여주는 래스터 플롯에서도 분명합니다.
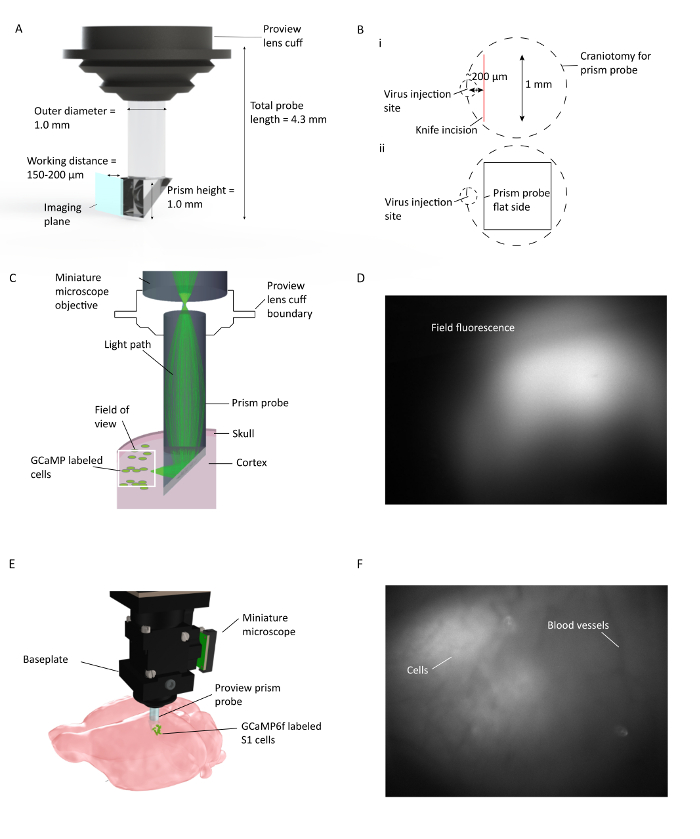
그림 1 : 자유롭게 움직이는 쥐에서 여러 피질 층을 가로 지르는 생체 내 칼슘 2+ 영상. ( A ) 프리즘 프로브 사양 및 이미지 평면 묘사. 빗변 안쪽의 반사 코팅은 프리즘 프로브 삽입면에서 90 °의 이미징을 허용합니다. 렌즈 cuff는 렌즈 홀더와 통합되어 임플란트 시술을 간소화하고 임플란트시 주위 조직 형광을 잠재적으로 볼 수 있습니다 ( B ) (i). (ii) 나이프 절개 및 바이러스 주사 부위에 대한 프리즘 프로브 편평한면의 위치를 보여주는 그림. ( C ) 마우스 피질에 이식 된 프리즘 프로브를 통해 전체 시야 내의 작은 영역에 대한 빛 경로를 보여주는 생체 내 Ca 2+ 영상 장치 설정의 예. ( D ) 프리즘 프로브 설치 중 시야의 예. 미니어처 현미경은 프리즘 프로브를 고정하는 렌즈 홀더에 부착되어 프리즘 프로브 설치 중에 바이러스 발현을 검사 할 수 있습니다. ( E ) GCaMP6f 표지 S1 세포의 다층 피질 이미징을위한 프리즘 프로브와 현미경의 통합. F보기 필드베이스 플레이트 설치 중. 생체 이미지에 일부 셀이있는베이스 플레이트 설치시 명확한 혈관 패턴이 표시됩니다. 획득 소프트웨어 창에서 DF / F가 켜지면 셀이 더 잘 보입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
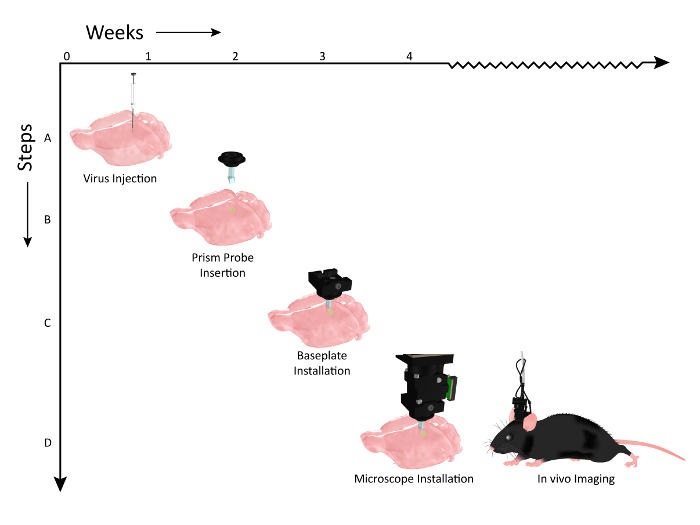
그림 2 : 프리즘 프로브 이식 및 현미경 설치를위한 워크 플로 이벤트의 타임 라인을 보여주는 도식. 주 수는 Y 축을 따라 프로 시저의 X 축 및 워크 플로우 단계에 표시됩니다. ( A ) 마우스 somatosensory 피질의 여러 레이어를 레이블에 동일한 dorso - ventral 축을 따라 바이러스 주입 (AAV1.CaMKII.GCaMP6f.WPRE.SV40)을 보여주는 그래픽. ( B ) 바이러스 주입 2 주 후, 프리즘 probe는 바이러스 주입 사이트에 평행 한 축에 이식된다. ( C ) 프리즘 프로브 주입 후 약 1 주일 동안, 동물의 현미경으로 발현 여부를 확인하고, 세포 집단이 보이면 머리판에베이스 플레이트를 올려 놓는다. ( D ) 그 동물은 관련 행동 과제 동안 만성 이미징을 준비합니다 (마우스 클립 아트는 UW-Madison Biochemistry MediaLab의 허락을 받아 수정되었습니다). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
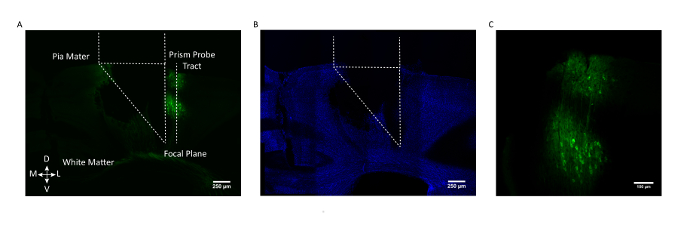
그림 3 : 프리즘 프로브 위치와 GCaMP 표현의 사후 검증. ( A ) 프리즘 프로브 영역과 그 영상화면이 마주 보는 대표적인 마우스 두뇌의 코로나 단면GCaMP6f 발현 세포 (AAV1.CaMKII.GCaMP6f는 2/3 및 5 층의 뉴런에서 발현 됨). ( B ) DAPI에 대한 염색 후 동일한 코로나 뇌 절편. Scale bar = 250 μm ( C ) somatosensory cortex에서 GCaMP6f 발현 세포의 확대도. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
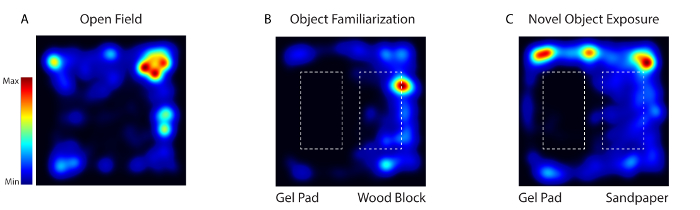
그림 4 : 습관, 익숙 함 및 소설 대상의 마우스 활동 비디오 소프트웨어를 사용하여 비디오를 추적합니다. ( A ) 1 일째에, 동물은 어떤 대상도없는 행동 경기장에 놓이게되었다 (열린 필드). ( B ) 2 일에서 4 일 사이에 동일한 두 개의 질감이 다른 대상 (젤 패드와 나무 블록)이 경기장에 배치되었습니다 (Object Fami거짓말). ( C ) 5 일째, 대상 중 하나가 새로운 대상 (모래 종이가있는 나무 블록)으로 대체되었습니다 (소설 대상 노출). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
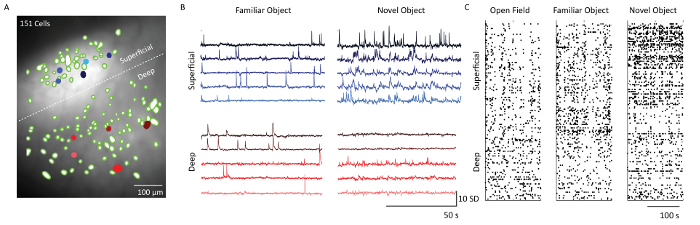
그림 5 : 현미경으로 촬영 한 대표 마우스의 체 감각 피질의 표면 및 심층에서의 칼슘 역학 ( A ) 프리즘 프로브 시야를 통해 현미경 기록의 신경 공간 필터 (녹색 얼룩)와 평균 형광 강도 투영의 병합 된 이미지. 흰 점선으로 표시된 과립과 과립 사이의 경계. 스케일 바 = 100 μm. ( B ) 칼슘은 5 개의 표면 및 깊은 층 셀 (파란색과 빨간색으로 채워진 c패널 A의 ells). 주성분 분석과 독립 성분 분석에 이어 형광의 표준 편차를 나타내는 단위. 수평 눈금 막대 50 초 및 수직 눈금 막대 10 SD ( C ) 공개 필드, 개체 숙지 및 소설 개체 탐색에 표시된 표면 (레이어 2/3) 및 심층 (레이어 5)의 셀 래스터 그림. 눈금 막대 = 100 초. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
깨어있는 행동 중에 신경 회로 활동을 이해하는 것은 건강과 질병에서 효과적으로 뇌 기능을 해부하는 데 필요한 신경 과학적 조사의 핵심 단계입니다. 피질은 깨어있는 행동의 맥락에서 연구하는 데 특히 중요합니다. 왜냐하면 그것은 많은 중요한 감각,인지 및 실행 기능에서 중요한 역할을하기 때문입니다.
대뇌 피질의 기둥은 피질의 기본 기능 단위로 생각되며 피질 세포의 집단 수준 활동은 기둥 내의 물리적 위치에 따라 다르다고 알려져 있습니다. 예를 들어 체세포 감각 피질에서 2/3 층의 흥분성 뉴런은 주로 다른 신피질 영역으로 진행하고 다른 피질 네트워크를 변조합니다 30 , 더 깊은 층의 세포는 주로 시상과 같은 피질 하부 영역에 작용합니다 31 . 100의 활동 기록하기자유롭게 행동하는 피험자에서 서로 다른 층을 가로 질러 시간에 따라 동시에 사전에 지정된 피질 세포를 재현하는 것은 대뇌 유사 정보 흐름에 대한 우리의 이해를 크게 향상시켜 실시간 행동 정보 및 작업 관련 시간 정보에 의해 알린 피질 기둥의 미세한 기능 해부를 가능하게합니다. 저울.
이 수준의 신경 회로 데이터를 수집하는 것은 효율적이고 유선형의 소형 현미경 플랫폼을 사용하여 자유롭게 행동하는 피험자 (또는 원하는대로 머리 고정 피험자)에서 대규모 칼슘 2+ 영상을 수행 할 수있게합니다. 세포 형 특정 표적화를 가능하게하고, 만성적으로 이식 된 프리즘 프로브에 의해 제공되는 다층 시야를 이미징하기 위해 유 전적으로 코딩 된 칼슘 지시약과 함께 사용되는이 프로토콜은 많은 가능한 응용 중 하나의 사례를 탐구했다 : 마우스의 체성 감각 대뇌 피질 처리 물리적으로 새로운 객체와 결합합니다 ( 그림 5 ).이것은 깨어 있고 자유롭게 행동하는 동물에서 여러 피질 층을 연구하기위한 세포 유형 특이적인 생체 내 접근법의 첫 번째 절차적인 일러스트레이션이며 능동적 인 두뇌의 층류 구조를 이해하는 데 사용할 수있는 실험 방법의 스펙트럼을 확장합니다.
이 기술에서 프리즘 프로브에 의해 가능해진 시각의 망원경 (periscopic) 시야는 관심 부위에 직접적으로 조직의 보존이 요구 될 때 다른 뇌 구조에 적용될 수있다. 예를 들어, CA3 이미징은 해마 기능의 중단없이 달성 될 수있다.
Ca 2+ 활동을 이미징하기위한 프리즘 프로브 기반 접근법은 피질에 마이크로 프리즘을 물리적으로 삽입하고 영구적으로 삽입해야하는데, 이는 렌즈 프로브가 삽입되는 피질 병변의 생성과 동일합니다. 이것은 정점 수상 돌기 및 과정의 절단을 포함하여 국소 신경 회로에 혼란을 야기 할 수 있습니다. 티그의 절차는 또한 영역에서 glial 세포의 초기 활성화를 일으킬 것입니다, 이것은 프리즘 얼굴에서 약 150 μm의 조직에 국한 될 것으로 예상되고, 뇌가 치유 된 후 가라 앉을 것으로 예상 22 . 이 기술이 실험을 계획 할 때 동물의 정상적인 회로 해부학 및 / 또는 행동에 영향을 미치는지 고려하는 것은 매우 중요합니다. Behavioral Control Group은 교묘 한 실험 결과를 생성 할 수있는 기준 행동에 중요한 변경이 없도록 항상 수행되어야합니다.
신경 내학 적 조작, 다양한인지 적, 사회적, 운동 적 또는 고유의 행동 패러다임을 가진이 소형화되고 이동성 인 Ca 2+ 영상 기법을 사용하고 다른 생리적 측정 기준과 결합하면 행동 및 신호에서 신경 회로의 기능적 역할을 이해하는 데 초점을 맞춘 연구가 심화되고 풍부해질 수 있습니다 처리 32 . 억압 또는 활동약물로 조절되는 특정 경로의 작용은이 기술을 사용하여 쉽게 연구 할 수있는 관련 행동에 영향을 줄 수 있습니다 33 . 칼슘 지시자의 표적을 변경해서 다른 세포 유형으로 밖으로 분기하는 것은 다른 강력하고 유용한 신청이고, 다양한 신경 회로 질문을 제시하는 실험적인 공구의 많은 창조적 인 조합을 가능하게합니다.
공개
저자는 저널의 정책을 읽고 다음과 같은 경쟁 이익을 가지고 있습니다. SG, SO 및 VC는 Inscopix의 임금 직원입니다.
감사의 말
저자들은 AAV1-GCaMP6f의 관대 한 기증으로 하워드 휴즈 의학 연구소의 Janelia Research Campus의 Genetically-Encoded Neuronal Indicator and Effector (GENIE) 프로젝트의 V. Jayaraman, DS Kim, LL Looger 및 K. Svoboda에게 감사드립니다. University of Pennsylvania 벡터 코어. 그들은 또한 공 촛점 현미경 검사 서비스에 NIH NS069375 보조금으로 지원되는 Stanford University의 A. Olson과 Neuroscience Microscopy Core에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
참고문헌
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698 (2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158 (2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763 (2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -. B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유