JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
심장 근육 세포 기반 액츄에이터 및 자체 안정화 바이오 오봇 - 제 2 부
요약
이 연구에서는 기능화 된 엘라스토머 캔틸레버 암을 갖춘 생물학적 액추에이터와 자체 안정화 수영 biorobot에 심근 세포를 뿌리고 배양하여 시간에 따른 생화학 및 생체 역학 특성을 분석했습니다.
초록
최근에는 합성 기계적 백본과 통합 된 살아있는 세포 또는 조직 구성 요소로 구성된 하이브리드 장치가 개발되었습니다. 비 오로봇 (biorobots)이라고 불리는이 장치는 살아있는 구성 요소의 수축 활동에서 생성 된 힘에 의해서만 구동되며, 많은 고유 한 이점으로 인해 기존의 완전 인공 로봇의 대안이 될 수 있습니다. 여기서는이 두 부분으로 구성된 기사의 첫 번째 부분에서 설계, 제작 및 기능화 된 생물학적 액추에이터와 바이오 오봇을 시드하고 특성화하는 방법을 설명합니다. 폴리 디메틸 실록산 (PDMS) 염기 및 박막 캔틸레버로 구성된 조작 된 생물학적 액추에이터 및 바이오 오봇 장치를 피브로넥틴으로 세포 부착을 위해 작용 화시켰다. 기능화 후에, 신생아 쥐의 심근 세포를 고밀도로 PDMS 캔틸레버 팔에 파종하여 합류 세포 시트를 얻었다. 장치는 매일 이미지화되었고 캔티 (canti)의 움직임레버 암이 분석되었다. 파종 후 2 일째에, 우리는 자발적 수축 중에 세포에 의해 가해지는 힘으로 인한 외팔보의 굽힘을 관찰했다. 캔틸레버 벤딩 (cantilever bending)의 정량 분석에서, 세포가 시간에 따라 성숙함에 따라 표면 스트레스가 점진적으로 증가하는 것이 관찰되었다. 마찬가지로, 우리는 지느러미 역할을하는 PDMS 외팔보 암 (cantilever arm)의 작동으로 인해 생체 로봇의 움직임을 관찰했다. 장치의 수영 프로파일을 정량화함에 따라, 핀의 정지 각도에 의해 영향을받는 다양한 추진 모드가 관찰되었다. 운동 방향과 고동 주파수는 지느러미의 정지 각도에 의해서도 결정되었고, 142μm / s의 최대 수영 속도가 관찰되었다. 이 원고에서 우리는 조작 된 장치를 심근 세포로 채우는 과정과 생물학적 액추에이터 및 바이오로봇 활동을 평가하는 절차를 설명합니다.
서문
바이오 오봇 (Biorobots)은 일반적으로 PDMS 나 하이드로 겔 (hydrogels)과 같은 부드럽고 신축성있는 물질로 구성된 기계적 백본에 통합 된 살아있는 세포를 기반으로 한 장치입니다. 세포는 자발적으로 또는 자극에 반응하여 리듬 수축을 겪고, 따라서 액츄에이터로서 기능한다. 세포 수축으로부터 생성 된 힘은 다양한 바이오 오봇 (biorobot)을 유도합니다. 포유 동물의 심장 세포 (cardiomyocytes)와 골격 근육 세포는 수축 특성으로 인해 비오 로봇의 작동에 종종 사용됩니다. 심근 세포와 골격근 세포 외에 곤충 근육 조직 2 와 외과 근육 조직 3 과 같은 다른 세포 유형이 사용되었습니다. 곤충 근육 조직은 실온에서 생물학적 액추에이터의 작동을 가능하게합니다.
biorobot의 기능과 성능은 주로 생물학적 액추에이터의 강도와 일관성에 의해 결정됩니다 ( 즉,. 근육 세포), 기계적 백본 구조는 주로 운동, 안정성 및 힘의 메커니즘을 결정합니다. 이러한 장치는 전지에서 발생하는 힘에 의해서만 구동되기 때문에 화학적 오염 물질이나 작동 소음이 없습니다. 따라서 다른 기존 로봇에 비해 에너지 효율적인 대안을 형성합니다. 다양한 문헌에서 살아있는 세포와 조직을 생체 로봇 1 , 4 , 5에 통합하는 다양한 방법에 대해 논의 해 왔습니다. 미세 제작 및 조직 공학 기술의 진보로 도보, 그립, 수영 또는 펌프 작동이 가능한 비 오보봇 (biorobot)을 개발할 수있었습니다. 일반적으로, 세포는 합류 세포 시트로서 기계적 (중합체) 백본 상에 직접 배양되거나, 링 및 스트립과 같은 비계 내의 3 차원 액츄 에이션 구조로 몰딩된다. 대부분의 경우, 비오 로봇은이들 세포는 외부 자극없이 자발적 수축을 나타내는 본래의 능력을 가지기 때문에, 심근 세포 시트 ( 6 , 7 )를 사용하여 제조된다. 한편, 골격 근육 세포 시트에 대한 보고서는 막 탈분극을 시작하기 위해 체외 에서 수축을 시작하는 자극이 필요하기 때문에 제한됩니다 8 .
이 프로토콜은 먼저 얇은 PDMS 외팔보로 만들어진 기능화 된 생물 학적 액츄에이터에 cardiomyocytes를 심는 방법을 설명합니다. 그런 다음 수영 프로필의 파종과 분석에 대해 자세히 설명합니다. 캔틸레버는 피브로넥틴과 같은 세포 접착 성 단백질로 관능 화되고 심근 세포와 합류하여 시딩된다. 세포가 장치 계약서에 뿌리면 캔틸레버가 구부러져 작동기 역할을합니다. 시간이 지남에 따라 세포가 성숙함에 따라 세포의 표면 스트레스 변화를 추적합니다.캔틸레버 벤딩. 여기에서 개발 된 생물학적 액추에이터는 섬유 아세포 또는 유도 된 다 능성 줄기 세포와 같은 모든 세포 유형의 수축 특성을 분화를 결정할 때 측정하는 데 사용할 수 있습니다.
biorobot에 대한 이전 연구의 대부분은 생물학적 액추에이터 개발에 초점을 두었지만 biorobot 아키텍처 및 기능 기능의 최적화는 대부분 무시되었습니다. 최근에는 자연에서 영감을 얻은 바이오 오봇 (biorobots)에서 수영 모드를 구현 한 몇 가지 연구가 있습니다. 예를 들어, 편모충을 기반으로 한 운동 6 , 해파리 추진 9 , 바이오 하이브리드 광선 4 를 이용한 수영 biorobots가 설계되었습니다. 다른 문학 작품 들과는 달리, 여기서 우리는 자기 안정화 구조를 만들기 위해 기계적 백본의 성질을 변화 시키는데 중점을 둔다. 이 연구에서 개발 된 바이오 오봇 (biiorobot)은 일정한 피치, 롤, 그리고 메신저를 유지할 수있다.그것이 수영 할 때의 수심. 이 매개 변수는 각 기본 합성물의 두께를 변경하여 수정할 수 있습니다. PDMS 액추에이터, submergible biorobot 및 장치의 기능화 개발과 관련된 제작 단계는이 두 편의 기사의 Part 1과 최근 작업 7 에서 자세히 설명합니다. 여기에서 개발 된 기술은 화물 운송과 같은 다양한 어플리케이션을위한 고효율의 비 오로봇 (biorobot)을 개발할 수 있습니다.
이 연구에서 수행 된 격리 과정은 초기 연구 10 과 최근 출판 된 연구 7 에서 설명한 과정과 유사합니다. PDMS 액추에이터 및 바이오 오로봇 장치를 제작하는 데 사용되는 미세 제작 방법은이 두 편의 원고 파트 1에 자세히 설명되어 있습니다. 이 원고의 프로토콜 섹션은 조작 된 PDMS에 심근 세포를 파종하는 단계를 설명합니다.ctuator 및 biorobot을 세포 접착 단백질로 기능화시킨 후
프로토콜
여기에 설명 된 모든 절차는 승인 된 프로토콜을 사용하여 수행되었으며 Notre Dame 대학의 기관 동물 관리 및 사용위원회의 규정에 따라 수행되었습니다.
1. 세포 배양 및 배양
- 시작하기 전에 10 % 태아 소 혈청 (FBS)과 1 % 페니실린 항생제 (DMEM 완결)가 첨가 된 작은 깔때기, 피펫 및 따뜻한 Dulbecco Modified Eagle Medium (DMEM)을 준비하십시오.
- 기능화 된 장치 (생물 학적 액추에이터 또는 biorobot)와 함께 T - 25 플라스크를 가져 가라. 세포 배양에 앞서 장치 준비, 기능화 및 보관에 대한 자세한 내용은이 두 부분으로 된 원고의 1 부 4 절을 참조하십시오.
- 작고 정사각형 인 플라스틱 시트를 굴려서 깔때기를 준비하십시오. T-25 플라스크 안의 생물학적 액츄에이터 또는 바이오 오봇 위에 놓습니다. 넓은 장치의 직경을 장치 전체에 맞게 조정하십시오.플라스크의 상단이 단단히 조여 질 때 높이가 맞아야합니다.
- biorobots 들어, 자장 과정을 통해 플라스크의 바닥에 장치를 개최 자석을 사용합니다.
참고 : 여기에는 하나의 네오디뮴 디스크 자석 (직경 1.26 ")이 사용되었지만 비슷한 크기와 강도를 지닌 임의의 자석도 자기 니켈 -PDMS 복합베이스로 비오봇 로봇을 고정시키는 데 사용할 수 있습니다. - 적어도 30 분 전에 플라스틱 시트를 자외선 살균하십시오.
- biorobots 들어, 자장 과정을 통해 플라스크의 바닥에 장치를 개최 자석을 사용합니다.
- 깔대기 바닥과 플라스크 사이에 큰 간격이 없는지 확인하십시오.
- 1.6 x 10 7 세포 / ML의 밀도로 완료 DMEM의 cardiomyocytes를 Resuspend하고 천천히 깔때기를 통해 장치에 정지의 400 μL를 드롭하십시오. hemocytometer 또는 다른 세포 카운터를 사용하여 얻은 세포의 수를 결정합니다.
- 장치와 깔때기를 방해하지 않고 천천히 시스템을 인큐베이터로 다시 이동하십시오.hin. 37 ° C에서 24 시간 동안 배양.
- 잠복기 후, 천천히 깔때기를 제거하고, PBS로 시료를 부드럽게 씻어 내고 플라스크를 10 mL의 신선한 DMEM으로 채우십시오.
참고 : biorobots의 경우, 장치가 해상되도록 자석을 제거하십시오.
2. 생화학 적 특성
- 칼슘 플럭스 분석
참고 : 칼슘 플럭스 분석은 세포 상호 연결성을 평가하기 위해 수행됩니다. 형광, 칼슘 이온 특정 염료로 세포를로드하는 절차는 이전에 설립 프로토콜 11 에 설명 된 프로세스를 수행합니다.- 먼저 필요한 물질, 칼슘 fluo-4-acetomethyl (AM) 에스테르, 비이 온성 계면 활성제 폴리올 ( 표 참조) 및 Tyrode 의 소금 용액을 준비하십시오.
- 긴 핀셋을 사용하여 장치를 배양 플라스크에서 Tyrode 's salt solu 2 mL가 들어있는 35 mm 페트리 접시로 부드럽게 옮깁니다 .
- 별도의 원심 분리 튜브에서 따뜻한 Tyrode 용액 (37 ℃로 가온) 1 mL를 취하고 칼슘 fluo-4 AM 염료 (작동 농도 : 3-5 μM)와 비이 온성 계면 활성제 폴리올 (작업 농도 : 0.2 %). 샘플 용액을 칼슘 지시약 염료, fluo-4 및 0.2 % 비이 온성 계면 활성제가 보충 된 따뜻한 Tyrode 용액으로 교체하십시오. 37 ° C에서 25 - 30 분 동안 품어 라.
- 염료 솔루션을 제거하고 부드럽게 신선한 Tyrode의 솔루션으로 샘플을 씻으십시오. 이미징 이전에 37 ° C에서 또 다른 30 분 동안 완료 신선한 DMEM 2 ML에 샘플을 다시 품다.
참고 : 이 분석 및 관련 비디오의 결과는 이전에 출판 된 연구 7 에서 제공됩니다.
- 면역 형광법
주 : 모든 샘플의 이중 면역 염색은 이전에 확립 된 프로토콜> 12.- PBS, 일차 항체 (안티 (안티) 의 0.1 % 세포 lyse 세제 (자료 표 참조) diH 2 O, 인산염 - 버퍼 식염수 (PBS), 4 % paraformaldehyde (PFA)에 10 % 염소 세럼 (GS) - 마우스 단일 클론 항체 심장 트로포 닌 -1 및 항 - 토끼 모노클로 날 항체 connexins-43), 2 차 항체 (Alexa 594 접합체 및 염소 항 마우스 IgG (H + L) Alexa 488 접합체) 및 DAPI.
주의 : 파라 포름 알데히드는 발암 성입니다. - 플라스크에서 관심의 샘플을 제거하고 부드럽게 PBS로 두 번 씻으십시오. 표본 준비 및 기능화에 대한 자세한 내용은이 2 편 원고의 1 부 4 절을 참조하십시오.
- 작은 coverslip (직경 : 12mm 또는 15mm)에 PBS의 방울을 추가합니다. 부드럽게 핀셋으로 장치의베이스를 잡고 끝에서 가위를 사용하여 얇은 PDMS 암 (캔틸레버, 그림 1 )을 절단하여베이스 상단에 연결합니다이자형. 셀 부착면을 위로 향하게하여 캔틸레버 암을 액적 위로 옮깁니다. PBS 방울은 세포가 건조되는 것을 방지합니다.
- 이전에 설명한대로 4 % PFA로 샘플을 고정하고 샘플의 이중 면역 염색을 수행하십시오 12 .
- immunostaining 후, 안티 페이드 장착 시약을 사용하여 깨끗한 유리 슬라이드에 샘플을 탑재하고 24 시간 동안 어둠 속에서, 방해받지 않고 옆으로 설정합니다.
- 모든 샘플에 대해 절차를 반복하십시오.
참고 : 이 분석 및 관련 이미지의 결과는 이전에 출판 된 연구 7 에서 심도있게 논의됩니다.
- PBS, 일차 항체 (안티 (안티) 의 0.1 % 세포 lyse 세제 (자료 표 참조) diH 2 O, 인산염 - 버퍼 식염수 (PBS), 4 % paraformaldehyde (PFA)에 10 % 염소 세럼 (GS) - 마우스 단일 클론 항체 심장 트로포 닌 -1 및 항 - 토끼 모노클로 날 항체 connexins-43), 2 차 항체 (Alexa 594 접합체 및 염소 항 마우스 IgG (H + L) Alexa 488 접합체) 및 DAPI.
3. 이미징
- 이산화탄소 배양기에서 T - 25 플라스크를 똑바로 세우고 인큐베이터 내부의 이미징 시스템을 준비하십시오. 줌 렌즈 ( Table of Materials 참조)를 사용하여 카메라 ( 재료 표 참조)를 사용하여 장치를 기록하십시오. 광원의 경우,LED 표시등을 사용하십시오.
참고 : 여기에 백색광 LED 스트립이 사용되었지만 일반 LED는 작동합니다. - 카메라를 운영 체제에 연결하고 카메라 별 소프트웨어를 엽니 다 ( 재료 표 참조). 상단 패널의 "파일"탭 아래에있는 카메라 이미지를 클릭하여 모든 카메라 옵션을 열고 올바른 카메라를 선택하십시오.
- 소프트웨어 내의 상단 패널에있는 탭 목록에서 "live"를 선택하십시오.
- 렌즈 다이얼을 조정하여 수동으로 초점을 맞 춥니 다. 상단 패널에서 "ROI (region of interest)로 자르기"를 선택하십시오. 그런 다음 생물학적 액추에이터 장치와 캔틸레버 암을 둘러싸고 ROI를 표시하기 위해 비디오 프레임에 수동으로 사각형을 그립니다.
참고 : 적절한 ROI를 선택하면 이미지 파일의 크기가 최소화됩니다.- biorobots의 경우, 장치의 수영 동작을 기록하기 위해 전체 화면을 캡처하십시오.
참고 : biorobots에 대한 ROI를 작성할 필요가 없습니다.
- biorobots의 경우, 장치의 수영 동작을 기록하기 위해 전체 화면을 캡처하십시오.
- 녹화를 시작하기 전에 화면의 상단 패널에있는 탭 중 하나에서 "카메라 설정"을 선택하십시오. 막대를 각각 밀어서 또는 수동으로 값을 입력하여 라이브 이미지의 노출과 픽셀 비율을 조정하여 프레임 속도를 설정하십시오. 프레임 속도를 약 30 ± 2fps로 설정하십시오.
참고 : 노출 및 픽셀 비율을 변경하면 라이브 이미지의 밝기와 대비가 변경됩니다. - 소프트웨어의 상단 패널에서 "기록"버튼을 클릭하면 1,000 x 1,000 픽셀 해상도의 액추에이터 비디오를 정확히 30 초 동안 레코딩 할 수 있습니다. 모든 샘플에 대해이 과정을 반복하십시오.
4. 고정 받침대에있는 생물학적 액츄에이터의 이미지 분석
- 사용자 정의 스크립트를 실행하는 프로그래밍 소프트웨어 ( 예 : Matlab)를 사용하여 이미지를 분석하십시오. 재료 표 보기 및 Supplemental File 을 참조하십시오.
참고 : 스크립트는 기록 된 비디오의 각 프레임을 표시하고 이미지에 캔틸레버의 포인트 조정을 기록하는 사용자의 마우스 입력을 수신하고 최소 사각 피팅을 통해 입력 포인트를 통과하는 원의 직경과 중심을 계산하고 입력 및 계산 된 모든 데이터를 나중에 사용하기 위해 내보내십시오.- 아이콘을 클릭하여 프로그래밍 소프트웨어를 엽니 다. 상단의 메뉴 막대에서 "파일"-> "열기"를 클릭하고 이미지 분석을위한 .m 스크립트 파일을 선택하십시오. 기록 된 TIFF 이미지가 .m 파일과 동일한 폴더에 있는지 확인하십시오. "실행"을 클릭하여 스크립트를 실행하십시오.
참고 : 대화 형 디스플레이가 변경을 위해 팝업됩니다. - 실제 프로그램을 시작하려면 "재생"을 누르십시오. "open"버튼을 클릭하고 분석 할 TIFF 파일을 찾습니다.
- "기본 및 #34; 버튼을 클릭 한 다음 캔틸레버가 상단의베이스에 부착되는 지점을 클릭하십시오. Enter를 누르십시오. 그러면 캔틸레버베이스의 위치를 나타 내기 위해 각 프레임의 이미지에 사각형 마커가 배치됩니다.
- "크기 조정"버튼을 클릭 한 다음 유리 비드의 한쪽 가장자리를 수동으로 클릭하십시오. 마우스 포인터를 유리 구슬의 반대쪽으로 가져간 다음 "Enter"키를 누릅니다.
참고 : 이것은 유리 구슬의 직경을 측정하는 선을 그려야합니다. 유리 비드는 직경이 3mm이므로 표시된 픽셀과 3mm가 관련됩니다. - "분석"버튼을 클릭하십시오. 캔틸레버베이스를 나타내는 첫 번째 정사각형 마커에서 짧은 거리에있는 캔틸레버를 클릭하십시오.
- "분석"버튼을 클릭하십시오. 그런 다음 캔틸레버베이스를 나타내는 첫 번째 사각형 표식에서 짧은 거리에있는 캔틸레버를 클릭하십시오. 팁을 포함하여 캔틸레버를 계속 클릭하고 Enter 키를 누릅니다.끝난. 그러면 캔틸레버에서 클릭 한 각 점에 "x"가 표시됩니다.
참고 : 사각 마커의 좌표와 x 표식에 따라 원의 중심과 지름은 최소 사각 피팅 기능을 사용하여 계산됩니다 (사용 된 스크립트에 대한 첨부 파일 참조). x 표식과 정사각형을 통과하는 원이 이미지 위에 자동으로 겹쳐 표시됩니다. - 중첩 된 원이 캔틸레버 프로파일을 올바르게 추적하는지 확인하십시오.
참고 : 캔틸레버가 매우 평평한 경우 캔틸레버 프로파일이 올바르게 추적되는지 판단하기 어렵습니다. 그림 3을 참조하십시오. - "다음 프레임"버튼을 클릭하십시오. 그러면 TIFF 파일의 다음 프레임으로 전환됩니다. 기준과 눈금은 이전 단계에서 이미 설정되었습니다.
- TIFF 파일의 모든 프레임이 완료 될 때까지 4.1.5 ~ 4.1.7 단계를 반복합니다. 일단 모든 프레임이 처리되면ssed, "내보내기"버튼을 클릭하십시오.
참고 : 이것은 분석 된 캔틸레버의 TIFF 파일 이름을 가진 스프레드 시트 파일을 만듭니다. 파일 이름을 편집하여 캔틸레버의 측면 (왼쪽 또는 오른쪽)을 분석합니다.
- 아이콘을 클릭하여 프로그래밍 소프트웨어를 엽니 다. 상단의 메뉴 막대에서 "파일"-> "열기"를 클릭하고 이미지 분석을위한 .m 스크립트 파일을 선택하십시오. 기록 된 TIFF 이미지가 .m 파일과 동일한 폴더에 있는지 확인하십시오. "실행"을 클릭하여 스크립트를 실행하십시오.
- 스프레드 시트의 스트레스 계산.
- 다음 방정식을 사용하여 캔틸레버의 표면 응력 "σ"을 계산합니다.
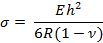
여기서 E, R, v 및 h는 각각 영률, 곡률 반경, 포아송 비 및 캔틸레버 두께입니다.
참고 : 캔틸레버의 두께는 감도를 변경하기 위해 변경할 수 있습니다. 이 연구에서 E = 750 kPa, v = 0.49, h = 25 μm 13,14의 값 을 얻었다. - 단계 4.2.1의 방정식을 사용하여 표면 응력을 계산합니다. 를 엽니 다.xls 스프레드 시트 파일. 출력에는 먼저 기본 및 원의 x 및 y 좌표와 곡률 반경이 표시된 여러 열이 있습니다. 이것을 토대로 클릭 된 각 포인트의 x와 y 좌표를 계산하십시오.
참고 : 시간 경과 이미지 프레임에 응력을 플롯하면 시간이 지남에 따라 캔틸레버에 작용하는 힘의 변화가 표시됩니다. 골은 심근 세포가 이완되는 동안 외팔보에 가해지는 응력 또는 세포 견인력으로 인해 외팔보에 작용하는 정적 응력을 보여줍니다. 피크는 심근 세포의 박동에 의해 작용 된 캔틸레버의 동적 응력을 보여줍니다. 이 값은 cardiomyocytes의 수축에 의해 생성 된 힘의 최대 금액에 해당합니다.
- 다음 방정식을 사용하여 캔틸레버의 표면 응력 "σ"을 계산합니다.
5. 수영 바이오 오봇의 분석
- 이미지 분석 소프트웨어를 사용하여 biorobot의 위치를 기록하십시오.
참고 : th에서 사용되는 소프트웨어에 대한 자료 목록을 참조하십시오.섹션입니다.- 이미지 분석 소프트웨어 ( 예 : ImageJ)를 엽니 다. "파일"과 "열기"를 누르고 수영 biorobot 비디오 파일을 선택하십시오. "확인"을 클릭하고 프로그램이 파일을로드하게하십시오. 스프레드 시트 소프트웨어를 엽니 다.
- 로드 된 바이오 오빗 비디오에서 알려진 치수 ( 예 : 생물학적 액추에이터에 포함 된 직경 3mm의 유리 비드)에 대한 참조를 찾습니다.
참고 : 치수가 알려진 모든 객체가 작동합니다. 이렇게하면 각 비디오의 픽셀 길이 비율이 결정됩니다. - "직선"도구를 사용하여 유리 비드에 선을 그립니다. '분석'을 클릭하고 '배율 설정'을 선택하십시오. "알려진 거리"필드를 "3,000 μm"로 설정하고 "확인"을 클릭하십시오.
참고 : 이것은 x와 y 좌표를 마이크로 미터로 설정합니다. - 장치에서 마커 역할을하는 프레임 사이에서 흔들리지 않는 지점을 선택하십시오.
노트 :받침대의 모서리를 선택하는 것이 좋습니다. - 첫 번째 프레임의 5.1.4에서 선택한 지점을 가리 킵니다. 스프레드 시트에 x 및 y 좌표를 기록하십시오.
- 이미지 분석 소프트웨어 창으로 다시 전환하고 오른쪽 화살표 키를 눌러 다음 프레임으로 변경하십시오. 마커를 다시 가리키고 (5.1.4 단계) 스프레드 시트에 x 및 y 좌표를 기록하십시오.
- 모든 프레임에 대해 5.1.6 단계를 반복하십시오.
- 좌표계 7 스프레드 시트를 사용하여 biorobot의 수영 매개 변수를 계산하십시오.
- 각 비디오의 알려진 프레임 속도에서 프레임 사이의 기간을 계산하십시오.
- 총 거리를 포함하여 이동 된 거리를 찾기 위해 프레임 간의 x 및 y 좌표의 변화를 계산합니다.
- y 축을 따라 최대 변화로부터 수축의 진폭을 계산하십시오. 두 수축 사이의 기간의 역으로부터 각 비 오로봇에 대한 고동 주파수를 결정합니다.
- 기음x 방향으로 이동 한 총 시간과 거리에서 각 장치의 수영 속도를 계산합니다.
- 분석 된 각 biorobot 비디오에 대해 5.2 단계를 반복하십시오.
- 측정 된 각 매개 변수를 표준화하십시오.
참고 : 모든 값을 표준화하여 차이를 더 잘 시각화하십시오. 이 프로토콜은 저주파수 수축 (수평 LF) ( 그림 4 ) 7 수평 모드 biorobot에 관한 표준화를 보여줍니다.
6. 단백질 발현 분석
참고 : 2.2.4 및 2.2.5 단계에서 준비된 탑재 샘플을 공 촛점 현미경을 사용하여 이미지화했습니다. 이미지는 3 개의 채널에서 동시에 20X, 40X 및 60X 배율로 획득되었습니다 (460nm, 488nm 및 594nm). 각 샘플에 대해 서로 다른 위치에서 40 배의 배율로 5 개의 이미지 세트가 캡처되었으며 각 채널은 개별 .TIFF로 저장되었습니다.파일. 노출 설정은 사용 된 대물 렌즈의 배율에 의해 결정되었으며 해당 배율에서 모든 캡처에 대해 일정하게 설정되었습니다.
- 이미지 분석 소프트웨어를 열고 "File"-> "Open"을 선택하여 이미지를로드하십시오.
- ROI를 표시하기 위해 이미지 프레임에 직사각형 다각형을 그립니다. "Analyze"-> "Measure"를 선택하여 평균 형광 강도를 측정하십시오.
- 모든 샘플에서 강도 측정을 수집하고 각 조건에 대한 각각의 평균 강도를 계산하려면 6.2 단계를 반복하십시오.
참고 : 여기에서 다른 조건은 1 일, 2 일 및 6 일과 같이 서로 다른 시점을 나타냅니다. - 추가 통계 분석 및 데이터 플롯 생성을 위해 스프레드 시트로 결과를 내 보냅니다.
결과
얇은 PDMS 캔틸레버 (두께 25 μm)와 심근 세포로 만들어진 생물학적 액추에이터는 그림 1 의 장치의 개략도와 스크린 샷에서 볼 수 있듯이 수영 biorobot의 핵심을 구성합니다. 세포는 배양에서 24 시간 후에 수축을 나타 내기 시작하고, 외팔보의 굽힘은 날 2에 의해 관찰되었다. 장치의 측면 프로필은 매일 기록되었고, 표면 스트레스는 칸틸 레버 암을 사용하여 캔?...
토론
여기에 설명 된 절차는 PDMS 기반 액추에이터 및 biorobots에 대한 성공적인 시딩 방법을 설명하며, 이는 심근 세포의 부착을 용이하게합니다. 또한, 세포의 행동과 장치의 성능을 특징 짓는 이미지 수집 및 후속 분석 프로세스가 설명되었습니다.
우리는 24 시간 후 cantilever arms에서 세포의 자발적 수축을 관찰했다. 수축의 강도는 시간이 지남에 따라 꾸준히 증가하여 6 일째에 최?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
MT Holley는 Louisiana Board of Regents의 Graduate Fellows 프로그램에서 지원하고 C. Danielson은 Howard Hughes Medical Institute 교수 프로그램의 지원을받습니다. 이 연구는 NSF 보조금 번호 : 1530884에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Cardiomyocytes (primary cardiac cells) | Charles River | NA | Isolated from 2-day old neonatal Sprague Dawley rats |
| Dulbecco’s modified eagle’s media (DMEM) | Hyclone Laboratories | 16750-074 | with 4500 mg/L glucose, 4.0 mM L-glutamine, and 110 mg/L sodium pyruvate |
| Fetalclone III serum | Hyclone industries, GE | 16777-240 | Fetal bovin serum (FBS) |
| Dulbecco’s phosphate buffer (PBS) | Sigma-Aldrich | D1408-100ML | |
| Penicillin-G sodium salt | Sigma-Aldrich | P3032 | |
| Goat serum | Sigma-Aldrich | G9023 | |
| 4,6-diamidino-2-phenylindole dihydrocholride powder (DAPI) | Sigma-Aldrich | D9542 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | Solution (1 mg/ml) |
| Calcein-AM and ethidium homodimer-1 kit (Live/Dead Assay) | Molecular Probes | L3224 | |
| Calcium Fluo-4, AM | Molecular Probes | F14217 | calcium indicator dye |
| Tyrodes salt solution | Sigma-Aldrich | T2397 | buffer solution |
| Pluronic F-127 | Molecular Probes | P3000MP | nonionic surfactant-20 % solution in Dimethylsiloxane (DMSO) |
| 16% Parafomaldehyde | Electron microscopy | 15710 | Caution: Irritant and combustible |
| Triton x-100 | Sigma-Aldrich | X-100 100 mL | cell lyses detergent, (4-(1,1,3,3-Tetramethylbutyl)phenyl-polyethylene glycol, t-Octylphenoxypolyethoxyethanol, Polyethylene glycol tert-octylphenyl ether) |
| ProLong gold antifade reagent | Molecular Probes | P10144 | Mounting agent |
| Alexa Fluor 594 Phalloidin | Molecular Probes | A12381 | Actin filament marker |
| Goat anti-rabbit IgG (H+L) secondary antibody, Alexa Fluor 594 conjugate | Molecular Probes | A-11012 | |
| pha | Molecular Probes | A-11001 | |
| Anti-connexin 43 antibody | Abcam | ab11370 | Gap junction marker |
| Anti-cardiac troponin I antibody | Abcam | ab10231 | Contractile protein |
| 16% EM grade paraformaldehyde solution | Electron microscopy | 100503-916 | |
| Polydimethylsiloxane (PDMS) | Elsevier | Sylgard 184 | |
| Materials and Equipment | |||
| Camera | Thor Labs | DCC1545M | |
| LED light strip | NA | NA | Any white LED without spectrum emission |
| Confocal microscope | Nikkon C2 | NA | Confocal microscope with three filter set. |
| Zooming lens | Infinity | Model# 252120 | |
| Software | |||
| Matlab | Mathworks | NA | Used in Section 4) for biological actuator analysis. |
| Image J | National Institute of Health | NA | Java-based image processing software. Used in Section 5) for biorobot analysis. Free Image Processing and Analysis software in java. (https://imagej.nih.gov/ij/) |
| Thor Cam | Thor Labs | NA | Camera operating software |
참고문헌
- Feinberg, A. W. Biological Soft Robotics. Annu. Rev. Biomed. Eng. 17, 243-265 (2015).
- Akiyama, Y., et al. Room Temperature Operable Autonomously Moving Bio-Microrobot Powered by Insect Dorsal Vessel Tissue. PLOS ONE. 7, 38274 (2012).
- Herr, H., Dennis, R. G. A swimming robot actuated by living muscle tissue. J. NeuroEng Rehabil. 1, 6 (2004).
- Park, S., et al. Phototactic guidance of a tissue-engineered soft-robotic ray. Science. 353 (6295), 158-162 (2016).
- Cvetkovic, C., et al. Three-dimensionally printed biological machines powered by skeletal muscle. Proc. Natl. Acad. Sci. 111, 10125-10130 (2014).
- Williams, B. J., Anand, S. V., Rajagopalan, J., Saif, M. T. A. A self-propelled biohybrid swimmer at low Reynolds number. Nat. Commun. 5, (2014).
- Holley, M. T., Nagarajan, N., Danielson, C., Zorlutuna, P., Park, K. Development and characterization of muscle-based actuators for self-stabilizing swimming biorobots. Lab. Chip. 16, 3473-3484 (2016).
- Hopkins, P. M. Skeletal muscle physiology. Contin Educ Anaesth Crit Care Pain. 6, 1-6 (2006).
- Nawroth, J., et al. A tissue-engineered jellyfish with biomimetic propulsion. Nat Biotechnol. 30 (8), 729-797 (2012).
- Ehler, E., Moore-Morris, T., Lange, S. Isolation and Culture of Neonatal Mouse Cardiomyocytes. J. Vis. Exp. JoVE. (79), e50154 (2013).
- Bers, D. M. Calcium Fluxes Involved in Control of Cardiac Myocyte Contraction. Circ. Res. 87, 275-281 (2000).
- Shin, S. R., et al. Carbon-Nanotube-Embedded Hydrogel Sheets for Engineering Cardiac Constructs and Biological actuators. ACS Nano. 7, 2369-2380 (2013).
- Park, J., et al. Real-Time Measurement of the Contractile Forces of Self-Organized Cardiomyocytes on Hybrid Biopolymer Microcantilevers. Anal. Chem. 77, 6571-6580 (2005).
- Tamayo, J., et al. Quantification of the surface stress in microcantilever biosensors: revisiting Stoney's equation. Nanotechnology. 23, 475702 (2012).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nat. Methods. 10, 781-787 (2013).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in Cardiomyocyte Isolation, Culture, and Gene Transfer. J. Mol. Cell. Cardiol. 51, 288-298 (2011).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Sfakiotakis, M., Lane, D. M., Davies, J. B. C. Review of fish swimming modes for aquatic locomotion. IEEE J. Ocean. Eng. 24, 237-252 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유