JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
포도당 섭취량 측정 및 인슐린 자극에 대한 반응
요약
이 방법에서는 인간의 일차 근육 세포 를 체외에서 배양 하여 분화 된 근육 세포를 얻고 포도당 섭취율을 측정합니다. 우리는 방사성 표지 된 [ 3 H] 2-deoxy-D-Glucose를 사용하여 기저 및 인슐린 자극 상태의 비율을 정량화하는 상세한 프로토콜을 제공합니다.
초록
골격근은 포유 동물에서 가장 큰 글루코즈 침전물이며 포도당 항상성에 크게 기여합니다. 근육 세포의 인슐린 감수성 평가는 근육 포도당 대사를 탐색하고 대사 변화를 특징 짓는 모든 연구에 중요한 관련성이 있습니다. 근육 세포에서 글루코스 전달 인자 4 형 (GLUT4) 단백질은 인슐린에 반응하여 세포막으로 전이되어 세포 내로 포도당을 대량으로 주입합니다. 포도당 흡수 속도를 증가시켜 인슐린에 반응하는 근육 세포의 능력은 인슐린에 대한 근육 세포 민감성을 정량화하는 표준 판독 값 중 하나입니다. 인체의 주요 myotubes는 세포가 인슐린 감도를 포함하여 기증자 표현형의 많은 특징을 유지하기 때문에 시험 관내 모델에 적합합니다. 이 생체 외 모델은 또한 인슐린 반응에 영향을 줄 수있는 화합물의 검사에도 적합합니다. 분화 된 myotubes에서 포도당 섭취량의 측정 반영인슐린 민감성.
이 방법에서는 인간의 일차 근육 세포 를 시험관 내 에서 배양 하여 분화 된 근육 세포를 얻고 인슐린 자극이 있거나없는 포도당 섭취율을 측정합니다. 우리는 방사성 표지 된 [3H] 2-deoxy-D-Glucose ([ 3 H] 2dG)를 사용하여 수동 및 활성 포도당 수송 속도를 정량화하기위한 상세한 프로토콜을 제공합니다. 활성 기저 및 인슐린 자극 속도와 자극 배수를 정량화하는 계산 방법이 제공됩니다.
서문
골격근은 포유 동물에서 가장 큰 글루코즈 침전물이며 포도당 항상성에 크게 기여합니다. 이 인슐린 반응 조직은 인슐린 자극에 의해 유발되는 포도당 섭취의 주요 부위입니다 1 .
제 2 형 당뇨병에서 인슐린 저항성은 골격근을 포함한 여러 조직에서 관찰되며 정상 혈당 농도 이상으로 이어집니다. 따라서,이 조직과 그 세포의 인슐린 감수성 수준을 결정하는 것이 목적과 상관없이 대상의 결함을 특성화하거나 개선하고자하는 치료의 효율성을 평가하는 것이 중요합니다. 인체 또는 동물 대상에서 인슐린 감수성을 평가하는 표준 표준 기술은 고 인슐린 혈증 클램프입니다. DeFronzo가 1979 년 2 월에 도입하여 3 , 4 년 이후로 수정 된이 방법은 전신을조직 인슐린 반응은 정상적인 혈당 농도를 유지하기 위해 인슐린 자극하에 포도당이 관류되는 비율로 측정됩니다.
인슐린 감도 탐사는 또한 체외 근육 모델을 사용하여 세포 수준에서 수행 할 수 있으며, 포도당 섭취량 측정은 인슐린 자극 5 , 6 , 7 에 대한 세포의 생물학적 반응을 정량화하는 효율적이고 신뢰할 수있는 도구로 남아 있습니다. 실제로 포도당 섭취량 측정은 인슐린이 수용체에 결합하여 GLUT4가 농축 된 소포를 전이시키고 세포 내 신호 전달 및 인산화 캐스케이드를 포함하여 인슐린 자극에 대한 세포 생물학적 반응을 정량화합니다.
이것은 분화 된 myotubes가 신진 대사 특성을 포함한 기증자 표현형의 많은 특징을 유지하기 때문에 인간 표본에 대한 주요 관심사이다환자 및 환자에서 관찰 된 장애 9 , 10 , 11 , 12 . myotubes는 골격근 13,14에 구조적, 대사 적 및 표현형 유사성을 표시하며 , 포도당 전달체 15 및 세포 인슐린 신호 전달기구 16 의 발현을 포함합니다. 따라서 기본 근육 세포에서 포도당 섭취량을 측정하는 것은 기증자의 근육 표현형을 특성화하거나 근육 세포에서 인슐린 감수성에 대한 중재 (약물, 영양 또는 신체 활동)의 효과를 조사하는 것과 관련이 있습니다.
배양 된 myotubes에서 포도당 섭취량을 측정하는 것은 또한 인슐린 감수성을 수정하는 실험을 수행 할 때 신뢰할 수있는 도구입니다 17 , 18 . 시험 관내 모델은 인슐린 반응성을 향상시킬 수있는 화합물의 검사에 적합하거나 인취 또는 유도 된 인슐린 저항성을 예방하거나 역전시킬 수있는 화합물 19 , 20 , 21 , 22 , 23에 적합 합니다.
여기서 우리는 인간의 myotubes를 배양하고 분화시키고 세포 포도당 섭취율을 측정하기위한 상세한 프로토콜을 설명합니다. 이 방법은 실험실에서의 준비, 협동 또는 상업적으로 이용 가능한 공급 업체에서 유래하든 인간 근육 전구 세포의 모든 공급원에 적용 할 수 있습니다. 마우스 및 쥐 기원의 각각 C2C12 및 L6과 같은 불멸 근육 세포주도이 프로토콜을 사용하여 포도당 섭취 측정에 사용할 수 있습니다.
우리는 방사성 표지 된 [3H] 2dG를 사용하여 기저 및 인슐린 자극 상태의 속도를 정량화하는 상세한 프로토콜을 제공합니다. 티그는 라벨이 붙어있는 글루코스 아날로그를 사용하여 1 차 세포로 작업 할 때 일반적인 상태 인 감소 된 출발 물질로 글루코오스 진입을 정확하게 측정 할 수 있습니다. 변형 된 포도당 분자는 신진 대사 경로를 입력 할 수 없으므로 세포 내에 축적되어 총 세포 방사능을 통한 신뢰할 수있는 정량을 가능하게합니다. 실험 조건은 포도당 수송 억제제 (cytochalasin B)의 사용을 포함하며, 측정은 인슐린 유무에 관계없이 수행됩니다. 이 조합은 인슐린 반응 지수의 배수 변화 계산뿐만 아니라 포도당 활성 진입 속도의 결정을 가능하게합니다. 이 방법은 단일 배양 시간 동안 인슐린 1 회 투여 량으로 제시되지만, 프로토콜은 투여 량 반응 또는 시간 경과 실험을 위해 쉽게 수정할 수 있습니다 12 .
프로토콜
세포 배양 용 배지 및 용액의 제조
- 배양 배지 준비
- 글루타민 (2 MM), 페니실린 / 스트렙토 마이신 (5 μg / ML 최종), 2 % 태아 송아지 혈청 (FCS) 및 2 % 혈청 대체물을 햄의 F - 10 매체를 보충하여 확산 매체 (PM)를 준비합니다.
- 글루타민 (2 MM), 페니실린 / 스트렙토 마이신 (5 μg / ML 최종) 및 2 % FCS와 Dulbecco의 수정 독수리 매체 (DMEM) 보완하여 차별화 매체 (DM)를 준비합니다.
- 포도당 섭취 용액의 제조
주의 : 방사성 물질 취급은 허가 된 요원이 제한되고 통제 된 구역에서만 허용됩니다. 물질 및 폐기물은 적절한 절차, 지침 및 현지 법규에 따라 처리해야합니다.- X-Dulbecco의 인산 완충 식염수 (X-DPBS)를 준비하기 위해 0.2 % (w / v) (최종 농도)의 소 혈청 알부민umin (BSA). 0.2 μm 필터를 통해 용액을 여과하십시오. 4 ° C에서 보관하십시오.
- 차가운 2- 데 옥시 -D- 포도당 (2dG) 용액을 준비하기 위해 2dG 16.4mg을 가하고 증류수 10mL에 용해시켜 10mM 용액을 만든다. 4 ° C에서 보관하십시오.
- 방사성 표지 된 2dG (2dG *) 용액을 얻기 위해 차가운 2dG 600 μL와 X-DPBS 5400 μL에 방사성 표지 된 [ 3 H] 2dG 6 μL를 첨가한다.
참고 : 최종 농도는 1 mM 2dG이고 표지는 1 μCi / mL입니다.- 방사성 표지 된 2dG * 용액의 20 μL 분액 (TC20)을 따로 보관하십시오.
- 배양 혼합물의 준비
- 사이토 카라 신 B 혼합물의 경우, 방사성 표지 된 2dG * 용액 2 mL에 20 mM cytochalasin B 2 μL를 첨가한다.
참고 : cytochalasin B의 원액은 dimethyl sulfoxide (DMSO)에서 10 mg / mL이다. - DMSO 혼합물의 경우 나머지 4 mL의 방사성 동위 원소 표지 된 2dG * 용액에 4 μL의 DMSO를 첨가한다.
- 사이토 카라 신 B 혼합물의 경우, 방사성 표지 된 2dG * 용액 2 mL에 20 mM cytochalasin B 2 μL를 첨가한다.
2. 인간 일차 근육 세포의 배양
- 인간의 근육 인공 위성 세포로 6-well 판의 씨앗 뿌리기
참고 : 냉동 바이알 (250,000 개의 세포 포함)에서 사내 (자세한 내용은 참조 24 참조) 또는 상용 근육 세포를 사용하십시오. 단일 조건에서 포도당 섭취의 측정에 필요한 하나의 6- 웰 플레이트를 얻기 위해 250,000 개의 세포에 대해 다음 절차를 수행합니다.- 급속 냉동 된 물 (37 ° C)에서 사내 24 의 냉동 된 유리 병 또는 인체 근육 인공 위성 세포의 상업적 준비를 신속하게 해동하여 작은 얼음 블록 만 유리 병에 남아있게합니다.
- 예열 된 (37 ° C) PM 10 mL가 들어있는 50 mL 플라스틱 관에 직접 붓습니다.
- 500 XG에서 5 분 동안 원심 분리기와 뜨는을 폐기하십시오.
- 부드럽게 pre-warmed 오후 18 ML (세포 당 42,000 세포를 얻기 위해 세포 펠렛을 resuspend3 mL의 배지). 6-well plate (9.6 cm 2 )의 각 well에 3 mL를 분배한다.
참고 : 플레이트의 6 개의 개별 웰은 수동 수송 억제 (웰 1 및 2), 기초 속도 (웰 3 및 4) 및 인슐린 자극 속도 (웰 5 및 6)에 대한 글루코스 흡수의 이중 측정을 수행하도록 요구된다. 6). 뚜렷한 치료법이 필요한만큼 많은 6- 웰 판을 반복하십시오. - 세포가 90 %의 합류점에 도달 할 때까지 표준 배양 조건 (37 ° C, 5 % CO2)에서 인큐베이션하십시오.
참고 :이 단계는 세포 배치에 따라 48 ~ 72 시간이 소요됩니다. 이 단계에서 매체를 바꾸지 마십시오.
- 근육 세포의 분화
- PM을 제거하고 (48-72 h 후) 예열 된 DM (우물 당 3 mL)로 교체하십시오. 37 ° C, 5 % CO 2 에서 배양하십시오.
참고 : 세포가 정렬되고 다핵 핵이 형성되는 안정된 상태에 도달하기까지 5 일이 걸립니다. 일반적으로 기본myotubes은 1g / L 글루코스 배지에서 배양됩니다. 따라서 배양 중에 포도당이 고갈되지 않도록하려면 플레이트를 3 mL 배지로 채워 충분한 포도당 기질이 항상 세포에 사용 가능한지 확인하십시오. - 2 일마다 DM 배지를 교체하십시오.
참고 :이 시점부터 myotubes는 중요한 변화없이 최대 7 일 동안 안정적이며 포도당 섭취량 측정은 언제든지 수행 할 수 있습니다.
- PM을 제거하고 (48-72 h 후) 예열 된 DM (우물 당 3 mL)로 교체하십시오. 37 ° C, 5 % CO 2 에서 배양하십시오.
- 근육 세포 치료 (선택 사항)
참고 : 일차 근전도는 인슐린 자극 및 포도당 섭취 측정 전에 변형 (약물 검사, 신호 전달 경로의 억제제 / 활성제 등 )을 유도하기 위해 며칠 동안 치료할 수 있습니다. 근육 세포는 인슐린 감수성에 영향을 미칠 수있는 치료에 투여 할 수 있으며, 포도당 섭취량 측정은 이러한 영향을 수치화합니다. 예를 들어, 근육 세포와 포화 지방산 팔미틴산 염 배양은 인슐린 저항성을 촉진하고,nsulin은 포도당 섭취를 자극했다.- 10 % BSA (지방산이없는)와 0.5 mL의 팔미틴산 염 (팔미)이 보충 된 DM 12 mL를 준비하십시오. 10 % BSA (지방산이없는) 만 보충 된 DM 12mL를 준비하십시오.
- 인간의 기본 myotubes와 함께 두 개의 6 잘 접시를 준비하고 섹션 2.1 및 2.2 (차별의 5 일)에 설명 된대로 그들을 문화.
- 5 일에 PBS 2 mL로 각 웰을 씻으십시오. 한 접시에 PALM이 들어있는 DM 2 mL를 넣으십시오. 다른 판에는 DM이 들어있는 BSA 2 mL를 넣으십시오.
- 37 ° C, 5 % CO 2 에서 48 시간 동안 품어 낸다.
3. 인슐린 자극
- 2 ML PBS로 두 번 differentiated 근육 세포를 씻으십시오.
- 조심스럽게 PBS를 제거하고 혈청 고갈에 대한 3 시간 (37 ° C, 5 % CO 2 ) FCS없이 DM 3 ML과 품어.
- 모든 웰의 배지를 FCS없이 DM 3 mL로 교체하십시오. 우물 5와 6에 100 nM 인슐린을 첨가하십시오.
- 인간의 myotubes 문화를 위해 품어1 시간 (37 ℃, 5 % CO2).
4. 포도당 섭취량
- 인슐린 자극 1 시간 후, X-DPBS (세척 당 1 mL)로 두 번 우물을 씻는다.
- cytochalasin B 혼합물 1 mL를 웰 1과 2에 넣고 1 mL의 DMSO 혼합물을 웰 3 - 6에 첨가합니다. 15 분 (37 ° C, 5 % CO 2 ) 동안 항온 처리합니다. 잠복기가 끝나면 즉시 판을 얼음 위에 놓습니다.
5. 세포 용해
- 얼음처럼 차가운 PBS 1 ML로 세포를 두 번 씻으십시오.
- 50 MM NaOH 600 μL로 각 우물에있는 세포를 Lyse. 얼음 위에서 5 분 동안 배양하고 느린 궤도 회전으로 부드럽게 섞는다.
참고 : lysate가 너무 점성이 있다면 1.5 mL NaOH로 희석하십시오. - 피펫을 사용하여 resuspend하고 세포 lysate를 수집합니다.
6. 방사성 표지 포도당의 측정
- 각 세포 용 해물 400 μL를 액체 섬광 계수 약병에 넣으십시오. 네거티브 컨트롤 바이알 400 개 준비50 mM NaOH μL 및 TC20 20 μL를 포함한 양성 대조 바이알 (단계 1.2.3.1에서).
- 각 바이알에 액체 섬광 솔루션 4 ML을 추가합니다. 캡을 닫고 각 약병을 철저히 섞으십시오 (1-2 초).
- 각 바이알을 액체 섬광 계수기에 넣고 제조자의 지시에 따라 방사능을 측정합니다. 10 분 동안 각 신틸레이션 바이알에 대한 분당 카운트 (CPM)를 기록하십시오.
참고 : CPM = "분당 분해"x "계수 효율".
7. 포도당 섭취의 비율
- 남은 lysate (200 μL, 단계 5.2)를 사용하여 단백질 농도를 측정합니다. Bradford 25 또는 이와 동등한 방법을 사용하여 각 세포 용 해물의 단백질 농도를 결정합니다. 각 우물에 대한 총 단백질 양 (mg)을 mg 단위로 계산하십시오.
- TC1 (방사성 표지 2dG * 1 μL 값)을 얻으려면 TC20의 CPM 값을 20으로 나눕니다.
- 각 바이알에 대해 t그는 포도당 섭취의 속도를 다음과 같이 계산합니다 :
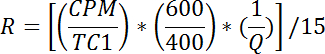
참고 : R은 pmol / mg / min 단위로 측정됩니다. 우물 1 - 2에 대한 R의 평균은 수동 수송 속도, R p를 제공한다 . 우물 3-4에 대한 R의 평균은 기초 총 수송 율 Rbt를 제공한다 . 우물 5-6에 대한 R의 평균은 인슐린이 총 수송 속도를 자극하게 한다 .- 다음과 같이 기초 활성 수송율 (R ba )을 계산하십시오 :
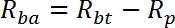
- 다음과 같이 인슐린 자극 활성 수송율 (R ia )을 계산하십시오 :
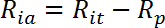
참고 : myotubes와 같은 인슐린 반응 세포에서 포도당 흡수 속도는 일반적으로 R ba , R ia 및 R ia / R ba 와 같은 폴드 인슐린 자극의 세 값으로 표시됩니다.
- 다음과 같이 기초 활성 수송율 (R ba )을 계산하십시오 :
결과
3 일에 myoblast는 합류점에 도달합니다 ( 그림 1A ). 이 단계의 근육 아세포는 전형적으로 단핵 세포이다. 배지를 교환하고 8 일째 분화를 완료 하였다 ( 도 1b ) (프로토콜 섹션 2). 분화 5 일 후, myotubes 정렬 및 일반적으로 polynucleated 있습니다. 글루코오스 섭취량 측정 전에 사람의 주요 근육 세포를 팔미틴테이트 또는 BSA 만 처리 하?...
토론
포도당 섭취는 세포 배양에 대한 활성제 또는 억제제와 포도당 사용에 미치는 영향, 세포가 인슐린에 반응하는 능력을 시험하는 중요한 생물학적 측정입니다. 여기에 설명 된 방법은 빠르고 신뢰할 수있는 것으로 나타 났으며 건강한 대상 및 / 또는 신진 대사에 영향을받은 6 , 7 , 10 , 12 ,
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 재정 지원을 위해 Radiobiology 서비스 (Lyon-Sud 병원) 및 Fond National Suisse (FNS)의 Anne Charrié를 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Human primary muscle cell | In house preparation from human skeletal muscle biopsies | In house preparation from human skeletal muscle biopsies | If not available, use commercial source |
| Human primary muscle cell | Promocell | C-12530 | Should be cultured with associated media C23060 and C23061 |
| 6-well plate | Corning | 356400 | BioCoat Collagen I Multiwell Plates |
| Ham's F10 | Dutscher | L0145-500 | 1 g/L glucose |
| Glutamine | Dutscher | X0551-100 | |
| penicilin/streptomycin 100x | Thermo fisher scientific | 15140122 | |
| Serum substitute UltroserG | Pall France | 15950.017 | serum substitute in text |
| DMEM low glucose | Dutscher | L0064-500 | 1 g/L glucose |
| Fetal Calf Serum | Eurobio | CVFSVF00-01 | |
| Dulbecco's Phosphate-Buffered Saline | Dutscher | L0625-500 | Contains Mg2+ (0.5 mM) and Ca2+ (0.9 mM) |
| Insulin solution human | Sigma-Aldrich | I9278 | |
| 2-deoxy-D-glucose | Sigma-Aldrich | D6134 | |
| Albumin bovine | euromedex | 04-100-812-E | |
| fatty acid-free BSA | Roche | 10,775,835,001 | |
| palmitate | Sigma-Aldrich | P0500 | |
| Deoxy-D-glucose, 2-[1,2-3H (N)] | PerkinElmer | NET328A001MC | Specific Activity: 5 - 10 Ci (185-370GBq)/mmol, 1 mCi (37MBq |
| Cytochalasin B | Sigma-Aldrich | c2743 | |
| PICO PRIAS VIAL 6 mL | PerkinElmer | 6000192 | |
| ultima gold MW CA | PerkinElmer | 6013159 | scintillation liquid |
| bêta counter | PerkinElmer | 2900TR |
참고문헌
- Stump, C. S., Henriksen, E. J., Wei, Y., Sowers, J. R. The metabolic syndrome: role of skeletal muscle metabolism. Ann Med. 38 (6), 389-402 (2006).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Fossum, E., Hoieggen, A., Moan, A., Nordby, G., Kjeldsen, S. E. Insulin sensitivity relates to other cardiovascular risk factors in young men: validation of some modifications of the hyperinsulinaemic, isoglycaemic glucose clamp technique. Blood Press Suppl. 2, 113-119 (1997).
- Heise, T., et al. Euglycaemic glucose clamp: what it can and cannot do, and how to do it. Diabetes Obes Metab. 18 (10), 962-972 (2016).
- Sell, H., Jensen, J., Eckel, J. Measurement of insulin sensitivity in skeletal muscle in vitro. Methods Mol Biol. 933, 255-263 (2012).
- Sarabia, V., Lam, L., Burdett, E., Leiter, L. A., Klip, A. Glucose transport in human skeletal muscle cells in culture. Stimulation by insulin and metformin. J Clin Invest. 90 (4), 1386-1395 (1992).
- Sarabia, V., Ramlal, T., Klip, A. Glucose uptake in human and animal muscle cells in culture. Biochem Cell Biol. 68 (2), 536-542 (1990).
- Richter, E. A., Hargreaves, M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 93 (3), 993-1017 (2013).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. Apmis. 109 (11), 735-744 (2001).
- Bouzakri, K., et al. Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulin receptor substrate-1 in primary culture of skeletal muscle cells from patients with type 2 diabetes. Diabetes. 52 (6), 1319-1325 (2003).
- Scheele, C., et al. Satellite cells derived from obese humans with type 2 diabetes and differentiated into myocytes in vitro exhibit abnormal response to IL-6. PLoS One. 7 (6), e39657 (2012).
- Jackson, S., et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families. Diabetes. 49 (7), 1169-1177 (2000).
- Aas, V., et al. Are cultured human myotubes far from home?. Cell Tissue Res. 354 (3), 671-682 (2013).
- Bakke, S. S., et al. Myotubes from severely obese type 2 diabetic subjects accumulate less lipids and show higher lipolytic rate than myotubes from severely obese non-diabetic subjects. PLoS One. 10 (3), e0119556 (2015).
- Stuart, C. A., et al. Hexose transporter mRNAs for GLUT4, GLUT5, and GLUT12 predominate in human muscle. Am J Physiol Endocrinol Metab. 291 (5), E1067-E1073 (2006).
- Al-Khalili, L., et al. Insulin action in cultured human skeletal muscle cells during differentiation: assessment of cell surface GLUT4 and GLUT1 content. Cell Mol Life Sci. 60 (5), 991-998 (2003).
- Tsuka, S., et al. Promotion of insulin-induced glucose uptake in C2C12 myotubes by osteocalcin. Biochem Biophys Res Commun. 459 (3), 437-442 (2015).
- Gorbunov, E. A., Nicoll, J., Myslivets, A. A., Kachaeva, E. V., Tarasov, S. A. Subetta Enhances Sensitivity of Human Muscle Cells to Insulin. Bull Exp Biol Med. 159 (4), 463-465 (2015).
- Breen, D. M., Sanli, T., Giacca, A., Tsiani, E. Stimulation of muscle cell glucose uptake by resveratrol through sirtuins and AMPK. Biochem Biophys Res Commun. 374 (1), 117-122 (2008).
- Pinnamaneni, S. K., Southgate, R. J., Febbraio, M. A., Watt, M. J. Stearoyl CoA desaturase 1 is elevated in obesity but protects against fatty acid-induced skeletal muscle insulin resistance in vitro. Diabetologia. 49 (12), 3027-3037 (2006).
- Gastebois, C., et al. Transition from physical activity to inactivity increases skeletal muscle miR-148b content and triggers insulin resistance. Physiol Rep. 4 (17), (2016).
- Naimi, M., Tsakiridis, T., Stamatatos, T. C., Alexandropoulos, D. I., Tsiani, E. Increased skeletal muscle glucose uptake by rosemary extract through AMPK activation. Appl Physiol Nutr Metab. 40 (4), 407-413 (2015).
- Feng, Y. Z., et al. PPARdelta activation in human myotubes increases mitochondrial fatty acid oxidative capacity and reduces glucose utilization by a switch in substrate preference. Arch Physiol Biochem. 120 (1), 12-21 (2014).
- Perrin, L., et al. Human skeletal myotubes display a cell-autonomous circadian clock implicated in basal myokine secretion. Mol Metab. 4 (11), 834-845 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Bouzakri, K., et al. Malonyl CoenzymeA decarboxylase regulates lipid and glucose metabolism in human skeletal muscle. Diabetes. 57 (6), 1508-1516 (2008).
- Shemyakin, A., et al. Endothelin-1 reduces glucose uptake in human skeletal muscle in vivo and in vitro. Diabetes. 60 (8), 2061-2067 (2011).
- Alkhateeb, H., Chabowski, A., Glatz, J. F., Luiken, J. F., Bonen, A. Two phases of palmitate-induced insulin resistance in skeletal muscle: impaired GLUT4 translocation is followed by a reduced GLUT4 intrinsic activity. Am J Physiol Endocrinol Metab. 293 (3), E783-E793 (2007).
- Coll, T., et al. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 283 (17), 11107-11116 (2008).
- Gaster, M., Rustan, A. C., Beck-Nielsen, H. Differential utilization of saturated palmitate and unsaturated oleate: evidence from cultured myotubes. Diabetes. 54 (3), 648-656 (2005).
- Hage Hassan, R., et al. Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells. Diabetologia. 55 (1), 204-214 (2012).
- Haghani, K., Pashaei, S., Vakili, S., Taheripak, G., Bakhtiyari, S. TNF-alpha knockdown alleviates palmitate-induced insulin resistance in C2C12 skeletal muscle cells. Biochem Biophys Res Commun. 460 (4), 977-982 (2015).
- Hommelberg, P. P., et al. Palmitate-induced skeletal muscle insulin resistance does not require NF-kappaB activation. Cell Mol Life Sci. 68 (7), 1215-1225 (2011).
- Yang, M., et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes. Lipids Health Dis. 12, 104 (2013).
- Peng, G., et al. Oleate blocks palmitate-induced abnormal lipid distribution, endoplasmic reticulum expansion and stress, and insulin resistance in skeletal muscle. Endocrinology. 152 (6), 2206-2218 (2011).
- Lambernd, S., et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia. 55 (4), 1128-1139 (2012).
- Nikolic, N., et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise. PLoS One. 7 (3), e33203 (2012).
- Hsu, F. L., et al. Antidiabetic effects of pterosin A, a small-molecular-weight natural product, on diabetic mouse models. Diabetes. 62 (2), 628-638 (2013).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Catalano, K. J., et al. Insulin resistance induced by hyperinsulinemia coincides with a persistent alteration at the insulin receptor tyrosine kinase domain. PLoS One. 9 (9), e108693 (2014).
- Liu, H. Y., et al. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM). J Biol Chem. 284 (40), 27090-27100 (2009).
- Renstrom, F., Buren, J., Svensson, M., Eriksson, J. W. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism. 56 (2), 190-198 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유