Method Article
절차 및 자동화 된 모 세관 전기 이동 기반 Immunoassay 방법에 대 한 중요 한 최적화 전략
요약
모 세관 기반 immunoassay 상용 플랫폼을 사용 하 여 총 단백질 준비에서 대상 단백질을 측정 하는 보여 줍니다. 또한, 노출 시간, 단백질 농도, 및 항 체 희석의 분석 결과 매개 변수 셀 문화 모델 시스템 최적화 되어 있다.
초록
모 세관 기반 immunoassays 활용 하는 새로운 기술이 전통적인 immunoassays에 비해 빠르고 더 정량적 단백질 평가 약속. 그러나, 유사한 다른 항 체 기반 단백질 분석 실험, 단백질 농도, 항 체 희석, 노출 시간 등의 모 세관 기반 immunoassay 매개 변수의 최적화는 의미 있고 신뢰할 수 있는 생성에 중요 한 전제 조건 데이터입니다. 측정 신호에 변화는 변화 lysate 농도에 직접 비례 분석 결과의 선형 범위 내에서을 해야 합니다. BEAS-2B, 인간 기관지 상피 세포 라인에 적절 한 lysate 농도, 항 체 희석, 및 노출 시간을 선택 하는 과정은 여기에 설명 했다. 분석 결과 선형성 p53 및 α-tubulin 항 체와 전체 셀 추출 단백질 농도의 범위 표시 됩니다. 긴 노출 시간, 최고 농도에서 볼 신호 소진의 예 고는 α-tubulin 항 체 희석 곡선 채도 보여주는 표시 됩니다. 또한, 실험 결과 예 최적화 된 매개 변수를 사용 하 여 독 소 루비 치료 셀에 대 한 보고 됩니다.
서문
모 세관 전기 이동 immunoassays 크기 또는 충전 분리 시스템을 사용 하 여 세포 lysates의 단백질 발현을 측정 하 고 전통적인 immunoassays 이상의 몇 가지 장점을 제공. 예를 들어 자동화 된 모 세관 기반 프로시저 젤, 전송 장치, 필요 없다 서쪽 오 점에 비해, 그리고 수동 세척. 또한, 필요한 단백질의 절대 금액은 약 10 배, 모 세관 기반 시스템 희귀 세포 유형 또는 제한 된 샘플1,2와 함께 사용 하기 위해 이상적. 결과 자동화 된 시스템을 사용 하 여 3 h 만큼 적게 하 고 이전 보다 양적 하 고 기존의 서양 보다 재현할 수 입증 되었습니다 절차3,,45오 점. 크기 기반 분석에 대 한 프로세스 및 나트륨 라우릴 황산 염 (SDS), dithiothreitol (DTT)를 포함 하는 샘플을 로드 이루어져 붙일 분리 및 매트릭스를 포함 하는 모 세관 컬럼으로 분자량 마커를 표시. 모세 혈관에 적용 하는 전압 크기, 견본에서 단백질 분리 그리고 자외선 움직이게 모 세관 벽에 분리 된 단백질. 모 세관은 다음 특정 대상 1 차 항 체와 양 고추냉이 과산화 효소 (HRP)와 면역 조사-활용 된 이차 항 체. Luminol 그리고 과산화 수소 촉매 충전 결합된 장치 (CCD) 카메라에 의해 측정 하 고 단백질을 quantitate 분석 chemiluminescent 가벼운 발생.
단백질 농도, 항 체 희석, 노출 시간 등 분석 결과 조건의 최적화 상대적 용이성 및 자동화 된 모 세관 기반 전기 이동 immunoassay 플랫폼의 속도도 불구 하 고 정확 하 고 재현성을 얻기 위해 중요 하다 결과입니다. 일반적으로, 이러한 시스템에 대 한 분석 결과 최적화 하기 위해 다음 절차를 수행 합니다.
화면 1)을 평가 하 고 신호 및 특이성 단백질 대상에 대 한 항 체를 선택 수행 되어야 한다. 가능한 경우, 순화 된 단백질 또는 대상 epitope 특이성;을 평가 하기 위해 사용할 수 있습니다. 그러나, 그것은 아직도 모델 시스템에서 공급 하는 총 단백질의 잠재적인 일반적인 신호 들을 평가 하는 것이 중요입니다.
2) 다음, 분석 결과의 동적 범위는 결정 될 필요가 있다. 이상적인 상황에서 신호 배로 (피크 영역을 사용 하 여 측정)는 관찰 샘플 농도 두배로 된다; 그러나, 실제로, 예측 가능한 방식으로 (예를 들어, 선형 적합) 입력 신호에 비례 변화는 단백질 정량화에 대 한 충분 한. 또한,이 최적화는 단백질 농도 높은 신호 하지만 여전히 실험 모델에 대 한 선형 범위 내에서 정의 합니다.
3) 최적화 단계 2에서에서 선택한 고정된 단백질 농도 사용 하 여 최적의 항 체 농도 결정 합니다. 항 체 농도 증가, 신호 채도에서 정점까지 증가 한다. 이 채도 레벨 항 체 농도 단백질 농도의 정확한 측정을 위해 필요 합니다.
단백질 농도, 항 체 희석, 및 자동화 된 모 세관 기반 크기 분석 결과6 에 대 한 노출 시간을 최적화 하는 데 사용 하는 프로세스는 전체 셀 추출 BEAS-2B의 기관지는 SV 40 변형 인간에서 격리를 사용 하 여 보여 줍니다. 상피 세포 라인입니다. 셀 또는 조직 추출에서 단백질 격리 게시 프로토콜7,,89 의 숫자를 사용 하 여 수행할 수 있습니다 그리고 여기 적용 되지 않습니다. 최적화 된 조건을 사용 하 여 시험 실험의 결과 또한 총에 대 한 보고 및 phosphorylated 1.2, 독 소 루비 (일반적인 화학요법 에이전트 유도 세포 apoptosis10)에 노출 하는 문화에서 (15, 20 떠들고 떠들고) p53 1.8, 그리고 2.4 µ g/mL 미디어 수확 전에 h 4에 대 한. P53 피크 넓이에 ɑ-tubulin, 로드 제어로 사용 되는 정규화 됩니다.
프로토콜
참고: 모든 시 약 및 샘플 제조 업체에 따라 준비가 확인 ' s 프로토콜을 아래에 설명 된. 이 절차 동안, 니트 릴 장갑, 랩 코트, 폐쇄 터진 신발, 및 안전 고글 적절 한 개인 보호 장비를 착용 하십시오. 특정 재료, 시 약 및 장비 필요한 테이블은 별도로 제공 됩니다. Bradford 분석 결과 11와 같은 사용 하 고, lysate 버퍼와 호환 되는 설립된 방법론을 사용 하 여 미리 샘플의 총 단백질 농도 결정 한다.
1. 샘플 및 시 약으로 제조 업체에 의해 제공 된 표준 팩에서의 준비
- dithiothreitol (DTT)의 400 m m 작업 솔루션을 준비, 추가 40 µ L 이온된 물 맑은 튜브를 포함 하는 제조업체에서 제공합니다. 솔루션을 소개 하 고 느리고 부드러운 pipetting으로 솔루션을 혼합 하 여 거품을 방지 하는 것이 중요 하다.
- 추가 20 µ L 10 배 샘플 버퍼와 분홍색 튜브 형광 5 X를 포함 하는 준비 된 400 m m DTT 솔루션의 20 µ L 믹스 마스터 (재료의 표 참조).
참고: 마스터 믹스 (MM) 포 일 덮개와 제조 업체에 의해 밀봉 하 고 피 펫 팁으로는 피어 싱 해야 합니다. DTT는 피 펫에 splashing 피하기 위해 느린 pipetting으로 부드럽게 혼합. - 그런 다음 16 µ L 이온된 물 추가, 2 µ L의 샘플 버퍼, 그리고 제조업체에서 제공 하는 백색 biotinylated 사다리 튜브를 준비 400mm DTT 솔루션의 2 µ L X 10 제공. 부드럽게 혼합 하 고 변성 시키기 위한 0.6 mL 튜브로 전송.
- 준비 0.1 샘플 버퍼 제공 된 10 물으로 솔루션 1: 100 배 희석 하 여 x. 모든 샘플을 희석 샘플 버퍼 x 0.1 충분 한 준비.
- 총 단백질의 최종 원하는 농도에 따라 달라 집니다 샘플에 추가 되는 0.1 x 샘플 버퍼의 양을 계산 합니다. 믹스 1 5 부 형광 m M x 4 부분과 원하는 최종 단백질 농도 달성 하기 위해 샘플을 희석.
다음과 같이
- 계산 볼륨: (i) 형광 m M x 볼륨 5 (Desired 최종 단백질 농도) = / 5; (ii) 단백질의 양 = (총 볼륨 필요한 x 원하는 최종 단백질 농도) / 단백질 농도; 주가 (iii) 볼륨 0.1 샘플 버퍼 x 총 볼륨-5 m M 볼륨 x-단백질 재고량 =.
2. 샘플 및 사다리의 변성
- 장소 준비 샘플 및 biotinylated 사다리, 부 화 직후 5 분 소용돌이 튜브 95 ° C 열 블록에 실행 ~ 5 회전 탁상 원심 분리기 및 얼음에 있는 s
참고: 일부 단백질 단백질 집단을 방지 하 고 모 세관 매트릭스에서 마이그레이션 향상을 gentler 변성 조건 (예를 들어, 70 o C 10 분)를 요구할 수 있습니다. 경우 높은 분자 무게 무거운 번짐 (예를 들어 비디오 참조)이이 옵션을 고려 하십시오.
3. 항 체의 준비
- 최적화 정한 (대표 결과 비디오 참조), 제공된 항 체에서 1 차적인 항 체 (예, 1:50, 1: 100)의 원하는 dilution(s)을 준비 희석제 2.
참고: 항 체는 일반적으로 사용 높은 농도에서 모 세관 기반 immunoassay 보다 전통적인 서 부 럽 대. 제공 된 이차 항 체는 희석 하지 않고 사용 가능.
4. Luminol S 및 과산화 수소 준비
- luminol S와 과산화 수소의 1:1 혼합물 준비.
- 혼합 하 고 얼음에 저장 소용돌이
참고:이 혼합물 각 실험 분석 결과 대 한 신선한 준비는 중요 하다.입니다. 250ul 총 믹스 전체 접시를 실행 하는 데 필요한.
5. 분석 결과 접시의 준비
- 그림 1에서 같이 로드 샘플 및 시험 접시에 위의 준비 시 약. 각 행에 대 한 자세한 내용은 아래를 참조 하십시오. 우물에서 증발을 최소화 하기 위해 접시 뚜껑 시 추가 사이 대체 됩니다 확인 하십시오.
- 행 A, Biotinylated 사다리의 피펫으로 5 µ L 잘 a 1에. 나머지 행에 대해 피펫으로 우물 A2-A25에 샘플 (5 µ L 각)을 준비.
참고: 그것은 필수적입니다는 A1 잘 항상 사다리, 포함 카트리지에서 첫 번째 모 세관이이 표준 실행을 위한 최적화 된. - 행 B, 각 잘 (B1-B25)에 항 체 희석제 2 피펫으로 10 µ L.
- 행 C, 항 체 희석제 2 피펫으로 10 µ L 잘 c 1에에. 나머지 행에 C 우물, 1 차적인 항 체 (C2-C25 우물)의 피펫으로 10 µ L.
- 잘 d 1에 D, 피펫으로 10 µ L Streptavidin HRP의 행에서. 나머지 행에 D 우물, 이차 항 체 (웰 스 D2-D25)의 피펫으로 10 µ L.
- 행 E, 각 잘 (E1-E25)에 갓된 luminol 과산화 수소 혼합의 피펫으로 10 µ L.
- 마지막으로 추가 구획 당 500 µ L 워시 버퍼 버퍼 우물의 상위 3 행의 각.
참고: 그것은 부드럽게 pipetting 고 거품 로드 모 세관을 방해할 수 있습니다로 실행 하지 팁에서 최종 볼륨을 추방 하 여 거품 형성을 최소화 하는 것이 중요. - 모든 웰 스는 로드 되 면, 거품을 제거 하 고 우물의 바닥에 액체가 하 실 온에서 5 분 ~ 1000 x g에서 격판덮개 원심. 작은 피 펫 팁 또는 깨끗 한 바늘 표시 모든 거품을 팝업 (예를 들어, 25 게이지 무 균 " 담당자 상단 " 바늘).

그림 1 . 분석 결과 접시 pipetting 서식 파일. 컬러 코딩 적절 한 시 약 및 샘플 (최대 24 총) 분석 결과 판에 추가 된 나타냅니다. A25까지 A2 우물에서 샘플 준비 잘 A1 (오렌지)에 biotinylated 사다리를 추가 (라이트 블루), 항 체 희석제 2 웰 스 B25 B1 및 C1 (밝은 녹색), 웰 스 C2 (blue) C25, streptavidin HRP 잘 D1 최대에 1 차적인 항 체 (다크 핑크), 이차 항 체에 D25까지 D2 우물 (짙은 녹색), 그리고 웰 스 E1 E25 (보라색)까지 luminol 과산화 수소 혼합. 워시 버퍼 큰 중간 접시의 처음 세 행에 추가 우물 (진한 파란색). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
6. 모 세관 immunoassay 악기를 시작
- 악기와 함께 컴퓨터에 설정 되어 있는지 확인. 아무 워밍업 시간이 필요 하다.
- 는 컴퓨터에 계측 소프트웨어를 엽니다. 먼저, 선택은 " 분석 결과 " 윈도우의 오른쪽에 탭 및 " 새로운 분석 결과 " 아래는 " 파일 메뉴 " 왼쪽에. 크기, 크기 범위 (예를 들어, 12-230 kDa), 및 카트리지 선택 특정 분석 결과에 사용 된 형식 (예를 들어, 25 모 세관).
참고: 한 5 월도 입력 분석 결과 매개 변수를 원하는 경우 단백질 농도, 항 체 종류와 희석를 포함 하 여, 하지만 이러한 분석 결과 시작할 필요가 없습니다. - 오렌지 패널 위에 버튼을 누르면 악기에 문을 열고.
- 신중 하 게 포장에서 모 세관 카트리지를 제거합니다. 유리 모 세관을 건드리지 않고, 카트리지 홀더에 카트리지를 놓습니다. 카트리지 좌석 실내 빛 파랑 오렌지에서 변화를 관찰 하 여 확인 합니다.
- 벤치에 단단히 접시를 보유 하 고 신중 하 게는 플레이트의 하단 부분에서 증발 인감을 벗기다. sm으로 이러한 분리 매트릭스 우물에서 모든 거품을 팝업모든 피펫으로 팁 또는 깨끗 한 바늘 (예를 들어, 25 게이지 무 균 " 담당자 상단 " 바늘).
- 분석 결과 접시 접시 홀더, 완전히 장착 보장에 놓고 악기 문 닫습니다.
- 클릭 합니다 " 시작 " 소프트웨어에 단추.
참고: 없음 시작 단추가 나타나면, 악기와 연결이 손실 되었습니다. 왼쪽된 상단 메뉴에서 도구를 선택한 다음 연결. 악기의 시리얼 번호로; 팝업 표시 이 선택한 다음 연결을 클릭 합니다. 시작 단추를 이제 나타납니다. - 실행 완료 되 면 삭제 접시. 카트리지를 제거 하 고 폐기, 팝업 거품을 사용 되었을 수 있는 모든 바늘 함께 sharps 용기에 배치. 악기를 정기적으로 사용 하는 경우 연결 문제를 방지 하려면에 힘을 두고 (예를 들어, 적어도 매주).
7. 분석 실험
- 분석 하기 전에 다음과 같은 품질 검사를 수행 하는 것을 확인.
- 선택 하 여 확인 형광 표준
- 는 " 표시 표준 " 아이콘. 기준에서 올바르게 식별 된 체크는 " 그래프 보기 " 탭. 그들은 올바르지 않은 경우에 서는 " 단일 보기 " 아이콘을 정확한 피크를 마우스 오른쪽 단추로 클릭 하 고 선택 " 힘 표준 ", 또는 잘못 된 피크를 마우스 오른쪽 단추로 클릭 하 고 선택 " 하지 표준 ". 각 새로운 모 세관이이 검사 수행.
- 확인 클릭 하 여 biotinylated 사다리는 " 샘플 " 및 " 단일 보기 " 아이콘. 실험 탭에서 사다리를 선택 합니다. 피크는 잘못 식별 된 경우에 그것에 오른쪽 클릭 " 그래프 보기 " 선택 " 제거 피크 ".
참고: 예를 들어 biotinylated 사다리 12-230 kDa 키트 사용 한다 표시 12, 40, 66, 116, 180, 및 230 kDa 크기 봉우리. 이 단계는 수행 하지 경우 샘플 봉우리의 크기 조정 것입니다 제대로 계산 하지, 가짜 결과 생산. - 보기 샘플 봉우리를 분석. 실험적인 계산에 필요에 따라 분자량, 피크 면적, 피크 높이 및 신호 잡음 (S/N)를 포함 하 여 봉우리 테이블에서 데이터를 파생.
- 확인 클릭 하 여 biotinylated 사다리는 " 샘플 " 및 " 단일 보기 " 아이콘. 실험 탭에서 사다리를 선택 합니다. 피크는 잘못 식별 된 경우에 그것에 오른쪽 클릭 " 그래프 보기 " 선택 " 제거 피크 ".
결과
노출 시간 - 결정 신호 났
신호 났을 때 luminol 및 과산화 기판 너무 빨리 소진 되 면 발생할 수 있습니다. 이 다른 화학 노출 시간에 데이터를 검토 하 여 확인할 수 있습니다. 분석 소프트웨어에서 "편집-> 분석-> 이미지"로 이동 합니다. 노출 범위는 5에서 480 s. 그래서 각 노출에서 데이터 있어야 비슷한 신호/시간 계수는 electropherogram에 y 축 신호/시간, 보고 합니다. 이 계수 감소 순차적으로 더 이상 노출 경우에 luminol 고갈 된다 p53 할-1 항 체 (그림 2)에서 볼 수 있듯이. 기판 고갈 때문이 분석 결과 여겨질 수 있다 5-30의 노출에만 0.2 µ µ g/L 농도까지 측정. 따라서,이 예에서 15 s p53에 대 한 최적의 데이터 분석 노출 시간을 결정 했다.
Lysate 적정 - 선형 동적 범위를 결정
최대 영역에 의해 측정 된 신호에 변화는 샘플에서 단백질의 양을 변화에 비례 각 분석 결과의 선형 동적 범위 내 측정 촬영는 중요 하다. 15 s의 최적의 노출 시간을 사용 하 여 이전 섹션에서 분석 결과 선형성 농도 (그림 3)의 15 범위 보다 큰 이상의 p53 및 ɑ tubulin 설명 된다. 우리의 경험에서는, R2 값 > 적합 선형 회귀의 0.9 간주 됩니다 알려진 (해당 되는 경우 분석 결과 절대 양적 측정) 또는 샘플의 순화 된 단백질의 희석 범위에 대 한 허용 알 수 없는 대상 단백질의 lysate (경우 분석 결과 상대 정량 측정이 이다).
항 체 희석의 최적화
포화 농도에서 항 체를 사용 하 여 사용 하면 측정 신호 변경만 단백질에 변화 예정 이다. 데모, 두 BEAS 2B 셀 라인 (0.2 µ g / µ L 총 단백질 분석 결과에 로드)를 추출 하는 전체 셀 직렬 희석된 ɑ tubulin 항 체 농도가 1:25-1:800 (그림 4)까지 조사 했다. Chemiluminescent 신호 (여기, 피크 영역으로 측정 되는) 항 체 희석에 대 한 표시 했다. 채도 1시 50분 가까이 관찰 되었다 희석 곡선에서 눈에 띄는 고원을 시작 하는 위치.
실험적인 예 심-독 소 루비 치료 BEAS 2B 셀에
최적화 된 분석 결과 조건을 사용 하 여, BEAS 2B 세포 배양 독 소 루비의 3 개의 다른 농도와 대우 되었다 (1.2, 1.8, 2.4 µ g/mL) 4 h (그림 5, 표 1). 활성화 포스트 번역 상 수정 p53의 세포 주기 검거, 노화, 및 apoptosis12를 포함 하 여 여러 가지 세포 응답 중재. 특히, 떠들고 15의 인 산화는 독 소 루비 치료13후 apoptosis 결과 p53의 transcriptional 활성화에 기인 했다. 이 데모에서는 ɑ tubulin 정규화 피크 영역 컨트롤의 겹으로 제공 됩니다. 흥미롭게도, 3.5 떠들고에서 p53 인 산화 4-fold 증가 15 2-fold 떠들고 20에 phosphorylated p53의 수준 증가 독 소 루비에 4 h 노출 후 관찰 되었다. 이러한 결과 p53;의 활성화를 나타냅니다. 그러나, 아무 복용량 응답 선택 농도 대 한 볼 수 있다 (반대로, 가장 낮은 복용량 테스트 elicited 가장 높은 응답). 총 p53이 모델 시스템에서 명확한 치료 응답을 설명 하지 않았다. 우리는 이전 BEAS 2B 셀 아연 처리14비슷한 조건에서 총 p53의 증가 수준의 부재에서 p53 인 산화의 활성화를 관찰.

그림 2 . 검출 신호 소진 노출 이미지 비교. 레인 플레이 쇼 1: 500 희석에서 p53 할-1 항 체와 조사 BEAS 2B lysates의 단백질 농도 감소. 화학 신호 계수, 피크 높이 악기 소프트웨어에서으로 보고 겹쳐 있다. 피크 높이 달리 비주얼 밴드 농도 자동으로 생성 하 고 밴드와는 다른 하나의 패널에서 하지 비교의 원조 악기에 의해 조정. 신호와 사라질 시작 (분할 피크) 기판 소모를 나타내는 두 개의 긴 노출에 노출 시간이 증가할수록 감소 화학 신호에 note. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 . 레인 플레이 보여주는 lysate 적정. 차선을 보여주는 lysate 적정 플레이 BEAS-2B 1: 500 p53 할-1 또는 1시 50분 ɑ-tubulin와 조사 때 lysate의 (A) . 피크 면적 값과는 달리 비주얼 밴드 농도 자동으로 생성 하 고 밴드와는 다른 하나의 패널에서 하지 비교의 원조 악기에 의해 조정. 선형 회귀 분석 (B)는 분석 실험은 각각 0.20 µ g / µ L를 0.025 0.40 µ g / µ L, R2 의 값 0.999 및 0.985, 0.01에서 테스트 하는 전체 범위 선형 확인 합니다. 선형 범위 가운데 총 단백질 농도 (예를 들어, α-tubulin 위한 µ 0.2 µ g/L)에서 잠재적인 대상 단백질 변이 수용 하기 위해 선정 됐다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 . 두 개의 별도 BEAS 2B 단백질 lysates 기준선 정규화 없이 대 한 α-tubulin 항 체 희석 곡선. 명확한 depar선형성에서 진짜 야 1:50 (0.02)에서 본 희석, 채도 나타내는. 1시 50분 그러므로이 항 체에 대 한 최적의 희석으로 선택 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
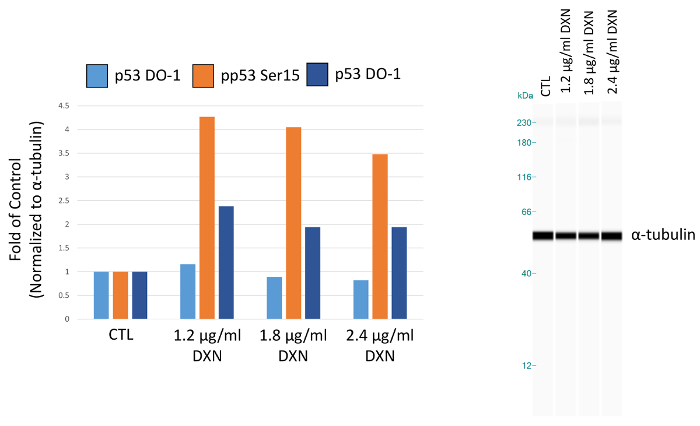
그림 5. 총에 떠들고 4 h 독 소 루비 (DXN) 치료의 효과 phosphorylated BEAS 2B 세포의 p53 단백질 표정. 피크 넓이 α-tubulin 정규화 되며 제어 (CTL)의 겹으로 꾸몄다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
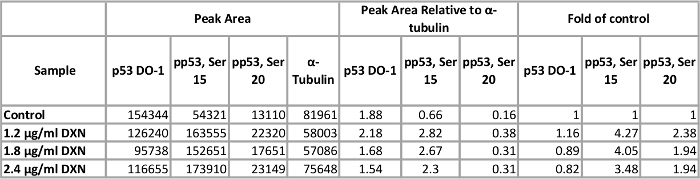
표 1입니다. 총에 떠들고 4 h 독 소 루비 (DXN) 치료의 효과 phosphorylated BEAS 2B 세포의 p53 단백질 표정. 이 테이블의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
수십 년 동안, 계속 있다 모 세관 전기 이동 기반 immunoassay 방법의 개발에 지속적인된 관심 비용 때문에 낮은 샘플 및 시 약, 감소 처리 전통적인 방법에 비해 시간과 높은 호환성 절차4,15를 자동화 합니다. 모 세관 전기 이동, electrokinetic, 폴리머 체질, 및 (각각 다른 속성에 의해 단백질 분리, 전자 방법 등을 활용 하는 단백질의 분리에 대 한 서로 다른 프로토콜의 수가 있다 정전기, 파티션 평형, 체질 분리 행렬 및 pH의 속성)16. 여기, 우리는 체질 분리, 자동화 된 폴리머를 사용 하 여 항 체 (또는 immunoassay) 모 세관 전기 이동 법 방법 및 상업적으로 채택된3설명 합니다. 이 시스템의 장점은 사용 및 운영, 표준화 및 상용 시 약 및 시 약 및 샘플 서쪽 오 점, 같은 전통적인 단백질 분석 실험에 비해 덜 요구 하는 안정적이 고 민감한 측정의 용이성을 포함 효소 연결 된 immunoassay 그리고 다른3,,45형식. 그러나 그것은 지적 하고있다이 기술 이전 평가에서 평가 될 수 있다 단백질의 크기 범위는 사용 가능한 분리 매트릭스4, 최근 제품 440 kDa17 2에서 측정 범위 확대에 의해 제한 되어 . 또한, 일부 lysate 버퍼 분석 결과18과 호환 되도록 알려져 있다, 따라서 실험 시 약 사용의 선택을 고려해 야 합니다 미리.
상업적으로 사용할 수 있는 구성 요소와 자동화 된 절차의 주요 장점은 표준화 된 방법 및 시 약을 통해 결과의 일관성입니다. 이 프로시저 내에서 중요 한 단계를 자동화 하 여 시험 실패의 가능성을 최소화 합니다. 그러나, 그것은 모 세관 전기 이동 기반 immunoassay 문제를 최소화 하기 위해 프로토콜 중 특정 관행을 준수 해야 합니다는 것을 주의 하는 것이 중요. 첫째, 그것은 중요 하 luminol-S/과산화 수소 혼합물 준비 신선 하 고 즉시 플레이트 로드 하기 전에입니다. 산화 제 추가 분석 결과 후 특정 항 체 분석 결과 대 한 일관 된 측정 결과 일관 된 타이밍 일관 된 발광 높아집니다. 또한,는 주로 산화 에이전트의 힘에 영향을 미치는 만료 되지 않은 시 약 사용 되는 중요 하다. 또한, 그 샘플, 항 체, 및 다른 시 약의 로드 순서 엄격 하 게 따라 ( 그림 1참조) 중요 하다. 모든 시 약 장소 pipetted 분석 결과 실패와 낭비 실행 발생 합니다.
이러한 중요 한 단계 외 기법으로 기본 문제 일반적으로 최적화를 통해 극복할 수 있습니다. 사실, 이러한 조건을 각 모델 시스템/항 체 결합 하 고 그러므로 각 새로운 분석 결과 대 한 경험적으로 결정 한다. 이 문서에서는, 우리는 세 가지 일반적인 최적화 절차에 초점: 노출 시간, lysate 적정 및 1 차적인 항 체 희석. 측정 결과 생성 하는 기능 때 luminol 기질 하지 되 고 급속 하 게 고갈, 신호 손실에 기판 고갈 결과 노출 시간 분석에 따라 달라 집니다. Lysate 적정도 동일한 단백질 대상에 대 한 다른 항 체로 서 다른 모델 시스템, 다 수 각 분석 결과의 선형 동적 범위를 결정 합니다. 항 체 희석 또는 포화 농도 근처 선택 신호에 변화 것입니다 영향을 받지 않을 무료 항 체의 부족 하지만 서로 다른 양의 사용 가능한 단백질 대상 epitope에 의해서만 확인 합니다. 항 체 외피 시간과 스태킹/샘플 로딩 시간 최적화 과정에서 다른 고려 사항이 포함할 수 있습니다. 대부분의 경우 악기에 대 한 기본 설정에서에서 해상도 감도의 좋은 균형을 제공 합니다. 그러나, 경우에 따라 가난한 해상도나 감도 개선할 수 있습니다 이러한 매개 변수를 조정 하 여.
모 세관 전기 이동 기반 immunoassay 메서드는 빠르고, 효율적, 재현할 수 단백질 측정을 제공합니다. 이러한 방법을 연구 및 개발에서 주로 이용 되었습니다, 이러한 기술의 일관성 규제 및 임상 응용 프로그램에 잠재적인 유틸리티가 있다. 예를 들어 질병의 진행과 환경 유독 또는 환자 취약 부분 모집단의 식별 액세스할 수 행렬, 혈액, 소변, 타 액 등에서 측정 단백질 바이오 마커 기반 될 수 있습니다. 시 약 및 작업 비용 드롭 샘플 및 평가 동시에 증가 될 수 있는 대상의 수, 우리가 가능성이 이러한 종류의 응용 프로그램에 사용 되는 모 세관 전기 이동 기반 immunoassay 방법 볼 것 이다.
공개
저자 들은 아무 경쟁 금융 관심사 선언 합니다. 이 원고는 국민 건강 및 환경 효과 연구 실험실에 의해 검토 하 고 게시에 대 한 승인. 콘텐츠는 반드시 미국 EPA의 의견을 반영 하지 않는 않습니다 상표명 또는 상용 제품의 언급 구성 승인 또는 사용을 위해 추천.
감사의 말
저자는 키스 Tarpley는 미국 EPA 사무실의 개발을 위한 연구와 개발-연구 삼각형 공원 (RTP 오드) 그래픽 및 미디어 팀의 녹화, 그리고 교육용 비디오의 편집을 감사 하 고 싶습니다. 우리는 또한 우리의 데이터. 의 최적화에 관한 유용한 대화에 대 한 ProteinSimple에서 데보라 Pritchett를 감사 하 고 싶습니다. JM Guynn 했다 오크 리 지 연구소 과학 및 미국 환경 보호국에서 교육 연구/참여 프로그램에 지원 됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Wes instrument | ProteinSimple (Santa Clara, CA) | 004-600 | |
| P53 DO-1 primary antibody | Santa Cruz Biotechnology, Inc. | sc-126 | |
| phosphorylated p53 (ser 15) primary antibody | Cell Signaling Technology | 9286 | |
| phosphorylated p53 (ser 20) primary antibody | Cell Signaling Technology | 9287 | |
| alpha-tubulin primary antibody | Cell Signaling Technology | 3873 | used as a loading control |
| Compass Software | ProteinSimple (Santa Clara, CA) | provided with the Wes | |
| 12-230 kDa Master kit | ProteinSimple (Santa Clara, CA) | PS MK02 (since replaced by a new kit #) | |
| www.proteinsimple.com/consumables_sw_wes.html | INCLUDES PART NO: Wash Buffer (60 mL) 042-202 10X Sample Buffer (440 μL) 042-195 Pre-Filled Microplates (8) PS-PP01 Capillary Cartridges (8) PS-CC01 Antibody Diluent II (20 mL) 042-203 Luminol-S (1.5 mL) 042-233 Peroxide (1.5 mL) 042-234 Streptavidin-HRP (132 μL) 042-414 Standard Pack (8): Biotinylated ladder, fluorescent 5X master mix, DTT, and empty 0.6 mL tube PS-ST01 Anti-Rabbit Secondary Antibody 042-206 or Anti-Mouse Secondary Antibody 042-205 | ||
| Name | Company | Catalog Number | Comments |
| Cell culture, treatment, and harvest (using vendor recommended protocols; protocols not included in manuscript) | |||
| BEAS-2B cells | American Type Culture Collection (ATCC, Manassas, VA) | CRL-9609 | |
| keratinocyte growth medium, KGM Gold | Lonza Ltd (Basel, Switzerland) | 192152 | for cell culture |
| keratinocyte basal medium, KBM Gold | Lonza Ltd (Basel, Switzerland) | 192151 | serum free medium for chemical dosing |
| doxorubicin | Sigma-Aldrich (St. Louis, MO) | D1515 | |
| Coomassie Blue Bradford Assays | ThermoFisher Scientific (Waltham, MA) | 23200 | for protein quantification |
| Nuclear Extract kit | Active Motif (Carlsbad, CA) | D1515 | used to prepare whole cell lysates |
| INCLUDES: | |||
| Lysis Buffer AM1 | |||
| 1M dithiothreitol (DTT) | |||
| Protease Inhibitor Cocktail | |||
| 10X PBS | |||
| Phosphatase Inhibitors |
참고문헌
- Bradley, H. L., Sabnis, H., Pritchett, D., Bunting, K. D. . Hematopoietic stem cell protocols. 1185, (2014).
- Guo, L., Eldridge, S., Furniss, M., Mussio, J., Davis, M. Use of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes (hiPSC-CMs) to Monitor Compound Effects on Cardiac Myocyte Signaling Pathways. Curr Protoc Chem Biol. 7 (3), 141-185 (2015).
- Chen, J. Q., et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system. Anal Biochem. 442 (1), 97-103 (2013).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. J Transl Med. 13, 182 (2015).
- Liu, S., et al. The Application of a Novel Nanovolume Capillary Electrophoresis- Based Protein Analysis System in Personalized & Translational Medicine Research. J Bioanal Biomed. S3 (004), (2013).
- ProteinSimple Western. . Size Assay Development Guide, Revision 1. , (2014).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. J Vis Exp. (93), (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Silva, J. M., McMahon, M. The fastest Western in town: a contemporary twist on the classic Western blot analysis. J Vis Exp. (84), e51149 (2014).
- Thorn, C. F., et al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics. 21 (7), 440-446 (2011).
- Ernst, O., Zor, T. Linearization of the bradford protein assay. J Vis Exp. (38), (2010).
- Taira, N., Yoshida, K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets. Histol Histopathol. 27 (4), 437-443 (2012).
- Thompson, T., et al. Phosphorylation of p53 on key serines is dispensable for transcriptional activation and apoptosis. J Biol Chem. 279 (51), 53015-53022 (2004).
- Currier, J. M., Cheng, W. Y., Menendez, D., Conolly, R., Chorley, B. N. Developing a Gene Biomarker at the Tipping Point of Adaptive and Adverse Responses in Human Bronchial Epithelial Cells. PLoS One. 11 (5), e0155875 (2016).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Shintani, H. . Handbook of Capillary Electrophoresis Applications. , (1997).
- . Wes reagents and consumables :: ProteinSimple Available from: https://www.proteinsimple.com/consumables_sw_wes.html (2017)
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유