Method Article
샘플을 측정 하는 측정 가능한 잔여 질환과 급성 골수성 백혈병에 Leukemic 줄기 세포에 대 한 프로세스 골 포괄적인 프로토콜
* 이 저자들은 동등하게 기여했습니다
요약
또는 측정 최소 잔여 질병 (MRD)의 위험 평가 정제 하 고 급성 골수성 백혈병 (AML)에서 재발 예측에 대 한 중요 한 예 후 바이오 마커 이다. 이러한 포괄적인 지침과 일관 되 고 정확한 식별 및 MRD의 검출을 위한 모범 사례 권장 사항을 효과적인 AML 치료 결정에 도움이 수 있습니다.
초록
환자는 완전 한 죄 사 함 (CR) 달성 여부를 확인 하기 위해 활용 하는 형태 론 적 검사와 급성 골수성 백혈병 (AML)에 응답 기준을 다시 설정 하 고, 최근 되었습니다 수 있습니다. 약 한 CR 성인 환자의 절반 골에 있는 잔여 AML 셀의 파생물 인 12 개월 이내 재발 됩니다. 남아 있는 백혈병 세포, 또는 측정 최소 잔여 질병 (MRD)로 알려진이 정량이이 relapses의 예측에 대 한 강력한 바이오 마커를 될 수 있습니다. 또한, 여러 연구의 회 고 분석 AML 환자의 골 수에서 MRD의 존재와 가난한 생존 상관을 보이고 있다. 뿐만 아니라 총 leukemic 인구, 반영 세포 면역-표현 형 (LAIP), 임상 결과와 관련 된 관련 된는 백혈병을 품고 있지만 그래서 백혈병 줄기 세포 (LSC), 둘 다 수의 미 숙 저주파 부분 모집단 cytometry MRD 또는 MRD와 같은 접근 방식을 통해 모니터링. 질병 또는 질병 관련 기능 (비정상적인 분자 마커 또는 탈 선 immunophenotypes) 기준으로 잔여 백혈병 (stem) 세포의 탐지를 가능 하 게 하는 중요 한 분석의 여부는 대폭 향상 된 MRD 평가 급성 골수성 백혈병. 그러나, 고유의 고 질병으로 AML의 복잡성을 감안할 때, 골 수를 샘플링 및 MRD 및 LSC 분석 방법 해야 될 조화를 이루고 가능 하면. 이 원고는 적절 한 골 수 aspirate 샘플링에 대 한 상세한 방법론 설명, 수송, 최적의 멀티 컬러 흐름 cytometry 평가 대 한 처리 및 게이팅 MRD LSC 치료 결정에 도움이 평가 전략 대 한 AML 환자.
서문
급성 골수성 백혈병 (AML)은 골 수의 악성 특징 결함 비정상적인 증식 및 골수성 조상 세포의 축적으로 성숙 프로그램에 의해 정상 조, 그리고 궁극적으로 골 수 실패의 저해 . 질병은 매우 이질적인 형태, immunophenotype, 세포 유전학, 분자 착오 및 유전자 식 서명, 뿐만 아니라 치료 반응과 치료 결과1,2. 완전 한 죄 사 함 (CR), 분자, cytogenetic의 결과 의해 크게 유도 후 죄 사 함 치료 뒤 달성을 목표로 유도 화학요법을 포함 하는 현재 관리 및 immunophenotypic 연구의 구성 추가적인 화학요법 또는 헌 (수용자) 줄기 세포 이식3의 여러 코스. 높은 면제 율에도 불구 하 고 후 최대 90%, 성인 5 년 생존의 집중적인 화학요법만 약 30%-40%, 주로의 개발 때문입니다 일반적으로 화학 요법에 저항 하 고 그로 인하여 매우 취급 하기 어려운 relapses. 아이 들에 있는 결과가 낫다, 약 1/3도 재발 하는 비록. 따라서, 절박 한 재발의 조기 발견 unmet 의학 필요를 채울 것입니다 고 후 사 함 치료4가이드 수 있습니다.
잔여 질병 치료의 모든 진단 및 사후 진단 저항 메커니즘/요인; 합계를 반영 수 있습니다 후 따라서 측정 예 후 및 치료 지침에 대 한 수단이 있을 수 있습니다. Defining 잔여 질병 (최소 잔여 질병 및 지금 추천된으로 측정을 잔여 질병 또는 MRD 이전의 함) 5% 폭발 세포의 형태학 기준 보다 훨씬 가능성 위험 classification의 풍경이 변하고 있다. 현재 주로 MRD를 감지 하는 데 사용 하는 두 가지 방법 교류 cytometry-및 분자 기반, 후자는 역전사 PCR (RT-정량)5 에 의해 평가 되 고 또는, 다음 세대에 의해 조기 단계에 있지만 (NGS)를 시퀀싱. 성인 뿐만 아니라 아이 들에서 많은 연구는 이미 다양 한 MRD 접근 AML 모두 후 유도 및 통합 치료6,7, 그리고 질병 부담 (새로운 정의에 강한 전조 정보 제공 증명 우수한 형태 CR) 지금 나오고 있다8. MRD 흐름에 의해 평가 및 분자 기술 되어야, 그리고 사실 이미 되고있다, AML에 모든 임상 시험에서 표준 제안 합니다.
이 원고에서는 골 수 샘플, 골 샘플링을 포함 하 여 및 처리 절차 cytometry 앞에 MRD의 정확 하 고 재현 immunophenotypic 특성을 얻기 위해 상세한 흐름 cytometry 절차를 설명 합니다. 진단 및 속 행에서 좋은 품질의 골 샘플의 가용성은 임상 사이트 및 임상 시험이이 측정의 성공에 결정적 이다. 사실, 이러한 사전 분석 고려 사항은 중요 한 분자 (PCR 및 NGS) MRD 접근의 있습니다. MRD의 immunophenotypic 특성, aberrantly 표현된 마커 보통 골수성 및 조상 마커, 백혈병 관련 된 immunophenotype (LAIP)9를 식별 하기 위해 결합 됩니다. MRD는 치료, 내장 또는 취득 백혈병 약물 저항, pharmacodynamics 등 치료, 면역 감시 및 규정 준수의 활동에 대 한 응답에 영향을 미치는 많은 요인의 결과 측정 합니다. 따라서, MRD는 매우 강한 후 진단 전조 매개 변수 수신기 작동 특성 (ROC) 분석에 의해 결정 된 커트 오프 수준에 dichotomized 때 임상 결과와 관련 된입니다. HOVON 42a의 우리의 성인 AML 일대에 대 한 연구, 인하 수준 LAIP 긍정적인 세포/총 백혈구의 0.1%에서 설정 됩니다. 부정적인 대 긍정적인 MRD 상태를 결정 하기 위한이 기준을 사용 하 여, 환자의 그룹 식별할 수 있습니다 크게 악화 재발 발생률, 재발 및 전반적인 생존6을. 또한, 우리는 환자 결과10의 강력한 예측을 제공 하는 줄기 세포와 같은 기능 (CD34 + CD38-백혈병 줄기 세포, 또는 LSC), 미 숙, 약물 내성 백혈병 세포의 측정을 설명 합니다. 함께 LAIP 및 LSC 양식 흐름 cytometric MRD 접근 접근 한다. LAIP 접근 LSC 접근 약 80%의 환자에 적용할 수 있는 하는 동안, 환자의 약 90% 위해 적당 하다. 매개 변수 하나 또는 둘 다 함께 이상 환자의 95%를 평가할 수 있다.
마지막으로,이 게시 cytometry MRD 평가를 상세한 작업 설명이 제공 됩니다. 이것은 포함 한다: 1) 조화 및 골 샘플링 절차의 표준화, 샘플 2) 교통 지도 3) 상세한 설명 leukemic 세포 검출의 FACS 단일 셀 튜브 접근을 포함 한 여러 가지 항 체 패널을 사용 하 여 함께 LSC, 4 하)는 FACS의 표준화 된 측정, 5 기계) MRD 측정 및 6에 대 한 분석 프로그램) LSC 탐지에 대 한 분석 프로그램.
우리는 거의 그것은 최종 결과의 품질에 대 한 중요 한 문제 논의 이후 샘플 준비를 포함 하 여 프로시저의 모든 측면을 표시 하고자 합니다. 골 수 포부와 생 검 임상 절차 골 수 내 조 혈 모 세포를 평가 하는 데 사용 되는. 이러한 완전 한 혈액 검사 (CBC) 및 혈액 얼룩 수행 됩니다. 골 수 포부에 대 한 최적의 방법 정확한 진단과 후속 MRD 측정에 대 한 결정적 이다. 또한, 성공적인 골 수 aspirate LAIP 및 LSC 흐름 분석 (10 백만 이상 실행 가능한 세포)을 수행할 충분 한 세포를 포함 해야 합니다. 여기, 우리 골 수 포부를 수행 하기 위한 방법을 설명 해야 적절 한 셀 샘플링 (및 결과 제한 hemodilution에 대 한 잠재력) 필요한 정확한 진단 및 추가 연구에 대 한 지침을 제공 하 고. 이러한 사전 분석 고려 사항은 중요 한 분자 (PCR 및 NGS) MRD 접근의 있습니다. 모든 표본 immunophenotyping에 대 한 컬렉션의 24 시간 이내에 우선적으로 처리 한다. 비록 하지 추천, 골 수 및 말 초 혈액 샘플 수 여전히 처리 되며 분석 72 h 최대 주위 온도에 유지 될 때. 또한, 재료와 함께 모든 보정 나중 연구/품질 평가 등을 위한 무 균 세포의 cryopreservation 수 있도록 무 균 조건 하에서 수행 되어야 합니다.
프로토콜
프로토콜 연구 코드의 지침 및 VU 대학 의료 센터의 연구 윤리 위원회를 다음과 같습니다.
1. 골 수 포부와 샘플 준비
-
환자 및 재료 준비
- 1% lidocaine 16 게이지 바늘을 사용 하 여 하나 또는 두 개의 10 mL 주사기를 채우십시오. 21 게이지 바늘 바늘을 교체 합니다.
- 시계 유리에 5 %EDTA 두 방울을 넣어.
- 유리 슬라이드를 설정 (n = 15 일치 환자 번호 및 날짜) 얼룩 준비에 대 한.
- 환자 옆 decubitus 위치에 놓습니다. 뛰어난 후부 장 골 척추 찾아서 펜으로 표시 합니다.
참고: 일반적으로, 후부 우량한 장 골 등뼈는 위치 한 손으로 폭 장 골도 머리 하는 중간에 한 손으로 폭 측면 원심. 여성, 실제 척추는 좀 더 측면, 어떤 사람은 조금 더 중간에 있을 수 있습니다. - 0.5-1 액체와 피부 소독 원형 바깥쪽 의도 생 지역에서 에탄올에 %.
- 멸 균 장갑의 패키지를 열고 멸 균 장갑에 넣고 살 균 필드를 만드는 테이블에 패키지를 내려 놓 아 라. 포부 바늘 패키지를 열고 멸 균 분야에 그것을 배치 합니다.
- 피부 및 피하 조직 그리고 마지막으로 침투. 과에서 그런 방법으로 1 cm 직경의 지역 마 취 lidocaine를 관리 합니다.
참고: 적절 한 관리는과을 lidocaine의 참을성 있는 안락에 대 한 가장 중요 한 요소 중 하나입니다. 과 적절 하 게 도입 바늘 의도 생 검 위치를 활용 하 여 취 되어 있는지 여부를 테스트 하 고 환자의 통증 느낌 부탁 드립니다. 주의: 어린이 완전히 전체 절차 동안 마 취. - Aspirate 바늘을 잡고 (15가 x 2.8") 종 려 및 바늘의 금속 샤프트 팁; 근처의 측에 대하여 검지 손가락에 인접 끝 이 위치는 더 제어할 수 있습니다.
- 장 골 척추 쪽으로 피부를 통해 (빠르게 번갈아 pronating/supinating 운동)에 의해 회전 운동으로 바늘을 소개 하 고 후부 장 골 척추의 접촉으로 바늘을가지고.
- 즉 바늘과;의 마 취 영역에 도입 확인 환자는 압력과 고통 느껴야 합니다. 환자는 아픔을 느낀다, 바늘, 위치를 변경 하거나 더 lidocaine을 관리 합니다.
- 부드러운 하지만 회사 압력을 사용 하 여, 교체 시계 방향으로 카운터 시계 방향으로 움직임에 회전 하면서 바늘을 사전. 골 수 구멍으로 입구는 일반적으로 감소 저항에 의해 감지 됩니다.
- 바늘에서는 stylet을 제거 합니다. 10 mL 빈 주사기 바늘에 연결 합니다.
- 부드러운 당겨 주사기 플런저를 철수 하 여 부정적인 압력을 적용 합니다. 골 수 발음 되는 때 경련 센 세이 션과 통증을 느낄 수 있습니다 그들은 환자에 게 경으십시오. 충분 하지 않은 골 spicules 출시 되 면 또 다른 포부 한 빠른 무승부와 함께 수행 되어야 한다. 대부분 spicules 초기 풀에서 얻은 첫 번째 1-2 mL에 있을 것입니다. 만 1-2 mL 샘플 희석을 피하기 위해 발음
참고: 희석 hemodilution 고 MRD 결과 혼동 수 있습니다). - 주사기를 제거 하 고는 stylet 포부 바늘으로 바꿉니다. 시계 유리 및 헤 파 린 코팅 8 mL 튜브에 나머지에 골 수의 일부를 꺼냅니다.
참고: 적절 한 anticoagulation 되도록 표본 튜브 골 수 aspirate 삽입 후 즉시 각 튜브를 반전. 골 수 응고 종종 부적절 한 자료의 원인입니다. 추가 골 같은 자리에서 발음 될 수 있다 하지만 선호, 바늘은 새로운 aspirate 전에 5-10 m m 고급 이다. 가급적 이면 삽입 레벨 당 이상의 2 무 취해야 한다. 대표 하는 첫 번째 숫자를 증가 함께 튜브를 표시 확인, 두 번째 및 연속 그립니다. 그것은 가장 관련성이 높은 진단 분석에 대 한 첫 번째 무승부를 사용 하 여 일반적인 규칙 이다. - 또는 삽입 장소에서 바늘을 제거 하 고 골 수 구멍에서 원래 삽입 장소는 몇 밀리미터에 다시 절차를 반복.
참고: 중요 한 혈액 오염을 피하기 위하여 풀 당 1-2 mL 이상의 발음 하지 마십시오. - 자료 필요한 만큼 반복 합니다. 구체적인 임상 연구 프로토콜에 대 한 충분 한 자료는 발음 하는 골 수 바늘을 제거 합니다.
참고: 느리거나 그렇지 않으면 어려운 골 수 포부의 경우 미리 응고 제와 얼굴이 빨 개 했다 주사기를 사용 하 여 유용할 수 있습니다. 건조 탭의 경우이 원고의 범위를 벗어납니다 있는 판형 생 검을 수행 합니다.
-
Morphologic 시험에 대 한 얼룩의 준비
- 최적의 형태 평가, spicules (예: 플라스틱 주걱을 사용 하는) 시계 유리에 aspirate에서 밖으로 선택 하 고 유리 슬라이드에 배치 합니다.
- 부드럽게 다른 유리 슬라이드 위에 골 수와 슬라이드 놓고 조심 스럽게 미십시오. 어떤 압력을 피하십시오.
참고: 매우 큰 골 spicules 경우에 약간의 압력 수 있습니다 발휘 될, 셀 확산의 두께 감소. 누가 표본 튜브를 처리할 수 있는 도우미에서 도움말에서 절차 혜택. 환자 수와 수 연속 골 무승부의 튜브의 정확한 라벨링 하는 것이 중요 합니다. - 슬라이드를 철저 하 게, 건조 하 고을 수행할 수 있습니다 그 룬 발트 Giemsa 얼룩 (재료의 표 참조). 형태에 대 한 가벼운 현미경 검사 ( 그림 1참조).
참고: 그림 1A 로 구성 된 그림 1B 동안 다른 기능 세포 유형의 주로 leukemic 돌풍으로 AML 환자 건강 한 골 수의 얼룩을 보여 줍니다. 잔여 leukemic 부담을 더 나은 정의 하려면 immunophenotyping 수행 될 필요가 있다.
2입니다. 추가 처리를 위해 자료 전송
-
전송에 대 한 샘플의 준비
- 자료 누출 되지 것입니다 하 고 튜브를 깨뜨리지 않을 것 이다 있는지 확인 하려면 올바른 포장 확인 ( 그림 2참조).
참고:에서 우리의 다른 세포의 생존 능력을 경험 하 고 골 실 온에서 보관 하는 경우 가장 잘 보존 된입니다. 장기 운송이 최고의 운송 중 온도 안정성에서 원조 하기 위하여 실내 온도 ' 젤-팩 '을 사용 하 여 달성 된다. - 패키지 라벨 패키지, 머리말 붙인된 전송의 손실을 방지 하기 위해 정확한 형태를 추가 하거나 환자의 스위칭.
참고:이 포함 적어도 한다: (양식 1) 환자 데이터. 이 연구와 일반적으로 ' 생년월일 '을 포함 해야 합니다. 수신 실험실에 도착 후 재료의 올바른 처리에 대 한 필수, 구체적으로 요청 된 실험실 분석 (분자 진단, immunophenotyping, MRD 등)이 양식에 명확한 진술이입니다. (양식 2) 주소 및 전화 번호는 담당자의 고 필요한 세관에 대 한 논문. 메일에서 패키지를 잃지 않으려면 보내는 실험실 항상 샘플을 전송 받는 실험실을 알립니다. "추적 및 추적"의 사용을 권장 합니다.
- 자료 누출 되지 것입니다 하 고 튜브를 깨뜨리지 않을 것 이다 있는지 확인 하려면 올바른 포장 확인 ( 그림 2참조).
-
다른 기관에서 샘플을 받고
- 적합 한 물류 연구소는 연구소에 전달 되 자 마자 실험실에서 샘플을 받을 장소에 있는지 확인 합니다.
참고: 최적의 물류 조직 선호 중앙 연구소는 필요, 어떤 수신 및 지역의 병원에서 및 외부 병원에서 모든 자료를 수집. 특히, 유통 및 집행 연구소와 명확한 통신을 위한 프로토콜을 할당 필수적 이다. - 샘플을 받은 후 정확 하 게 하드 카피 양식 및 MRD ID 번호, 재판 특정 ID 번호, 병원 등록 번호, 보내는 연구소, 생년월일, 자료 등의 중요 한 분야를 포함 하는 보안된 데이터베이스에 적절 한 번호 매기기 note 유형 (골 수 또는 말 초 혈), 백혈구 (WBC), 골 수 포부의 날짜, 측정의 품질에 대 한 샘플 및 어떤 발언 관련의 측정의 날짜.
참고: 선호,이 데이터베이스는 또한 장착 (또는 다른 데이터베이스에 연결) 추가 데이터를 포함 분석 결과 및 후속 데이터 등 추가 환자 데이터의.
- 적합 한 물류 연구소는 연구소에 전달 되 자 마자 실험실에서 샘플을 받을 장소에 있는지 확인 합니다.
3. 교류 Cytometer 설치
참고:이 섹션은 Euroflow 지침에 기반. 11
-
FCS SSC 변수와 대상 형광 채널에 대 한 광 전 증폭 관 (PMT) 전압의 설정
-
FCS SSC에 대 한 매개 변수 교류 cytometer 시동 하 고는 "Cytometer 설치 및 추적 (CST)" 중부 표준시 구슬 (재료의 표 참조)와 교류 cytometer에서 실행을 수행 합니다. 건강 한 기증자 (섹션 4.1에서에서 설명)에서 적혈구 lyse
- 새 실험 만들기 (메뉴에서: 새로운 실험, 실험 선택 빈 실험) 제조업체의 소프트웨어를 사용 하 여 (재료의 표 참조) 측면 (SSC) 도트 점도 FSC 그리고 SSC 매개 변수를 설정 하기 위한 대 앞으로 분산형 (FSC)와 함께. 이 실험 FSC/SCC PMT 날짜와 이름을 지정 합니다. 먼저 현재 cytometer 설정 사용 (오른쪽 클릭: "현재 중부 표준시 적용"). 이러한 설정은 중부 표준시-교정 구슬 (재료의 표 참조)를 사용 하 여 중부 표준시 성능 검사와 함께 생성 된 것. FSC 그리고 SSC "글로벌 실험 설정"에서 세포를 시각화 하기 위해 조정 합니다. 참고: 우리의 교류 cytometer에서 이들은 285 V와 400 V 각각입니다. "사용 보상" 확인: 경위/악기 설정/보상.
- 셀 (FSC) 및 세분성 (SSC)의 크기를 평가 하기 위해 레이블이 없는 측정을 시작 "셀 습득" 기능에 의해 주변 혈 lysed. 조정/미세 tune FSC 그리고 SSC 전압 문이 림프 구 인구에 대 한 다음과 같은 말은 대상 값에 도달 하 고 림프 톨 게이트: FSC: 100000 (범위 95,000 105000); SSC: 15000 (13000 17000 범위)
- 취득 하 고 적어도 10, 000 건의 측정 하 여 데이터를 기록 합니다. FSC 뜻을 확인 하 고 SSC 문이 림프 톨에 대 한 값을 대상으로 하 고 필요한 경우 다시 조정.
- 설정 대상 형광 채널 PMT 전압 피크-8 무지개 구슬 교정 입자 (재료의 표 참조)를 사용 합니다.
- 7 피크에 대 한 FACS에 새 실험을 만듭니다. 모든 필요한 점 플롯과 워크시트를 "대상 평균 형광 강도 (MFI)"을 만들고 (n = 2; FSC SSC, FITC PE 대 대), 히스토그램 (n = 8; 한 히스토그램 각 형광 검출기) 및 각 형광 채널에 대 한 참조 (편차 (CV)의 계수 및 MFI) 피크 값을 보여주는 통계.
- 갓 dH2O. 부드럽게 소용돌이 솔루션에서 비즈를 섞어 1 mL에 무지개 구슬의 1 방울 (± 60 µ L)를 포함 하는 솔루션을 준비 합니다.
- 위에서 FSC/SSC 전압 및 5000의 임계값과 "낮은" 유량에 (녹음) 없이 "취득" 기능을 사용 하 여 무지개 구슬의 형광을 측정 시작의 PMT 설정을 사용 합니다. 게이트 내의 구슬 인구 P1 SSC 점 작 대 FSC에서 "사각형 게이트 버튼"을 사용 합니다. 7번째 피크-PE 점 작 대 FITC에서 인구 P2 게이트
- 구슬 제공 주석된 MFI 대상 채널에 따라 대상 MFI 값에 도달 모든 형광 채널에서 7-봉우리 무지개 구슬 서 스 펜 션 및 조정/미세 tune PMT 전압의 인수를 계속 합니다.
- 약 10000 이벤트의 데이터를 수집 하 고 7일 에 대 한 MFI를 확인을 "기록"를 사용 하 여 피크 구슬. 필요한 경우 PMT 전압을 수정 합니다. 7번째 피크에 대 한 대상 MFI 값에 도달 한 번, 레코드/최종 PMT 값에 대 한 파일을 덮어씁니다.
- 최종 PMT 값을 저장 하 고 PMT 설치 됩니다 날짜와 제조 업체의 소프트웨어의 카탈로그에 저장 하는 파일의 이름을. 이 PMT 설치를 사용 하 여 각 형광 염료에 대 한 이상 유출 해결을 위한.
-
FCS SSC에 대 한 매개 변수 교류 cytometer 시동 하 고는 "Cytometer 설치 및 추적 (CST)" 중부 표준시 구슬 (재료의 표 참조)와 교류 cytometer에서 실행을 수행 합니다. 건강 한 기증자 (섹션 4.1에서에서 설명)에서 적혈구 lyse
-
형광 보정 설정
- 흠 없는 제어 및 각 형광 색소 활용 된 항 체에 대 한 튜브 라벨 (사용된 형광 테이블 s 1 참조). 각 튜브에 버퍼의 100 µ L를 플라스틱.
- 와 다 색 보상 구슬의 병 동 (재료의 표 참조) 철저 하 게이 구슬의 각 튜브를 1 전체 드롭 (± 60 µ L)을 추가 합니다.
참고: 각 튜브에 그들을 추가 하는 동안 튜브의 측면 구슬 떨어지는 하지 마십시오. 이 낮은 구슬 농도에 발생할 수 있습니다 그리고 보상 매트릭스의 결과 영향을 미칠 수 있습니다. - (이 얼룩 106 세포에 충분 한 것이) 피 펫의 형광 색소 활용 된 항 체 충분 한 테스트에 대 한 적절 한 볼륨 계산 해당 튜브와 소용돌이에 철저 하 게. 흠 없는 제어 튜브에 항 체를 추가 하지 마십시오. 실 온 (RT)에서 어둠 속에서 15 ~ 30 분 동안 품 어.
- 워시 버퍼의 4 개 mL를 추가 (인산 염 버퍼 식 염 수 (PBS)/0.05% azide-0.1% 인간 혈 청 알 부 민 (HSA) (자료의 표 참조)) 각 관에. 원심 튜브 300g 에서 10 분 제거는 상쾌한 고 각 튜브를 워시 버퍼의 0.2 mL를 추가 하 여 비드 펠 렛 resuspend. 소용돌이 튜브 철저 하 게.
- 제조 업체의 분석 소프트웨어를 엽니다 (재료의 표 참조) 새 실험을 만듭니다 (메뉴에서: 새로운 실험, 실험 선택 빈 실험) 현재 날짜와 보상 파일 이름을 바꿉니다.
- "Cytometer 설정"으로 이동한 섹션 3.1에서에서 PMT 설정을 사용 합니다. FSC에 임계값 5000 이며 모든 사용된 형광의 보상 값은 제로 해야 합니다.
- 필요에 따라 레이블 전용 튜브를 포함 하 여 보상 컨트롤을 만듭니다. 흠 없는 컨트롤을 포함 해야 합니다. 메뉴에서 선택: 실험, 보상 설치 만들 보상 컨트롤.
- 흠 없는 제어 튜브를 로드 하 고 조정 내의 비드 인구 주위 P1 게이트 P1 게이트 내의 구슬만 포함 되어 있는지 확인.
- P1 게이트를 마우스 오른쪽 단추로 클릭 하 고 "적용을 모든 보상 제어"를 선택 합니다. 모든 단일 레이블이 형광 튜브에 대 한 기록 데이터입니다. P2 게이트 각 형광 히스토그램에 긍정적인 인구 포함을 확인 합니다. 경우에 게이트를 조정할 필요.
- 보상을 계산 합니다. 선택 실험, 보상 설치, 보상을 계산 합니다.
- 보상 계산 성공 하지 않으면 오류 메시지가 표시 됩니다. 필요한 조정을 하 고 다시 계산 합니다. 보상 계산에 성공 하면 대화 상자가 보상 설치에 대 한 이름을 묻는 나타납니다.
- (예를 들어 YY-MM-DD 8 색상 설정)의 이름을 입력 하 고 클릭 합니다, 링크 및 저장. 보상 설치 또한 보상 설치 카탈로그에 저장 됩니다.
참고: 동일한 설정은 사용 하 여 동일한 fluorophores 모든 실험에 대 한 사용할 수 있습니다.
4. 교류 Cytometry 평가 (LAIP 및 LSC)
참고: 여기 우리는 대량 세포 절차, 얼룩이 지기 전에 WBC의 기본 농도 얼룩을 수 있는 설명 합니다. 대부분 MRD 프로토콜 일부 성공적으로 세포의 용 해 전에 얼룩 등의 다른 옵션을 사용 하는 있지만이 접근 방식을 사용 합니다. 전체 골 수 세포의 용 해 전에 얼룩 우선 셀 손실12, 최소화 하지만 예측할 수 없는, 너무 낮은 세포 농도의 단점이 있다.
-
대량 세포 세포의 용 해
참고: unmanipulated 샘플 수평에서 계속 RT, 흐름 cytrometric 인수는 같은 날 다음 날 전체 절차를 시작 하기 위해 수행할 수 없는 경우.- 여러 번 샘플을 반전 하 여 동질성을 anticoagulated 골 수 샘플을 resuspend. Tuerk 솔루션 얼룩 셀 챔버 계산 셀을 사용 하 여 골 수 세포 (백혈구 (WBC))의 농도 결정 (재료의 표 참조).
- 피펫으로 별도 15 mL 튜브로 골 수의 필요한 볼륨. 셀의 금액은 별도 얼룩 튜브;의 수에 한 얼룩 (한 관)에 대 한 LAIP 측정 및 LSC 튜브의 측정을 위한 8 x 106 백혈구에 대 한 약 2 x 106 백혈구 세포를 사용 합니다.
- Lysing 솔루션을 추가 하 여 붉은 혈액 세포를 lyse (재료의 표 참조). 솔루션 lysing의 필요한 볼륨 세포 현 탁 액의 10 배 볼륨 이어야 합니다.
- 반전, 부드럽게 혼합 하 고 실시간에 10 분 동안 품 어 7 분 800 g 실시간 삭제에 대 한 원심 (예: 진공 펌프 또는 파스퇴르 피 펫)와 상쾌한. 인산 염 버퍼 염 분에 셀 펠 릿 resuspend (PBS)/0.05% azide-0.1% 인간 혈 청 알 부 민 (HSA) (자료의 표 참조) 실시간 사용 튜브의 최대 볼륨에서.
- 실시간에서 7 분 800 g에 대 한 원심 분리기 (예: 진공 펌프 또는 파스퇴르 피 펫)와 상쾌한 삭제. 다시 100 x 106 WBC/mL의 세포 농도를 PBS/0.05% azide-0.1% HSA에에서 셀 펠 릿을 일시 중단 하 고 수 의도 튜브의 분할.
-
Cytometry에 대 한 셀의 얼룩
- 피펫으로 단일 클론 항 체 (모 압) 칵테일 솔루션 적절 한 형광 활성화 된 세포 분류 (FACS) 튜브로 혼합 하 고 어둠 속에서 15 분 동안 lysed 골 수 세포와 품 어.
참고:이 때 매우 중요 한 협동 염료 사용 됩니다. 예를 들어 standardly 우리의 실험실 (테이블 S1)에 사용 되는 패널의 믹스를 참조 하십시오. - 3 mL PBS/0.05% azide-0.1% 셀은 세척. 셀 400g에 5 분 동안 원심 (예: 진공 펌프 또는 파스퇴르 피 펫)와 상쾌한와 300 µ L PBS/0.05% azide-0.1%HSA에서 셀 펠 릿 resuspend을 삭제 합니다.
- LSC 측정: 400 µ L PBS/0.05% azide-0.1% HSA에에서 셀 펠 릿 resuspend 및 빈 구슬의 4 µ L을 추가 (예: Spherotech, 재료의 표 참조) 분석에 부정적인 제어 인구로 사용 하.
- 열고는 MRD 또는 LSC 실험 레이아웃은 FACS에 (재료의 표 참조) 측정 MRD 적어도 100000 WBC에 대 한 문이 진단 및 1 X 106 WBC 후속에서 AML 샘플에서 AML 환자 샘플의 측정에 대 한 이벤트 및. LSC에 대 한 실험 적어도 4 x 106 모두 진단 및 신뢰할 수 있는 LSC 결과 대 한 후속에서 WBC를 측정합니다.
- 결과의 분석에 대 한 표준화 된 적절 한 파일을 사용 하 여 데이터를 저장 합니다. 다른 측정된 마커 AML 셀에 및 AML 줄기 세포 (양수, 음수, 오버/언더 식)에 한 재고를 확인 하 고 실험실에 이러한 데이터를 저장.
- 없는 진단 LAIP 사용할 수 있을 경우 모든 가능한 측정 LAIP 정상에서 다른 접근 방식에서 식별 될 수 있습니다 있도록 후속에 모든 4 튜브 측정 합니다.
- 진단에 가장 신뢰할 수 있는 LAIP(s)13 을 선택 하 고, 가능한 많은 이벤트를 획득 하지만 > 정의 된 최소 숫자.
- 피펫으로 단일 클론 항 체 (모 압) 칵테일 솔루션 적절 한 형광 활성화 된 세포 분류 (FACS) 튜브로 혼합 하 고 어둠 속에서 15 분 동안 lysed 골 수 세포와 품 어.
5. 백혈병 관련 면역-고기 (LAIP)의 식별: 다른 세포 인구 분석
참고: FCS 파일 다른 세포 인구 (재료의 표 참조)의 최적의 시각화에 대 한 여러 가지 소프트웨어 프로그램을 분석할 수 있습니다.
-
화이트 혈액 세포 인구
- CD45 긍정적인 세포와 FSC/SSC 음모; 내 낮은 FSC (비-실행 가능한 세포, erythroid 세포) 나가는 실행 가능한 나타나는 셀 게이트 이 WBC (그림 3A나) 포함. WBC를 표시 하 고 기본 마커 (예 CD34, 중 하나를 사용합니다 그림 3Aii) 드 CD45dim 지역 (그림 3Aiii)에서 폭발의 마지막 위치를 확인 하는 데 도움이.
- CD45dim 셀 게이트 하 고 다시 (그림 3B나) 금감위/SSC 플롯에 셀 게이트. 프로그램에서 인구 트리에 % 폭발으로이 게이트 % 셀을 보고 하는 동안 (그림 3Bii) CD34 게이트를 제거 합니다. SSC/CD34에 폭발 플롯 및 게이트 CD34 양성 세포 (Figure3Biii) 표시.
-
림프 톨
- 세포를 사용 하 여 내부 제어: 부정적인 제어 및 긍정적인 컨트롤로 림프 인구로 골수성 인구.
- 백혈구 인구 (그림 4A)에서 시작 합니다. CD45높은/SSC낮은 인구로 (그림 4B) 림프 톨 게이트.
- CD13 부정/CD33 부정적인 세포 (그림 4C-E)에 대 한 CD34, CD117, CD13 또는 CD33 및 게이트를 사용 하 여 게이트에서 아니 골수성 세포는 다는 것을 확인 하십시오. 인구 트리 (그림 4 층)에서이 인구 '세포'를 호출 합니다.
-
진단에서 LAIP
- 게이트 폭발 그리고 연속적으로 SSC/CD34 CD34 긍정적인 셀 플롯 인구 트리에서 이러한 '기본 마커'를 호출.
- 골수성 마커 (CD33)에 대 한 림프 표시 (CD7)와 함께 기본 셀,이 경우 CD34 양성, 그리고 새로운 음모에 림프 톨을 플롯 합니다. 탈 선 인구 (참조에 대 한 지침은 보충 파일 1) 게이트, 인구 트리에서 'LAIP 긍정적인' 전화.
참고: LAIP를 선택 하는 마지막 폭발 인구에 LAIP %로 보고 됩니다. 감도, 특이성의 보안과 LAIPs MRD 측정에 충분 한 경험을 가진 인사로만 설정할 수 있습니다. 총은 이러한 매개 변수는 LAIP의 품질을 결정합니다. 진단에서 4 개의 다른 LAIP 평가의 예는 그림 5 A-D에 부여 됩니다. - LAIPs (폭발에 %)의 식을 결정 하 고 데이터베이스에이 데이터를 보존 또는 엑셀 파일.
- FACS 분석 보고서 및 MRD 측정에 사용할 수 있는 LAIPs의 메모를 확인 합니다.
참고: LAIPs의 정의 허가 전문가의 팀에 때문에 그것이 정확한 MRD 측정 수행에 필수적인 기능.
-
MRD 후속에
- 5.1에서 하지만 시간이 지점에 따라 치료; 후에 설명 된 대로 돌풍 게이트 이 게이트의 정확한 평가 전하실 수 있습니다. 진단에서 설립 되었다 LAIP 표현 형에 집중 하 고 미 숙 인구 게이트.
- 대로 5.1에서 설명 합니다. 정확한 폭발 게이트 정의 aberrancy에 따라 하 고 그들을 밖으로 게이트 위해서는 골 수 및 정상 식 회생의 알고 있어야
- 같은 게이팅 전략에 따라 포인트를 반복 하 고 전체 백혈구 인구에 있는 LAIP 세포의 백분율로 MRD를 결정 합니다. 예제 그림 6A , 6B참조 하십시오.
- MRD의 % ≥ 경우 MRD 양성을 보고 백혈구의 0.1%. MRD 팀과 매주 토론을 표준 형식으로 분석 된 데이터를 인쇄 합니다. 합의 도달한 후에 결과 등록 합니다. 에 임상 결과 의사 소통 하기 전에 감독자에 의해 승인 되어야 하는 결과 보자.
6. 줄기 세포 MRD (LSC 단일 튜브)14 의 분석
-
진단 및 후속 LSC의 분석
- 5.1 섹션에 설명 된 대로 폭발 셀 게이트.
- 잠재적인 부정적인 컨트롤 CD38-, 적혈구-분수 (즉 나머지 적혈구 세포, SSC낮은/FSC낮은 및 CD45부정적인특징 후) 게이트. 필요한 경우, 죽은 세포와 세포 조각이이 음모에 여분의 게이트 하 여 제외할 수 있습니다.
- Leukemic 돌풍 게이트 내에서 CD34의 표현 부분 모집단을 결정 합니다. 선택이이 인구는 CD34 내의+ CD38- 셀 (커트 오프로 사용: 임계값 결정에 대 한 빈 교정 구슬의 상단 테두리 (재료의 표 참조), 레드-분수 또는 사용 103 컷오프 지점으로). 전화이 인구 'CD38낮은 창시자' (그림 7).
: 참고 추가 파일 1에 대 한 자세한 내용은 설정 CD38-cut 오프 수준. - 진정한 CD34 + CD38매우 낮은 줄기 세포 인구, 빨간색 분수, 빈 교정 구슬의 더 낮은 국경의 중간값을 사용 하 여이 CD38낮은 인구 내의 결정 또는 10 선택 컷오프 지점 (그림 72 ). 자세한 내용은 CD38-cut 오프 레벨 설정에 대 한 보충 파일 1을 참조 하십시오.
- 두 모집단 내에서 분석 각 leukemic 마커 패널에 제공 하 여 정상적인 조 혈 줄기 세포 (LSC 대 HSC) 대 leukemic 줄기 세포 게이트 (즉 CD45RA 콤 비-6 (CLEC12A, 팀 3, CD7, CD11b, CD22, CD56 PE에서 모두), CD123, CD33 및 CD44).
- 다른 줄기 세포 마커 양성/부정적 다른 마커의 긍정/부정적으로 비교 하 고 HSC 주파수 대 LSC를 세밀 하 게 조정 대의 줄기 세포 마커를 플롯 합니다.
- 미 숙 폭발, 림프 톨, CD34 + 세포의 백분율을 보고 합니다. 모든 별도 표식에 대 한낮은 CD38 CD38verylow 의 총 숫자와 마커 (긍정적이 고 따라서 종양 약)는 CD38낮은 CD38verylow 의 숫자를 나열 합니다.
- 표식에 대 한 선택 잘 구별 leukemic 줄기 세포 추가 분석에 대 한 대 정상 조 혈 줄기 세포. 총 WBC의 백분율로 LSC 및 HSC의 비율을 계산 합니다.
참고: LSC ≥ 0.004%의의 비율으로 보고 진단에서 긍정적인 LSC는 컷오프는 후속에서 0.0001%. 그러나 탈 선 줄기 세포 후속 샘플에서 게이팅 진단에서, 줄기 세포 인구에 있는 핸드폰 번호 될 수 있는 매우 작은 분석와 비슷합니다. 따라서 충분 한 이벤트 획득의 필요성.
결과
AML 환자의 90%에서 적어도 1 개의 LAIP은 확인할 수 있습니다. LAIP + 진단에서 원시 폭발 세포의 세포의 정확한 비율을 생성 하기 위해 폭발 게이트의 적절 한 설정을 중요 하 고 그림3에서 시각으로 확인 필요 합니다. CD34 + 기본 셀에 aberrancy의 특정 종류를 품고 각 환자의 예는 그림 5에 시각 이다. 에 따라 업 MRD의 측정, 이전 정의 된 LAIP + 셀 문이 고 WBC의 LAIP + 셀의 비율로 정의. 따라서이 게이트의 설정은 바로 MRD 결과 달성 하기 위해 중요 합니다. 그림 6 유도 치료의 두 번째 주기 후 완전 한 죄 사 함에는 환자와 relapses MRD 긍정적인 결과 (≥ 0.1%) 후 환자를 보여준다.
현재 프로토콜은만이 구획의 철저 한 특성화 CD38-인구 분수 처럼 가장 유력한 줄기 세포 비호 나타났습니다 CD34 + 세포, 줄기 세포 정의 적당 하다. 이 분수에서 HSC에서는 LSC를 분리 하기 위하여 추가 마커 사용 됩니다. LSC 구별을 가장 많이 선택 된 표식은 CD45RA 및 PE 표시 6 특정 LSC 마커 은닉 콤 채널 있습니다. 추가 임상 평가 바탕으로, ≥ 0.004%의 커트 오프 수준을 LSC 양성으로 정의 된 고 0.0001%의 커트 오프 수준을 follw 업10에 사용 되었다 하는 동안 진단에 더 생존에 연관 되었다.
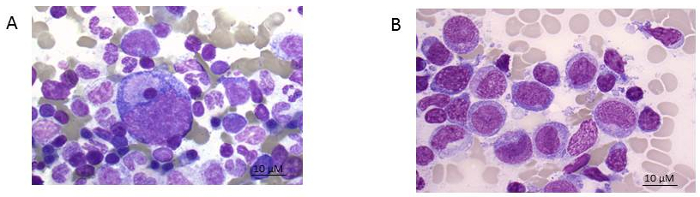
그림 1 : 골 수 얼룩. A) 건강 한 기증자와 B) AML 환자 (팹 5 하위). Giemsa 얼룩 100 배 확대 표시입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
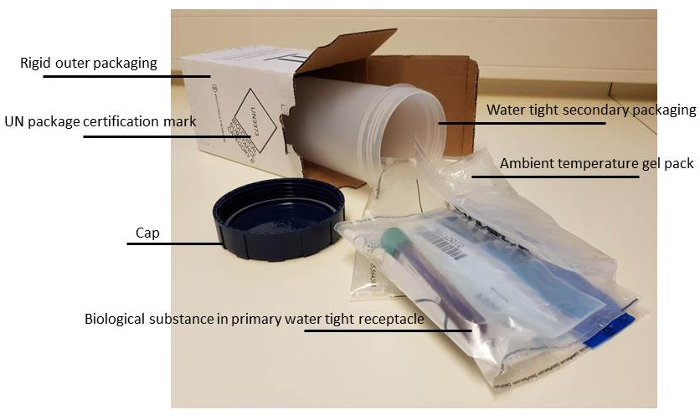
그림 2 : 생물 학적 체액에 대 한 포장 재료 수정. 생물 학적 체액을 운반의 규정과 규칙에 세부 사항 더 질병 통제 및 예방 센터의 웹사이트15 에서 찾을 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
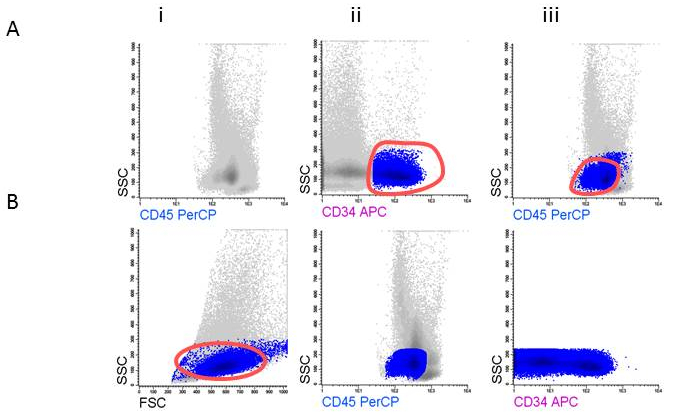
그림 3 : 폭발 셀을 정의 하기 위한 전략을 게이팅. A) 게이팅 CD45dim, B) 게이팅 CD34 + 폭발.
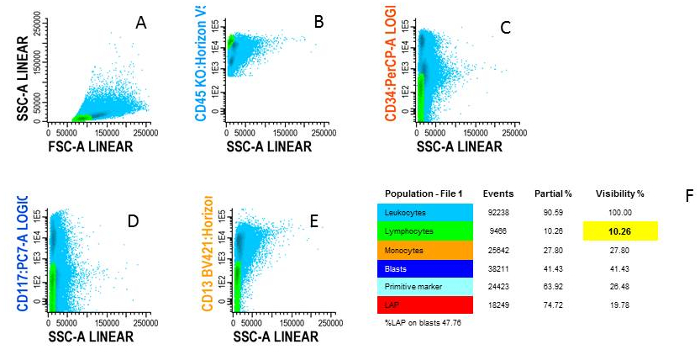
그림 4 : 림프 톨 게이트. A) 블루 셀은 B) 녹색 세포는 림프 톨 CD45높은/SSC낮은, C 특징 FSC/SSC 작 에서처럼 WBC) CD34, D) CD117과 E) CD13에 대 한 부정을 위한 부정에 대 한 부정적의 예제 F)는 다른 세포 유형에 표시 되는 개요 인구 나무입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
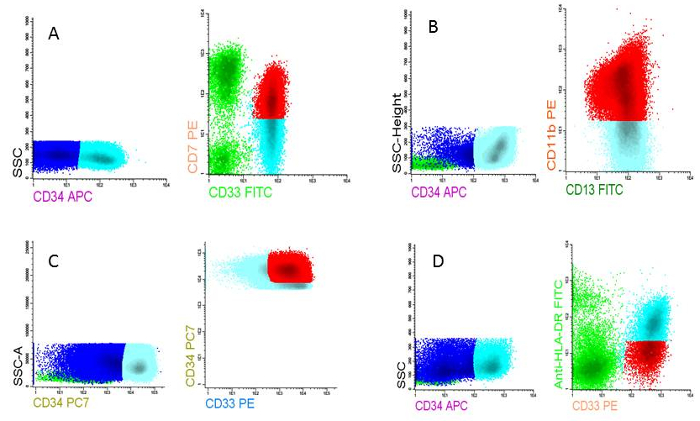
그림 5 : 급성 골수성 백혈병 진단에 LAIPs. A) LAIP에 따라 혈통 aberrancy 크로스 (CD7 CD33 표현 셀에), B) 비동기 차별화를 기반으로 하는 LAIP (CD13 표현 셀에 CD11b), 정상 세포 (CD34매우 높은 CD13에 표현 하는 셀)에 비해 overexpression를 기반으로 하는 C) LAIP D) LAIP underexpression (HLA-DR낮은 CD33에 표현 하는 세포) 정상 세포에 비해 기반으로 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
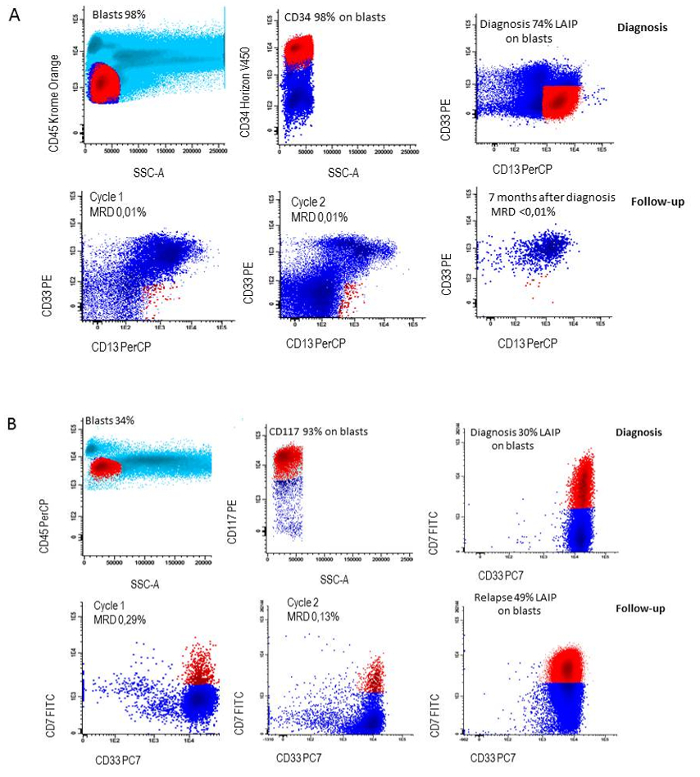
그림 6 : LAIP 치료 동안 다음. 진단에서 A) LAIP 정의 (CD34 + CD13 + CD33-) 연속 완전 한 죄 사 함, 진단에서 B) LAIP 정의에 남아 있던 환자에서 속 행 동안에 LAIP의 손실 (CD117 + CD7 + CD33 +) 및 환자에 속 행 동안 LAIP의 지 속성 들 relapsed. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
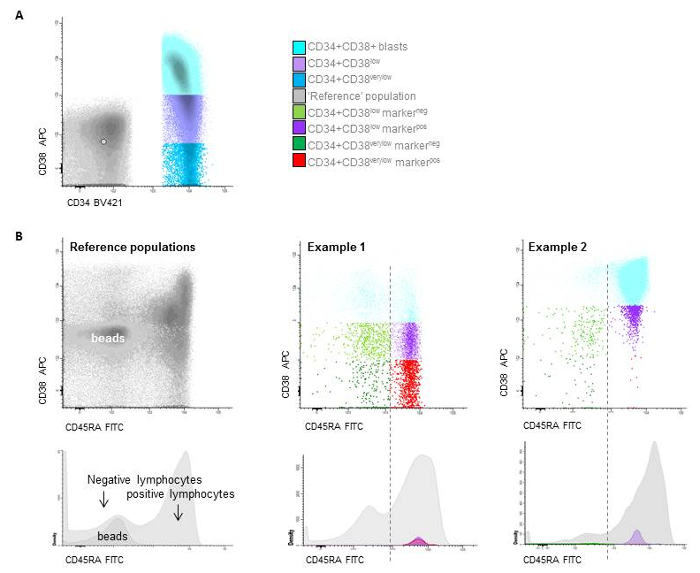
그림 7 : 줄기 세포 게이팅. A) Gating의 다른 CD34 + / CD38 인구 기반 구슬 (CD38매우 낮은 LSC를 나타내는 진정한 부정적인 세포로 정의 되어 있으며 구슬의 중간 아래 위치 하면서 구슬의 상단 테두리 아래 CD38낮은 이다), B) 2 환자 CD45RAneg 와 CD45RApos 식에 따라 후속에 HSC 및 LSC 사이 구별의 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
보충 파일 1. 여기를 클릭 하십시오 다운로드가이 파일.
보조 파일 2. 여기를 클릭 하십시오 다운로드가이 파일.
보충 파일 3. 여기를 클릭 하십시오 다운로드가이 파일.
토론
충분 한 데이터는 사용할 수 있는 MRD 양성 가난한 생존와 관련 된 것에 대 한 증거를 보여 및 따라서 MRD 평가는 임상 결정을 만들 수 있습니다 추가 전조 정보를 제공 하 여 환자의 결과 향상 될 수 있습니다. 그러므로, MRD의 면역 phenotypic 평가 대 한 일관 되 고 통일 된 방법 궁극적으로 환자 치료를 개선 하기 위해 필수적입니다. 이것은 또한 중요 한 여러 임상 사이트에서 임상 연구를 비교할 때 고 있습니다 궁극적으로 임상에 도움이 결정 하 고 전반적인 생존을 위한 대리 임상 끝점으로 제공. 단단한 지침 서는 정확 하 고 일관 된 MRD 측정에 대 한 보증 개념 디자인의 지침을 유럽 백혈병 네트워크 (ELN)의 공동된 작업을 주도하 고 있다. 이 포괄적인 문서 출판된 늦은-2017, 되며 많은 연구 그룹 및 앞으로 이동 하는 실험실에 대 한 도구가 될 것 이다.
프로토콜 내에서 중요 한 단계
MRD 분석의 중요 한, 그리고 종종 간과 측면 MRD의 정확한 결심에 샘플 품질의 영향 이다. 이 때 더 명백한 물자는 주어진이 설정에서 고려 되어야 하는 데 필요한 추가 작업 고려 글로벌 임상 실험에서 다른 기관에 이송 됩니다. 환자를 혼합의 위험을 줄이기 위해 정보 및 샘플 적절 한 관리의 적시 납품은 중요 합니다. 다시, 전송의이 단계에서 올바른 양식 또는 가져오기 요청된 분석의 명확한 지정 전자 병원 시스템에는 필요 합니다. MRD 샘플링의 치료에서 무대를 지적 또한 중요 한 임상 의사 결정 (예 후 치료의 두번째 과정)와 관련이 있을 수 있습니다 때문 이며 따라서 명확 하 게 정의 해야 합니다. 모의 데이터 (예를 들어 1 월 1 일 출생의 년 당) 사용 환자 또는 분석을 혼합의 위험을 증가 시킵니다. 법에 의해 필요한 경우 익명된 식별 방법은 사용 되어야 한다.
모든 표본 immunophenotyping에 대 한 컬렉션의 24 시간 이내에 우선적으로 처리 한다. 비록 하지 추천, 골 수 및 말 초 혈액 샘플 수 여전히 처리 되며 분석 72 h 최대 주위 온도에 유지 될 때. 또한, 재료와 함께 모든 보정 수행할 수 있는 가장 메 마른 조건 하에서 (로컬) 바이오 뱅크에 셀의 추가 cryopreservation 남아 관련: 많은 임상 연구는 더 이상 백혈병 세포를 조사 하는 추가 분석 이후 단계에서 수행을 분자, 면역 phenotypic 및 기능 기능을 존중 합니다. 그러나 biobanking의 내용은이 원고의 범위 내에서 않습니다.
진단 도구를 사용 하 여 MRD cytometry, 뿐만 아니라 MRD 평가의 품질 관리에 관한 공인된 실험실 필요한 의미 합니다. 이 특정 참조 실험실 또는 (재) 참조 팀 MRD 측정 흐름 파일을 분석 하는 샘플을 배포 해야 합니다.
이 문서는 임상 샘플-효과적인 요구 하는 특정 작업, 책임, 그리고 자주 통신 전문가의 전체 팀에에서 MRD의 결심에 골 aspirate 컬렉션에서 가장 중요 한 작업을 설명 합니다. 특성화 및 분석입니다. 각 작업 절차에 중요 한 이기 때문에, 사운드 물류 각 실험실과 특별히 훈련을 받은 작업에 대 한 충분 한 백업 인재에 프로토콜을 포함 하는 것이 좋습니다. 또한, 몇 가지 상대적으로 주관적인 단계 절차 (특히 LAIP 및 LSC 탈 마커 식별)의 부분에서, 이후 그것은 최종 결과 대 한 토론 팀, 여 고의 팀에 의해 허가 하는 최종 보고서에 필수적 감독자입니다. 현재 노력 (LAIP 및 LSC) MRD 분석 표준화 하는 것을 도울 것 이다 컴퓨터 소프트웨어 개발을 추구 하 고는.
수정 및 문제 해결
각 실험실 MRD 측정 문서 ELN의 지침에 설명 된 대로 비교 결과 대 한 필수적입니다 마커의 표준화 된 백본 데 있지만 다른 부분 모집단을 정의 하는 데 사용할 수 있는 항 체의 그것의 자신의 세트를 가질 수 있습니다. 위의 참조. 고려 될 필요가 및 결과의 분석을 어렵게 만들 수 있는 몇 가지 문제는 선택한 마커의 불문.
기술의 한계
LAIP 및 LSC 탈 마커 식의 식별 처음 진단에서 평가 하 고 (중과 치료 후) 시간이 지남에 MRD의 표현 형의 정확한 특성화에 대 한 모니터링. 이상 환자의 95% LAIP LSC (또는 둘 다)을 통해 평가 될 수 있다, 그러나 아직도 일부 환자 없다 정의 된 LAIPs 또는 아무 CD34 + CD38-LSCs CD34 부정적인 폭발, 제시 또는 누락 된 진단 샘플을가지고. 이러한 경우에, 그것은 여전히 가치가 시도 하 고 사용 가능한 셀 수 있으며 다음 가장 신뢰할 수 있는 (주는 leukemic 세포의 가장 강한 구별)을 선택으로 광범위 한 항 체의 패널 MRD 측정 LAIP. 고려 할 궁극적으로 재발 하는 환자의 비율 완전히 진단 immunophenotype AML 질병의이 성분으로 인해 유사 하지 않습니다 어쨌든 권장 MRD에서 항 체의 광범위 한 패널을 측정. 이러한 immunophenotypic 교대 LSCs 폭발 세포 등 치료16 동안 발생을 표시 하 고 측정 가능 질병이 소위 곧 인구에 기반 할 수 있습니다. 그러나이 시간에, 그것은 되었습니다 결정 되지 여부 모든 immunophenotypic 부분 모집단 질병 재발으로 이어질 것입니다 하 고 따라서 MRD 맞춤형 치료를 보고 하지 관행에 따라 임상 시험에서이 세포. 그것은 중요 인구 변화 때문 LSC를 누락의 위험에 가장 중요 한 aberrancy 정의 마커 있는 하나의 cytometry (PE) 채널141 개의 관 접근에 의해 감소 된다.
기존의 방법에 관하여 의미
이 프로토콜에서 설명 하는 방법을 하나 이상의 LAIPs, 치료 하는 동안 뒤에 셀의 정의에 의존 합니다. 이 방법의 단점은 최근에 보였다 LAIP 치료 동안 변경 될 수 있습니다. 이런식으로 다른 탈 선 마커 일부 곧 인구를 놓칠 수 있습니다. 이 회피, 진단에만 그 대신 모든 탈 마커 측정 하 기쁠 것 이다. 다음 여러 실험실17에서 사용 되는 "정상에서 다른" 접근 방식에 비슷한 것입니다.
미래의 응용 프로그램
최근, MRD는 새로운 임상 시험 디자인에 대 한 여분의 관심을 받고 있다. 전문된 치료 옵션 및 대상된 약물 치료의 시대에서 결과 조치로 MRD 사용 하 여 궁극적으로의 빠른 소개는 급히 치료 필요 수 있도록 새로운 치료의 임상 효능을 설정 하는 데 필요한 시간이 줄어듭니다. 병원에 옵션입니다. 적절 한 물류의 중요성 및 조화 MRD 평가의 실제적인 실행은 FDA MRD를 사용 하 여 전반적인 생존 대신 대리 끝점으로의 타당성을 조사 하 고 현재로 미래 급성 골수성 백혈병 치료 성공에 중요 한 18를 측정합니다.
공개
여러 독립적인 기관에 줄기 세포 관의 유효성 검사에 사용 하는 항 체 칵테일 친절 하 게 BD에 의해 제공 되었다. 저자는이 원고에 관하여 공개 없다.
감사의 말
이 연구는 VONK 네덜란드 암 협회 (알프 2013-6371)와 Egbers 기초에 의해 지원 되었습니다. 우리는 네덜란드 AML MRD 작업 그룹 공동 작업에 대 한 및 지속적인 개선 및 AML MRD의 표준화에 대 한 유익한 토론 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| BD Biosciences | 120995496,060996589 and 013729 | FACS Canto II | |
| BD Biosciences | 555360 | CD7 FITC | |
| DAKO | F076701 | CD2 FITC | |
| Sanquin | M1613 | CD36 FITC | |
| BD Biosciences | 332778 | CD15 FITC | |
| BD Biosciences | 335039 | CD45RA FITC | |
| BD Biosciences | 345810 | CD56 PE | |
| BD Biosciences | 337899 | CD22 PE | |
| BD Biosciences | 345785 | CD14 PE | |
| Miltenyi Biotec | 130-080-801 | CD133 PE | |
| BD Biosciences | 562566 | Clec12a PE | |
| BD Biosciences | 565568 | Tim-3 PE | |
| BD Biosciences | 332774 | CD7 PE | |
| BD Biosciences | 333142 | CD11b PE | |
| BD Biosciences | 337899 | CD22 PE | |
| BD Biosciences | 345810 | CD56 PE | |
| BD Biosciences | 347222 | CD34 PERCP-CY5.5 | |
| BD Biosciences | 558714 | CD123 PERCP-CY5.5 | |
| Beckman Coulter | B49221 | CD117 PE-CY7 | |
| BD Biosciences | 562854 | CD33 BV421 | |
| BD Biosciences | 345791 | CD19 APC | |
| BD Biosciences | 333143 | CD11b APC | |
| BD Biosciences | 345800 | CD33 APC | |
| BD Biosciences | 345807 | CD38 APC | |
| BD Biosciences | 641411 | HLA-DR APC-H7 | |
| BD Biosciences | 560532 | CD44 APC-H7 | |
| BD Biosciences | 562596 | CD13 BV421 | |
| BD Biosciences | 348811 | CD34 PE-CY7 | |
| Beckman Coulter | A96416 | CD45 Krome Orange | |
| BD Biosciences | 655873 | CD45 HV500c | |
| BD Biosciences | 655051 | CST beads | |
| BD Biosciences | 555899 | Pharm lysing solution | |
| BD Biosciences | 644204 | Multicolor CompBeads | |
| BD Biosciences | 655051 | CST beads | |
| BD Biosciences | FACSDiva software | ||
| Cytognos | Infinicyt | ||
| Spherotech | Euroflow RCP-30-5a | ||
| Sigma-Aldrich | Tuerk solution | ||
| Spherotech | BCP-100-5 | Blank Calibration Particles Beads | |
| HSA | |||
| Azide | |||
| ddH2O |
참고문헌
- Döhner, H., et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 129 (4), 424-447 (2017).
- Zwaan, C. M., et al. Collaborative Efforts Driving Progress in Pediatric Acute Myeloid Leukemia. J Clin Oncol. 33 (27), 2949-2962 (2015).
- Cornelissen, J. J., et al. The European LeukemiaNet AML Working Party consensus statement on allogeneic HSCT for patients with AML in remission: an integrated-risk adapted approach. Nat Rev Clin Oncol. 9 (10), 579-590 (2012).
- Grimwade, D., Freeman, S. D. Defining minimal residual disease in acute myeloid leukemia: which platforms are ready for "prime time"?. Hematology. 2014 (1), 222-233 (2014).
- Krönke, J., et al. Monitoring of minimal residual disease in NPM1-mutated acute myeloid leukemia: a study from the German-Austrian acute myeloid leukemia study group. J Clin Oncol. 29 (19), 2709-2716 (2011).
- Terwijn, M., et al. High prognostic impact of flow cytometric minimal residual disease detection in acute myeloid leukemia: data from the HOVON/SAKK AML 42A study. J Clin Oncol. 31 (31), 3889-3897 (2013).
- van der Velden, V. H. J., et al. Clinical significance of flowcytometric minimal residual disease detection in pediatric acute myeloid leukemia patients treated according to the DCOG ANLL97/MRC AML12 protocol. Leukemia. 24 (9), 1599-1606 (2010).
- Ossenkoppele, G., Schuurhuis, G. J. MRD in AML: time for redefinition of CR?. Blood. 121 (12), 2166-2168 (2013).
- Feller, N., et al. MRD parameters using immunophenotypic detection methods are highly reliable in predicting survival in acute myeloid leukaemia. Leukemia. 18 (8), 1380-1390 (2004).
- Terwijn, M., et al. Leukemic stem cell frequency: a strong biomarker for clinical outcome in acute myeloid leukemia. PLoS One. 9 (9), e107587 (2014).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Paietta, E. Assessing minimal residual disease (MRD) in leukemia: a changing definition and concept?. Bone Marrow Transplant. 29 (6), 459-465 (2002).
- Loken, M. R., et al. Residual disease detected by multidimensional flow cytometry signifies high relapse risk in patients with de novo acute myeloid leukemia: a report from Children's Oncology Group. Blood. 120 (8), 1581-1588 (2012).
- Zeijlemaker, W., et al. A simple one-tube assay for immunophenotypical quantification of leukemic stem cells in acute myeloid leukemia. Leukemia. 30 (2), 439-446 (2015).
- . Guidance for Collection, Transport and Submission of Specimens for Ebola Virus Testing Available from: https://www.cdc.gov/vhf/ebola/healthcare-us/laboratories/specimens.html (2017)
- Bachas, C., et al. The role of minor subpopulations within the leukemic blast compartment of AML patients at initial diagnosis in the development of relapse. Leukemia. 26 (6), 1313-1320 (2012).
- Ravandi, F., et al. Persistence of minimal residual disease assessed by multiparameter flow cytometry is highly prognostic in younger patients with acute myeloid leukemia. Cancer. 123 (3), 426-435 (2017).
- Hourigan, C. S., et al. Measurable residual disease testing in acute myeloid leukaemia. Leukemia. 31 (7), 1482-1490 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유