JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
해로운 효과의 낮은 압력 플라즈마 살 균 새 균의 subtilis 포자를 사용 하 여 라이브 셀 현미경의 생존에 조사
요약
이 프로토콜 추적에 의해 모니터링 활력 매개 변수 및 저압 플라즈마 처리 후 새 균의 subtilis 포자를 되살리는에서 DNA 복구 프로세스의 관련성을 평가 하는 데 필요한 중요 한 연속 단계를 보여 줍니다. 형광 표시 DNA 복구 시간 해결 confocal 현미경 검사 법 및 전자 현미경 검사를 통해 단백질.
초록
플라즈마 살 균 산업, 임상, 및 spaceflight 목적으로 기존의 살 균 방법에 유망한 대안 이다. 저압 플라즈마 (LPP) 방전 급속 한 미생물 비활성화 이어질 활성 종의 광범위 한 스펙트럼을 포함. 효율성과 LPP에 의해 살 균의 메커니즘 연구, 우리는 기존의 살 균 절차에 대 한 그들의 특별 한 저항 때문에 새 균의 subtilis 테스트 기체의 포자를 사용 합니다. 우리는 B. subtilis 포자 monolayers, 이중 유도 결합된 플라즈마 반응 기, 스캐닝 전자 현미경 (SEM)을 사용 하 여 포자 형태학의 특성에서에서 저압 플라즈마에 의해 살 균 과정의 생산을 설명 하 고는 발 아 및 라이브 셀 현미경으로 포자의 파생물의 분석. 플라즈마의 주요 대상 게놈 소재 (DNA) 이며 포자 부흥 시 플라즈마 유도 DNA 장애의 복구는 생물의 생존을 위해 중요 한. 여기, 우리는 포자의 발 아 능력을 연구 하 고 DNA의 역할 붙일 이라는 DNA 복구 단백질 (RecA) 시간 해결 공초점 형광 현미경 검사 법으로 추적 하 여 LPP와 치료 후 포자 발 아 및 파생물 복구 합니다. 치료 및 치료 포자 monolayers는 발 아에 대 한 활성화 개별 포자의 반응에 따라 시간이 지남에 거꾸로 confocal 라이브 셀 현미경으로 시각. 우리의 관측 공개 출 아 포자를 빨리 성장 하 고 일부 LPP 트리트먼트 120 s. RecA YFP (노란색 형광 단백질) 형광 몇 포자에만 감지 되 고 모두에 개발 되었다 후 최소에 도달의 기간에 따라 달라 집니다. LPP 취급 포자에 약간의 상승으로 빨리 성장 세포. 또한, 일부 식물 박테리아의 세포질에 있는 증가 보여주었다 LPP 취급 포자에서 파생 된 그리고 lyse 경향이. 개별 포자의 분석에 대 한 설명된 방법 포자 발 아 및 파생물의 다른 측면의 연구에 대 한 훌륭한 될 수 있습니다.
서문
우주 탐사의 주요 목표는 생명체와 다른 행성 몸과 우리의 태양계에 있는 달에 생체의 서명에 대 한 검색입니다. 미생물의 전송 또는 탐험의 중요 한 영역을 지구 근원의 생체 개발 및 생활 탐지 임무 화성과 유로 파1등 행성의 시체의 무결성을 영향을 미칠 특정 위험입니다. 여는 위원회의 공간 연구 (COSPAR) 1967 년에에서 설립, 행성 보호의 국제 지침 다른 행성, 그들의 위성, 소행성, 및 다른 천체를 유인 하 고 로봇 임무에 대 한 엄격한 규제를 부과 하 고 규제는 청소 및 살 균 지상파 미생물 오염 제거 하 고 천체2의 교차 오염을 방지 하기 위하여 발사 하는 우주선과 이전 중요 한 하드웨어 구성 요소. 지난 10 년간 비 열 플라즈마의 응용 spaceflight 응용 프로그램3,,45뿐만 아니라 생물 의학 및 영양 연구에 광범위 한 관심을 얻고 있다. 신속 하 고 효율적인 미생물 비활성화6을 민감한 부드러운 고 열 불안정 물질 동안 제공 플라즈마 살 균은 기존의 살 균 방법에 유망한 대안 이다. 플라즈마 방전 자유 래 디 칼, 입자, 중립/흥분 원자, 광자 자외선 (UV), 진공 자외선 (VUV) 스펙트럼에 있는 급속 한 미생물 비활성화3반응 요원의 혼합물을 포함 합니다. 이 연구에서 우리는 새 균의 subtilis endospores 유리 테스트 표면에 배포를 비활성화 하 이중 저압 유도 결합된 플라즈마 (DICP) 소스7,8 에 의해 생성 된 저압 플라즈마를 사용 합니다.
가족 Bacillaceae 의 그람 양성 박테리아는 토양, 퇴적 물, 및 클린 룸 시설 등 국제 우주 정거장9,10 비정상적인 환경에서 뿐만 아니라 공기의 자연 서식 지에 널리 배포 ,11. 속 균 의 가장 뚜렷한 특징은 영양소 고갈12등 불리 한 조건, 살아남기 위해 저항력 휴면 endospores (포자 라 함)을 형성 하는 기능 이다. 포자는 일반적으로 훨씬 더 다양 한 트리 트 먼 트 및 환경 스트레스, 열, 자외선, 감마 방사선, 건조, 기계적 장애, 및 강한 산화 제와 같은 독성 화학 물질을 포함 하 여 식물 세포 들 보다 저항 또는 pH 변화 에이전트 (참조13,14에서 검토) 되며 따라서 미생물 비활성화 방법의 효율성을 테스트 하기 위한 이상적인 개체. 때문에 genomic DNA는 박테리아15,16, 병 변의 플라즈마 유도 DNA 수리의 플라즈마 처리의 주요 목표 (예: DNA 이중 가닥 나누기) 포자에 부흥은 박테리아13의 생존을 위해 중요 한 17.
따라서, 우리 연구 포자의 발 아 용량 및 DNA 복구의 역할 포자 발 아 및 파생물 다음 개별 포자에 의해 낮은 압력 아르곤 플라즈마와 포자를 치료 후 하 고 형광 표시 DNA의 그들의 표현을 수리합니다 시간이 해결 공초점 형광 현미경 검사 법으로 단백질 RecA. 우리는 재현할 수 있는 테스트 결과, 저압 플라즈마 살 균에 대 한 포자 monolayers의 처리, 플라즈마 처리 포자에 대 한 준비를 달성 하기 위한 monolayers에 B. subtilis 포자의 준비의 단계 지시를 주고 ultrastructural 평가 모니터링 활성 DNA와 함께에서 개별 포자의 수준에서 스캐닝 전자 현미경 (SEM), 그리고 라이브 셀 현미경 분석을 사용 하 여 셀 내에 플라즈마 처리에 발생 하는 프로세스를 복구 합니다.
프로토콜
1. 새 균의 subtilis 포자 생산 및 정화
- 포자 생산에 대 한 각각의 5 mL 하룻밤 문화 전송 B. subtilis 스트레인, 적절 한 항생제, 200 mL (당 리터 16 g 영양 국물, KCl 2 g, 0.5 g MgSO 더블 강도 액체 쉐 퍼 포자 형성 매체를 보충 4* 7 H2O 2 mL 1 M Ca (3)2, 2 mL의 0.1 m M MnCl2 * • 4 H2O 2 mL 1 m m FeSO4, 2 mL 50% (w/v) 포도 당18) 72 h 또는 문화 > 95%까지 37 ° C에서 활발 한 통 기 통풍으로 육성 sporulated는. 다음 변종 포자 사용 됩니다: B. subtilis PY79 (야생 유형) B. subtilis PY79ΔrecA:: 네오 (DNA 수 선 단백질 RecA의 결핍) B. subtilis PY79 recA yfp:: 고양이 (RecA 융합 노란색 형광 단백질 [YFP]19).
- 50 mL 튜브에 3000 x g에서 15 분 동안 원심 분리 하 여 포자를 수확 하 고 반복된 세척 단계 (최대 15 시간) 단계 대조 현미경 검사 법에 의해 순도 및 발 아 상태에 대 한 멸 균 증류수 H2O와 검사를 사용 하 여 샘플을 정화. 포자 현 탁 액 단계 밝은 포자 (> 99%)으로 구성, 자유롭다 식물 세포 (막대), 세균된 포자 (검정 / 회색 외관)과 세포 파편, 그렇지 않으면 현미경 실험을 방해 수 있습니다 추가 확인 하십시오. 원하는 순도 도달할 때까지 샘플을 씻으십시오.
- 50 µ L 파운드 agar에 10 직렬 희석의 밖으로 도금 하 여 포자 titer 결정 (예: 사용 30 µ L 샘플 + 270 µ L 살 균 물 1시 10분 희석. 받아 270 µ L H2O 1: 100 희석에 대 한 특정 희석에서 30 µ L 등등) CFU (콜로 니 형성 단위)을 계산 하 고 37 ° C에서 접시를 밤새 품 어. CFU 결정 후 집중 또는 살 균 물으로 희석 하 여 mL 당 109 포자를 샘플을 조정 합니다.
2. 샘플 준비 졸 입금 새 균의 subtilis 포자의
참고: 축적 및 포자의 중첩 발생할 수 있습니다 처리 도중, 효과 그림자 궁극적으로 위조 된 비활성화 속도 론 인. 이 문제를 최소화 하기 위해에 어로 졸 증 착 기술은20여 포자 샘플을 준비 합니다. 간단히, 가압된 캐리어 가스 (여기서 N2)의 흐름으로 콘서트에 액체 처리량을 조절 하는 전기 타이머와 높은 정밀도 2 물질 노즐을 제어 합니다. 질소 가스 흐름을 사용 하 여 노즐 출구를 통해 주입 된 액체 샘플을 분산.
- (생존 활동)에 대 한 멸 균된 현미경 슬라이드 형태의 샘플 캐리어 또는 25 mm coverslips 라운드 (DNA 수리의 형광 추적 프로세스/cLSM; confocal 레이저 스캐닝 현미경 검사 법) 전자식으로 작동된에 어로 졸 분사 장치 내부 에 노즐 정렬. 사용 된 포자 농도에 해당 하는 데 필요한는 원하는 최종 농도의 백배.
- 포자 문화의 1 mL 노즐 액체 입구 전송과 0.1의 살포 과정 시작 1.3 바의 압력에서 s. 분무 포자 현 탁 액 (1 x 107) 균일 하 게 분산된 포자 단층을 형성 하는 초 이내 급속 하 게 말리는 현미경 슬라이드에 얇은 필름을 형성 합니다. 실 온에서 살 균 컨테이너에서 처리 샘플 캐리어를 저장 합니다.
3. 저압 플라즈마 처리
- 생물 학적 샘플의 처리를 위한 플라즈마 시스템을 준비 하 고 5에서 시스템을 작동 5 분 동안 500 W에서 아르곤 플라즈마와 Pa. 이것에 의해, 시스템의 모든 표면은 청소 하 고 예 열. 이 시스템을 배출 하는 동안 주위 공기, 질소, 산소, 그리고 물, 즉 분자의 고집을 감소 시킨다. 시스템의 전처리 후 챔버를 환기 하 고 유리 선반의 도움으로 원자로 용기의 센터에 샘플을 신중 하 게 배치 합니다.
- 적어도 3 개의 생물 복제를 사용 합니다. 챔버를 닫고 2 아래 철수 아빠 나중, 챔버로 공정 가스를 채우기. 5 시스템에 압력 조절 실바
- 정의 된 프로세스 시간 후 전력 및 가스 공급을 해제 하 고 신중 하 게 샘플 홀더에서 샘플을 부을 방지 하기 위해 시스템을 환기. 환기, 후 샘플을 제거 하 고 시스템에서 다음 매개 변수에 대 한 샘플을 배치 합니다. 플라즈마 치료 비 컨트롤 샘플만 진공을 노출에 대 한 (5 Pa) 응용된 플라즈마 긴 시간에 해당 공정 가스의 존재에.
4. 복구 및 포자 생존의 평가
- 압력가 10% 폴 리 비닐 아세테이트 (PVA)의 솔루션을 준비 하 고 신중 하 게 약 500 µ L로 샘플 캐리어 커버 그들이 4 h. 스트립에 대 한 공기 건조 소독 집게를 사용 하 여 (지금 포자 샘플을 포함 하는) 말린 PVA 레이어 및 2 mL에 전송 반응 관입니다. 튜브를 살 균 물의 1 mL를 추가 하 고 vortexing 통해 PVA 레이어 디졸브. 이 절차를 리드 > 포자의 95% 회복21그들의 발 아 능력는 영향을 미치지 않습니다.
- 직렬 (즉 270 µ L 살 균 H2O + 30 µ L 샘플/전 희석) 96 잘 접시에 메 마른 물에 1시 10분에서 샘플을 희석. 50 µ L 각 희석 Lysogeny 국물 영양 한 천 (파운드)에 밖으로 하십시오, 37 ° C에서 접시를 밤새 품 어 고 자란된 식민지 (CFU)의 수를 열거.
5. 라이브 셀 현미경 검사 법, 출 아 포자에서 DNA 복구 프로세스의 추적
- 발 아 실험에 대 한 준비는 1 m m 두께 1.5% 파운드-한 천 패드, 끓는 700 µ L 매체와 피펫으로 멸 균 현미경 페 트리 접시에 그것. 10 분 후는 8 m m x 8 m m x 1 m m 파운드-한 천 패드 살 균 메스를 잘라 하 고 신중 하 게 25 m m 유리 coverslips에 쉬고 있는 포자 monolayers 위에 agar를 전송.
참고:이 단계 개별 포자의 시각화에 대 한 중요 하 고 영양 한 천에 의해 유도 된 발 아의 활성화 쪽으로 그들의 반응에 따라 허용. 따라서, 파운드-한 두 가지 목적, relocalization 표면을 따라와 광학 초점을 방지, 표면에 포자를 해결 하기 위해 (1) 및 (2) 발 아에 대 한 포자 활성화를 제공 합니다. - Agar와 샘플, 취재 후 전송 유리 coverslip 빠르게 이미징 챔버 및 현미경으로 자동된 confocal 레이저 스캐닝 현미경으로 샘플 63 X를 사용 하 여 거꾸로 광학 / 1.3 apochromatic 비행기 기름 침수 목표.
-
이미징을 수행 형광 (YFP)는 여기의 514 nm의 방출 파장은 520 및 560 nm 사이 검출 될 수 있다.
- 스캔 모드 사진 배율 (전송 빛 경로) 중 하나를 사용 하 여 레코드 필드 밝은 이미지.
- 2.6%, 레이저 파워와 시간 경과 시리즈를 기록 하 고 5 공기 단위 및 30 초당 1 프레임의 샘플 주파수에서 confocal 조리개 설정 실험에 따라 5 h 0 h에서 s. 그것은 특정 참고 단색의 고용량 514에서 조명 레이저의 nm는 완전히 (그림 1A, B) 발 아를 억제.
- 전체 이미징 프로세스 동안 난방 단계에서 37 ° C (주변 공기 습도)에서 샘플 계속. 적어도 3 개의 생물 복제를 사용 하 여 각 조건에 대 한. 포자 집계, 다층된 포자 배포 또는 오염 먼지 입자에 의해 발생할 수 있습니다 ("그림자") 플라즈마 처리의 차단 및 (그림 1C, D) 숨겨진된 포자의 발 아를 활성화.
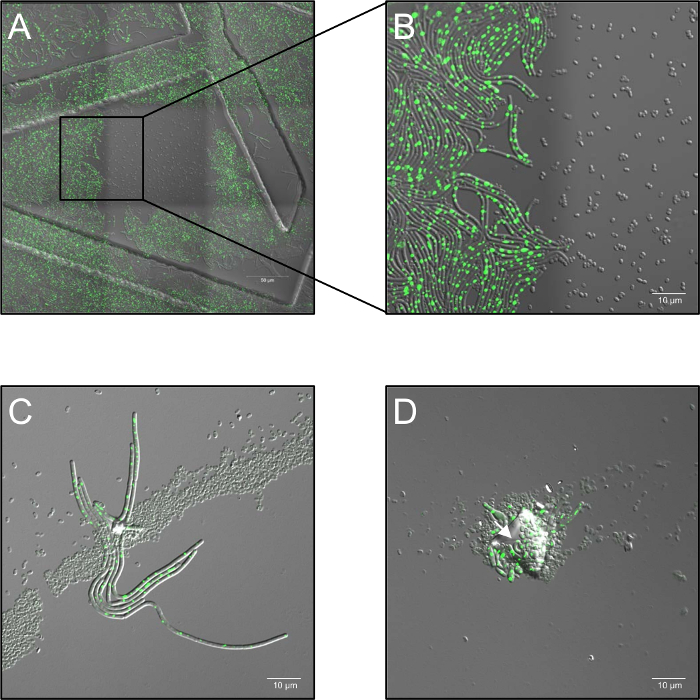
그림 1: 잠재적인 문제 confocal 살아있는 세포 형광 현미경 플라즈마 처리 포자의 동안 관찰. (A, B) 단색의 높은 복용량에 의해 발 아 포자의 억제 (514 nm) 레이저 조명. (A) B. subtilis (LAS72, RecA YFP)의 개요 (3 맞춘된 프레임 x 3) 발 아의 개시 후 180 분 포자. 중간에 프레임 (= 프레임) 주변의 지역 조명 하지 했다 반면 30 s 간격 (514 nm, 70% 레이저 전원), 레이저 빛의 높은 복용량에 노출 되었다 (밝은 분야 채널과 RecA YFP 형광;의 병합 된 이미지 구조 했다 주문 35 mm 이미징 찍힌된 500 µ m 그리드와 요리를 사용 하 여 발생 하는). (B) X 4를 보여줍니다 반면 포자, 단색 레이저 조명의 고용량에 노출 됐다 않았다 하지 발 아 하 고 성장, 보여주는 조명 및 조명 비 지역 사이 국경의 확대 보기에서 포자 비 조명 영역 완전히 밝은 RecA YFP 형광 (녹색 신호)를 표현 하는 무성 한 박테리아를 복구. (C, D) 입자 오염에 의해 덮여 포자 또는 포자 (화살표)의 여러 레이어 플라즈마 처리에 의해 비활성화에서 기본 포자를 보호 하 고 그들의 발 아 및 파생물 ("그림자 효과")를 허용 하는 것 같다. (C) 포자의 발 아 또는 (D)에 개시 후 60 s 한 군데 180 분 플라즈마 처리 했다 120 s 240 분 후 몇 군데와 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
6. 스캐닝 전자 현미경 (SEM)
- 스캐닝 전자 현미경을 사용 하 여 치료 컨트롤에 비해 플라즈마 처리 포자의 표면 형태에 대 한 ultrastructural 정보를 제공. 금-팔라듐과 coverslips에 말린된 포자 monolayers 코트 (3 nm) 스퍼터 coater를 사용 하 여. 이미징 샘플, 지형 대조를 계시 하는 렌즈에서 2 차 전자 검출기를 포함 하 여 5 kV 가속 전압에 운영에 대 한 필드-방출 스캐닝 전자 현미경을 사용 합니다.
7. 데이터 분석
- 여기서 N은 평균 치료 샘플의 CFU 고 N0 은 치료 진공 컨트롤의 CFU 평균 몫 N/N0에서 포자 생존을 결정 합니다. 시간 (초)의 기능으로 아르곤 플라즈마 처리에 의해 포자 비활성화를 플롯 합니다. 평균 및 표준 편차로 표현 하는 모든 데이터 (n = 3).
- 라이브 셀 이미징 이미징 소프트웨어를 사용 하 여 이미지를 분석 합니다. 포자 발 아의 비율 계량 및 플라즈마 처리 후 빨리 성장, 대표 프레임 4 h 후에 뿐만 아니라 실험의 시작 부분에 있는 포자. 포자 생존 분석 실험의 의미 결정에 대 한 사용 하 여 단방향 ANOVA 테스트 (분산 분석) 통계 소프트웨어와 함께). P 값 < 0.05로 통계적으로 유의 한 것으로 간주 됩니다.
결과
플라즈마 처리 B. subtilis 의 생존 포자
B. subtilis 포자의 플라즈마 처리 사용이 연구 보기 생존 감소 (그림 2) 플라즈마 처리의 내구 증가 함께. RecA표현 스트레인의 포자-YFP 융합 유전자 유전 수정 세균 활력에 더 큰 영향을에 나타내는 야생 유형 긴장의 포자와 비슷한 생존 곡선을 보여주?...
토론
낮은 온도 사용 하 여 표면 살 균, 저압 플라즈마는 이온화 방사선, 화학 치료 등 오히려 기존의 살 균 절차를 유망한 대안 (예: 가스 H2O2 와 같은 또는 에틸렌 산화물) 또는 건조 하 고 습 한 열23. 일반 살 균 방법을 주로 효과적인 살 균을 제공 하지만 그들은 치료 재료 영향 및 연산자에 대 한 잠재적인 위험을 나타내는 알려져 있습니다. 저압 플라즈마는 자...
공개
관심 없음 충돌 선언.
감사의 말
저자는 그녀의 도움을 비디오 촬영 하는 동안이 작업 및 Nikea J. 울 리 히의 부분 그녀의 우수한 기술 지원에 대 한 안드레아 슈뢰더를 감사합니다. 우리는 또한 새 균의 subtilis 긴장의 그의 관대 한 기부에 대 한 일 A. 시 몬스를 감사 하 고 싶습니다: LAS72 및 LAS24. 이 작품은 부분에서 교부 금에 의해에서 지원 독일 연구 재단 (DFG) Paketantrag (PlasmaDecon 박 728) PA (AW 7/3-1) 고 RM (모 2023/2-1)와 DLR DLR-FuW-프로젝트 ISS 생활, 프로그램 RF-FuW, Teilprogramm 475 (F.M.F, M.R. R.M.)를 부여 합니다. F.M.F. (6 년의 기간 동안 헬름홀츠 협회 (헬름홀츠 Gemeinschaft)에 의해 투자 되었다 쾰른, 독일, 독일 항공 우주 센터 (DLR)를에서 헬름홀츠 공간 생명 과학 연구 학교 (SpaceLife)의 박사 학위 장학금에 의해 지원 되었다 부여 번호 VH-KO-300) 항공 집행 위원회와 항공 우주 의학 연구소를 포함 하 여 DLR에서 추가 자금을 받았다. 이 연구의 결과 펠릭스 M. Fuchs의 박사 논문에 포함 될 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
참고문헌
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유