Method Article
큰 볼륨 내에서 특정 세포 목표를 찾아내기를 위한 직렬 섹션의 복합 계층적 이미징
요약
이 프로토콜 이미징 나노 해상도 스캐닝 전자 현미경 (SEM)을 사용 하 여 조직에서 특정 셀을 대상. 가벼운 현미경 목표를 식별 하 고는 SEM.에서 계층적 방식으로 다 수 생물학 물자 수 지 포함에서 직렬 섹션의 처음 몇 군데
초록
혼합된 셀 인구 또는 조직 내에서 ultrastructural 해상도에서 특정 셀을 대상으로 하는 것은 계층적 이미징 빛과 전자 현미경의 조합을 사용 하 여 얻을 수 있습니다. 수 지에 포함 된 샘플 배열 ultrathin 섹션의 수백의 리본 메뉴의 구성으로 구분 되며, 실리콘 웨이퍼 또는 導 코팅된 coverslips의 조각에. 어레이 낮은 해상도 fluorophores 후 스마트폰 카메라 또는 급속 한 큰 지역 개요에 대 한 가벼운 현미경 (LM) 또는 넓은 분야 형광 현미경 (형광 가벼운 현미경 검사 법 (FLM)) 같은 디지털 소비자를 사용 하 여 몇 군데. 중 금속으로 얼룩 후, 후 배열 스캐닝 전자 현미경 (SEM)에 몇 군데는. 대상 선택 FLM에 의해 생성 된 3 차원 복원 또는 아무 형광 마커를 사용할 수 있는 경우 중간 해상도 SEM 이미지 스택에서 만든 3D 개조에서 가능 하다. Ultrastructural 분석에 대 한 선택된 대상 마지막으로 고해상도에서 SEM에 기록 됩니다 (몇 나노미터 이미지 픽셀). 리본 처리 도구 어떤 ultramicrotome에 개조 될 수 있는 시연입니다. 그것은 배열 생산 및 단면 칼 보트에서 기판 제거와 함께 도움이 됩니다. Sem에서의 배열 자동된 이미징 허용 하는 소프트웨어 플랫폼을 설명 합니다. 직렬 블록-얼굴 SEM (SBF-SEM) 집중 된 이온 빔 SEM (거짓말-SEM) 등의 큰 볼륨 그들 데이터를 생성 하는 다른 방법에 비해이 방법은 두 가지 주요 이점이 있다: (1) 수 지에 포함 된 샘플은 보존, 이기는 하지만 썬 업 버전. 그것은 다른 방법으로 얼룩진 고 다른 해상도로 촬영 될 수 있습니다. (2)로 섹션 후 얼룩이 질 수 있다, sem의 이미징에 대 한 대비를 소개 하는 조직 블록 전도성 렌더링 중 금속으로 샘플 강하게 블록 스테인드를 사용 하 여 필요는 없습니다. 이것은 메서드를 사용 하면 다양 한 재료와 생물학 질문에 적용할 수 있습니다. 특히 사용된 자료 예를 들어, 생 은행 및 병 리 실험실에서 수 있습니다 직접 포함 되며 3d에서 재구성.
서문
조직 ultrastructural 해상도 큰 볼륨을 재구성을 위해 SEM에 따라 다른 이미징 방식의 번호 사용된1되었습니다: 포괄적인 리뷰는 사용할 수 있는 예., SBF SEM2, 거짓말-sem의3및 배열에 대 한 (에서)4의 tomography 후자의 방법 샘플 자료는 다양 한 기판에 직렬 섹션으로 유지 되지만, SBF SEM과 거짓말-sem의 파괴적인 방법이 있습니다, 샘플 블록에 노력 하 고 이미징 동안 그것을 사용. SEM에 수 지의 충전 때문에 그들은 또한 강력 하 게 금속된 샘플 블록5에 따라 다릅니다.
다른 한편으로, 특정 세포 또는 조직 샘플 내 관심의 구조 식별 특히 상호 빛과 전자 현미경 검사 법 (클레 멘 타인)6,,78에서 이익 수 있습니다. FLM을 사용 하 여 대상에 대 한 걸이 형광 신호9를 끄다 것 때문에 많은 양의 중 금속의 응용 프로그램을 하겠습니다. 이러한만 약간 금속된 샘플에 대 한에 배열 될 수 있습니다 쉽게 후 무거운 금속으로 얼룩진 LM 이미징 후 이후 선택 방법입니다. 또한, 샘플의 거의 모든 종류에서 사용할 수 있습니다, 그리고 심지어 일상적인 샘플의 병리학에서 보물 가슴10.
또 다른 큰 장점은 계층적11 또는 다중 해상도 이미지12에 대 한 잠재력은: 모든 고해상도 이미지를 필요는 없습니다, 목표는 다른 형식 (예를 들어, FLM) 또는 선택할 수 있습니다 저해상도 SEM 이미지입니다. 만 재미 있는 지역 조직 또는 세포 인구에서 고해상도의 이미징 디지털 데이터 저장 공간을 절약 하 고 쉽게 처리 하는 작은 이미지 데이터 세트를 생성. 여기, AT 워크플로 오히려 약하게 금속된 샘플을 사용 하 여 설명 된다: 식물의 뿌리 (애기 thaliana) 냉동 고압 친수성 수 지에 포함 된.
배열 준비, 스테인드, 그리고 FLM에 SEM, 몇 군데 고 이미지 스택을 등록 하는 방법을 설명 합니다. 또한, FLM 볼륨의 3D 개조를 사용 하 여 나노 해상도 sem 이미징에 대 한 특정 셀을 선택 하는 방법을 보여 줍니다.
프로토콜
참고: 샘플 블록 생산 해야 하 고 일부 중 금속을 포함. 고정 및 그림 1A-B 에 나와 있는 두 개의 샘플 되었습니다 프로토콜을 포함11곳에서 설명 합니다. 즉, 그림 1A 샘플 화학적으로 고정 되었다, 1% OsO4, 1 %uranyl 아세테이트와 다음 첫번째와 Spurr의 수 지에 포함 된 일괄적 스테인드. 샘플 그림 1B에서 고압 얼, 아세톤에 0.4 %uranyl 아세테이트와 대체 및 Lowicryl HM20 수 지에 포함 된 고정. 파우더 무료 장갑을 사용 하 여 다음 준비 단계.
1. 배열 만들기
- 샘플 블록의 조정
참고: 부품을 삽입 하는 경우에 항상 나사를 조입니다.- ultramicrotome의 샘플 홀더 샘플 블록 삽입, 홀더 트리밍 블록으로 놓고는 ultramicrotome의 낮은 단계에 그것을 슬라이드.
- 샘플 주위 수 지만 작은 테두리를 떠나 면도날으로 포함 된 조직 주위 멀리 수 지를 잘라. 대상에 도달할 때까지 위에서 트림.
참고: 블록-얼굴의 모양은 사다리꼴 또는 사각형 있을 수 있습니다 (우리는 성공적으로 두 도형을 사용). 사용 하는 사각형의 긴 측면 선행 및 후행 가장자리 넓은 지역 안정화 리본 접착제 혼합물에 의해 덮여 있다 중요 하다. - Ultramicrotome는의 팔에 샘플 홀더를 넣고 칼 소유자에 의해 더 낮은 단계에 있는 트리밍 블록을 대체 합니다. 칼 홀더에 다이아몬드 트림 나이프 (일반적으로 45 °)를 삽입 합니다. 블록-얼굴 트림 나이프에 지에 정확히 하 게 평행 하 게 정렬.
참고: 병렬 선도 (아래) 및 후행 (상단) 가장자리 정확 하 게 생산, 설정 하거나 반대편 트림만 칼을 이동 합니다. 큰 볼륨 (몇 백 섹션), 90 ° 트림 칼은 유리 하다. - 모든 4 개의 측을 부드럽게 한 다음 샘플 홀더를 회전 하는 선행 및 후행 가장자리는 지금 수평 위치에.
- 조심 스럽게 코트 접착제 혼합 블록의 선행 및 후행 측면. 이쑤시개13에 고정 하는 몇 가지 머리에서 형성 된 작은 브러쉬를 사용 합니다. 이 혼합물의 용 매 초 내 증발 하기 때문에이 단계를 신속 하 게 수행 합니다. 이 혼합물을 가진 블록 얼굴을 오염 하지 마십시오. 코팅된 샘플 블록 5-10 분 동안 건조 하자.
참고: 섹션의 큰 숫자에 대 한 (> 200), 그것은 수 있기 때문에 시간과 함께, 접착제의 돌출 후행 가장자리에 쌓아 잠재적으로 세워 다시 섹션은 나이프만, 첨단 코트 더 있을 수 있습니다.
- 기판의 준비
- 실리콘 웨이퍼의 조각 칼 보트 (대략 2 x 2.5 c m2 에 대 한 점보 칼)에 맞는 크기로 잘라. 필요한 경우 표시 (숫자 또는 문자) 웨이퍼 조각 또는 영구 마커를 청소 하기 전에 다이아몬드 선 침으로 청소 후. 소 프로 파 놀과 보풀 조직 수동으로 실리콘 웨이퍼를 청소.
참고: 상호 이미징 사용 인듐 주석 산화물 (ITO)-유리 coverslips 코팅. 그들은 매우 신중 하 게 처리 되어야 합니다 그리고 여분의 청소는 필요 하지 않습니다. - 이동식 접착제를 사용 하 여 캐리어 판의 한쪽 기판 수정.
참고: 또는, 기판 가장자리 수 있습니다 수 고정 접착 테이프의 2 개의 줄무늬를 사용 하 여 나이프에 평행 하 게 아래로. - 플라즈마 공기를 친수성 표면 기판 (글로우 방전)을 활성화 합니다. 이 한 방울의 물이 매우 얇은 필름 (낮은 접촉 각, 그림 2C, D) 기판 확산에 배치 하는 방식으로 이루어져야 합니다. Hydrophilization 매개 변수는 사용; 플라즈마 장치에 따라 달라 집니다. 여기에 사용 되는 매개 변수에 대 한 테이블의 자료를 참조 하십시오.
참고: 플라즈마 활성화 아주 휘발성 이다, 그래서이 기판 사용 직전 합니다. - 칼 배에서 기판의 최적의 습윤을 달성 하기 위해 나이프에 가까이 탑재 기판으로 기판 홀더의 클램프에 반송파를 삽입 합니다.
참고: 웨 커 외에 기판 홀더, 컴퓨터 지원 설계 (CAD) 드로잉을 포함 하 여에 대 한 자세한 설명이 제공 됩니다. 11
- 실리콘 웨이퍼의 조각 칼 보트 (대략 2 x 2.5 c m2 에 대 한 점보 칼)에 맞는 크기로 잘라. 필요한 경우 표시 (숫자 또는 문자) 웨이퍼 조각 또는 영구 마커를 청소 하기 전에 다이아몬드 선 침으로 청소 후. 소 프로 파 놀과 보풀 조직 수동으로 실리콘 웨이퍼를 청소.
- 단면화 준비
- 점보 다이아몬드 칼 칼 홀더에 삽입 클리어런스 각도 점보 나이프 (0 °), 설정 하 고 증류수와 칼 배를 채우기. 샘플을 1-2 밀리미터의 거리에 접근 칼.
- 기판의 기판 홀더 나사 1-3 (그림 2A)를 사용 하 여 물에 낮은. 홀수 선의 기판의 상단 세번째에 있는 확인 하십시오.
참고: 기판 및 캐리어 플레이트 사이의 접착제 깨끗 한 집게와 기판 이끌어 여 치료 잘 확인 하십시오. 그것은 안 이동 해야 합니다. - 실리콘 웨이퍼를 사용 하 여 여유 공간을 볼 수 어렵다 때문에 낮은 기판 당신이 그것을 느낄 때까지 바닥을 터치. 이제 기판 작은 금액 인상. 기판도 캐리어 절단 하면서 칼 보트를만 지 다는 것을 확인 하십시오.
- 보트의 수 위를 조정 하는 주사기 또는 피 펫을 사용 합니다. 쌍안경을 통해 보면서 추가 또는 물 수 면의 전체 영역 표시는 ultramicrotome의 최고 밝은 조명의 균일 반영 될 때까지 제거.
- ultramicrotome의 하단 빛에 전환 합니다. 팔 중간 위치에 및 철회는 ultramicrotome의 손으로 바퀴를 사용 하 여 안에 있는지 확인 합니다. 접근 나이프는 나이프의 반사까지 샘플 블록 얼굴에 표시 됩니다.
- 샘플 칼을 정렬 하는 ultramicrotome의 조정 옵션을 사용 합니다. 먼저 칼, 회전 하 고 회전 하 고 샘플을 기울기.
샘플 및 칼의 차이에서 볼 수 있는 가벼운 줄무늬 병렬 모서리 (똑바로 평행선과 하지 쐐기 모양)으로 표시 하는 경우 참고: 그것은 제대로 정렬 됩니다. - 샘플의 경사를 확인: 가벼운 줄무늬 두꺼운 되지 않습니다 있는지 확인 하십시오 또는 샘플을 위와 아래로 이동 하면서 얇은. 필요한 경우, 호 조정 나사를 사용 하 여이 문제를 해결. 블록-얼굴 보다 큰 (하지만 그것을 만지지 않는다) 때까지 샘플을 가까이 칼을 이동 합니다.
- 섹션 두께 (피드), 절단 속도 절단 창 제어 장치에 설정 합니다.
- 단면을 시작 합니다. 필요한 경우 첫 번째 전체 섹션은 절단 되 고 때까지 기다립니다. 일부 섹션 컷 확실 하는 그들은 함께 스틱 형태 리본 (그렇지 않으면 접착제 다시 적용 될 수 있다). 높은 피드 값 시작 (최대 200 nm 울트라 칼에 대 한) 첫 번째 전체 섹션은 절단 되 고 때까지. 그런 다음, 원하는 피드 값을 설정 합니다. 적절 한 리본 안정성, 100의 섹션 두께 1 mm/s의 절삭 속도 및 좋은 시작 지점입니다. 가장 낮은 달성 섹션 두께 약 60 nm, 샘플 품질에 따라.
- 단면을 중지 합니다. 나이프에서 모든 불필요 한 (부분적으로 잘라) 섹션을 제거 하 고는 속눈썹/고양이 머리를 사용 하 여 보트. 작은 파편의 많은 경우, 주위에 떠 있는 한 피 펫으로 완전히 물 제거 하 고 신선한 물으로 배를 채우기. 지금 과정은 첫 번째 생산 리본에 대 한 준비.
- 단면
- 단면을 시작 합니다. (실제 수는 섹션 및 기판의 크기에 따라 달라 집니다) 섹션의 수를 삭감 했다, 일단 단면 프로세스를 중지 하 고 속눈썹14 또는 더 나은 아직 나이프에 부드럽게 쓰 다듬어는 나이프에서 리본을 분리 한 매우 고양이 모피에서 부드러운 머리입니다.
- 조작 (밀어넣기/끌어오기) 기판으로 속눈썹과 리본 기판에 첫 번째 섹션을 연결 하는 고.
참고: 그것은 기판의 마른 부분에 스틱까지 리본을 부드럽게 밀어 필요가 있다. - 계속 단면 기판에 리본을 부착 합니다. 1 개의 측에 시작 하 고 점차 이상 각 새로운 리본 메뉴에 다른 이동.
참고: 이미 연결 된 리본을 풀면 피하기 위해 거 대 한 물의 움직임을 피하십시오. 같은 공기 흐름에 대 한 사실 이다. 사용 하 여 호흡 방패는 ultramicrotome 제공. 불리 한 환경 조건에서는 ultramicrotome 대 한 인클로저에15를좋습니다. - 기판 리본으로 완전히 덮여 때 (일반적으로 4-5 리본은 가능), 부드럽게 리프트-에서 밖으로 기판 기판 홀더의 micromanipulator 나사를 사용 하 여 칼 보트.
참고: 적절 한 움직임은: 수직으로 들어올려 (나사 1) 및 (나사 3), 밖으로 회전/기울기 또는 둘 다의 조합. - 리본 배열 먼지 없는 환경에서 그것을 저장 하기 전에 건조 보자. 건조 후, 제거 접착제 탑재 기판 시일 캐리어에서 (같은 날, 그렇지 않으면 기판 제거 너무 어려울 수도 있습니다 또는 법규나 동안 휴식 있습니다) 합니다.
2. LM 이미징 얼룩
참고: 다른 얼룩/라벨 메서드는 가능, 면역 형광 검사 프로토콜을 포함 하 여. 여기 직접, 오히려 불특정 얼룩 세포 벽을 대략적으로 선택 됩니다.
-
Propidium 요오드 화물 얼룩
- 대형 유리 parafilm으로 페 트리 접시 (직경 30 cm)의 바닥을 커버 하 고 습 한 챔버 구축 젖은 티슈로 접시의 가장자리 라인.
- 솔루션 coverslip 당 약 300-500 µ L을 사용 합니다. parafilm에 각 coverslip에 대 한 한 방울을 놓고 넣어 유리 거꾸로 드롭, 섹션 얼룩 액체 접촉 되도록 합니다. 접시를 커버 하 고 빛 으로부터 샘플을 보호 하기 위해 알루미늄 호 일 포장. 16 h 4 ° c.에 대 한 샘플을 품 어
- 집게와는 coverslip를 제거 하 고 증류수의 80 mL 가득 100 mL 비 커에 그것 위로, 아래로 이동 하 여 그것을 씻어. 신선한 물으로 다른 비 커에이 단계를 반복 합니다. 압축 공기와 함께 신중 하 게 coverslip 건조.
3.는 FLM에서 이미지 스택에 기록
- 일반적인 넓은 필드 FLM의 무대에 coverslip 장소.
- 형광 관찰에 대 한 적절 한 필터 세트 (재료의 테이블)을 선택 합니다.
- 각 섹션에는 적합 한 렌즈, 걸릴 개체의 이미지: 시야를 방향을 일정 하 게 유지 하려고. 루트 팁 40 X 공기 목표 사용 되었습니다.
참고: 만약 리본 완벽 하 게 똑바로 하지 않습니다, 회전 무대 이미지를 복용 하는 동안 섹션 reorient 도울 수 있다. 만약에 가능 하다 면, 이미지 중앙에 특정 기능 또는 기록된 이미지의 가장자리에 같은 거리에 있는 섹션의 가장자리 등 기능을 유지. - 만약에 가능 하다 면, 16 비트를 사용 하 여 포화 픽셀을 제한 하 여 노출 시간 일정 하 게 유지.
4입니다. 등록 FLM 이미지 스택
- 가상 스택으로 피지16 로 이미지 시리즈를 가져옵니다.
- 파일 메뉴에서 새로운 TrakEM17 (빈)를 엽니다.
- 이미지 필드를 마우스 오른쪽 단추로 클릭 하 고 "레이어 당 한 조각"으로 TrakEM의 스택을 가져올.
- 레이어 (오른쪽 클릭으로 이미지 필드) 정렬, 범위를 설정 (첫 번째 마지막 이미지), 참조로 없음을 선택 하십시오. 모든 설정에 대 한 기본 값을 사용 하 고 원하는 변환으로 엄밀한 선택 합니다.
- 등록 완료 하 고 만족 스러운 때 저장 하 여 정렬 된 데이터 집합 마우스 오른쪽 단추로 클릭 하 고 내보내기를 선택 합니다. 플랫 이미지 마지막 이미지에서 첫 번째 범위를 설정 하 고 결과 스택 표시 하는 소프트웨어를 하자. Tif 형식으로 스택에 저장 합니다.
5. 얼룩이 지 고 SEM 이미지 장착
주: 얼룩 솔루션 준비 테이블의 자료를 참조 하십시오. 솔루션을 저장할 수 있습니다 4 ° C에서 최대 12 개월까지 빛과 공기 로부터 보호.
주의: 리드 시트르산과 uranyl 아세테이트 독성이 있는 중 금속을 포함. 장갑을 착용 하 고 지방 자치 단체의 지시에 따라 폐기물 처리.
- 대형 유리 parafilm으로 페 트리 접시 (직경 30 cm)의 바닥을 커버 하 고 습 한 챔버 구축 젖은 티슈로 접시의 가장자리 라인.
참고: NaOH의 여러 알갱이 리드 시트르산의 과도 한 강 수를 방지 하기 위해 얼룩 방울 근처 페 트리 접시 내 위치는 중요 하다. -
Uranyl 아세테이트 얼룩
- 2680 x g에서 uranyl 아세테이트 솔루션 앙금 작은 입자를 몇 초 동안 원심.
- 솔루션 coverslip 당 약 300-500 µ L을 사용 합니다. parafilm에 각 coverslip에 대 한 한 방울을 놓고 넣어 유리 거꾸로 드롭, 섹션 얼룩 액체 접촉 되도록 합니다.
- 실 온에서 10 분 동안 incubate와 얼룩 동안 접시를 다룹니다.
- 집게와 비 커에 그것을 아래로 이동 하 여 세척 coverslip 가득 제거 증류수 (단계 2.1.3 참조).
-
시트르산 얼룩 리드
- Uranyl 아세테이트 인큐베이션 기간 동안 리드 시트르산 솔루션을 준비 합니다.
참고: 리드 시트르산 항상 즉시 어떤 침전 제거 하려면 사용 하기 전에 필터링 해야 합니다. 또한 단계 5.2.1에서 몇 초 동안 2680 x g에서 리드 시트르산 용액을 원심. - 솔루션 coverslip 당 약 300-500 µ L을 사용 합니다. 각 coverslip에 대 한 한 방울에는 parafilm uranyl 아세테이트 얼룩 후에 coverslips를 세척 하기 전에 즉시 놓고 섹션 얼룩 액체와 접촉 하는 드롭에 유리를 거꾸로 넣어. Uranyl 아세테이트 얼룩 후에 coverslips를 세척 하기 전에 즉시는 parafilm에 방울 (300-500 µ L)를 놓습니다.
참고: 침전의 형성을 방지 하려면 마십시오 하지 호흡 리드 시트르산 방울에. - 거꾸로 드롭에 씻어 coverslip 장소 (저기 건조 필요 없다).
- 실 온에서 5 분 동안 incubate 그리고 얼룩이 지는 동안 접시를 커버.
- 집게와는 coverslip를 제거 하 고 신선한 물 (단계 5.2.4) 비 커에 위에서 설명한 대로 그것을 씻어.
- Uranyl 아세테이트 인큐베이션 기간 동안 리드 시트르산 솔루션을 준비 합니다.
- 압축 공기와 함께 신중 하 게 coverslip 건조.
-
Sem의 이미징에 대 한 샘플 장착
- 스티커 카본 패드와 알루미늄 명세서에 실리콘 웨이퍼를 탑재 합니다.
참고: 이토 코팅 coverslips 수 있습니다 하거나 장착할 실버 페인트 및 Cu-테이프를 사용 하 여-전도성 표면에 스텁 연결 되어 있는지 확인-또는 위와 같이 탄소 패드와 함께. 이 경우, 스텁 하 이토-표면에서 전도성 연결 은색 페인트 방울과 함께 할 수 있다.
- 스티커 카본 패드와 알루미늄 명세서에 실리콘 웨이퍼를 탑재 합니다.
6. 계층적 sem 이미지
참고: 필드 방출 SEM에서에서 선택 낮은 기본 에너지 (3 kV 또는 낮은), 빔 보조 또는 다시 흩어져 전자의 효율적인 수집을 위해 800 pA, 충전을 방지 하 고 적당 한 작업 거리 50에서 범위에 있는 현재. 빔 전류 선택 샘플 속성에 따라 달라 집니다 (예., 수 지 포함); 또한 전자 복용량 절충 한 작은 전류 (샘플에 덜 유해한) 그리고 높은 전류, 속도 이미징에 대 한 유익 하 고 따라서 총 이미지 수집 시간을 낮춘 다는 것입니다. 다시 흩어져 전자 전용된 탐지기 좋은 대조를 제공 하 고 샘플의 충전에 덜 민감한 적게 샘플의 표면 유물 (주름, 칼 자국)의 표시. 밝기 및 대비는 히스토그램을 중심으로 조정 되어야 한다.
-
SEM 이미지
- 먼저 100 x에 대 한 낮은 확대율에서 각 코너의 이미지를 잡아 하 여 배열의 네 모퉁이 정의 합니다. 관심 (ROI) 전체 배열을 바깥쪽 영역을 만듭니다. 다음 매개 변수는 이미징 프로토콜 지정: 큰 이미지 픽셀 크기를 (예를 들어 1000 nm), 및 짧은 유지 시간 (예를 들어, 0.2 µ s)에서 고속 이미징에 대 한 수 있는 이차 전자 (SE) 검출기를 사용 하 여.
참고:는 큰 스캔 시야 (FOV)는 이미지의 주변에 왜곡 될 수 있습니다에서 전자 광학 제한을 극복 하기 위해 전용된 낮은 확대 모드 (대부분 sem의 제조 업체에 의해 제공) 사용 매체, 1 2 k 검색 필드를 사용 하거나 단일 이미지입니다. - 첫 번째 섹션에는 조직 개요 투자 수익을 생성 하 여 설정 섹션을 생성 합니다. 도장 도구를 사용 하 여 모든 후속 섹션을 복제. 회전 ROIs 구부러진된 리본을 수용 하는 데 필요한 때.
- 중간 픽셀 크기를 사용 하 여 이미지 시리즈 기록 (약 50 nm)와 면만 식별 대상 구조를 인식 하 고 충분히 긴 시간. FOV를 사용 하 여 단일 이미지 6-10 k 픽셀의 범위에 대 한.
참고: 아틀라스 5 소프트웨어 자동으로 직렬 섹션에 걸쳐 큰 투자 수익/섹션 영역을 커버 하는 인접 한 이미지의 구성 하는 모자이크를 수집할 수 있습니다. - 높은 해상도 sem의 이미징에 대 한 대상 구조를가지고 있는이 섹션 집합 내에서 설정 하는 사이트를 만듭니다. 단계 정밀에 대 한 계정에 충분히 큰 투자 수익을 확인 합니다. 확인 하 고 사이트의 위치를 조정 합니다.
참고: 그것은 어디 자동 초점 및 autostigmation 수행 센터 구조 세부, 예를 들어"빈" 소재에 앉아 있지 않습니다 이러한 방식으로 ROIs를 배치 하는 것이 중요., 그들. - 자동 초점 설정을 정의 하 고 적어도 성능을 조사해 리본 (즉, 무대는 여행 긴 거리)의 길이 몇 군데 있을 것입니다 사이트에 가까운 작은 수익에.
- 고해상도 sem의 수집에 대 한 영상 프로토콜을 정의 합니다. 보고 막 구획, 3-5 nm 이미지 픽셀 크기를 선택 하십시오. 이미지는 너무 시끄러운 따라 검출기의 유지 시간을 선택 합니다.
- 인수를 시작 하기 전에 적어도 검사 프로토콜 옵션을 사용 하 여 각 리본 메뉴의 첫 번째 섹션에 초점 값을 정의 합니다.
- 대상 ROIs의 전체 시리즈를 통해 자동화 된 SEM 이미지를 시작 합니다.
- 이미지 시리즈, 선호 tif 형식으로 수집 된 데이터를 내보냅니다.
- 먼저 100 x에 대 한 낮은 확대율에서 각 코너의 이미지를 잡아 하 여 배열의 네 모퉁이 정의 합니다. 관심 (ROI) 전체 배열을 바깥쪽 영역을 만듭니다. 다음 매개 변수는 이미징 프로토콜 지정: 큰 이미지 픽셀 크기를 (예를 들어 1000 nm), 및 짧은 유지 시간 (예를 들어, 0.2 µ s)에서 고속 이미징에 대 한 수 있는 이차 전자 (SE) 검출기를 사용 하 여.
7입니다. 등록의 SEM 이미지 스택
- 가상 스택으로 피지로 이미지 시리즈를 가져옵니다.
참고:이 섹션의 수와 투자 수익의 크기에 따라 몇 기가바이트의 범위에 큰 데이터 파일을 있을 것입니다. - SEM 이미지 추가 가능, 관심의 구조에 가까운 지역에 처리를 위해 스택 및 밝기 및 대비 조절 자르기.
- 파일 메뉴에서 새로운 TrakEM17 (빈)를 엽니다.
- 이미지 필드를 마우스 오른쪽 단추로 클릭 하 고 "레이어 당 한 조각"으로 TrakEM의 스택을 가져올.
- 정렬 레이어 (오른쪽 클릭으로 이미지 필드), 최소 자승법 모드 선택, 범위를 설정 (첫 번째 마지막 이미지), 참조로 없음을 선택 하십시오. 설정에 대 한 기본 값을 사용 하 고 원하는 변환으로 엄밀한 선택 합니다.
- 등록 완료 하 고 만족 스러운 때 저장 하 여 정렬 된 데이터 집합 마우스 오른쪽 단추로 클릭 하 고 내보내기를 선택 합니다. 플랫 이미지를 만드는 마지막 이미지를 처음부터 범위를 설정 하 고 결과 스택 표시 하는 소프트웨어를 하자. Tif 형식으로 스택에 저장 합니다.
결과
워크플로 수 지 블록에 포함 된 샘플 (그림 1) 시작을 여기 설명 합니다. 샘플 준비 하는 동안 일부 중 금속은 조직에 도입 되어야 하지만 그것은 오히려 강한 금속에 대 한 최적화 된 프로토콜을 사용 하 여 필요가 없습니다. 그림 1A (유채과 야채) 블록-스테인드 통상 1% OsO4 와 1 %uranyl 아세테이트, 그림 1B 에서 애기 루트는 약하게만 메탈 0.5 %uranyl 아세테이트를 사용 하 여 식물 뿌리를 보여 줍니다. 형광 담금질 하는 경향이 일부 중 금속 후자 샘플 유형 상호 접근에 대 한 가장 적합 하다. 몇 백 섹션의 배열 수 있는 전용된 기판 홀더 (그림 2)와 (그림 1C)을 생산. 형광 라벨 후 같은 배열 표준 넓은 필드 FLM (그림 1D)에 몇 군데 다음 헤비 메탈 솔루션 스테인드 되며 다른 해상도 (그림 1E-G) SEM에 몇 군데.
배열, 재현할 수 세대에 대 한 중요 한 도구는 기판에 톰의 칼 보트에서 여러 리본을 배치 하는 경우에 특히는 기판 홀더 (그림 2A, 저자의 연구실에 맞춤형)와 점보 다이아몬드 현미경 슬라이드 (그림 2B)에 맞게 충분히 큰 보트 칼. 리본의 좋은 관측 수 평면 초승달 모양 필요 하 고 플라즈마 기판의 청소에 의해 달성 될 수 있다: 증류수의 작은 물방울 그림 2C (치료 기판)에서 기판에 렌즈 모양의 구조를 형성 한다 박막 (그림 2D, 플라즈마 활성화 기판) 하지만. 이러한 조건 하에서 ITO 코팅 coverslip의 마른 부분에 부착 된 리본은 쉽게 시각화 (그림 2E)와 관찰 하 고 수 물에서 기판의 리프트 아웃 동안 제어.
예를 들어, 배열 propidium 요오드 화물 식물 세포 벽을 물 들일 표준 넓은 필드 FLM (그림 3A)와 몇 군데 있었다. 이후 섹션은 100 nm 두께, 심지어 과도 같이 얼룩 약간 모호 하 게 소개. 등록 후, 완전히 복원 된 볼륨에 포함 된 두 개의 셀 3d에서 고해상도 이미징 이미지 스택 (그림 3B)에서 선정 되었다 (참고 추가 영화 S1). 추가 uranyl 아세테이트 및 리드 시트르산과 얼룩, 다음 배열 몇 군데는 SEM. 개요, 60 nm 이미지 픽셀; 기록 표시 그림 3 C 이미지의 중앙에 어두운 광장 어디 자동 초점 기능, 실행 하 고 추가 복용량 약간의 오염에 지도 위치를 나타냅니다. ROIs 그 직렬 섹션 (조각 51 248 435 조각의 총에서)에 적합 한 5 nm 이미지 픽셀 크기 다음 기록 된 FLM 스택에서 선택한 두 개의 대상 셀을 포함 하 (그림 3D; 보충 영화 S2참고).
여기에 설명 된 sem에서 배열의 자동화 된 계층적 이미징 소프트웨어/하드웨어 플랫폼 솔루션 ZEISS 아틀라스 5로 이루어졌다. 전체 배열에 대 한 개요와 SE 검출기를 사용 하 여 만들어진 첫째, 매우 큰 (1000 nm) 이미지 픽셀 및 매우 낮은 유지 시간 (그림 4A). ROI만 조직 개요 첫 번째 섹션에 배치 하 고 배열의 다른 모든 섹션에 전파 했다. 이 섹션 세트 60 nm 이미지 픽셀 (그림 4B) 긴 망설임 시간을 사용 하 여 다음 기록 했다. 마지막으로, 두 대상 셀에 1을 더한 단계 부정확, 담당 하는 세포를 둘러싼의 "레이어"를 포함 하는 사이트 집합 다음 매개 변수를 설정 했다: ESB (에너지 선택적 후방 산란) 검출기, 5 nm 이미지 픽셀, 아주 긴 (40 µs) 면만 시간 ( 그림 4C). 이러한 이미지를 확대 subcellular 세부 사항 (그림 4D) 그들 (V), 미토 콘 드리 아 (M), 핵 (N), 및 바인딩과 그물 (화살표) 등을 보여 줍니다. 또한 하나의 목표 셀의 subcellular 세부 사항에 전체 배열에 대 한 개요에서 확대에 대 한 보충 영화 s 3 을 참조 하십시오.
여기 (200 섹션)에 표시 된 배열 플러스 추가 250 섹션 중 약 8 h 생산 했다, LM, 그리고 언젠가 FLM에 (수동으로) 기록에 대 한 얼룩 한 밤. 후 얼룩 개별 배열 수에 따라 총에서 약 1-2 시간 걸립니다. Sem의 녹음에 대 한 몇 시간 아틀라스 실행 설정 및 자동된 녹음은 3-4 h 중간 해상도 (60 nm 픽셀 크기) 섹션 세트 (200 섹션, 450 x 200 µ m2) 및 고해상도 (5 nm 픽셀 크기)에 대 한 약 5 일 투자 수익 (200 섹션, 55 x 30 µ m2) 두 개의 대상 셀을 포함 하. Note는 여기에 표시 된 샘플의 낮은 금속 내용으로 인해 매우 느린 검색 속도 고해상도 투자 수익에 대 한 40 µs의 드웰 타임 (현재 사용할 수 있는 탐지기)에 대 한 암시는 좋은 신호 대 잡음 검출을 도달 하는 데 사용할 했다.
일부의 단계에서 전체 워크플로 경향이 함정: 이상적으로 리본 더 많거나 적은 직선과 (그림 5A) 올바른 순서로 배치 해야. 그러나, 구부러진 (그림 5B), 곡선된 (그림 5D), 또는 심지어 깨진된 리본 종종 생산 됩니다. 이 비대칭 또는 unevenly 침투 샘플에서 뿐만 아니라 잘못 된 트리밍 (선도 및 정확 하 게 병렬), 또는 비-균일 하 게 적용된 접착제, 발생할 수 있습니다. 특히 성가신 샘플은 부드럽고 매우 하드 구성 요소가 포함 된. 후자의 구성 요소 (그림 5C) 여기에 표시 된 식물 뿌리의 세포 벽과 같은 침투 하기 어려울 수 있습니다. 이 경우, 주름 (화살촉) 가변 압축 및 단면 동안 휴식에 의해 쉽게 발생할 수 있습니다. 대 한 sem에서 이미지, 자동 곡선된 리본 되지 않습니다 큰 문제 이후는 ROIs 리본의 곡률에 맞게 회전 될 수 있습니다.
프로토콜에서 다른 중요 한 단계 얼룩: 부적절 한 세척 잔류물 (그림 5E, F), 섹션에서 발생할 수 있고 최악의 경우 ( 그림 5 층에 두 개의 대상 셀 중 하나에 원) 가장 흥미로운 영역을 커버. 또한, 먼지 (그림 5D, 강하게 산란 입자) 더러운 기판 캐리어와 함께 칼 보트, 예를 들면에 소개는 심각한 문제가 발생할 수 있습니다: FLM, 먼지는 높은 형광 수 (cf. 보충 영화에에서 몇 조각 S1) 일부 등록 알고리즘 작동 하지 않습니다에 같은 정도. 그러나, TrakEM17 에 "정렬" 기능 추가 영화 s 1에서 같이 이러한 스택을 처리할 수 있습니다.
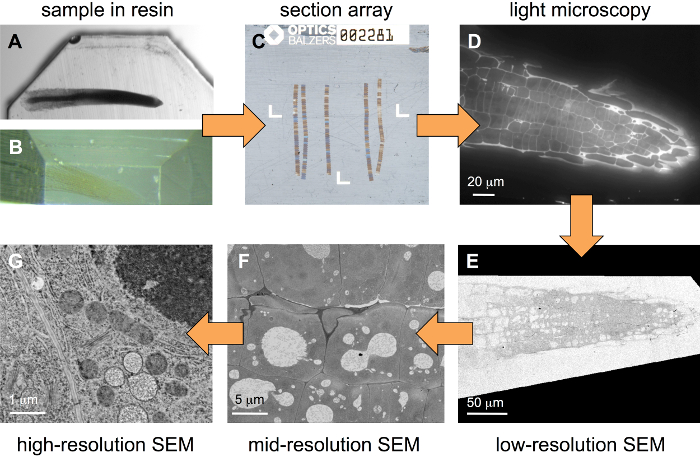
그림 1: 워크플로 상호 계층적 이미징. 수 지 블록 (A, 강력 하 게 증 착된 샘플)에 포함 된 샘플에서 시작, 샘플 첫 손질된 (B, 약하게 금속된 샘플) 이며 다음 배열 직렬 섹션 (C)의 여러 개의 리본으로 구성 된, 여기에 배치 된 ITO 코팅 coverslip ultramicrotome는을 사용 하 여 생산 됩니다. 형광 염료와 염색, 후 이미지의 넓은 필드 FLM (D)에 기록 됩니다. 소금 추가 라운드 중 금속 얼룩 후 스택은 몇 군데 SEM (E-G)에서 다른 해상도 (이미지 픽셀 크기). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 배열의 준비 도구. 표준 ultramicrotome (A)에 연결 하는 움직임의 7 축 micromanipulators에서 조립 하는 기판 홀더: 나사, 동그라미, 강조는 (1) 수직 및 수평 운동 (2) 및 (3) 기판 캐리어의 기울이기 . 여기 슬라이드 크기의 알루미늄 캐리어 (B)에 장착 된 플라즈마 활성화 실리콘 웨이퍼의 조각으로 대형 기판 (화살표)를 맞게 특대 보트 점보 다이아몬드 칼. 20 µ L 방울 증류수 치료 실리콘 웨이퍼 기판 (C) 또는 플라즈마 활성화 기판 (D)에 배치. 4 리본 칼 보트에 떠 있는 그들의 낮은 끝에 의해 이토 코팅 coverslip에 연결 된. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
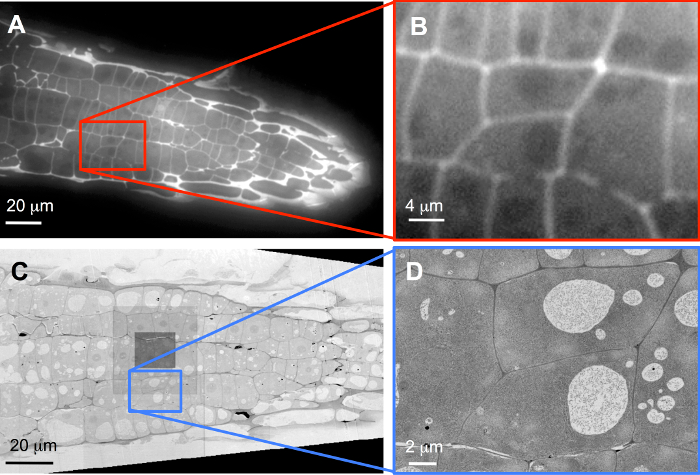
그림 3: LM 데이터와 sem의 데이터의 상관 관계. FLM (A, B)와 (A, C) 개요 및 대상 셀 (B, D) 기록 및 SEM (C, D). (B) 소프트웨어 줌 이며 원래 데이터 기록 했다 1,388 x 1040 화소 카메라 칩에 40 X 객관적 렌즈와 60 nm 이미지 픽셀 크기, 및 (D) (C)는 기록 하는 동안 5 nm 이미지 픽셀 크기를 보여주는 진정한 해상도 SEM.에 있는 증가 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 계층적 ZEISS 아틀라스 5 제공을 사용 하 여 sem에서 이미지 배열 개요 1000 nm 이미지 픽셀 SE 검출기 (A)를 사용 하 여 기록. 섹션은 모든 섹션에서 조직에 배치 하 고 60 nm 이미지 픽셀 (B) 기록 수익 설정 합니다. 사이트 설정 직렬 수익 대상 셀에 배치 하 고 5 nm 이미지 픽셀 (C)와 함께 기록 합니다. (D) 같은 고해상도 이미지로 확대, 그들 (V), 핵 (N), 미토 콘 드리 아 (M), 및 바인딩과 그물 (화살표) 같은 세포내 막 구획 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
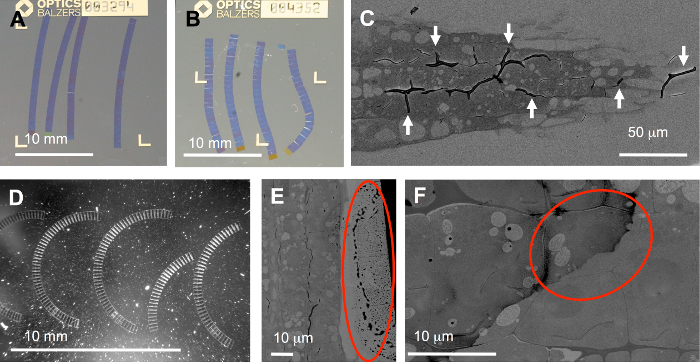
그림 5: 전형적인 문제. 1. 단면 과정에서 발생 하는: 구부러진 (B) 또는 곡선된 리본 (D), 또는 심지어 주름 (C) 리본 이토 코팅 coverslips 이상적으로 직선 (A), 하지만 불규칙 압축 단면 중에 발생할 수 있습니다. 2. 단면 및 얼룩 동안 기판 및 물, 예를 들면에 리본 처리로 인 한: 빛 입자를 기판 (D)에 뿌리고, 섹션 e에서(원), 또는 먼지에 물방울의 가장자리 조직 부족 때문에 밖으로 얼룩져 (F) 얼룩 후 세척. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
보충 영화 S1: FLM 이미지 스택. 435 이미지 피지16 TrakEM17 를 사용 하 여 정렬 하 고 동영상 파일 (.avi)로 저장 됩니다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보충 영화 S2: SEM 이미지 스택. 210 이미지 피지16 TrakEM17를 사용 하 여 정렬. 이 데이터 집합의 원래 스택 (300 이미지) 15 기가바이트 했다. 3.3 GB에서 스택 (정렬 하 고 두 셀을 대상만을 자르기) 후 소형화, 그것은 x에 확장 했다 y 0.2의 요인에 의해 피지를 사용 하 여 및 다음.avi 동영상으로 저장. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
보충 영화 S3:는 SEM.에서 다른 해상도 수준으로 확대 영화에서 만들어지고.mp4 형식에서 아틀라스 5 소프트웨어에서 내보낸. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
대상 멀티 모달 계층에 의해 조직 내에서 특정 셀에 대 한 워크플로 시연 했다: 수 지에 포함 된 샘플 사용자 정의 설계 기판 소유자를 사용 하 여 전도성 기판에 배치 되는 직렬 섹션의 배열로 나누기입니다. fluorophore로 후는 FLM에서 이미징, 재건된 볼륨 대상 셀을 선택 하는 데 사용 됩니다. 후 추가 얼룩 대비 소개 중 금속 라운드, 이러한 목표는 SEM는 자동화 된 소프트웨어 플랫폼을 사용 하 여 나노 스케일 해상도에서 몇 백 섹션에 몇 군데는.
생산 몇 가지 긴 리본을 조밀 하 게 포장된 배열, 기판 홀더 여기에 설명 된 것과 비슷한가 필요 합니다. 유능 하 고 환자 사람 연결 하 여러 리본 실리콘 기판, 반 칼 보트에 열 중 하 고 리본 기판에 앉아있을 때까지 점차적으로 수 위를 낮추는 방법으로 배열을 검색할 수 있습니다. 그러나,에 있는 우리의 경험, 기판은 칼 보트 (1.3.2 프로토콜에서에서 참조 참고)의 어떤 부분을 만질 때 형성을 무 너 뜨 리는 경향이 있다. 또한,이 절차는 훨씬 더 어려운 ITO 코팅 기판: (1) 때문에 이토 유리의 투명도, 그것 보고 어렵습니다 물의 가장자리 리본 끝; 첨부 해야 (2) ITO 코팅 표면 고광택된 실리콘 웨이퍼 보다 훨씬 거칠어 있기 때문에, 리본 리프트- 작은 조각 몇 가지 섹션으로 구성 된 플 로트 수 있습니다, 따라서 섹션의 순서를 파괴 하는 동안 휴식 하는 경향이.
전체 워크플로 FLM 데이터에 상관 없이 가능한 이기도합니다. 이 경우에, sem에서 데이터 컬렉션 여러 세션에서 할 수 있습니다. 초기 3D 재구성 또는 적어도 낮은 또는 중간 해상도 데이터의 평가 대상 식별 해야 할 수 있습니다. 또한, 기존의 조직학 얼룩 명시 LM에 대 한 (안 필요한 FLM)을 적용할 수 있습니다. 물론, 다른 옵션6,7,8 은18에 초기 논문에서 이미 시연으로 배열에 라벨 또는 유전자 형광 성 단백질 (XFPs) 인코딩 또는 미리 라벨을 포함 하는 항 체 와 샘플 준비 중 형광의 보전.
설명한 방법의 일반적인 제한은 특정 두께의 섹션 및 3D 볼륨의 결과 개별 샘플링을 사용 하 여: SEM 섹션 표면 (d에서에서 유일한 데이터 수집 이후 Z 해상도 섹션의 두께 만큼 좋은 수 선택 기본 에너지/방문 에너지에 epending). 이 결과 3D 볼륨 이방성 복, 예를 들어있다는 뜻., 100 nm3 경우 100 x 5 x 5 nm 섹션과 이미지 픽셀 크기가 5 nm 사용 됩니다. 1 µ m 아래 크기 범위에서 아주 작은 요소,이 대 한 진정한 ultrastructural 충분 한 않을 수 있습니다. 더 기술적인 한계 이미징 자동 SEM에서 사용 하는 무대의 정확도 이다. 이 때문에, 전체 대상 지역 몇 군데 되도록 무대 정확도의 규격 보다 더 큰 ROI를 선택할 필요가 있다.
블록-얼굴 이미징 방법 SBF SEM과 거짓말-sem의에 비해, 상호에 위에서 설명한 대로 이방성 복의 결정적인 단점이 있다. 거짓말-SEM, 5 nm3 x 5 x 5의 등방성 복 적절 한 드리프트 보정 장소에 있을 때 얻을 수 있습니다.
배열의 준비 하는 동안 섹션의 손실로 인해 재건 볼륨에서 간격 SBF SEM와 거짓말-SEM. 발생 하지 문제가 있을 접착제에 의해 좋은 리본 안정화, 일반적으로 이것이 리본의 마지막 부분에 대 한 문제: 나이프는 속눈썹을 사용 하 여에서 그것을 풀어 놓을 때 손상 될 수 있습니다. 그러나, 우리의 경험의 모든 20-50 단원의 한 부분 손실 않습니다 하지 영향 이미지 등록.
다른 한편으로, 배열 후 얼룩 가능성 좋은 신호 및 SEM 이미징, 여기에 표시 된 루트 팁 냉동 고압 등 약하게 금속된 샘플에도 대비 수 여. 따라서, 수많은 화학 고정 및 금속 단계에 의해 최적의 ultrastructural 보존 타협을 필요는 없습니다. 또한, 중간 정도의 경화와 병 리 실험실에서 일상적인 샘플 우수한 데이터10제공합니다. 일반적으로 이러한 포스트 포함 대비 향상 SBF SEM과 거짓말-sem의 대 한 불가능 하다. 또한, 이러한 메서드는 파괴 하 고, 이후 즉, 이미징, 계층적 다른 해상도 및 사이트에서 이미징 또는 시간에서 나중에 지점에서 반복된 이미징 동안 샘플 사용 불가능 합니다. 원칙적으로, 무제한 볼륨, 큰 FOVs (예를 들어, connectomics에서 전체 마우스 두뇌에 대 한 여러 밀리미터까지)으로 구성 된 모자이크, 바느질에 의해 만들어지고 섹션의 거 대 한 숫자에 거짓말-SEM, 100 µ m x 100 µ m 넘어 FOVs에에서 의해 취득 될 수 있다 일상적인 악기와 함께 달성 하기 어렵다입니다.
SBF SEM과 거짓말-sem의 위에서 언급 한 방법 모두 단면화 및 완전 자동화 된 방식으로 같은 악기 내 이미징 수행 이후 설명에 워크플로 추가 자동화 확실 한 장점 것입니다. 단면 자동화의 한 종류 존재: Kapton 테이프를 사용 하 여 기판 등으로 배열 한 FLM에서 이미지 어렵다 하지만 The ATUMtome12 생성 하 고 수집 섹션의 수천 수 있습니다. 여기에 사용 되는 ITO 코팅 coverslips에 최고 해상도 영상 가능 해야 합니다. 자동화에 대 한 추가, 매우 바람직한 대상 FLM 데이터 스택 기록 될 것 이다. 다른 한편으로, 자동화 비쌀 수 있다 고 기판 홀더를 제외 하면 여기에 제시 된 워크플로 조건 (하드웨어)만 계측 일상적인 EM 실험실 또는 핵심 시설, 낮은 만들기에서 일반적으로 사용할 수 있는 액세스 수준.
공개
키트는 기판 홀더의 기능 모델의 공급에 대 한 Boeckeler 계기에 의해 환급 받았다. 마 탈 러 ZEISS 현미경 GmbH,이 문서에 언급 된 현미경 시스템의 제조 업체의 직원입니다. 또한, ZEISS ZEISS 아틀라스 솔루션 패키지 다양 한 현미경과 거짓말-sem의 악기에 대 한 큰 영역, 3D 이미징 응용 프로그램에 대 한 특정 솔루션을 제공합니다. 다른 모든 저자를 사용 없다 공개 수 있습니다.
감사의 말
이 작품은 교육과 연구, 프로젝트 MorphiQuant-3 차원에 대 한 독일 연방 내각에서 그랜트 FKZ 13GW0044에 의해 지원 되었다. 기술 지원에 감사 Carolin Bartels 하 고.
자료
| Name | Company | Catalog Number | Comments |
| Instrumentation | |||
| Ultramicrotome | RMC | PT-PC | Alternative: Leica UC7 |
| Substrate holder | RMC | ASH-100 | Alternative: home built |
| Plasma cleaner | Diener | Zepto 40kHz | Alternatives: Ted Pella Pelco or other benchtop plasma cleaner Example Parameters for Diener Zepto with 40kHz generator (0-100W); 0.5 mbar, 5 sccm (Air), 10% performance |
| Widefield fluorescence light microscope | Zeiss | Axio Observer.Z1 | Alternatives: Leica, Nikon, Olympus |
| Fluorescence filter set | Zeiss | 43 HE (Cy3/DsRed) | |
| Objective lens | Zeiss | Zeiss Neofluar 40x | 0.75 NA |
| Decent workstation able to handle GB-sized image data | |||
| FESEM | Zeiss | Ultra 55 | Alternatives: FEI, Jeol, Hitachi, TESCAN |
| Name | Company | Catalog Number | Comments |
| Sectioning | |||
| Razor blades | Plano | T585-V | |
| Diamond knife for trimming 45° | Diatome | DTB45 | |
| Diamond knife for trimming 90° | Diatome | DTB90 | |
| Jumbo diamond knife for sectioning | Diatome | DUJ3530 | |
| Silicon wafer (pieces) | Si-Mat | Custom Made | Doping: P/Bor, orientation: <100>, thickness: 525 ± 25 µm, resistivity: 1-30 Ω-cm http://si-mat.com/silicon-wafers.html |
| ITO-coated coverslips | Balzers | Type Z | 22 × 22 × 0.17 mm https://www.opticsbalzers.com/de/produkte/deckglas-fenster/corrslide.html |
| Aluminium carrier | Custom Made | 76 × 26 mm | |
| Wafer forceps | Ideal-tek | 34A.SA | |
| Stubs forceps | Dumont | 0103-2E1/2-PO-1 | Dumoxel-H 2E 1/2 |
| Diamond scriber | Plano | T5448 | |
| Eyelash/very soft cat's hair | Selfmade | Alternative: Plano | |
| Brush | Selfmade | ||
| Pattex contact adhesive | Pattex | PCL3C | Kraftkleber Classic (the yellowish one) |
| Fixogum | Marabu | 290110001 | for fixing substrate to carrier |
| Adhesive tape | 3M | 851 | for fixing substrate to carrier |
| Isopropanol | Bernd Kraft | 07029.4000 | |
| Xylene | Carl Roth | 4436 | thinner for glue mixture |
| Rotihistol | Carl Roth | 6640 | alternative, limonene based thinner |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Image processing | Open source | Fiji (http://fiji.sc/#download) | |
| Image acquisition | Zeiss | Atlas 5 AT (module for Zeiss SEM) | Alternative for automated image acquisition: WaferMapper: https://software.rc.fas.harvard.edu/lichtman/LGN/WaferMapper.html |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Propidiumiodide | Sigma-Aldrich | P4170 | Stock solution: 1.5 mM in 0.1 % sodium azide |
| Uranylacetate | Science Services | E22400 | |
| Lead(II) Nitrate | Merck | 107398 | |
| Tri Sodium Citrate Dihydrate | Merck | 106448 | |
| NaOH pellets | Merck | 106469 | |
| 1M NaOH solution | Bernd Kraft | 01030.3000 | |
| Glass petri dish | Duran | 23 755 56 | |
| Name | Company | Catalog Number | Comments |
| Mounting | |||
| Stubs | Plano | G301F | |
| Carbon pads | Plano | G3347 | |
| Copper tape | Plano | G3397 | double-sided adhesive, conductive |
| Silver paint | Plano | G3692 | Acheson Elektrodag 1415M |
| Name | Company | Catalog Number | Comments |
| Solutions/mixtures | |||
| Adhesive mixture for coating blocks | Pattex contact adhesive /xylene as thinner, ratio 1:3. (Alternative for xylene: Rotihistol) | ||
| Reynolds lead citrate | 50 mL: Dissolve 1.33 g of lead(II) nitrate in 10 mL of dH2O. Dissolve 1.76 g of tri-sodium citrate dihydrate in 10 ml dH2O. Mix both and add 1 M sodium hydroxide until the solution is clear. Fill up with dH2O to 50 mL. | ||
| Propidium iodide staining solution | Prepare 1:1500 dilution from stock in dH2O. Vortex for adequate mixing. | ||
| Aqueous uranyl acetate | Dissolve 3 % uranyl acetate in dH2O (mix thoroughly). |
참고문헌
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: Volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience. J Microsc. 259 (2), 137-142 (2015).
- Kizilyaprak, C., Daraspe, J., Humbel, B. Focused ion beam scanning electron microscopy in biology. J Microsc. 254 (3), 109-114 (2014).
- Wacker, I., Schröder, R. R. Array tomography. J Microsc. 252 (2), 93-99 (2013).
- Tapia, J. C., Kasthuri, N., Hayworth, K. J., Schalek, R., Lichtman, J. W., Smith, S. J., Buchanan, J. High-contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy. Nat protoc. 7 (2), 193-206 (2012).
- Lucas, M. S., Günthert, M., Gasser, P., Lucas, F., Wepf, R. Bridging Microscopes: 3D Correlative Light and Scanning Electron Microscopy of Complex Biological Structures. Methods Cell Biol. 111, 325-356 (2012).
- De Boer, P., Hoogenboom, J. P., Giepmans, B. N. Correlated light and electron microscopy: ultrasructure lights up!. Nat Methods. 12 (6), 503-513 (2015).
- Verkade, P., Müller-Reichert, T. . Methods in Cell Biology Correlative Light and Electron Microscopy III. 140, 1-352 (2017).
- Gibson, K. H., Vorkel, D., Meissner, J., Verbavatz, J. -. M. Fluorescing the Electron: Strategies in Correlative Experimental Design. Methods Cell Biol. 124, 23-54 (2014).
- Wacker, I., Schröder, R. R., Schroeder, J. A. Pathology goes 3D: Exploring the potential of array tomography versus FIB nanotomography for a CADASIL sample. Ultrastruct Pathol. 41 (1), 114-115 (2017).
- Wacker, I., Spomer, W., Hofmann, A., Thaler, M., Hillmer, S., Gengenbach, U., Schröder, R. R. Hierarchical imaging: a new concept for targeted imaging of large volumes from cells to tissues. BMC Cell Biol. 17 (1), 38 (2016).
- Hayworth, K. J., Morgan, J. L., Schalek, R., Berger, D. R., Hildebrand, D. G. C., Lichtman, J. W. Imaging ATUM ultrathin section libraries with WaferMapper: a multi-scale approach to EM reconstruction of neural circuits. Front Neural Circuits. 8, (2014).
- Micheva, K. D., O'Rourke, N., Busse, B., Smith, S. J. Array Tomography: Production of Arrays. Cold Spring Harb Protoc. 11, 1267-1269 (2010).
- Fahrenbach, W. H. Continuous serial thin sectioning for electron microscopy. J. Elec. Microsc. Tech. 1 (4), 387-398 (1984).
- Harris, K. M., et al. Uniform serial sectioning for transmission electron microscopy. J Neurosci. 26 (47), 12101-12103 (2006).
- Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., Preibisch, S., Rueden, C., Saalfeld, S., Schmid, B., Tinevez, J. -. Y., White, D. J., Hartenstein, V., Eliceiri, K., Tomancak, P., Cardona, A. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I., Preibisch, S., Longair, M., Tomancak, P., Hartenstein, V., Douglas, R. J. TrakEM2 software for neural circuit reconstruction. PLoS ONE. 7 (6), e38011 (2012).
- Micheva, K. D., Smith, S. J. Array Tomography: A new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유