Method Article
CD19 자동차 T 세포의 전 임상 평가 위한 Syngeneic 마우스 B-세포 림프 종 모델
요약
여기, 우리가 현재 생산과 retroviral 변환 및 또는 lymphodepleting 없이 BALB/c 마우스에서 설립된 syngeneic A20 B-세포 림프 종에 대 한 치료로 활용 하 여 murine CD19 차 T 세포의 전 임상 시험에 대 한 프로토콜 미리 컨디셔닝.
초록
CD19 공상 항 원 수용 체 (자동차) T-세포 치료의 놀라운 임상 성공 급성 림프 구성 백혈병 (ALL) andnon-Hodgkin 림프 종 (NHL)에 대 한 두 번째 세대 공상 항 원 수용 체 (자동차)의 승인을 주도하 고 있다. 필드의 초점은 이제 덜 인상적 완전 한 응답 속도 관찰 된다 다른 혈액 악성 종양에서 이러한 성공을 모방에 있습니다. 자동차 T 세포 또는 다른 치료 modalities의 공동 관리의 엔지니어링 추가 다른 암 설정에서 성공적인 치료에 장애물 극복 성공적으로 수 있습니다.
우리는 따라서 다른 CD19 자동차 T 세포의 전 임상 테스트 수행할 수 있는 모델을 제시. 이 테스트 B-세포 림프 종 모델 결과 일반적으로 유익한 자동차 T-세포 치료 될 것.
이 프로토콜을 사용 마우스의 재현 생산 MP71 retroviral 구조와 pCL 에코 포장 플라스 미드 retroviral 입자 분 비의 컬렉션 뒤 같은 E 프로듀서 셀 칼슘 인산 염 transfection 통해 자동차 T 세포와 재조합 인간 fibronectin 조각 및 원심 분리를 사용 하 여 변환입니다. Retroviral 변환의 유효성 검사 및 확인 대상 림프 종 세포 vivo ex, cytometry, luminometry 및 효소 연결 된 immunosorbent 사용 죽 차 T 세포 수의 시험 (ELISA), 또한 설명.
프로토콜 테스트 차 T 세포 vivo에서 lymphoreplete에 고 lymphodepleted syngeneic 마우스, 베어링 설립, 조직 림프 종 같습니다. 안티-암 활동 vivo에서 생물 발광 및 질병 진행에 의해 모니터링 됩니다. 우리 때 1세인트 또는 lymphodepleting 사전 및 자동차 T를 활용 하 여 장기 remissions 달성 하는 쥐의 소수와 함께 2차 세대 자동차 설립된 B-세포 림프 종의 근절의 전형적인 결과 보여 셀 lymphoreplete 쥐에 IL-12를 표현입니다.
이러한 프로토콜은 다른 추가 수정, 차 T 세포의 조합 및 다른 치료제와 CD19 차 T 세포를 평가 하는 데 사용 하거나 다른 대상 항 원에 대 한 자동차 T 세포의 사용을 위해 적응 수 있습니다.
서문
공상 항 원 수용 체 (자동차) T-세포 치료의 CD19 치료에 놀라운 임상 성공을 보이고 있다+ 재발된 급성 림프 구성 백혈병1 과 axicabtagene tisagenlecleucel의 승인에 지도 하는 악성 종양 진보적인 큰 B-세포 비 Hodgkin 림프 종2 2017에 대 한 ciloleucel.
암과 질병의 진행 및 치료 메커니즘 모두에서 면역 체계 사이 상호 작용의 중요성은 점점 더 인식된3,4,되 고5. 예, 그것은 잘 종양 microenvironment (TME) 면역 세포6,,78의 이펙터 기능을 억제할 수 있는 요인으로 맞이 하 게 됩니다 문서화. 또는 생 면역 세포와 epitope 확산 못쓰게 종양 퇴치 및 장기 저항 종양 도전9,10키 수 있습니다. 이러한 현상의 둘 다 면역 체계가 부족 xenogeneic 모델에서 평가할 수 없습니다. 마찬가지로, 유전자 변형 단백질을 이용 하 여 시스템 epitope11,12확산에 필요한 면역 관용을 깨는 도전을 정확 하 게 반영 하지 않습니다. 따라서, 완전 한 기능 면역 체계와 syngeneic 모델은 암 질병 진행 및 면역 치료제의 이러한 중요 한 측면을 모델링을 위한 파라마운트.
자동차 T-세포 치료의 중요 한 경고 lymphodepleting 사전 조절 치료 성공13,14필요 하다는 것 이다. 이것은 일반적으로 자동차 T 세포15,16의 주입 전에 화학요법을 투여 하 여 환자에 달성 된다. 표준 방법으로 환자의 설정에서 사용 하는 lymphodepletion를 모방 하기 위해 우리 관리 5 Gy 총 몸 방사선 조사 (TBI) 마우스 베어링 조직의 A20 B-세포 림프 종 치료 차 T 세포의 이전 lymphodepletion를 달성 하기 위해.
Lymphodepleting 사전 컨디셔닝 대부분의 환자에 대 한 문제가 되지 않습니다, 하는 동안 화학요법 에이전트와 함께 제공 되는 독성의 낮은 성능 상태 환자 차 T-세포 치료 받을 수 있습니다 의미 합니다. Lymphodepletion에 대 한 부적격 환자를 나타내는 테스트 시스템을 만들려면, 우리는 우리가 자동차 T-세포 림프 종 치료 모델 lymphoreplete syngeneic 마우스 모델 설립. 이 모델에서 차 T 세포 내에서 IL-12의 분 비의 성공률와 함께 설립된 림프의 박멸 이어질 수 살펴보았습니다 ~ 2517. 또한, 우리는 내 생 면역 세포 암 퇴치에 참여 했다 보였다.
여기 우리가 자세히 설명 마우스 자동차 T 세포의 생산을 위한 프로토콜 syngeneic 쥐 및 또는 lymphodepleting 사전 컨디셔닝의 사용 없이 차 T 세포 림프 종 치료에 림프 종 설립. 이 다른 transgenes 차 T 세포를 테스트 하는 다른 에이전트와 자동차 T 세포의 조합 연구 또는 림프 종에 대 한 다른 입양 세포 치료 또는 immunotherapy 전략의 사용에 대 한 사용할 수 있습니다.
프로토콜
모든 동물 실험 연구 지침에 대 한 동물 (과학적인 절차) 행위 1986의 후원 및 영국 조정 위원회에서 실시 했다. 모든 동물 연구 CRUK-맨체스터 연구소에서 실시 되었고 로컬 동물 복지에 의해 승인 하 고 윤리 검토 바디 (CRUK MI AWERB).
1입니다. 준비
- Maxiprep pMP71 retroviral 플라스 미드 및 pCL 에코 레트로 바이러스 포장 플라스 미드18구성 합니다.
참고: pMP71 mCherry와 FMDV2A 시퀀스를 구분 하는 자동차를 인코딩합니다. 이것은 다른 retroviral 구문으로 상호 교환 이다. pCL-에코 개 그, 유류 및 ecotropic 봉투 단백질을 인코딩합니다. - RPMI 1640 매체, FCS 10%, 1 %100 x 페니실린-스-글루타민 (PSG)를 사용 하 여 마우스 T 세포 배양에 대 한 완전 한 T 세포 매체 (TCM)을 준비 합니다.
참고: 솔루션에 들어 있는 100 IU/mL 페니실린, 스의 100 µ g/mL와 L-글루타민의 2 mM), 50 μ M β-mercaptoethanol 및 25 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic 산 (HEPES). - A20 셀 RPMI 1640, 10% FCS 0.05 m m β-mercaptoethanol 37 ° C, 5% CO2에서 문화.
- 문화 완전 한 Dulbecco의 수정된이 글 매체 (DMEM) (10% 태아 종 아리 혈 청 (FCS), 2 m L-글루타민, 1 μ g/mL puromycin 및 10 μ g/mL blasticidin m과 DMEM) 37 ° C에서 플래티넘-E (같은-E) 셀 5 %CO2.
참고: 같은 E 셀 293T 세포에서 파생 되 고 개 그, 유류 및 ecotropic 봉투 retroviral 단백질을 표현 한다. - 미디어 솔루션 1과 transfection 직전 2 transfection를 준비 합니다. 솔루션 1 (pH 7.9) DMEM + 10 %FCS + 25mm HEPES, 솔루션 2 (pH 7.1) DMEM + 25mm HEPES 포함을 포함 준비.
- 멸 균 인산 염 버퍼 식 염 수 (PBS)로 희석 하 여 10 μ g/mL 재조합 인간 fibronectin 조각 솔루션을 준비 하 고 사용까지-20 ° C에서 저장.
- 멸 균 (재조합 인간 fibronectin 조각 제외)를 사용 하 여 이전 0.2 μ m 필터를 통해 모든 미디어를 필터링 합니다.
2. T 세포의 retroviral 변환
- Transfection에 대 한 제 1 일: 준비
- 씨앗 7.5 x 106 플래티넘-E (같은-E) 세포가 완전 한 DMEM의 18 ml에서 15 cm2 조직 문화 요리에서 하 고 37 ° C, 5% CO2에서 밤새 품 어.
- 제 2 일: Transfection 같은 E retroviral 포장 셀 라인의
- Pcl-에코 패키징 벡터 DNA, 플라스 미드 DNA 인코딩 retroviral 자동차 구조 및 15 cm2 접시 당 3 mL transfection 솔루션 2의 최종 볼륨을 1 M CaCl2 의 150 μ 페 수를 39.6 μ g의 20.4 μ g을 준비 합니다. 10 s와 5 분을 위한 나머지와 동
- 15 cm2 요리에서 DMEM 미디어를 제거 하 고 transfection 솔루션 1의 12 mL를 바꿉니다.
주의 미디어를 변경할 때 15cm2 접시 중앙에 건조 수 있습니다. 이 transfected 같은 E 셀의 실질적인 죽음을 발생할 수 있습니다. 신속 하 게 작업 하 고 한 번에 단지 1-2 판에서 미디어를 제거 합니다. - 3 mL transfection 솔루션 각 접시에 걸쳐 drop-wise, 균등 하 게2 각 15 cm2 접시를 DNA와 CaCl를 포함 하는 2을 추가 합니다. 37 ° C, 5% CO2 하룻밤에 10 미 품에 대 한 측면으로 부드럽게 바위 접시.
- 제 3 일: 준비 포함 하는 바이러스의 변환에 대 한 표면에 뜨는
- 18 mL transfected 플레이트-E 셀의 미디어 중 완료 및 인큐베이터 돌아가기 교체 합니다.
주의 때 변경 미디어 15 cm2 접시 중앙에 건조 수 있습니다. 이 transfected 같은 E 셀의 실질적인 죽음을 발생할 수 있습니다. 신속 하 게 작업 하 고 한 번에 단지 1-2 판에서 미디어를 제거 합니다.
- 18 mL transfected 플레이트-E 셀의 미디어 중 완료 및 인큐베이터 돌아가기 교체 합니다.
- 주 3: 격리 및 생체 외에서 활성화 마우스 비장 T 세포의
- 파 킨 슨 병 외. 여 앞에서 설명한 6 8 주 오래 BALB/c 마우스에서 spleens 제거 19 그들에 젖어 살 균, 얼음 처럼 차가운, 50 mL 원뿔 튜브에 PBS.
- 족집게를 사용 하 여 전송 하는 비장 1.5 mL microcentrifuge 튜브 하 고 최소한의 힘으로는 방 앗 공이 사용 하 여 균질.
- 1000 μ 피 펫을 사용 하 고 ~ 100 μ m 기 공 셀 스 트레이너 포함 5 mL PBS 단일 세포 현 탁 액을 달성 하기 위해 50 mL 튜브에 부착 된 homogenate 전송 800 μ PBS. 추가 spleens에 대해 2.4.2 단계를 반복 합니다. 튜브 당 3 spleens 초과 하지 마십시오.
주의 왼쪽에 서 하는 경우 필터를 통해 전달 하는 Splenocytes 덩어리를 형성할 수 있다. 수동으로 소용돌이 친다 튜브를 간헐적으로 응집 하는 셀을 피하기 위해 여러 spleens 처리 하는 경우. 셀 스 트레이너에 조각 남은 수 수 추가 으깬에서 최소한의 힘을 사용 하 여 5 mL 주사기 플런저를 사용 하 여. - 최대 20 mL PBS와 함께 톱. 20 mL 세포 현 탁 액 50 mL 튜브에 밀도 그라데이션 미디어 (자료 테이블)의 20 mL에 부드럽게 레이어. 아니 브레이크 적용으로 20 분 대 한 800 x g에서 결과 중첩된 정지 원심
- 살 균 파스퇴르 피 펫 및 50 mL 튜브에 사용 하 여 인터페이스 계층에서 세포를 수확. 최대 50 mL PBS와 10 분 동안 800 x g에서 원심 분리기 세척 탑. 상쾌한 삭제 하 고 다시 완전 한 중에 셀을 일시 중단.
- hemocytometer를 사용 하 여 셀 수를 계산 합니다.
- 30 ng/mL 안티-CD3ε 항 체와 완전 한 중에 5 x 106 셀/mL의 농도에서 세포 문화 (145-2 C 11 복제), 30 ng/mL 안티 CD28 항 체 (클론 37.51), 100 U/mL 재조합 인간 일리노이-2와 2 ng/mL 재조합 murine 일리노이-7. 적절 한 크기의 조직 배양 플라스 크를 사용 하 여 셀 수확의 볼륨에 대 한.
참고: -항 원 제시 세포 CD3, CD28 항 체에 의해 T 세포 활성화에 필요한 정화 T 세포를 사용 하는 것은 항 체, 코트 접시 필요한 경우 또는 자석 구슬 (테이블의 재료)를 사용 하 여 - 37 ° C, 5% CO2 하룻밤에 마우스 splenocytes를 품 어.
- 변환에 대 한 접시의 주 3: 준비
- 10 μ g/mL 재조합 인간 fibronectin의 2 mL와 코트 비 조직 문화 6 잘 플레이트 그리고 하룻밤 4 ° c.에 품 어
- 제 4 일: 변환 마우스 T 세포의
- 신선한 비 조직 문화 6 잘 플레이트를 코팅된 접시에서 재조합 인간 fibronectin 조각을 전송. 변환의 2 라운드에 4 ° C에서 하룻밤이 번호판을 품 어.
- 원래 재조합 인간 fibronectin 조각 코팅 접시의 각 잘 하 중의 2 개 mL를 추가 하 고 일반적인 바인딩 차단 하 실 온에서 30 분 두고.
- 15 cm 조직 문화 요리에 완전 한 TCM의 18 mL 바꿀 transfected 같은 E 셀에서 상쾌한 포함 하는 레트로 바이러스를 수확.
주의 같은 E 셀의 건조 하지 않도록 신속 하 게 작동 합니다.
참고: Transfection의 성공 확인할 수 있습니다이 단계에서 형광 현미경 검사 법에 의해 형광 표식 유전자 mCherry (그림 1) 등을 활용 하는 경우. - 레트로 바이러스를 포함 하는 상쾌한 세포 파편을 제거 하 0.45 μ m 필터를 통해 필터링. 재조합 인간 fibronectin 조각 코팅 6 잘 플레이트에서 TCM를 제거 하 고 필터링 된 레트로 바이러스 포함 된 상쾌한 또는 각 잘 2.5 mL을 추가 (사용 중 모의 transfection 완료). 레트로 바이러스 또는 모의 미디어의 추가 관해서는 각 잘 레이블.
- 실 온에서 30 분 동안 1200 x g에서 격판덮개 원심
- 플레이트, 회전 하는 동안 활성화 된 T 세포를 수집 하 고는 hemocytometer를 사용 하 여 계산.
- 변환의 5 mL/총에서 5 x 106 활성화 splenocytes와 함께 수행 됩니다. 5 분 동안 500 x g에서 원심 분리 하 여 별도 튜브에 모의/변환에 대 한 splenocytes의 필요한 수를 작은.
- 다시 일시 중단 단계의 2.6.4 필터링 된 레트로 바이러스 포함 된 상쾌한의 2.5 mL 당 5 x 106 세포의 밀도에서 splenocytes 또는 TCM 부정적인 컨트롤. 재조합 인간 일리노이-2 (hIL-2) 및 재조합 마우스 일리노이-7 (밀-7)에 추가 200 IU/mL와 4 ng/mL의 최종 농도 각각.
- 2.6.5 단계의 완료에 원심 분리기에서 6 잘 플레이트를 수집 하 고 적절 한 우물 잘/5 mL의 최종 볼륨을 확인 하 고 100 U/mL hIL-2와 2 ng/mL 밀-7의 최종 농도에 2.5 mL/잘 다시 중단된 splenocytes를 추가.
- 실 온에서 90 분 동안 1200 x g에서 격판덮개 원심 원심, 후 37 ° C, 5% CO2 하룻밤에 접시를 품 어.
- 제 5 일: 변환의 2 라운드
- 이 다시 사용 될 수 있다 격판덮개에서 재조합 인간 fibronectin 조각을 수집 합니다. 2.6.5 2.6.2-단계를 반복 합니다.
- 플레이트, 회전 하는 동안 파스퇴르 피 펫을 사용 하 여 변환의 라운드 1st 에서 세포를 수집 합니다. 2 mL PBS와 각 잘 린스, 소용돌이 각 우물에 나머지 셀을 수집 합니다.
참고: 다시 sedimented 셀을 일시 중단 하는 위쪽 및 아래쪽 플라스틱. 별도 튜브에 각 제어/변환 그룹을 수집 합니다. - 5 분 다시 중단 셀 변환 200 IU/mL 일리노이-2와 4 ng/mL 일리노이-7의 당 2.5 mL에 대 한 500 x g에서 원심 분리기 튜브. 2.6.8 2.6.7-단계를 반복 합니다.
- 원심 분리기에서 셀을 제거 하 고 37 ° C, 5% CO2 단계 2.7.2-2.7.3로 불리고 수집 4 헤 셀에서 품 어.
- 셀의 개수, 5 분 동안 500 x g에서 원심 및 1 x 106 셀/mL 100 U/mL hIL-2, 2ng/mL의 조밀도에 완전 한 중에 다시 중단 밀-7. 적절 한 크기의 문화 플라스 크를 전송 및 37 ° C, 5% CO2에서 품 어.
- 100U/mL hIL-2, 2ng/mL를 포함 하는 신선한 TCM 미디어 추가 밀-7 매 2 일 셀 밀도의 1 x 106 셀/mL를 유지.
참고: 수확된 splenocytes 세포 유형의 다양 한 포함 되어 있습니다. 이러한 문화 조건 하에서 비 T 세포는 2-3 일에 걸쳐 죽어. 후 ~ 세포 배양, 4 일 T 세포의 수는 일반적으로 수확된 splenocytes의 총 수에 해당 일 0에.
3입니다. 변환 효율의 측정
- 하루 4 게시물 변환에서 불리고 또는 비 불리고 T 세포 (약 3 × 105 셀)의 샘플을 수집 합니다. 5 분 동안 500 x g에 세포 현 탁 액을 원심, 삭제는 상쾌한 PBS 한번 수송과 세포를 세척 하 고 다시 원심.
- 삭제는 상쾌한 고 적당 한 아민 반응 염료 (예를 들어, 라이브/죽은 얼룩, 1에서 100 희석) 잘 당 포함 된 PBS의 100 μ를 추가 합니다. 어둠 속에서 실 온에서 15 분 동안 품 어.
- PBS로 두번 워시 5 분 삭제는 상쾌한 500 x g에서 원심 및 FACS 버퍼 (1 100 희석)를 차단 하는 Fc 수용 체에 대 한 반대로 마우스 CD16/CD32 항 체를 포함의 50 μ와 품 어. 4 ° c.에서 10 분 동안 품 어
- 직접 추가 하는 반대로 마우스 CD4-BV786 및 CD8-BV711 항 체 (FACS 버퍼에서 1 μ/잘의 최종 농도)를 포함 하는 마스터 믹스를 얼룩이 지는 항 체의 50 μ. 어둠 속에서 4 ° C에서 30 분 동안 품 어. 3.3 세척 단계를 반복 합니다. 다시 1 %PFA 버퍼에 셀을 일시 중단 하 고 유지는 cytometry 분석까지 4 ° C에서 어둠 속에서.
- C d 4와 CD8 하위 집합 및 각각 (그림 2) 게이팅 자동차 식의 표식으로 BV711, BV785 및 mCherry 형광을 사용 하 여 해당 적합 cytometer로 세포를 분석 합니다.
4. 체 외에서 유효성 검사의 자동차 T 세포 활동
- Syngeneic 씨 대상 CD19+ 종양 세포 또는 100 μ에서 1 x 104 의 세포의 조밀도에 luciferase 식 없이 96 잘 U-하단에 TCM/잘 조직 문화 접시.
- 1 x 104 CD19 자동차 T 세포/잘 100 μ/잘 대상 (E:T) 비율 1: 1의 이펙터를 달성의 볼륨에 추가 합니다.
참고: E:T 비율을 설립 해야 합니다 각 자동차에 대 한 생성 하 고 대상 셀 라인. - 혼자 사용 T 세포와 부정적인 컨트롤로 혼자 종양 세포와 T 세포 phorbol myristate 아세테이트 (PMA)에 의해 자극된 (50 ng/mL)와 인터페론 감마 (IFNγ) 릴리스에 대 한 긍정적인 컨트롤로 ionomycin (1 μ g/mL). 37 ° c, 5% CO2 16-24 h에 대 한 공동 문화 세포.
- 공동 문화, 다음 5 분 동안 500 x g에서 격판덮개 원심 고 추가 IFNγ 및 IL-12 p 70 ELISA 분석에 대 한 상쾌한을 수집 합니다.
참고: 이-80 ° c.에 저장 될 수 있다 - 다시 소 (1.5 mg/mL의 최종 농도)를 포함 하는 PBS의 100 μ에 셀 펠 릿을 일시 중단 합니다. 37 ° c.에서 10 분에 대 한 번호판을 품 어 그런 다음 적당 한 루미 노와 각 우물에서 발광을 측정 합니다.
참고: 노출 시간 셀 라인을 밀도 최적화 해야 합니다. 대표 결과 그림 3a에 표시 됩니다. 자동차 T 세포의 세포 독성 전 비보 표현 루시페린을 공동 문화에 의해 셀 라인 대상 항 원 표현으로 수정할 수 있습니다. 자동차 T 세포 표적 세포를 죽 일, 소 출시, 따라서 luminometry 신호 감소 셀 죽으로 상관 된다. 비 불리고 셀 종종 긴 인큐베이션 기간 동안 특히 대상 세포 생존 능력에 영향을 가질 수 있습니다. 제조업체의 ELISA 프로토콜에 따라 상쾌한 murine IFNγ 및 IL-12 p 70의 농도 측정 합니다. 대표 결과 (그림 3b 와 3c)에 표시 됩니다. 셀 라인 표현 대상 항 공동 문화 차 T 세포의 전 비보 활성화 ELISA를 사용 하 여 표면에 뜨는 내용을 분석 하 여 분석 될 수 있습니다. 대상 셀에 자동차 T 세포의 비율 및 공동 문화 기간 각 자동차 구조, 대상 셀 라인 및 분석에 대 한 낙관 되어야 한다. PMA와 ionomycin 치료 T 세포와 대응 하는 그들의 능력의 품질을 확인 하는 긍정적인 컨트롤로 사용할 수 있습니다.
5. 평가 쥐에서 제 암 성 활동
-
프로토콜 1
- 100 mg/kg 정 맥 (IV) 배달 cyclophosphamide의 6-8 주 BALB/c 마우스에 수행 합니다. 중요 한 lymphodepletion17 (그림 4) 없이 종양 engraftment을 수 있습니다.
참고: A20을 설정 림프 종 차선 포획 률 2 개월 이상 걸릴 수 있습니다. 이 림프 종 세포의 배달에 앞서 1 일 cyclophosphamide의 사용에 의해 향상 될 수 있습니다. Lymphoreplete 마우스를 공부 하기 위하여 lymphodepletion를 일으키는 원인이 되기 없이 림프의 효율성을 높일 수 있는 cyclophosphamide의 복용량 파악. - 다음 날, 정 맥 (IV) 주입에 의해 쥐로 5 x 105 syngeneic A20 B-세포 림프 종 세포 luciferase 및 녹색 형광 단백질 (GFP)를 표현 하도록 수정 100 µ L를 주사.
- 허용 조직의 림프 종에 대 한 개발 하 쥐 ~ 17 일.
- 30 mg/mL 소의 이미지는 vivo에서 생물 발광 이미징 시스템을 사용 하 여 100 μ의 복 (IP)를 주입 하 여 조직의 림프의 존재를 확인 합니다.
- 구분 기호를 사용 하 여 인접 한 쥐로 신호 넘침을 방지. 관심의 일정 한 크기의 영역으로 복 부 측에 1 분 동안 쥐를 노출 합니다.
- 광자 (p/s) 당으로 상대 빛 단위 (RLU)를 표시 합니다. 설정, 각 종양 모델에 대 한 낙관 한다 사용 하 여 종양의 조기 발견을 선택할 수 있습니다 하지만 리드 하지 않습니다 채도 종양 도달 끝점으로 노출.
- 한 상수와 각 마우스에 대 한 기록 총 RLU 관심 영역 크기. (그림 5a 그리고 b).
- 주사 설립 베어링 lymphoreplete 쥐로 IV 주입에 의해 1 x 106 차 T 세포의 단 하나의 복용량 림프 종.
참고: (중요 한) 레벨을 주입 해야 합니다 설립 각 자동차 자동차 T 세포에서 발생 하는 모든 가능한 독성 특징은 해결 될 수 있도록 복용량 단계적 확대 일정을 사용 하 여 구성. 반대로 마우스 CD19 자동차 T 세포 독성을 표시 하지 않습니다, 비록 자동차 T 세포 증가 예상치 못한 독성에 줄 수 있습니다. 여러 자동차 구조 및 변환 효율성은 동일, 관리 하는 T 세포의 총 수 유지 되어야 한다 동등한 셀 준비로 T 세포 transduced 비 추가. - 30 mg/mL 소의 이미지는 vivo에서 생물 발광 이미징 시스템 (그림 5 c)를 사용 하 여 매주 100 μ의 IP 주사를 통해 질병의 진행을 모니터링 합니다.
- 밀접 하 게 독성의 징후에 대 한 마우스를 모니터 하 고 모든 고통을 발생할 수 전에 뒷 다리 마비 (HLP) 또는 병 적인 종양 짐의 초기 징후를 보여 주는 모든 마우스를 안락사.
참고: A20 림프 종에서 독성은 meninges의 종양 내 습을 통해 뒷 다리 마비를 포함할 수 있습니다. 변경 된 걸음 걸이의 이른 표시를 정기적으로 확인 합니다. 마찬가지로, 변경 된 동작에 의해 표시 된 불편으로 이어질 수 있는 큰 IP 종양이 발생할 수 있습니다. - 60-100 일 (그림 5 d)에 대 한 쥐의 생존을 모니터링 합니다. 실험의 결론에 따라 일정-1 방법으로 안락사를 수행 합니다.
- 100 mg/kg 정 맥 (IV) 배달 cyclophosphamide의 6-8 주 BALB/c 마우스에 수행 합니다. 중요 한 lymphodepletion17 (그림 4) 없이 종양 engraftment을 수 있습니다.
-
프로토콜 2
- 6 8 주 오래 된 BALB/c 마우스를 꼬리 정 맥 주사로 100 μ에 PBS의 마우스 당 200 밀리 그램/kg cyclophosphamide를 제공 합니다.
- 다음 날, 5 x 105 syngeneic A20 B-세포 림프 종 세포 100 μ PBS 통해 꼬리 정 맥 주입에서 luciferase GFP를 표현의 주사.
- 허용 조직의 림프 종에 대 한 개발 하 쥐 ~ 7-14 일
- 30 mg/mL 소의 이미지는 vivo에서 생물 발광 이미징 시스템을 사용 하 여 100 μ의 IP 주입 하 여 조직의 림프를 확인 합니다.
- Lymphodepletion 5 Gy 총 몸 방사선 조사 (TBI) 0.02 Gy/min에서 수행 합니다.
참고: 자동차 T-세포 치료를 받고 환자 크게 adoptively의 engraftment를 증가 하는 자동차 T 세포의 관리 차 T 세포를 전송 하기 전에 lymphodepletion를 달성 하기 위해 식이요법의 범위를 받 다. 이 총 몸 방사선 조사 (TBI) (그림 6)와 쥐에서 복제 될 수 있습니다. - 다음 날, PBS 통해 꼬리 정 맥 주입 베어링 쥐로 설립 종양의 100 μ에서 1 x 106 차 T 세포를 주사.
- 7 일 후 꼬리 정 맥 출혈을 통해 혈액 샘플을 수집 합니다.
- 각 혈액 샘플을 붉은 세포 세포의 용 해 버퍼를 추가 다음 섹션 3에에서 설명 된 대로 cytometry에 대 한 준비. Cytometry (그림 2)에 의해 순환에서 차 T 세포 지 속성을 분석 합니다.
참고: Cytometry 직전 세 구슬의 추가의 혈액 밀리 리터 당 차 T 세포의 수의 결심을 허용 한다. - 단계 5.1.5-5.1.8 (그림 7)에서 설명한 대로 질병 진행을 모니터링 합니다.
결과
T 세포의 고효율 변환에 대 한 신선한 retroviral 입자를 얻을 필요가 있다. PMP71 레트로 바이러스 플라스 미드 pCL 에코 프로듀서 플라스 미드와 같은 E 셀 라인의 transfection retroviral 입자의 분 비 세포 표면에 뜨는에 상승을 제공합니다. MCherry, 같은 형광 표식 유전자는 레트로 바이러스에서 인코딩된 때 성공적인 transfection 형광 현미경 검사 법 (그림 1)에 의해 확인할 수 있습니다. Transfected 같은 E 셀에서 상쾌한 바이러스를 포함 하는 T 세포를 통해 2 라운드 스핀 fection fibronectin 조각 코팅 접시에 transduce 데 사용 됩니다. 4 일 게시 cytometry 통해 변환 변환의 효율성을 확인할 수 있습니다. 성공적으로 불리고 셀 레트로 바이러스 (그림 2)에서 인코딩 표식 유전자를 표현 한다. 변환 효율성 범위에서 ~ 50-90% 효율을 1 세대 수용 체와 ~ 차 10-40% 가까이 retroviral 포장 용량 구성. 마커 유전자 발현 성공적인 retroviral 변환 보여줍니다, 그것은 그들의 표면에 그 표현 대상 항 원 세포와 매력적인 시 자동차 T 세포의 기능을 보여 최고. 대상 셀 라인 표현 luciferase 수정 직접 차 T 세포 (그림 3A)에 의해 셀 죽 일 정도의 테스트 luciferase 분석 실험에 사용할 수 있습니다. 대상 셀, ELISA, 정한 공동 문화 시 자동차 T 세포에서 이펙터 cytokines의 방출 자동차 T 세포 세포 독성 (그림 3B 와 3c)의 간접 측정으로도 사용할 수 있습니다.
이 프로토콜에서 생산 하는 자동차 T 세포 조직의 A20 림프 종 (주입 정 맥), 1 일 5 x 105 A20 셀 (그림 4)의 IV 주입 전에 cyclophosphamide의 100mg/kg 복용량을 설정 하 여 lymphoreplete 마우스에 평가할 수 있습니다. 소 및 이미지 캡처 vivo에서 생물 발광 영상을 사용 하 여 IP 주입 종양 부담 (그림 5A-C)에 걸쳐 지속적인 투자 수익 및 노출 시간을 사용 하 여 모니터링 하는 데 사용할 수 있습니다. 자동차 T 세포 표현 IL-12 수정 lymphodepleting 사전 마우스 (그림 5D)의 약 25%에서 질병-무료 생존을 주는 조건으로 조직의 림프를 근절 할 수 있다. Lymphodepleting 늘어진, 5 달성 Gy TBI 자동차 T 세포의 4 행정에 앞서 1 일 크게 향상 engraftment (그림 6). 이 모델에서는 1 세대 자동차 T 세포 조직의 A20 림프 종, 일반적으로 유도 하는 쥐 (그림 7)의 100%의 질병-무료 생존을 근절 할 수 있다.
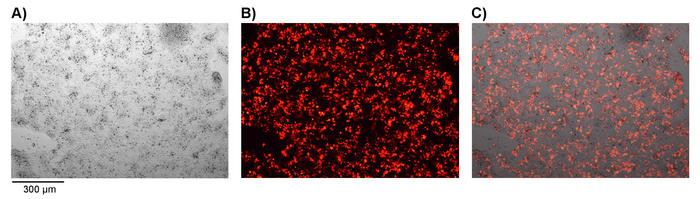
그림 1입니다. 같은 E 셀의 성공적인 transfection 확인. 같은 E 셀 retroviral 자동차 구조 및 pMP71와 pcl 에코 포장 벡터 플라스 미드 DNA 페. 성공적인 transfection mCherry 형광 표식 유전자의 표현에 의해 표시 됩니다. A) 밝은 분야 현미경 검사 법, B) 형광 현미경 검사 법 및 C) 병합 된 이미지 표시 됩니다. 확대 = 50 X. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2입니다. Cytometry에 의해 변환 효율 결정. Cytometry 하루 4 게시물 변환, 좀비 UV 라이브/죽은, mCherry, BV711를 사용 하 여 마우스 T 셀의 변환 효율을 결정 하는 데 사용은 하 고 라이브의 검출에 대 한 BV785, 자동차 건설, c d 4와 CD8 세포, 각각. 대표적인 결과 A) 비 불리고, B) mCherry.αmCD19.mCD3z와 C) mCherry.αmCD19.mCD3z.mIL12 1의 게이팅 함께 표시 됩니다) Singlets 2) 라이브 셀 3) CD4, CD8 4)와 5) 자동차를 표현 하는 mCherry 긍정적인 세포의 평가. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
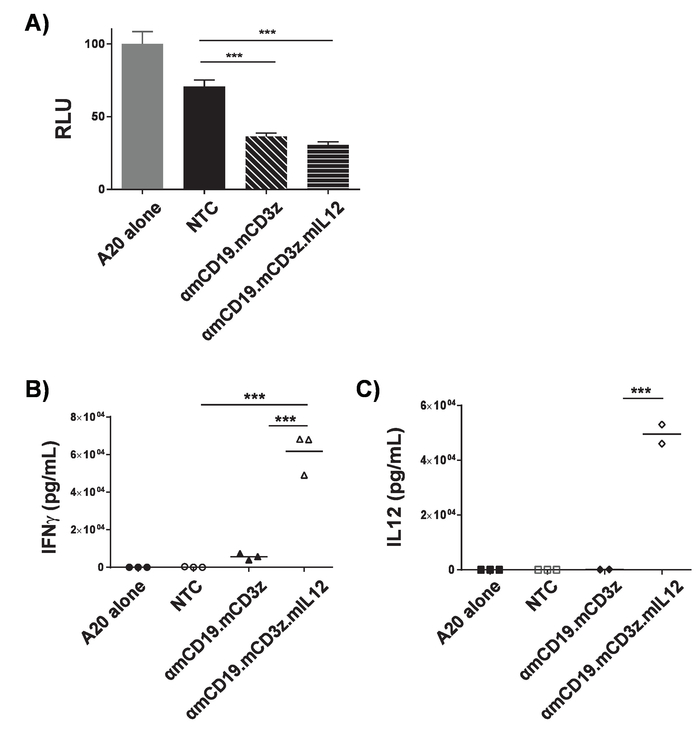
그림 3입니다. 자동차 T-세포 활동의 유효성 검사. ΑmCD19 차 T 세포 표현 luciferase 수정 A20 림프 종 세포와 공동 경작 했다 (1 x 104: 1 x 104) 16 h U-하단 96 잘 접시에 대 한. 후 공동 문화, 셀 했다 수송과, 그리고 상쾌한 수집. A) 셀 다시 PBS에 중단 되었고 luminometry 대상 셀의 가능성을 평가 하는 데 사용 되었다. 공동 문화에서 상쾌한 IFNγ (B) 및 IL-12 (C)의 존재에 대 한 평가 했다. 대상 셀에 자동차 T 세포의 비율 및 공동 문화 기간을 최적화 해야 합니다 각 자동차에 대 한 생성 하 고 대상 셀 라인. PMA와 ionomycin 치료 T 세포와 그들의 능력 세포 응답의 품질을 확인 하는 긍정적인 컨트롤로 사용할 수 있습니다. 오차 막대 표시 sd. 통계 분석 일방통행 ANOVA를 사용 하 여 수행 되었다. p < 0.001)입니다. 이 그림은17에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
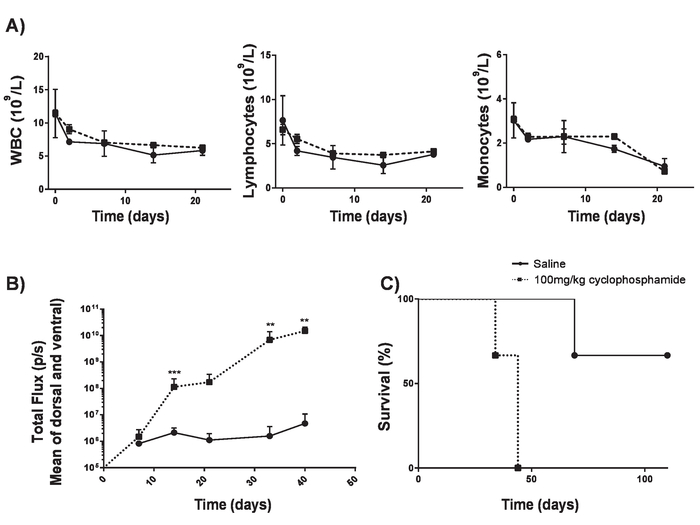
그림 4입니다. A20 림프 종 lymphodepletion 없이 설정. Cyclophosphamide는 lymphodepletion를 일으키는 원인이 되기 없이 림프 종 유도의 효율성을 높일 수 있습니다. A) cyclophosphamide의 100 mg/kg의 4 납품 후 6-8 주-오래 된 BALB/c 마우스의 혈액 카운트. 오차 막대 표시 SD B) 4 배달 cyclophosphamide의 날-1 염 분 100 mg/kg의 하루는 루미 노를 사용 하 여 측정 하는 0에서 5 x 105 A20 셀 4 납품 후 6-8 주-오래 된 BALB/c 마우스의 림프 종 부담. 쥐의 C) 생존 B). 오차 막대 표시 sd. 통계 분석 2-웨이 ANOVA를 사용 하 여 수행 되었다. * * p < 0.01, * * * p < 0.001). 이 그림 Kueberuwa 그 외 여러분 에서 수정 되었습니다. 17. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
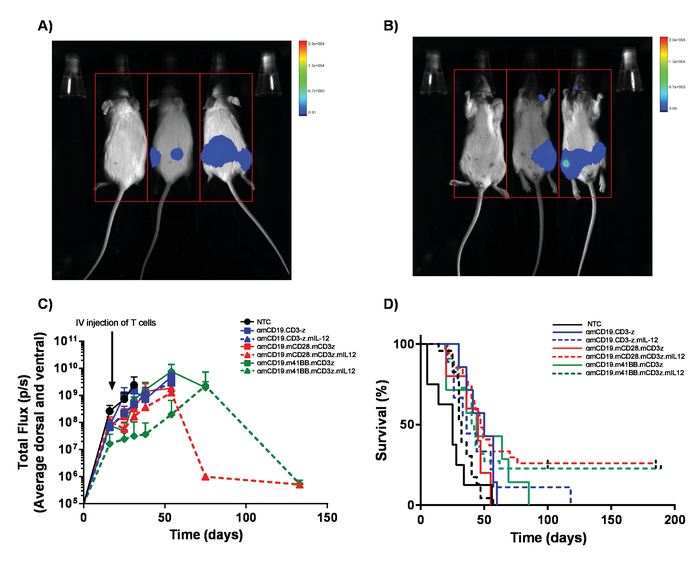
그림 5입니다. 림프 종 및 생존 모니터링. A20 림프 luciferase 표현 베어링 마우스 30 mg/mL 소의 100 µ L 복 (IP) 주사를 받을 고는 vivo에서 생물 발광 이미징 시스템을 사용 하 여 몇 군데 있었다. A) 마우스 복 부 측에 1 분 동안 노출 되었고 즉시 이미지 시체 (B)의 양쪽에 대 한 종양 중 선택 등을 성을 상실. C) lymphodepletion 없이 다양 한 αmCD19 자동차 T 세포를 받는 BALB/c 마우스의 림프 종의 대표적인 결과. 오차 막대 표시 SEM. D) 같은 쥐의 생존 율. 이 그림 Kueberuwa 그 외 여러분 에서 수정 되었습니다. 17. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
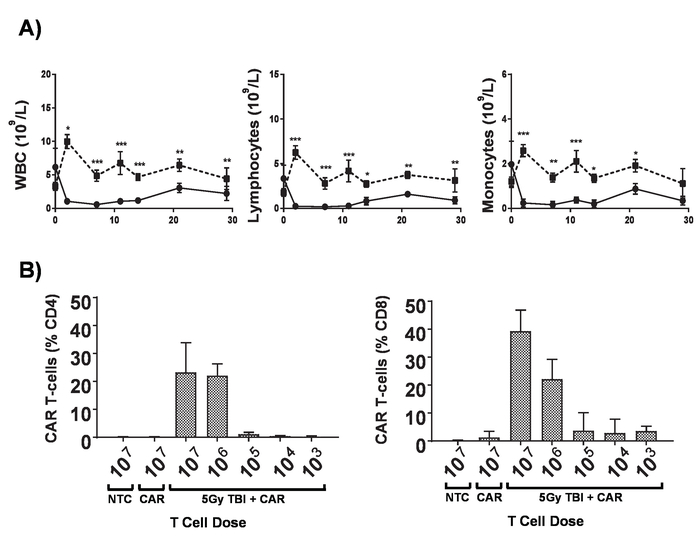
그림 6입니다. Lymphodepletion의 효과입니다. A) 0.02 Gy/분;의 복용량 비율 5 Gy TBI를 받은 후 6-8 주-오래 된 BALB/c 마우스의 혈액 카운트 오차 막대 표시 양방향 ANOVA sd. 통계 분석. p < 0.05 * * p < 0.01, * * * p < 0.001. B) CD4의 모니터링+ 와 CD8 cytometry mCherry 마커 유전자 7 일 게시물 관리에 대 한에 의해 쥐의 말 초 혈액에서+ 차 T 세포. 오차 막대 표시 sd. 이 그림 Kueberuwa 그 외 여러분 에서 수정 되었습니다. 17. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
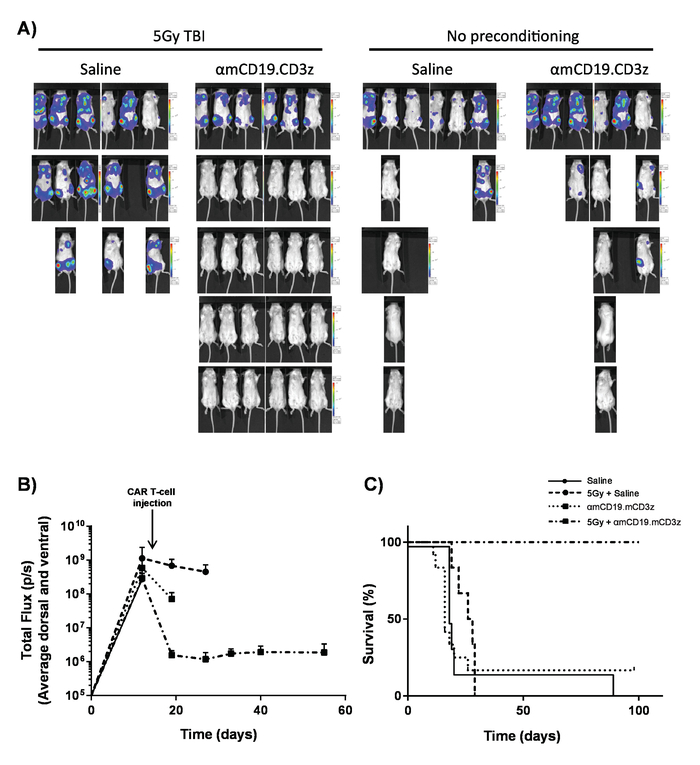
그림 7입니다. Lymphodepleting 사전 조화 차 T 세포 활동. 일반적인 결과 전날 차 T-셀 관리 5 Gy TBI의 영향을 보여주는. A) 는 vivo에서 생물 발광 이미징 시스템을 사용 하 여 30 mg/mL 소의 100 µ L 복 (IP) 주사 후 쥐의 이미징의 이미징 및 (B) 그래픽 표시. 오차 막대 표시 SEM. C) 같은 쥐의 생존. 이 그림은 수정 된 fromKueberuwa 그 외 여러분 되었습니다. 17. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
Syngeneic 마우스 모델 그대로 면역 시스템을 유지 하면서 질병 진행 및 치료의 테스트 수 있습니다. 이것은 파라마운트 immunotherapeutic 에이전트에 대 한 특히에서 면역 체계와 상호 작용 하는 치료에 관해서입니다.
여기에 설명 된 프로토콜은 두 가지 중요 한 작업 흐름, 첫 번째 자동차를 표현 하기 위해 마우스 T 셀을 수정 하 고 유전자. 이 변환의 유효성 검사 개시 7 일 필요합니다. 자동차 T 세포의 생산을 수 반하는 생쥐에서 조직의 림프의 설립이 이다. 자동차 T 세포 생산 실패 하거나 품질 되 고 부족, 거기 아니다 일반적으로 충분 한 시간 전에 마우스 대체 전지를 생산 하는 림프 종에 굴복 해야 합니다. 따라서 연구팀은 정확 하 게이 모델을 사용 하 여 성공적으로 치료 관리에 대 한 자동차 T 세포의 생산을 시간 순서 종양 투약 하 고 질병 진행 연구를 수행 하는 중요 한 이다.
낮은 T-셀 변환 효율에 대 한 일반적인 이유는 프로듀서 셀, 일반적으로 불 쌍 한 플라스 미드 순도 또는 transfection 미디어의 pH의 부정확 한 결정으로 인 한 가난한 transfection 효율 포함 되어 있습니다. 가난한 transfection T-셀 변환 효율 제한으로 전체 프로토콜 함께 진행 하기 전에 프로듀서 셀 transfection 효율을 확인 하는 것이 좋습니다. 그러나 재조합 인간 fibronectin 조각 수집 될 수 있으며 다시 사용 하는,-20 ° C에, 감소 된 변환 효율성에 여러 동결 해빙 결과 저장. 마우스 spleens 후 컬렉션은 또한 높은 얻는 것이 중요의 신속한 처리 가능한 T 세포의 생성 합니다.
여기에 설명 된 프로토콜 A20 셀 luciferase 표현 활용을 주목 한다. 이것은 선호 생물 발광 영상으로 조직의 종양 부담을 측정 하는 능력을 제공 합니다. 그러나, 기능적인 면역 체계의 존재 luciferase 응답 결과 왜곡 수 있습니다. 이전 마커 transgenes17에 쥐를 살아 나 기의 면역 반응을 테스트 했습니다. 그것은 이러한 면역 세포에 의해 종양 퇴치에 중요 한 역할을 재생 하지 않는 유효성을 A20 셀 transgenes의 무료를 사용 하 여 주요 실험을 복제 열쇠입니다.
임상 에이전트 사용 vivo에서 면역 결핍 생쥐에서 하실 수 있습니다, 하는 동안 마우스 암 세포에 대 한 마우스 자동차 T 세포를 사용 하 여 우리가 치료 효능 또는 질병 진행에 면역 체계의 기여를 평가 수 있습니다. 이 프로토콜 B-세포 림프 종 또는 IL-12 여기에 설명 된 대로의 분 비 등 추가 수정와 다른 자동차를 대상으로 하는 자동차의 전 임상 평가 위해 활용 될 수 있습니다. 그것은 그 면역 세포 사이 상호 작용 syngeneic 마우스 모델에서 평가 될 수 있습니다, 하지만 그들은 수 있습니다 하지 정확 하 게 정리 vivo에서인간 상호 작용을 언급 해야 합니다. 특히의, 인간 및 마우스 자동차 구조는 다운스트림 결과;에 달라 집니다. T 세포의 성장 위한 최적 활성화 및 셀 문화 조건에 다른20, 대상 항 식의 조직 분포 인간과 쥐 사이 다를 수 있습니다 및 경험 있는 독성 근본적으로 다를 수 있습니다. 그러므로 전 비보 및 결과 승산이 xenogeneic 모델 활용 필수적 이다.
요약 하자면, syngeneic lymphodepleted 및 lymphoreplete 모델의 림프 종 환자와 이전 항 암 치료/방사선 치료 없이 정리. 이 다양 한 새로운 면역 치료 대리인의 오는 파도와 중요 한 치료 전략의 테스트 수 있도록 임상 설정을 모방 하는 모델 시스템을 제공 합니다.
사전 컨디셔닝의 사용, 그것은 모든 마우스는 일반적으로 림프 종 선택을 취소 표시 됩니다. 와 최대 90% 완료 응답 속도 인간에서는, 이것은 대표입니다. 그러나 CD19 차 T-세포 치료에 대 한 도전을 relapses 관찰의 높은 주파수를 방지에 경첩 것입니다, 그는 종종 CD19. Relapses 하지 관찰 되었습니다이 모델에서, 그리고 종종 100 일 넘어. 병원에서 본 relapses 모방 수정 CD19 차 T-세포 치료의 미래 과제 도울 수 있었다.
공개
데이비드 Gilham 차 T 세포의 생산에서 포함 되는 Celyad에 대 한 작동 합니다. 작가의 나머지가 없다 공개 수 있습니다.
감사의 말
우리는이 연구 (그랜트 13031)와 CRUK 맨체스터 생물 자원 단위, 이미징 및 cytometry 및 분자 생물학 핵심 시설이이 작업을 지원 하기 위한 자금에 대 한 Bloodwise를 감사 하 고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filter | Appleton Woods | FC121 | |
| 0.45 µm syringe filter | Appleton Woods | FC122 | |
| 1.5ml pestle and microtube | VWR | 431-0098 | |
| 100X penicillin-streptomycin-glutamine (PSG) | Gibco | 10378016 | |
| 2-Mercaptoethanol (50 mM) | Gibco | 31350-010 | |
| Blasticidine S hydrochloride | Sigma- Aldrich | 15205 | |
| Bottle Top Filter (0.2 µm) | Scientific Laboratory Supplies | FIL8192 | |
| Brilliant Violet 711 anti-mouse CD8a Antibody | BioLegend | 100759 | 1 in 100 staining dilution. Clone 53-6.7 |
| Brilliant Violet 785 anti-mouse CD4 Antibody | BioLegend | 100552 | 1 in 100 staining dilution. Clone RM4-5 |
| Calcium chloride dihydrate | Sigma- Aldrich | C7902 | |
| Cell counting beads – CountBright absolute counting beads | Molecular Probes | C36950 | |
| Cell Strainer 100μm | VWR | 734-0004 | |
| Cyclophosphamide Monohydrate | Merck | 239785-1GM | |
| Dulbecco’s Modified Eagle medium (DMEM) - High Glucose | Sigma Aldrich | D6546 | |
| Dynabeads | Gibco | 11131D | |
| Ficoll Paque Plus | GE Healthcare | GE17-1440-03 | Sold by Sigma- Aldrich |
| Flow cytometer - LSR Fortessa x20 | BD Biosciences | 658222R1 | |
| Foetal Bovine Serum | Gibco | 10270 | |
| Haemacytometer | Appleton Woods | HC001 | |
| HEPES solution | Sigma- Aldrich | H0887 | |
| IL-12 p70 Mouse Uncoated ELISA Kit | Invitrogen | 88-7121-76 | |
| IL2, Proleukin | Novartis | PL 00101/0936 | |
| in vivo bioluminescence imaging system – in vivo xtreme II imaging system | Bruker | T149094 | |
| Ionomycin Calcium Salt | Sigma- Aldrich | I0634 | |
| Live/dead stain - Zombie Violet Fixable Viability Kit | BioLegend | 423114 | 1 in 100 staining dilution |
| Luminometer - Lumistart Omega | BMG Labtech | 415-301 | |
| Murine IFN-γ ELISA kit | Diaclone | 861.050.010 | |
| Paraformaldehyde | Sigma- Aldrich | 16005 | |
| pCL-Eco | Novus Biologicals | NBP229540 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma- Aldrich | P8139 | |
| Platinum E cell line | Cell Biolabs | RV-101 | (RRID:CVCL_B488) |
| Purified NA/LE Hamster Anti-Mouse CD28 | BD Biosciences | 553294 | Clone 37.51 |
| Purified NA/LE Hamster Anti-Mouse CD3ε | BD Biosciences | 553057 | Clone 145-2C11 |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553142 | 1 in 100 staining dilution. Clone 2.4G2 |
| Puromycin Dihydrochloride | Sigma- Aldrich | P8833 | |
| Recombinant human fibronectin fragment - RetroNectin Reagent | TaKaRa | T100B | |
| Recombinant Mouse IL-7 (carrier-free) | BioLegend | 577806 | |
| Red cell lysis buffer | eBioscience | 004-4333-57 | |
| RPMI 1640 Medium | Lonza | BE12-167F | |
| Trypsin - EDTA solution | Sigma- Aldrich | T3924 | |
| XenoLight D-Luciferin | Perkin Elmer | 122799 |
참고문헌
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM574106.pdf (2017)
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/biologicsbloodvaccines/cellulargenetherapyproducts/approvedproducts/ucm581259.pdf (2017)
- Liu, Y., Zeng, G. Cancer and Innate Immune System Interactions: Translational Potentials for Cancer Immunotherapy. Journal of Immunotherapy. 35 (4), 299-308 (2012).
- Janssen, L. M. E., Ramsay, E. E., Logsdon, C. D., Overwijk, W. W. The immune system in cancer metastasis: friend or foe. Journal for ImmunoTherapy of Cancer. 5 (1), 79 (2017).
- Pandya, P. H., Murray, M. E., Pollok, K. E., Renbarger, J. L. The Immune System in Cancer Pathogenesis: Potential Therapeutic Approaches. Journal of Immunology Research. 2016, 13 (2016).
- Vinay, D. S., et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology. 35, S185-S198 (2015).
- Gajewski, T. F., Meng, Y., Harlin, H. Immune Suppression in the Tumor Microenvironment. Journal of Immunotherapy. 29 (3), 233-240 (2006).
- Munn, D. H., Bronte, V. Immune suppressive mechanisms in the tumor microenvironment. Current opinion in immunology. 39, 1-6 (2016).
- Vanderlugt, C. L., Miller, S. D. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nature Reviews Immunology. 2, 85 (2002).
- Hardwick, N., Chain, B. Epitope spreading contributes to effective immunotherapy in metastatic melanoma patients. Immunotherapy. 3 (6), 731-733 (2011).
- Makkouk, A., Weiner, G. Cancer Immunotherapy and Breaking Immune Tolerance-New Approaches to an Old Challenge. Cancer research. 75 (1), 5-10 (2015).
- Jackson, S. R., Yuan, J., Teague, R. M. Targeting CD8(+) T-cell tolerance for cancer immunotherapy. Immunotherapy. 6 (7), 833-852 (2014).
- Brentjens, R. J., et al. Lymphodepletion and tumor burden govern clinical responses in patients with B-cell malignancies treated with autologous, CD19-targeted T cells. Journal of Clinical Oncology. 29 (15_suppl), 2534 (2011).
- Brentjens, R. J., et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood. 118 (18), 4817 (2011).
- Hay, K. A., et al. Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimeric Antigen Receptor-modified T Cell Therapy. Blood. 130, 2295-2306 (2017).
- Zhang, T., et al. Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase I clinical trials: a meta-analysis. Oncotarget. 6 (32), 33961-33971 (2015).
- Kueberuwa, G., Kalaitsidou, M., Cheadle, E., Hawkins, R. E., Gilham, D. E. CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity. Molecular Therapy - Oncolytics. 8, 41-51 (2018).
- Engels, B., et al. Retroviral vectors for high-level transgene expression in T lymphocytes. Human Gene Therapy. 14 (12), 1155-1168 (2003).
- Parkinson, C. M., et al. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. Journal of Visualized Experiments: JoVE. (54), e2966 (2011).
- Kueberuwa, G., et al. CCR7(+) selected gene-modified T cells maintain a central memory phenotype and display enhanced persistence in peripheral blood in vivo. Journal for Immunotherapy of Cancer. 5, 14 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유