Method Article
형광 효소 분석 결과 플랫폼에 그들의에서 젤 Renaturation 재조합 융합 단백질의 사용
요약
여기, 우리 N 터미널 hexahistidine/맥 아당 의무적인 단백질 및 형광 단백질 융합 재조합 기판 니켈 nitrilotriacetic의 표면에 부착 된 최근에 개발한 효소 분석 플랫폼의 상세한 절차를 제시 산 자기 agarose 구슬입니다. 나트륨 라우릴 황산 polyacrylamide 젤 전기 이동 법으로 분리 분석 결과 샘플의 후속에 젤 분석 또한 제공 됩니다.
초록
프로 테아 제는 생명체의 여러 생물 학적 경로 병 인; 그들의 필수적인 역할 때문에 집중적으로 공부 효소 따라서, 그들은 중요 한 약 대상입니다. 우리는 재조합 융합 단백질 기판의 사용에 따라 분해 활동의 수사에 대 한 분석 결과 자기 agarose 구슬-기반 플랫폼을 개발 했습니다. 이 분석 결과 시스템의 사용을 설명 하기 위해 한 프로토콜은 1 (hiv-1) 효소 인간 면역 결핍 바이러스 종류의 예제에 제공 됩니다. 도입된 분석 결과 플랫폼 프로 테아 제, mutagenesis, 운동, 금지, 또는 구체적 연구, 효소 활동 측정 등의 생 화 확 적인 특성에 효율적으로 이용 될 수 있다 그리고 그것은 높은 처리량에 적합 있을 수 있습니다. 기판 검사 또는 다른 분해 효소에 적용할 수 있습니다.
이 분석 결과 시스템에 적용 된 기판 포함 N 맨끝 hexahistidine (그6)과 맥 아당 의무적인 단백질 (MBP) 태그, 담배에 대 한 분열 사이트 엣지 바이러스 (TEV)와 에이즈-1 프로 테아 제, C 터미널 형광 단백질. 기판 대장균 세포에 효율적으로 일어날 수 있다 그리고 니켈 (Ni)-킬레이트-코팅된 비즈를 사용 하 여 쉽게 정화. 분석 결과, 동안 비드 연결 된 기판의 분해 절단 fluorimetry에 의해 측정 될 수 있는 형광 분열 파편의 석방을 이끌어 낸다. 또한, 분열 반응 나트륨 라우릴 황산 polyacrylamide 젤 전기 이동 법 (SDS 페이지)에 의해 분석할 수 있습니다. 에 젤 renaturation 분석 결과 구성 요소에 대 한 프로토콜 부분 renaturation 형광 단백질의 분자량 및 형광에 따라 그들의 감지 하면 설명도 되어 있습니다.
서문
분해 효소는 대사 경로 및 산업 어플리케이션에 그들의 중요성 때문에 가장 집중적으로 조사 효소 그룹에 속한다. 바이러스 성 질병에 그들의 중요 한 역할, 혈액 응고, 암의 규칙 및 심장 혈관 및 신경 퇴행 성 질환 약물 발견의 분야에서 저명한 대상 프로 테아 제를 만드는. 따라서, 기질 특이성의 상세한 특성 및 관심의 프로 테아 제 (PR)의 프로 파일링 억제제 중추 이며 선호, 비용 효율, 빠르고 강력한 생 화 확 적인 분석 실험1,2,에 의해 수행 됩니다. 3.
요즘, 복합 프로 파일링에 대 한 신약의 분야에 적용 하는 체 외 효소 분석 실험의 대부분은 균질, 형광 펩타이드 기반 및 높은 처리량 검열 (HTS)-호환 플랫폼4. 또한, 레이블이 지정 된 펩 티 드만 라이브러리 심사, 적합 하지 않습니다 하지만 그들은 또한 선택 된 기판에 운동 매개 변수 효소의 결정에 대 한 훌륭한 도구를 제공. 다른 경우에, 어디는 기판의 라벨은 불가능, 분리 기반 분석 분해 반응3의 운동 특성을 평가 하기 위해 가능한 솔루션을 제공할 수 있습니다.
일반적으로, 체 외 효소 분석 실험 기반 기판의 두 종류의 사용: 짧은 펩 티 드 또는 전체 단백질. 어디 짧은 펩 티 드 순서의 분열 분열 속성을 충분히 반영, 이러한 경우에 다음과 같은 표준 방법을 적용 됩니다: (i) 테스트 산화 된 인슐린 B-체인, (ii) 같은 표준 단백질 기질 검사 조합 화학, 또는 (iv)에 의해 만들어진 합성 하 고 붙일 레이블 펩타이드 라이브러리 심사 다른 프로 테아 제, (iii)의 상용 기판 유전자 방법을 사용 하 여, 예를 들면, 생물학 표시 기술5, 6. 기존의 분류 외 다른 새로운 플랫폼도 있습니다 기판 생성 (예를 들어, 대형 프로테옴 파생 된 펩타이드 라이브러리7 또는 재조합 융합 같은 유전 방법의 특별 한 하위의 단백질 기반 기판8,9,10,,1112).
위에서 언급 한 기판 형식 및 분석 실험의 모두 그들의 자신의 이점 및 한계, 그리고 분석 결과 형식 결합 또는 알려진된 플랫폼의 장점을 향상의 개발은 여전히 수요. 여기 우리는 재조합 형 기질을 이용 하는 형광 효소 분리 기반 분석 결과 대 한 프로토콜을 설명 합니다. 그의6 과 MBP 태그 TEV 홍보, 뒤에의 C-터미널 형광 단백질 (FP) (그림 1A)에 직접 연결 된 기판 시퀀스의 제어 분열 사이트에 융합이 융해 단백질에 의하여 이루어져 있다. 복제는 '복제 카세트'로 관심의 분열 사이트에 대 한 코딩 DNA 순서의 이전 금지 endonucleases 여 선형화 된 식 플라스 미드에 단일 결 찰 반응에 의해 수행할 수 있습니다.
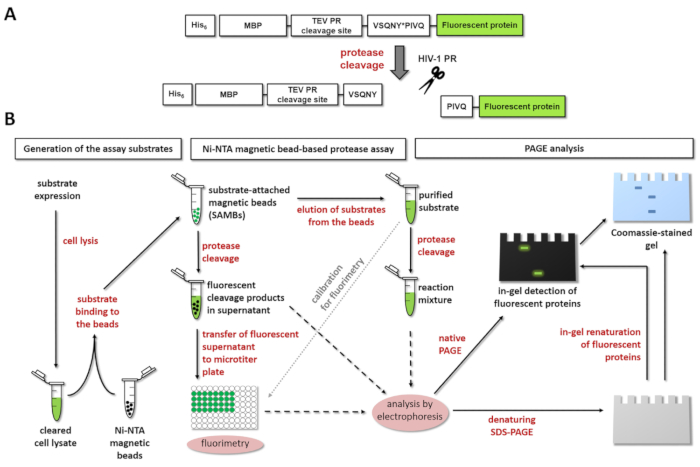
그림 1: 형광 효소 분석 실험의 원리. 프로 테아 제 (A) 형광 기판 및 인간 면역 결핍 바이러스 1 형에 의해 그것의 분열의 도식 표현 (HIV-1) 표시 됩니다. 에이즈-1 효소의 매트릭스/capsid 분열 사이트 시퀀스 내에서 분열 위치를 표시 하는 화살표 (VSQNY * PIVQ). (B)는 형광 기판 분석 하 효소 반응 Ni-NTA 자석 구슬-기반 분석 결과 의해 polyacrylamide 젤 전기 이동 법에 의해 뿐만 아니라, 워크플로 다이어그램에서와 같이 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
분해 분석 실험 기판-포함 하는 선호도 태그, 분해 분열 사이트 및 형광 단백질이 이미 유사한 재조합 단백질을 사용 하 여 설명 하 고 있지만8,,910, 시스템 제시 여기 통합 하 고이 방법의 장점에 개선 계획 이다. 중요 한 차이점은이 분석 결과 플랫폼 융합 단백질 기질 단백질 용 해도13 강화 TEV PRs에 대 한 제어 분열 사이트를 포함 하는 MBP 갖추고 있습니다. 또한,는 기판 새로운 세대 형광 단백질, 매우 안정 되 고 기판 집계 방지 단위체 양식을 포함 합니다. MTurquoise2 및 mApple 융합 형태14의 이전 게시 된 응용 프로그램, 게다가 여기 우리 또한 표시는 단위체를 포함 하는 재조합 형 기판의 사용에 의해 주어진 결과 향상 노란 형광 성 단백질 (mEYFP) 형광 태그. 이로써 우리 다른 형광 단백질 시스템의 호환성을 보여 하 고 몇 가지 일반적인 유형의 효소 분석 실험에 의해 취득 될 수 있는 결과 나타냅니다.
재조합 융합 단백질 대장균 BL21(DE3) 세포에 표현 되 고 니켈 nitrilotriacetic 산 (Ni-NTA) 분석 결과 대 한 기판으로 사용 되는-자기-agarose-구슬-첨부 양식 코팅. C 터미널 분열 제품 관심의 효소에 의해 분열 시 상쾌한에 구슬 표면에서 해방 됩니다. 자석 구슬에서 (포함 하는 효소 분열 제품) 상쾌한 분리 후 형광 효소의 분열 속성 확인을 측정할 수 있습니다. 앞에서 설명한 방법을 달리 여기, 시스템에 기판 및 C 터미널 분열 제품의 양은 유일 하 게 정량 상세한 기판 교정 절차에 따라. 분석 결과 시스템 분석 결과 샘플;의 SDS 페이지 분석에 의해 지원 될 수 있습니다. 후속 형광에 젤 시각화는 전기 이동 법 또는 nondenatured 및 변성 형광 구성 요소, 각각14-젤 renaturation 즉시 적용할 수 있습니다.
유연성과 구조 '복제 카세트'의 다양 한 구성으로 시퀀스의 시간 및 비용 효율적인 삽입을 허용 하 고, 따라서 기판 라이브러리의 생성을 촉진. 모든 분석 결과 단계는 자동화 및 HTS 호환, 이후 시스템 매력적 일 수 있다 특히, 예를 들어, 효소 특이성 측정 및 mutagenesis 연구, 또는 그것은 또한 활용 될 수 있습니다 효과적으로 산업 protease 억제제 심사에 대 한 및/또는 항 바이러스 약물 개발입니다.
효소 활동적인 매개 변수 (k고양이, Km) 개발된 분리 기반 분석 결과;에 의해 결정 될 수 있다 따라서, 그것은 적당 한 시간 코스, 기판에 따라 다릅니다, 그리고 억제 연구 등 개별 효소 활동적인 측정을 수행 수 있습니다. 이 자주 활용된 합성 펩타이드 기판에 대 한 좋은 대안을 제공 하는 재조합 융합 단백질 기질 때문에 높은 유사성에 대 한 그들의 polyprotein 기판에, 그들은 자연스럽 게 발생 대표 증명 효소-기질 상호 작용 더 정확 하 게.
프로토콜
1. 세대 기판 코딩 식 플라스 미드의
- PacI 및 NheI 금지 endonucleases, pDest 그의6-MBP FP 식 플라스 미드를 선형화. PDest-그의6-MBP FP의 세대에 대 한 Bozóki 외.14를 참조 하십시오.
- PDest-그의6-MBP FP 식 플라스 미드의 1500-2000 µ g, 2 µ L 각 PacI의 추가 및 NheI 금지 endonucleases, 10 x 버퍼의 10 µ L ( 재료의 표참조), 그리고 nuclease 무료 물 (있) microcentrifuge 관에서 100 µ L.
- 1 시간 동안 37 ° C에서 반응 혼합물을 품 어.
- DNA 보라색 염료 반응 혼합물에 로드 x 6의 20 µ L을 추가 하 고 분열 제품 사용 하 여 1 %agarose 젤 전기 이동 법으로 분리. 1 kB DNA 사다리 표준으로 적용 됩니다.
- 태 버퍼 (40 mM Tris, 20 m m 초 산, 1 mM EDTA, pH 8.5) 포함 20 µ L SYBR 녹색 솔루션의 20 mL에 15 분 동안 젤 린스 하 고 날카로운 도구를 사용 하 여 agarose 젤 선형화 플라스 미드의 밴드를 삭제할.
참고: 어두운 독서 블루 transilluminator (DRBT)에 의해 젤을 조명 하는 동안 약 7-8 kB에서 이산 하 고 밝은 대역으로 나타납니다 선형화 pDest 그의6-MBP FP 플라스 미드. - 제조업체의 지침에 따라 젤 추출 키트를 사용 하 여 젤 조각에서 선형화 식 플라스 미드 정화.
- 선형화 pDest 그의6-MBP FP 식 플라스 미드에 기판 시퀀스를 삽입 합니다.
- 앞으로 (FWD) 및 역방향 (계) 대장균 코 돈 최적화 oligonucleotide 뇌관 관심의 기판 시퀀스에 대 한 코딩 anneal.
참고: 단련 한 뇌관 PacI 및 NheI 금지 분열 endonuclease (그림 2)에 해당 하는 응집력 끝 어귀 될 것입니다.- 200 선형화 식 플라스 미드의 믹스 150 ng ng FWD 및 200의 계 oligonucleotide 뇌관 0.2 mL 중 합 효소 연쇄 반응 (PCR)에 튜브와 있을 추가 하 여 17 µ L 볼륨을 조정의 ng.
- 2 분 동안 65 ° C에서 그리고, 적어도 2 분 동안 4 ° C에 혼합물을 품 어.
- 결 찰 하 여 선형화 플라스 미드로 단련 한 뇌관의 삽입을 수행 합니다.
- 선형화 플라스 미드와 단련 한 뇌관을 포함 하는 혼합물에 T4 리가 버퍼 (10 배)의 2 µ L 및 T4 리가의 1 µ L를 추가 합니다.
- 16 h 16 ° C에서 결 찰 혼합물을 품 어.
- 앞으로 (FWD) 및 역방향 (계) 대장균 코 돈 최적화 oligonucleotide 뇌관 관심의 기판 시퀀스에 대 한 코딩 anneal.

그림 2 : Oligonucleotide 뇌관 분해 분열에 대 한 코딩 시퀀스 사이트. 정방향 및 역방향 뇌관 인코딩하는 VSQNY * 에이즈-1 홍보의 PIVQ 분열 사이트 순서 상호 보완적인 oligonucleotide 뇌관 어 닐 링 후 짧은 이중 가닥 DNA PacI 및 NheI 금지 endonucleases의 해당 끈끈한 끝을 포함 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 결 찰 혼합물의 5 µ L에 의해 BL21(DE3) 유능한 세포의 100 µ L를 변환 하 고 lysogeny 국물 (파운드) 한 천 배지 암 피 실린을 포함 하는 셀을 확산.
참고: 형광 단백질만 성공적인 결 찰 후 N 맨끝 퓨전 태그와 동일한 열려있는 독서 프레임에 있을 것입니다. 변환 후 몇 일 (관심의 삽입된 분열 사이트에 대 한 코딩 식 플라스 미드를 포함 하는) 식민지 보이는 형광 또는 심지어는 DRBT를 사용 하지 않고 표시 됩니다. - 글리세롤 재고 묘사 식민지에서 준비 합니다.
- 개별 식민지 파운드 매체 (100 µ g/mL의 최종 농도)에서 암 피 실린 포함의 5 µ L를 포함 50 mL 원심 분리기 튜브로 씻는 다.
- 지속적으로 220 rpm; 동요 하면서 8 h 37 ° C에서 그것을 품 어 그런 다음 실 온에서 5 분 동안 1000 x g 에서 원심 분리 하 여 세포를 수확.
- 부드럽게 80% 글리세롤 용액 (증류수로 희석) 1 mL에 셀을 일시 중단 하 고 추가 500 µ L 10 mM MgCl2 솔루션의는 서 스 펜 션.
- 냉동 관에 정지를 전송 하 고-70 ° c.에 주식을 저장
- DNA 시퀀싱에 의해 생성 된 플라스 미드의 순서를 확인 합니다.
- 50 mL 원심 분리기 튜브에서 100 µ g/mL 암 피 실린 포함 된 파운드 매체의 5 ml (1.7 단계에서 준비) 글리세롤 주식의 10 µ L를 추가 합니다.
- 지속적으로 220 rpm; 흔들어 동안 16 h 37 ° C에서 현 탁 액을 품 어 그런 다음 4 ° c.에서 10 분 2000 x g 에서 원심 분리 하 여 세포를 수확
- 격리 식 플라스 미드 플라스 미드 miniprep에 의해 셀 펠 릿에서 키트 ( 재료의 표참조) DNA 연속을 위한 순화 된 플라스 미드를 사용 하 여 제조업체의 지침에 따라.
참고: 시퀀싱에 대 한 5'-GATGAAGCCCTGAAAGACGCGCAG-3' (앞으로), 5'-GCAAGGCGATTAAGTTGGGTAACGC-3' (역방향) oligonucleotide 뇌관을 사용할 수 있습니다.
2입니다. 형광 기판의 표현
- 초보 문화를 준비 합니다.
- 50 mL 원심 분리기 튜브에서 100 µ g/mL 암 피 실린 포함 된 파운드 매체의 5 ml (1.7 단계에서 준비) 글리세롤 주식의 10 µ L를 추가 합니다.
- 지속적으로 220 rpm에서 떨고 있는 동안 15 h 37 ° C에서 정지를 품 어.
- 세균성 문화 (5 mL) 50 mL 500 mL 무 균 삼각 플라스 크에 100 µ g/mL 암 피 실린 포함 된 신선한 파운드 매체의 전송.
- 지속적으로 220 rpm에서 떨고 있는 동안 0.6-0.8 600 nm 파장에서의 흡 광도를 37 ° C에서 세포를 성장 한다.
참고: 항생물질 치료 단계 2.5에 적용 될 경우 권장 되지 않습니다 600 이상 0.6의 흡 광도를 셀 성장 nm. - 유도 단백질 표정 1mm 최종 농도에 이소프로필 β-D-1-thiogalactopyranoside (IPTG)를 추가 합니다.
- 항생물질 치료 적용 되지 않으면, 지속적으로 220 rpm에서 흔들어 동안 37 ° C에서 3 h에 대 한 문화를 품 어 고 단계 2.6 프로토콜을 계속 합니다. 항생물질 치료 적용 단계 2.5.1-2.5.3와 프로토콜을 계속 합니다.
참고: 일부 FPs 대장균 세포에 의해 생산 장시간 성숙 할 수 있습니다 (이전 작업 참조)16,17; 이러한 경우에 단백질 번역 수 있습니다 필요에 따라 체포 될 항생물질 치료에 의해 기판 솔루션의 형광 수확량을 증가 하기 위하여.- 지속적으로 220 rpm; 흔들어 동안 37 ° C에서 2 h 세포 현 탁 액을 품 어 그런 다음, 추가 (200 µ g/mL의 최종 농도)에 항생물질 솔루션.
- 지속적으로 220 rpm에서 흔들어 동안 37 ° C에서 형광 단백질의 숙성 시간에 따라 세포 배양 품 어.
- 2 x 25 mL 50 mL 원심 분리기 튜브 청소 및 4 ° c.에 15 분 동안 4000 x g 에서 원심 분리 하 여 세포를 수확 하는 문화를의 전송
- 삭제는 상쾌한 고 적어도 1 시간-70 ° C에서 세균성 세포 펠 릿을 저장 합니다.
참고: 표현된 형광 기판 포함 된 셀 또는 심지어는 DRBT를 사용 하지 않고 보이는 형광 표시.
3. 세포 파쇄
- 얼음에 언된 셀 펠 릿을 놓고 15 분 동안 녹여 보자.
- 펠 릿에 세포의 용 해 버퍼 (50mm NaH2포4, 300 mM NaCl, 이미 10 m m, 0.05% 트윈 20, pH 8)의 2 개 mL를 추가 하 고 셀을 일시 중단.
- 정지를 갓된 phenylmethanesulfonyl-불 소 (PMSF) 프로 테아 제 억제 물 솔루션 (8.7 mg/mL, 에탄올에 용 해)의 10 µ L를 추가 합니다.
- 현 탁 액을 lysozyme의 2 밀리 그램 및 20 단위의 DNase 추가 하 고 일시 중단.
- 15 분, 및 소용돌이 얼음에 정지를 품 어 그것 때때로.
- 1.5 mL microcentrifuge 관에는 서 스 펜 션의 2 x 1 mL를 전송 하 고 3 분, 10 라운드에서 정지를 sonicate 쥡니다 및 5의 s 휴식의 s.
- 10000 x g ; 실 온에서 20 분에 관을 원심 다음, 각 관에서 형광 상쾌한 (허가 세균성 세포 lysate)을 신중 하 게 제거 하 고 새로운 microcentrifuge 관에 그것을 전송.
참고: 지운된 lysates 형광 기질을 포함 하 또는 심지어는 DRBT를 사용 하지 않고 보이는 형광 표시 하 고 최대 2 주 동안 4 ° C에서 저장 될 수 있습니다. 그것을 동결 하지 않습니다. 맑게 lysates 샘플 준비 효소 분석 결과 (참조 섹션 4.1)에 대 한 직접 이용 될 수 있다 또는 또한 기판 정화에 대 한 사용할 수 있습니다 (단계 4.5.1 참조).
4. Ni NTA 자석 구슬-기반 효소 분석 결과
참고: 분석 결과 플랫폼의 유연성으로 인해 그것은 최적화할 수 있습니다 다양 한 유형의 연구를. 이러한 이유로, 선택의 효소의 활동 속도 차이로 인해 일부 (어디 표시 됩니다) 분석 결과 매개 변수에 명시적으로 설명 하실 수 없습니다 하지만 개별 목표와 실험 설계를 최적화 하는 데 필요한. 지도,으로 연구의 어떤 종류의 매개 변수는 특정 단계에 표시 됩니다.
- 샘플 준비
- 기판 연결 자석 구슬의 세대
- 닫힌된 2 mL 낮은 단백질 바인딩 (참조 테이블의 재료) microcentrifuge 튜브를 포함 하는 새 또는 재활용 (참조 섹션 4.7) Ni NTA 자석 agarose 구슬 자석 입자 집중 (MPC)에 배치 합니다.
참고: 적용 된 비드 서 스 펜 션의 양을 실험 설계에 따라 설정할 수 것입니다. 우리는 각 실험에서 자석 구슬 솔루션 (5%, v/v)의 1 mL을 사용합니다. - 구슬 벽 그리고/또한 microcentrifuge 튜브;의 뚜껑에 붙어 수 있습니다. 따라서 MPC 구슬의 모든 수집 되어 있는지 확인을 모든 방향에서 거꾸로 설정 합니다.
- 상쾌한을 제거 하 고 그것을 폐기.
- 세포의 용 해 버퍼 하 여 구슬을 씻어.
- 구슬에 세포의 용 해 버퍼의 1.8 mL을 추가 하 고는 MPC에서 닫힌된 튜브를 제거 합니다.
- 진동 및/또는 샘플은 완전히 동 질 때까지 튜브를 거꾸로 돌리는 튜브에 비즈를 일시 중단 합니다.
- MPC에 다시 튜브를 놓고 뒤집어 그것 구슬 수집 합니다.
- 튜브를 열고는 상쾌한을 삭제 합니다.
- 구슬에 1.0-1.8 mL는 허가의 lysate (단계 3.7에서에서 준비)를 추가 하 고는 MPC에서 튜브를 제거.
- 구슬과 완전히 균질 천천히 30 분 동안 실내 온도에 회전으로 튜브를 회전 때까지 거꾸로 닫힌된 튜브를 설정 합니다.
- MPC에 배치 하 고 뚜껑 및 구슬에서 지운된 세포 lysate를 제거 합니다.
참고: 지운된 세포 lysate 수 있습니다 삭제 또는 추가 사용 하기 위해 저장 (3.7 단계 후 메모를 참조). - 1% 추가 트윈 20 (pH 7) 기판 부착 자석 구슬 (SAMBs).
참고: SAMBs 또는 심지어는 DRBT를 사용 하지 않고 보이는 형광 표시.
- 닫힌된 2 mL 낮은 단백질 바인딩 (참조 테이블의 재료) microcentrifuge 튜브를 포함 하는 새 또는 재활용 (참조 섹션 4.7) Ni NTA 자석 agarose 구슬 자석 입자 집중 (MPC)에 배치 합니다.
- SAMBs의 세척
- MPC에 SAMB 서 스 펜 션 튜브를 놓고는 상쾌한을 삭제 합니다.
- SAMBs 3를 씻어 각 버퍼 x: 1%의 i) 1.8 mL 트윈 20 (pH 7); ii) 1.8 mL 세척 버퍼 (50mm NaH2포4, 300 m m NaCl, 5mm 이미, 0.05% 트윈 20, pH 7); 분열 버퍼 (50mm NaH2포4, 300 m NaCl, 0.05% 트윈 20, pH 7 m)의 iii) 1.8 mL.
참고: 세척 절차 단계 4.1.1.4 참조. 분열 버퍼 실험 필요에 따라 변경 될 수 있습니다 하지만 호환성을 결정 하기 위해 Ni NTA 자석 구슬의 설명서를 확인 하는 것이 좋습니다.
- SAMB 재고 솔루션의 준비
- SAMB 재고 솔루션을 만드는 세척된 SAMBs를 분열 버퍼를 추가 합니다.
참고: 후 버퍼를 추가 하지 마십시오 흔들어 또는 튜브를 뒤집어. 분열 버퍼의 볼륨 개별 실험 설계에 따라 달라 집니다 그리고 자석 구슬 (단계 4.1.1.1 참조)의 수와 단계 4.1.4.2에에서 사용 될 볼륨에 따라 계산 해야 합니다. 2 mL 튜브에 대 한 적용 된 볼륨은 최대 1900 µ L ( 표 1참조). SAMB 재고 솔루션의 권장된 마그네틱 비드 밀도 2%-10% (v/v)입니다.연구 유형 양의 분열 버퍼 (µ L) S-종속 측정 (그림 4) 1600 시간 과정 측정 (그림 5A) 1600 저해 연구 (그림 5B) 1900 pH 의존 연구 (그림 6) 1400
표 1: 측정의 다른 종류에서 SAMB 재고 솔루션을 준비 하는 데 사용 하는 분열 버퍼의 볼륨. - MPC에서 닫힌된 튜브를 제거 합니다. 즉시 SAMB 재고 솔루션을 사용 하거나 24 h까지 4 ° C에서 그것을 저장 합니다.
- SAMB 재고 솔루션을 만드는 세척된 SAMBs를 분열 버퍼를 추가 합니다.
- SAMB 재고 솔루션을 사용 하 여 분석 결과 샘플의 세대
참고: 분석 결과의이 부분의 세부 사항을 강력 하 게 개별 실험 설계 (샘플 종류는 표 2에 나와 있습니다)에 따라 달라 집니다.샘플 유형 노트 반응 샘플 (R) -분열 속성 평가에 사용
-효소와 버퍼 분열에서에서 기판 모두 포함기판 빈 샘플 (B) -자발적인 기판 분리 평가 대 한 사용 (단계 4.6.2 참조)
-버퍼 분열에서에서 기판만 포함기판 컨트롤 샘플 (C) -detemining 기질 농도 (단계 4.6.3 참조)
-차입 버퍼에서 기판만 포함
표 2: Ni NTA 자석 구슬-기반 효소 분석 결과의 샘플 종류.- 분석 결과 샘플에 대 한 낮은 단백질 바인딩 microcentrifuge 튜브의 2 개 mL를 준비 합니다.
참고: 다른 낮은 단백질 플라스틱 그릇을 바인딩 사용할 수도 있습니다. 라운드 또는 평면 하단 튜브를 사용 하 여 SAMBs의 자유로운 이동 보장. 표 3에서 튜브의 권장 되는 수를 참조 하십시오.연구 유형 R B C S-종속 측정 (그림 4) 5 5 2 시간 과정 측정 (그림 5A) 6 6 2 저해 연구 (그림 5B) 7 7 1 pH 의존 연구 (그림 6) 5 5 1
표 3: 시연된 연구에서 각 샘플 유형에 필요한 2 mL microcentrifuge 튜브의 수입니다. - 동질성까지 SAMB 재고 솔루션을 중단 하 고 즉시 샘플 튜브에 반응에서 분석할 기판의 양을 전송. 권장된 량은 25-300 µ L, 하지만 개별 실험 디자인 (표 4)에 따라 설정 됩니다.
참고: 모든 SAMBs 튜브의 하단에 측정 된 경우 확인 하십시오. SAMBs는 시험 결과 왜곡할 수 있는 튜브의 벽에 충실 수 있습니다. 다른 볼륨을 순차적으로 측정할 수 있다면, 높은 볼륨 aliquoting를 시작 하 고 펫 피 펫 팁의 변화를 최소화 하려고 합니다.연구 유형 R B C S-종속 측정 (그림 4) 25-50-100-150-250 25-50-100-150-250 25 시간 과정 측정 (그림 5A) 25 25 25 저해 연구 (그림 5B) 120 120 120 pH 의존 연구 (그림 6) 100 100 100
표 4: SAMB 솔루션의 시연된 연구에서 각 샘플 형식의 샘플 튜브 측정. - MPC에 aliquoted SAMB 정지를 포함 하는 샘플 튜브를 놓고 약간 MPC를 앞뒤로 이동 합니다.
- 신중 하 게는 SAMBs에서에서 상쾌한을 제거 하 고 그것을 폐기.
- MPC에서 튜브를 제거 하 고는 SAMBs를 신중 하 게 계산 된 양의 반응 버퍼 (분열 또는 차입 버퍼 [100 mM EDTA, 0.05% 트윈 20, pH 7])를 추가 합니다.
참고: 개별 실험 디자인 (표 5)에 따라 버퍼 볼륨을 계산 합니다. 2 mL 튜브에 대 한 반응 혼합물 (이 단계에서 추가 될 반응 버퍼의 볼륨 + 단계 4.2.3에서에서 추가할 솔루션의 볼륨)의 권장된 최종 볼륨은 50-150 µ L. 추가 버퍼에서 세척 되는 SAMBs의 모든 있는지 확인. 차입 버퍼 분열 버퍼 기판 제어 (C) 샘플의 경우에 대신 사용 됩니다. 저해 연구에 대 한 선택의 억제제가이 단계에서 추가 하는 것이 좋습니다.연구 유형 양의 반응 버퍼 (µ L) S-종속 측정 (그림 4) 68 µ L 분열 버퍼 시간 과정 측정 (그림 5A) 68 µ L 분열 버퍼 저해 연구 (그림 5B) 67.3 µ L 분열 버퍼 + 0.7 µ L 억제제 재고 솔루션 * pH 의존 연구 (그림 6) 69.5 µ L 분열 버퍼 * *
표 5: 시연된 연구에 반응 버퍼의 볼륨. * Amprenavir 디 메 틸-⁚;에 해결 되었다 amprenavir 재고 솔루션 (1에서까지 nM 1 µ M 농도) 억제 연구에 적용 된 ( 그림 5B참조). * * PH 6.0-8.5에서에서 원거리 적용된 분열 버퍼의 pH - 튜브의 뚜껑을 닫습니다. 이제 샘플 분석 결과 대 한 준비가 되었습니다.
참고: 샘플 최대 24 h, 4 ° C에서 저장 될 수 있다 하지만 저장은 SAMB 재고 솔루션 준비 후 즉시 사용 하는 경우만 (단계 4.1.3.2 참조).
- 분석 결과 샘플에 대 한 낮은 단백질 바인딩 microcentrifuge 튜브의 2 개 mL를 준비 합니다.
- 기판 연결 자석 구슬의 세대
- 분해 반응의 개시
- 실험 필요에 따라 분해 효소 솔루션을 준비 합니다.
참고: 그것은 분열의 버퍼를 사용 하 여 분해 하는 효소를 희석 하 고 좋습니다. 에이즈-114 TEV PRs18 의 정화에 대 한 프로토콜 이전 출판 되었습니다. - Thermoshaker의 교 반 속도 (600 rpm) 및 (표 6) 부 화 온도 설정 합니다.
연구 유형 부 화 온도 (° C) S-종속 측정 (그림 4) 37 시간 과정 측정 (그림 5A) 37 저해 연구 (그림 5B) 37 pH 의존 연구 (그림 6) 30
표 6: 다른 연구 종류에 적용 하는 외피 온도. 에이즈-1 홍보, 37 ° C는 권장, 30 ° C는 권장 TEV 홍보 - 분해 반응을 초기화 하기 위한 반응 샘플을 효소 솔루션을 추가 합니다.
참고: 공백 기판 (B) 및 C 샘플, 분열 버퍼 (버퍼 효소)와 추가 차입 버퍼, 각각 합니다. 볼륨 개별 실험 필요 (표 7)에 따라 계산 될 것입니다. 2 mL 튜브에 대 한 반응 혼합물 (단계 4.1.4.5에서에서 추가 반응 버퍼의 볼륨 +이 단계에서 추가 될 솔루션의 볼륨)의 권장된 최종 볼륨은 50-150 µ L.연구 유형 양의 효소 솔루션/효소 버퍼/차입 버퍼 (µ L) S-종속 측정 (그림 4) 2 시간 과정 측정 (그림 5A) 2 저해 연구 (그림 5B) 2 pH 의존 연구 (그림 6) 0.5
표 7: 검증 된 연구의 경우 분석 결과 샘플의 초기화 하는 동안 추가 효소 솔루션/효소 버퍼/차입 버퍼의 볼륨. - 부드럽게 튜브를 이동 하 여 신중 하 게 비즈를 약동 하 고 이미 떨고 thermoshaker 튜브를 즉시 넣습니다.
참고: 수동 샘플 종료 개시; 보다 더 많은 시간이 걸립니다 (4.3 절을 참조) 따라서, 적어도 2 분의 등록된 지연 반응의 개시 사이 좋습니다. - 실험 설계 (표 8)에 따라 샘플을 품 어.
연구 유형 보육 시간 (분) S-종속 측정 (그림 4A) 7 S-종속 측정 (그림 4B) 120 시간 과정 측정 (그림 5A) 0-2.5-5-10-15-20 저해 연구 (그림 5B) 10 pH 의존 연구 (그림 6) 60
표 8: 보육 시간 다른 측정에서 분석 결과 샘플에 적용.
- 실험 필요에 따라 분해 효소 솔루션을 준비 합니다.
- 분해 반응의 Termination
- 쉐이 커, 부 화의 끝에 30 s 사전에서 샘플을 신속 하 게 그것을 회전.
- MPC에 튜브를 배치, 그것은 15 대 서 s, 약간 MPC를 앞뒤로 이동 하 고.
- 뚜껑 열고 접시 또는 새로운 튜브는 상쾌한을 신중 하 게 전송 합니다.
참고:는 피 펫의 끝을 가진 집중된 비즈를 만지지 마십시오. C 샘플 및 분열의 고차를 가진 R 샘플의 수집된 상쾌한 보이는 형광 또는 심지어는 DRBT를 사용 하지 않고 표시할 수 있습니다.
- 형광 검출
- 검은 반 지역 microplate에 분리 된 샘플 supernatants의 2 x 30 µ L를 전송 합니다.
- 적절 한 여기 및 방출 필터를 사용 하 여 형광을 측정 합니다.
참고: 분열 버퍼 및 차입 버퍼의 기본 형광을 측정 합니다. 선택 필터 조합 필요 측정된 형광 단백질 (표 9) 기반으로 합니다.형광 단백질 여기 필터 (nm) 배기 필터 (nm) mTurqiouse2 355/40 460/25 mEYFP 544/15 590/10 mApple 544/15 590/10
표 9: 여기 및 방출 필터 다른 형광 단백질을 검출 하는 데 사용.
- 교정
참고: 단계 4.6.1, 형광 강도 값의 분열-또는 차입-버퍼-해결에서 보정 곡선을 생성 하 다른 농도에서 순화 된 기판 측정 필요.- 형광 성 기질을 정화.
참고: 정수, SAMBs 기판 빈 (B) 샘플의 효소 분석 결과 수집 될 수 있습니다, 또는 새로운 SAMB 정지 수 또한 준비 (4.1.1와 4.1.2 참조 섹션).- MPC 분열 버퍼 (2%-10%, v/v)의 1 mL에 SAMBs와 함께 튜브를 놓고 MPC 거꾸로 모든 방향으로 선회 하 여 자석 구슬 수집 합니다.
- 튜브를 열고 분열 버퍼 튜브와 뚜껑에서 모두 제거 합니다.
- MPC에서 튜브를 제거 하 고 추가 차입 버퍼의 400-600 µ L를 SAMBs.
- 천천히 5 분 동안 실 온에서 회전자와 닫힌된 튜브를 회전 합니다.
- MPC에 튜브를 놓고 거꾸로 MPC를 설정 하 여 비즈를 수집 합니다.
- 순화 그대로 형광 기판 (eluate)을 포함 하는 상쾌한을 제거 하 고 새로운 낮은 단백질 바인딩 microcentrifuge 관에 그것을 전송.
참고: Eluate 명확 하 게 보이는 형광 또는 심지어는 DRBT를 사용 하지 않고 표시 합니다.
- 병렬 버퍼 교환 두 0.5 mL 10 K 한 장치를 사용 하 여 수행 합니다.
- 각 한 장치로 절반 양의 준비 eluate (200-300 µ L)를 측정 합니다.
- 후 각 원심 분리 단계에서 희석 첫 번째 및 두 번째 외 장치 차입 버퍼와 분열 버퍼에 집중된 eluate 각각.
- 복구 후 120-200 µ L 사이 같은 볼륨에 다른 버퍼에 해결 집중된 샘플을 조정 합니다.
참고: 지금 분열 버퍼 해결 기판의 단백질 함량은 동일 차입 버퍼 해결 기판; 따라서, 그것 아니다 단백질 단계 4.5.3, 후자의 하나씩의 콘텐츠를 결정 하는 데 필요한 단백질 농도 측정에 사용 되는 방법 EDTA를 방해할 경우.
- 기판의 단백질 콘텐츠 280에서 흡 광도 측정 하 여 차입 또는 분열 버퍼에 해산 결정 nm.
참고: 다른 방법 (예: 브래드 퍼 드 또는 bicinchoninic 산 (BCA) 분석 실험)도 사용할 수 있습니다 단백질 농도 측정을 하지만 EDTA (차입 버퍼에 존재 하는) 또는 형광 기판의 흡수도 가능한 간섭 해야 고려. 4.5.4 단계에서 적용할 기판 솔루션의 초기 단백질 함량 0.4-2.0 사이 좋습니다 mg/mL는 보정을 생성 하기 위해서는 적절 한 범위에서 곡선. 소 광 계수 표 10 를 참조 하십시오.기판 분자량
(다)소 광 계수
(M-1 c m-1, 280에 nm 측정 물에)그의6-MBP-VSQNY * PIVQ-mTurquoise2 72101.7 96845 그의6-MBP-KARVL * AEAM-mTurquoise2 72042.7 95355 그의6-MBP-VSQNY * PIVQ-mEYFP 72367.1 94325 그의6-MBP-VSQNY * PIVQ-mApple 72145.9 105200
표 10: 분자 무게 그리고 다른 재조합 형광 성 융해 단백질 기판의 소멸 계수. - 적어도 8 개의 단계, 차입-와에서 각각 사용 하 여 차입 또는 분열 버퍼는 희석에 대 한 분열 버퍼 해결 기판 솔루션에서에서 두 가지 직렬 희석을 준비 합니다.
- 검은 반 지역 microplate에 각 희석 점의 30 µ L를 전송 합니다.
- 4.4.2 단계에서 적용 하는 설정을 사용 하는 fluorimeter와 형광을 측정 합니다.
참고: 분열 및 차입 버퍼의 기본 형광을 측정 합니다.
- 형광 성 기질을 정화.
- 분석 결과의 평가
- 보정 곡선을 플롯.
- 농도 (mM) (단계 4.5.4에서에서 사용), 순화 된 기판 솔루션의 단백질 콘텐츠 4.5.3 단계에서 결정에 따라 계산 합니다.
- (분열 버퍼 또는 차입 버퍼) 적용된 희석 버퍼의 기본 RFU 값으로 직렬 희석 포인트의 상대 형광 강도 값 (RFU)를 수정 합니다.
- 분열-또는 차입-버퍼-해결 순화 된 기판의 어 금 니 농도 대 한 수정 된 RFU 값을 플롯 하 고 선형 회귀 (힘 0 절편)을 수행 합니다.
참고: 높은 R2 값 (˃0.97) 형광 형광 단백질의 농도 사이 좋은 선형 상관 관계를 나타냅니다. 이 경우에 회귀선의 기울기 4.6.2 및 4.6.3 단계에서 시험된 범위에 분석 결과 부품의 농도 평가 하기 위해 사용할 수 있습니다. 실험 오류 및 데이터 포인트 분배 교정;의 안정성에 영향을 미칠 수 있습니다. 따라서 데이터에 의해 R2 와 기울기 값 영향을 여부를 확인 하기 위해 확대/축소 그래프 ( 그림3에서 참조)로 도움으로 그래픽 평가 수행할 수 있습니다.
- 반응 샘플의 C-터미널 형광 분열 제품의 금액을 계산 합니다.
- 해당 B 샘플의 RFU 값 각 R 샘플의 RFU 값을 수정 합니다.
- 수정 나누어 분열 제품 농도 (mM)에 반응 샘플에서 계산 분열 버퍼 기반으로 교정의 기울기에 의해 RFU 값 곡선 (단계 4.6.1.3 참조).
- 반응 샘플에 적용 된 기질 농도 계산 합니다.
- 기본 차입 버퍼 RFU 값 C 샘플의 RFU 값을 수정 합니다.
- 그들의 교정 나누어 C 샘플의 supernatants에 (mM)에 eluted 기판의 농도 계산 차입 버퍼 기반으로 교정의 기울기에 의해 RFU 값 곡선 (단계 4.6.1.3 참조).
- 단계 4.1.4.2, 다음 식에 따라 분석 결과 샘플을 만들기 위한 사용 SAMB 재고 솔루션의 (mM)에 기질 농도를 확인 합니다.
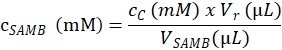
여기, cSAMB 섹션 4.1.3; 준비 SAMB 재고 용액의 몰 농도 cC C 샘플 단계 4.6.3.3;에서 계산에 eluted 기판의 어 금 니 농도 Vr 단계 4.1.4.5에서에서 반응 버퍼와 단계 4.2.3에서에서 효소 버퍼의 추가 의해 생성 하는 반응 혼합물의 볼륨은.; 그리고 VSAMB C 샘플 (단계 4.1.4.2) SAMB 재고 솔루션의 볼륨. - SAMB 재고 솔루션 (mM)에서 볼륨 (µ L)에 따라 각 반응 샘플 튜브 단계 4.1.4.2에서 측정의 어 금 니 농도에 따라 각 R 샘플에서 기판의 몰 농도 계산 합니다.
- 데이터 처리를 수행 합니다.
참고: 데이터 분석 실험의 목표에 따라 달라 집니다. 비디오의 예가 나와 데이터 처리에 대 한 기판 종속 운동 연구 에이즈-1 홍보에 그의6-MBP-VSQNY를 사용 하 여 * PIVQ mTurquoise2 기판. 초기 속도 값 C 터미널 분열 파편의 수에서 계산 되 고 적용 된 기질 농도 대해 그려집니다. 운동 매개 변수 Michaelis Menten 비선형 회귀 분석에 의해 결정 됩니다.
- 보정 곡선을 플롯.
- 마그네틱 구슬의 재활용
참고: 분석을 수행한 후 자기 agarose 구슬 수 수 수집 및 재활용.- MPC와 사용된 자석 구슬 수집 하 고는 상쾌한 삭제.
- 주어진 순서 대로 다음 버퍼의 1.8 mL와 구슬 세척: 재생 버퍼 A (0.05% 트윈 20, 0.5 M NaOH), 재생 버퍼 B (0.05% 트윈 20), 재생 버퍼 C (0.05% 트윈 20, 100 mM EDTA, pH 8), 재생 버퍼 B, 재생 버퍼 D ( 0.05% 트윈 20, 100 mM이4, pH 8), 재생 버퍼 B, 및 재생 버퍼 E (0.5% 트윈 20, 30% 에탄올, pH 7).
참고: 세척 절차 단계 4.1.1.4 참조.
- 주어진 순서 대로 다음 버퍼의 1.8 mL와 구슬 세척: 재생 버퍼 A (0.05% 트윈 20, 0.5 M NaOH), 재생 버퍼 B (0.05% 트윈 20), 재생 버퍼 C (0.05% 트윈 20, 100 mM EDTA, pH 8), 재생 버퍼 B, 재생 버퍼 D ( 0.05% 트윈 20, 100 mM이4, pH 8), 재생 버퍼 B, 및 재생 버퍼 E (0.5% 트윈 20, 30% 에탄올, pH 7).
- 재생 버퍼 E 4 ° c.에에서 재활용된 구슬 저장
- MPC와 사용된 자석 구슬 수집 하 고는 상쾌한 삭제.
5. 페이지 분석
-
샘플 준비
참고: Ni NTA 자석 구슬-기반 분석을 수행한 후 분석 결과 supernatants는 페이지에서 분석할 수 있습니다. 이 경우에, 5.1.1, 5.1.2 단계를 건너뜁니다. 그러나, 그것은 또한 관심 있는 protease와 솔루션에 소화 후 정화 형광 기판 솔루션 및/또는 그들의 분열 파편을 분석 가능. 이 경우에, 계속 단계 5.1.1 프로토콜.- 4.5.1 단계에 따라 정화 형광 기판 솔루션을 준비 합니다.
- 솔루션에서 소화를 수행 합니다.
- 1.5 mL microcentrifuge 튜브로 소화를 샘플 차입 0.5 mL 10 K 한 장치와 약 수에 분열 버퍼와 버퍼를 교환 합니다.
참고: 우리 aliquoted 페이지 분석에 대 한 68 µ L의 각 기판 샘플 튜브 수와 기판 솔루션 aliquoted을 볼륨 개별 실험 설계에 따라 최적화할 수 있습니다. - 샘플에 효소 솔루션을 추가 합니다.
참고: 페이지 분석을 위해 우리가 적용 2 µ L V-1 홍보,14, Bozóki 그 외 여러분 의해 설명 된 대로 준비 하지만 볼륨 개별 실험 설계에 따라 최적화 될 수 있습니다. 분해 하는 효소를 희석 분열 버퍼를 사용 하는 것이 좋습니다. - 실험 설계에 따라 샘플을 품 어.
참고: 페이지 분석에 대 한 우리 incubated 반응 혼합물에서 37 ° C, 하지만 보육 시간 45 분에 대 한 고 온도 실험 설계에 따라 설정 될 필요가 있다. - 5.1.3 단계를 수행 하 여 반응을 종료.
- 1.5 mL microcentrifuge 튜브로 소화를 샘플 차입 0.5 mL 10 K 한 장치와 약 수에 분열 버퍼와 버퍼를 교환 합니다.
- 페이지에 대 한 샘플을 준비 합니다.
참고: 형광 기판 포함 된 샘플 페이지는 nondenaturing 또는 변성 메서드에 의해 준비 수 있습니다. Nondenaturing 또는 변성 조건의 사용에 대 한 각각 5.1.3.1 또는 5.1.3.2, 단계를 따르십시오.- Nondenatured 샘플을 준비: nondenaturing 샘플 로딩 버퍼 (300 mM Tris, 20% 글리세롤, 0.05 %bromophenol 블루, pH 6.8) x 6의 6 µ L 30 µ L 샘플의 혼합.
- 변성된 샘플 준비: 변성 샘플 로딩 버퍼 (300 mM Tris, 20% 글리세롤, 0.05 %bromophenol 블루, 12 %SDS, 100 m m β-mercaptoethanol, pH 6.8), x 6의 6 µ L와 샘플의 30 µ L를 혼합 하 고 10 분 동안 95 ° C에서 샘플을 열.
-
SDS 페이지 분석
참고: 필요에 따라, 경우에 nondenatured (에서 준비 단계 5.1.3.1) 샘플 분석 하는, 네이티브 페이지도 수행할 수 있습니다. 이 경우에, 섹션 5.3 건너뜁니다.- SDS polyacrylamide 젤 (겹쳐 쌓이는 젤 분리 14%와 4% 사용)를 준비 하 고 전기 이동 법 버퍼 (2.5 m m Tris, 19.2 m m 글리신, 0.01 %SDS) 탱크를 채우십시오.
- Polyacrylamide 젤의 우물을 (5.1.3.1 또는 5.1.3.2 단계에서 준비) 샘플을 추가 하 고 120 V 전압에서 전기 영동을 수행.
- 실행 중인 모듈에서 젤 카세트를 제거 하 고 세척 탱크에 젤을 배치.
참고: Nondenatured 샘플 이미 젤, 또는 DRBT는 맨 눈으로도 볼 수 있다.
-
에 젤 renaturation 및 형광 단백질의 검출
참고: 변성된 샘플 (준비 단계 5.1.3.2)는 DRBT에 있는 형광 단백질을 감지, SDS 씻는 젤에서 부분적으로 renature 하는 단백질을 해야 합니다.- 젤을 ~ 100 mL의 증류수를 추가 하 고 30 분 이상 젤을 씻어 내어 주세요.
참고: SDS 제거 개선, 물 매 10 분을 대체 하거나 최대 60 분까지 씻어. - DRBT를 사용 하 여 또는 자외선 이미징 형광 단백질을 시각화.
- 젤을 ~ 100 mL의 증류수를 추가 하 고 30 분 이상 젤을 씻어 내어 주세요.
-
기존의 Coomassie 젤의 얼룩
- Nonfluorescent 단백질을 시각화 하기 위해 화려한 Coomassie 파란 염료와 젤 얼룩.
결과
그림 1A 는 특정 분열 사이트 시퀀스에서 에이즈-1 홍보에서 처리할 수 있는 대표적인 형광 재조합 단백질 기판의 도식 구조를 보여 줍니다. 그림 1B 는 기판 생산 및 Ni NTA 자석 구슬-기반 분석 결과 및/또는 페이지를 포함 하 여 효소 분석 실험에 있는 그들의 가능한 응용 프로그램을 나타냅니다.
Fluorimetry에 의해 신뢰할 수 있는 데이터를 얻으려면, 교정 절차는 형광 기판 및 분열 제품 수량을 결정 하는 데 필요한. 이 위해 다른 버퍼 조건에서 다른 기판의 형광 강도 값 측정 될 필요가 있고 분석 농도 범위 (그림 3)에 그들의 농도에 상관 될 필요가. 기판 및 분석 결과 샘플에서 분열 제품의 금액을 결정 하기 위해 보정 곡선의 기울기 값을 적용할 수 있습니다. 보정 곡선의 (표 11) 기판에 삽입 하는 분열 사이트 시퀀스의 독립 이며 잠재적으로 일련의 동일한 유형의 형광 단백질을 융합 하는 기판에 사용할 수 있습니다. 확대/축소 그래프 (그림 3) 뿐만 아니라 낮은 농도 범위를 확대 하려면 모든 선형 재발에 대 한 표시 됩니다. 그것은 보정 데이터 포인트의 적절 한 분배는 믿을 수 있는 교정에 대 한 필요 하기 때문에 신중 하 게 수행 해야 하는 것이 중요. 이러한 이유로 두 가지 직렬 희석 적용 됩니다 교정, 샘플 준비 하 R2 값은 형광 단백질의 농도 형광 경우에 충분 한 수의 데이터 요소 사이 좋은 상관 관계를 나타냅니다 때문에 가 전체 농도 범위를 커버 하는 데 사용 되었습니다. 또한, 실험 오류 높은 영향을 미칠 수; 교정의 정확성 따라서, 회귀 선의 그래픽 평가 할 수 있습니다 또한.
효소 분석 결과, 반응 속도 (그림 4A)에 기질 농도의 효력의 검사를 포함 하 여 다양 한 효소 측정을 수행할 수 있습니다. 비선형 회귀에 의해 데이터 효소 활동적인 매개 변수 (예: v최대 및 Km)를 확인 하기 위해 사용할 수 있습니다. 부족 한 비드 현 탁 액 및 분산 및 부적 절 한 반응 종료 차선의 결과 (그림 4B), 신뢰할 수 있는 효소 운동 값을 계산 하는 데 적합 하지 않습니다 발생할 수 있습니다.
시간에 제품 대형의 의존 (예를 들면, 동안에 분열 반응 매개 변수 최적화) 분석 결과 (그림 5A)에 의해 확인할 수 있습니다. 효소 활성 억제제 존재 수도 있습니다 (그림 5B)는 활성 효소 농도 및 억제 상수에 대 한 조사. 동일한 방법론을 사용 하 여, 다른 억제제의 효과 수 있습니다 또한 상영 분석 결과 의해.
효소 분석 실험은 효소 활동에 pH의 효과 조사할 때 유용 합니다. 그림 6A TEV 홍보, 넓은 최적의 pH 범위 (pH 6-9)의 예 의해 pH 의존을 효소 활동의 나타냅니다. PH 의존 효소 활동의 공부 (또는 데 산 성 pH 최적 효소 측정 될 필요가) 경우는 구슬에 재조합 형 기판의 선호도 바인딩 약간 산 성 pH에서 제한 될 수 있습니다 고려 하는 데 필요한. 구슬 (그림 6B)에서 기판의 높은 분리 시험 결과의 왜곡을 일으킬 수 있습니다. 구슬에서 자발적인 기판 분리를 고려, 반응 샘플 측정 값 그 B 샘플 수정 해야 합니다.
그림 7 (그림 7A) 블루 빛 transillumination를 사용 하 여 nondenatured 형광 단백질 그들의 색깔에 따라 젤에 분화 될 수 있다 보여준다. 기판/분열 파편의 분자 무게의 결정은 필요한 경우, 조건을 변성 시키기 사용할 수 있습니다 또한 샘플 준비, 형광 단백질 부분적으로 젤에 renatured 수 있습니다 자외선 조명에 의해 검출 될 수 있기 때문에 (그림 7B) 또는 Coomassie 얼룩 (그림 ℃). R 샘플 분석, C 터미널 분열 제품 있다면 표시 (그림 ℃), N 맨끝 분열 파편 및 uncleaved 기판 구슬에 부착 된 유지. 때때로, 단백질 nondenaturing 조건 (그림 ℃)를 사용 하 여에 불구 하 고 부분적으로 변성 될 수 있습니다 그리고 nondenatured 단백질 더 풍부한 동안, 변성된 형태도 샘플에서 감지. 이 현상은 분해 분열의 검출에 영향을 주지 않습니다 하지만 양적 densitometry nondenatured 샘플의 경우 고려 되어야.
자세한 설명은 2 mL 튜브-기반 분석 결과 대해서만 표시 됩니다, 분석 결과 96 잘 접시 기반 시스템 (그림 8), (표시 되지 않음) 본 연구실에서 이미 성공적으로 테스트 되었습니다에 대 한 적응 될 수 있습니다. 96 잘 접시 적응 형식 fluorimetric와 전기 이동 분석, 뿐만 아니라, 완벽 하 게 호환 이며, 획득된 데이터 또한 평가 될 수 있습니다이 문서에서 설명 하는 방법에 따라.
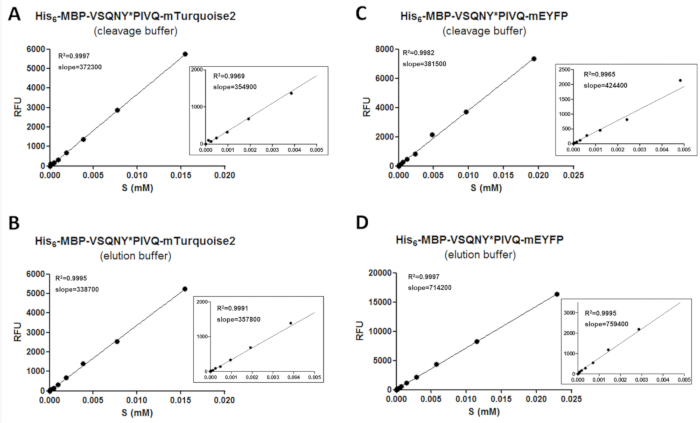
그림 3 : 교정 곡선. 대표 기판 보정 곡선을 다른 C 터미널 형광 태그를 융합 하는 두 개의 재조합 기판의 예제와 함께 보여 줍니다: (A 와 B) 그의6-MBP-VSQNY * PIVQ mTurquoise2 및 (C 와 D ) 그의6-MBP-VSQNY * PIVQ mEYFP. 확대/축소 숫자도 0-0.005에서 데이터 포인트의 선형 회귀를 나타내는 표시 됩니다 m m 기질 농도 범위. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
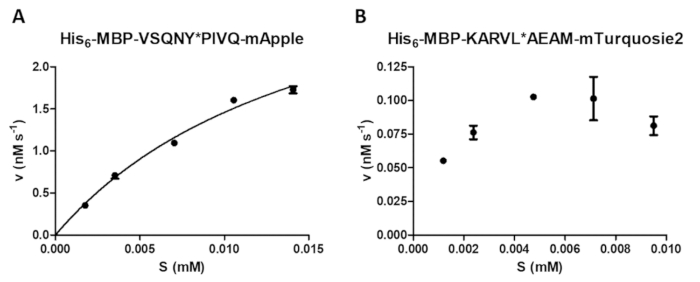
그림 4 : 효소 활동적인 매개 변수 결정. 기판 종속 운동 측정 했다 HIV-1 홍보 수행 (41.2의 마지막 활성 농도에 nM). 초기 속도 값 기질 농도 대 한 표시 했다 그리고 Michaelis Menten 비선형 회귀 분석을 수행 했다. 오차 막대를 나타내는 SD (n = 2). (A) A 대표 최적의 결과 그의6-MBP-VSQNY의 예제와 함께 표시 됩니다 * PIVQ mApple 퓨전 단백질 기질. (B) A 대표 차선의 결과 그에 대 한 표시 됩니다6-MBP-KARVL * AEAM mTurquoise2 기판, 적절 한 기질 농도의 설정은 SAMB 재고 솔루션의 부족 한 균질 때문에 문제 상대적으로 높은 오류 부적 절 한 반응 종료 인해 발생 하는 동안. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
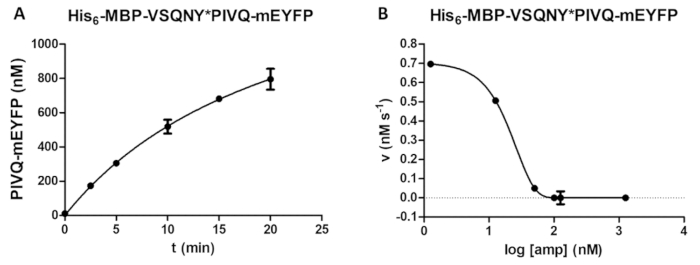
그림 5 : 시간-코스와 억제 연구. (A) 그의 6-MBP-VSQNY * PIVQ-mEYFP (0.00326 m m의 최종 농도)에서 재조합 융합 단백질 기판 했다 HIV-1 홍보에 의해 죽 습 (41.2의 마지막 활성 농도에 nM), 및 형광 성 PIVQ-mEYFP 분해 파편의 릴리스를 측정 했다 시간-과정 분석을 수행 합니다. 측정은 포인트 5 다른 시간에 실행 되었다. 오차 막대를 나타내는 SD (n = 2). (B) 그의6-MBP-VSQNY * PIVQ mEYFP 에이즈-1 홍보 활동에 amprenavir의 억제 효과 확인 하려면 (0.0015 m m)에서 기판으로 사용 되었다 (163.8의 총 농도에 nM). 데이터를 절반 최대한 억제 농도 (IC50) 평가 될 수 있는 플롯과 활성 효소 농도 의해 (41.2의 마지막 활성 농도 nM) 적용된 HIV-1 PR의 수 또한 계산 저해 곡선에. 오차 막대를 나타내는 SD (n = 3). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
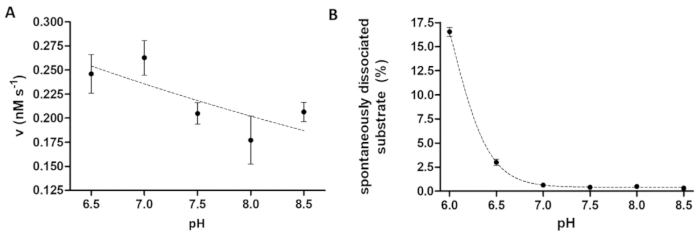
그림 6 : 효소 활동 및 자발적인 기판 분리 박사에의 의존을 공부 (A)는 그의6-MBP-VSQNY * PIVQ mTurquoise2 기판 (0.033 m m)에 TEV PR의 효소 활동 측정 하는 데 사용 되었다 (91.42의 마지막 총 농도에서 nM) 분열 버퍼 다른 pH 6.5-8.5의 범위를 설정. 오차 막대를 나타내는 SD (n = 2). 그려진된 데이터 되었습니다 이전14출판. (B) 기판 빈 샘플는 그의 자발적인 분리의 상대 형광 강도 값에 따라6-MBP-VSQNY * PIVQ mTurquoise2 기판 (0.033 m m) 자석 구슬에서 분열 버퍼를 사용 하 여 공부 했다 과 다른 산도, 6.0 8.5 사이. 그려진된 데이터 되었습니다 이전14출판. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
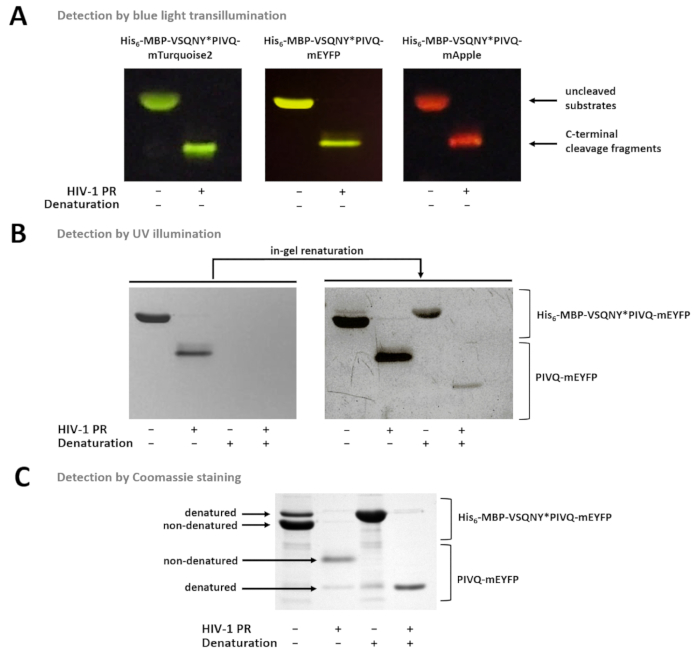
그림 7 : 다른 방법으로는 젤에 단백질을 감지. (A) Uncleaved 및 nondenaturing 샘플 준비 후 HIV-1 홍보 소화 퓨전 단백질 기판 SDS 페이지 후 블루 빛 transillumination에 의해 시각화 했다. 분열 반응 솔루션에 소화에 의해 수행 되었다. (B) 페이지, 직후만 nondenatured 단백질에서에서 검출 될 수 젤 UV 조명, SDS의 제거 후에 의해 이전 변성된 형광 단백질 되었다 renatured 부분적으로 감지 하 고. 샘플의 Ni NTA 자석 구슬-기반 분석 결과 supernatants에서 준비 되었다. (C) Coomassie 얼룩도 사용할 수 있습니다-젤 renaturation 후 단백질 검출. 젤-5 월에 SDS 현재 네이티브 단백질의 부분 변성 하지만 네이티브 샘플, nondenatured 형태는 더 풍부. 샘플의 Ni NTA 자석 구슬-기반 분석 결과 supernatants에서 준비 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 8 : 분석 결과 플랫폼의 96 잘 접시 기반 적응. (A) 분석 결과 2 mL 튜브 뿐만 아니라 또한 96 잘 접시의 우물에서 수행할 수 있습니다. 여기에 우리가 야생-타입 (wt) 또는 돌연변이 (mut-1 mut-4)을 포함할 수 있는 형광 기판의 시리즈를 사용 하 여 가상 효소의 특이성을 연구 분석 결과의 응용 프로그램에 대 한 도식 적인 표현을 표시 분열 사이트 시퀀스. 자석 구슬 처리, 96-잘 호환 자성 입자 집중 (MPC)는 실험에 사용 될 것입니다. 모든 표시 된 볼륨은 단일 잘 관련이 있습니다. 다른 기판의 절단 효율성 비교를 기판 변환 관련의 기판 빈 수정 RFU 값을 고려 하 고 반응 샘플의 기판 빈 수정 RFU 값의 비율에서 평가 될 수 있다 100으로 기판 제어 샘플입니다. (B) 후 직접 또는 nondenaturing 및 변성 샘플의 경우에 젤 renaturation 후 fluorimetry, 분리 supernatants의 샘플 페이지, 및 형광 단백질 구성 요소 또한 분석할 수 분석 결과 분석할 수 준비, 각각. 세 가지 분석 결과 샘플 종류 또한 각 그림에 설명 된: C 기판 제어, B = = 기판 빈, 그리고 R = 반응. 기판 제어 샘플 기판 빈 동안 차입 버퍼에 있고 반응 샘플 분열 버퍼에 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 버퍼 | 형광 단백질 | 슬로프 (%)의 CV % |
| 차입 | mTurquoise2 | 6.04 |
| 분열 | 9.11 | |
| 차입 | mApple | 10.92 |
| 분열 | 12.68 |
표 11: 기판 교정 곡선의 차이 (%CV) 값의 계수. 재조합 형 단백질 기판의 형광 삽입된 분열 사이트에 따라 달라 집니다 여부를 테스트 하려면 교정 mApple mTurquoise2 융합 기판 (6 변종, 각 포함 하는 다른 분열 사이트의 시리즈에 의해 수행 되었다 에이즈-1 효소의 시퀀스), 차입 및 분열 버퍼에서 둘 다. 우리는 슬로프의 CV % 값은 단일 기판 교정 기판 변형 같은 형광 태그를 포함 하 여 수행 하는 다른 측정의 평가 위해 이용 될 수 있다 의미는 모든 경우에, 15% 미만 발견.
토론
분해 효소의 집중 산업 및 학술 조사 및 급속 하 고 저렴 한 HTS 호환 효소 분석 플랫폼에 대 한 일정 한 수요 적절 하 게, 우리가 개발한 자석 구슬-기반 형광 효소 분석 결과입니다. 분석 결과 널리 활용된 합성 펩 티 드 기질에 새로운 대안이 될 수 있는 재조합 융합 단백질의 사용을 기반으로 합니다.
개발된 시험 형식에서 융합 단백질 기판은 Ni 킬레이트 코팅 자석 agarose 구슬의 표면에 움직일 수 있습니다. 기판 첨부 파일 그의6 선호도 태그 직접 접는 촉진 하 고 기판13의 물 가용성을 향상 MBP 태그 융합은 융합 단백질의 N 맨끝에 의해 제공 됩니다. MBP은 TEV PR의 분열 사이트와 관심의 효소에 선행 된다. 전 수 역할 분석 결과에서 제어 분열 사이트 조사를 효소에 의해 처리 될 수 있습니다 후자의. 분열이 사이트는 상호 교환; 관심의 분열 사이트에 대 한 코딩 짧은 dsDNA 시퀀스는 결 찰에 의해 식 플라스 미드의 유연한 '복제 카세트'에 삽입할 수 있습니다. 재조합 융합 단백질 효소 해방, 형광 C 터미널 분열 제품 분해 분열 ( 따라 발표의 끝점 검출을 가능 하 게 C 터미널, 매우 안정적인, 단위체 형광 단백질 태그 포함 그림 1A). 다른 버퍼에 해결 정화 형광 그대로 기판 기판 및 분열 제품의 어 금 니 농도 평가 하기 위해 교정도 사용 됩니다. 또한, fluorimetry, 후 분석 결과 구성 요소 분석할 수 있습니다 SDS 페이지 뿐만 아니라. 두 기본 (nondenatured)와 변성된 형광 성 단백질 구상 될 수 있다는 젤에는 전기 이동 법 후 즉시 또는 다음에 젤 renaturation 후 각각. 이 추가 절차에 함께 한 기존의 Coomassie 화려한 블루 얼룩-5 월 시험 결과 (그림 1B)의 확인에 대 한 효율적으로 사용할 수 있습니다.
높은 처리량 자동 환경에 완전히 적응 될 수 있는 한 낮은 볼륨 형식 간단 하 고 쉬운-을-실행 단계 분석 결과 절차에 의하여 이루어져 있다. 그러나, 독립적으로 수동으로 또는 자동화 시스템 분석 결과 수행, 분석 결과의 다음과 같은 부분으로 간주 됩니다 하지 중요 되며 절차를 수행 하는 동안 특별 한 주의 필요로. i) 자석 구슬 솔루션의. 균질 자석 구슬 솔루션 분석 결과, 모두 정화와 세척 단계에 걸쳐 사용 되어야 한다. 특히, 효소 분석 실험의 안정성 강하게에 따라 제대로 aliquoting 기판 부착 자석 구슬 (SAMB) 재고 솔루션. 서 스 펜 션 및 분산의 효과 증가 하기 위하여 2%와 10% (v/v) 사이의 구슬 농도 설정 하는 것이 좋습니다. 샘플 준비, 사용 하는 동안 버퍼 (예: 트라이 톤 X-100 또는 트윈 20) 비 세제까지 보충의 2%도 플라스틱 표면에 자석 구슬의 부착 저하 될 수 있습니다. 샘플 튜브의 벽에 구슬의 부착 구슬 정지 샘플 튜브의 벽에 대신에 튜브의 바닥을 신중 하 게 적용 되는 경우에 피할 수 있습니다. 효소 반응 동안 자석 구슬의 동질성 또한 중요 하 고 지속적으로 부 화 시 600 rpm에서 샘플을 떨고에 의해 지켜질 수 있다. V-하단 튜브의 사용 권장 하지 않습니다 동안 비즈는 제대로 둥근 또는 플랫 플라스틱 그릇에 분산 됩니다. 부적 절 한 비드 균질으로 인 한 차선의 결과 그림 4B에서 표시 됩니다. 2) 반응 샘플의 해지입니다. 방법의 또 다른 이점은 이다 효소 반응 열 변성 치료 또는 어떤 잠재적으로 방해 화학15의 사용 없이 종료 될 수 있습니다. 종료 자석 구슬 기존의 마그네틱 입자 집중 장치를 사용 하 여 반응 혼합물에서 분리 하 여 수행할 수 있습니다. 제거 반응 버퍼에 포함 되어 있는 활성 효소 생성 된 C 터미널 형광 분열 제품 uncleaved 기판 구슬에 연결 된 남아 있다. 반응 버퍼에 활성 효소의 존재로 인해 분리 절차를 신뢰할 수 있는 끝점 검출을 위한 신중 하 게 수행 해야 합니다. 집중 장치에 샘플 튜브를 배치 하기 전에 짧은 회전 원심 분리를 적용 하는 것이 좋습니다. 집중 장치에 튜브를 삽입 후 적어도 15 제공 수집 구슬에 대 한 s. 뒤로-및-앞뒤 구분의 약간의 운동 구슬의 수집을 용이 하 게 수 있습니다. 분리를 수동으로 수행된 하는 동안 종료 일반적으로 더 많은 시간이 걸립니다 보다는 반응의 개시 하는 것을 고려 하시기 바랍니다. 따라서, 약 2 분 등록 지연이 좋습니다는 식 이라고 사이 동일한 보육 시간 모든 샘플에 적용 하는 경우.
설명된 분해 분석 결과의 원리는 비교적 간단 하다; 그러나, 시스템의 유연 하 고 안정적인 기판 구조 보장 합니다. 분석 결과의 개별 최적화 선호도 구슬의 적용된 조건, 시 약, 첨가제와의 호환성만 제한 될 수 있습니다. 계약 제조 업체의 프로토콜, 우리 또한 그 Ni NTA 구슬 표면에 기판의 선호도 바인딩 실질적으로 약화 pH ≤에 6.515발견. 따라서 기판 빈 샘플 반응 견본을 병렬을 적용 하는 것이 좋습니다 그리고 자발적인 기판 분리의 속도 결과의 평가 도중 고려 될 필요가 있다.
어디 자기 구슬-기반 분석 구슬-호환 되지 않는 구성 요소 또는 낮은 산도의 사용으로 인해 수행할 수 없습니다, 이러한 경우에 순화 된 재조합 형 기판의 솔루션에 소화도 적용할 수 있습니다. 이러한 경우에 반응 혼합물은 전기 이동 법에 의해 분석 될 수 있다 고 설명된 프로토콜에 따라 젤에 단백질을 구상 될 수 있다. 분해 활동을 조사, 솔루션에서 소화 및 단백질의 젤에서 검출 될 수 있습니다 fluorimetry의 대체 도구. 설계 기판 시스템의 참신은 SDS 페이지를 변성 시키기 후에 젤 renaturation 단계의 응용 이다. 네이티브 (nondenatured) 형광 단백질 전기 이동 법 동안 그들의 형광을 유지 하는 동안 변성 (그림 7B) 시 형광 속성은 폐지 됩니다. 그러나, 변성된 단백질의 형광 젤에서 SDS의 제거에 의해 부분적으로 복구할 수 있습니다. 따라서, 변성 조건을 사용 하 여 반응 컴포넌트의 분리 가능 하 게 형광 기반 뿐만 아니라 분자 무게-기반 식별. Coomassie 스테인드 젤의 분석에 비해 형광에서 젤 탐지의 또 다른 장점은 이다 (네이티브 또는 renatured) 형광 단백질은 쉽게 그들의 형광에 따라 젤에 확인할 수 있습니다 ( 그림 7참조). 분열 반응 nonfluorescent 오염 물질을 포함 하는 샘플에서 수행 하는 경우 또는 매우 닮은 서로 분자 무게 단백질이 중요 한 수 있습니다.
효소 분석 실험을 사용 하 여 유사 하 게 설계 된 기판에 이미 출판 이전8,,910, 그리고 비록 이러한 경우에 대 한 관심의 분열이 사이트는 또한 선호도 태그 사이 형광 단백질, 제시 하는 분석 결과 시스템 여기 뿐만 아니라 기술된 아이디어를 반복 하지만 이전 플랫폼의 다른 장점 결합 한 고도 더 개선 완료: i) MBP 융합 파트너의 활용 ii)는 TEV 홍보 제어 분열 사이트, iii의 존재) 새로 설계 된 단위체 FPs, 및 iv를 사용 하 여) 독특한 기판 교정 절차의 응용 프로그램. 자체 분석 결과 특히 효소 특이성 및 운동 연구, 비싼 계측에 대 한 필요 없이 시간 및 비용 효율적인 방법으로 안전에 유용 하도록 설계 되었습니다. 메서드는 두 산업 및 학술 연구 목적 적합 하 고 저렴 한 도구 될 목적 이다. '복제 카세트' 식 플라스 미드의 유연성으로 인해 시스템 재조합 기판 라이브러리의 신속 하 고 저렴 한 세대에 대 한 적합 한 수 있습니다. 여기 설명된 분석 결과 기질 특이성, 효소 mutagenesis의 구현에 대 한 가능한 도구 이며, 억제 연구 하 고, 또한, 효소 활동을 수행 하는 다른 도구를 제공. (운동 매개 변수의 결심에 세균성 세포 파쇄)에서 분석 결과 플랫폼 HTS 및 자동화 기반 환경에 적응 시킬 수 있다 하 고, 산업 protease 억제제 검사 및 항 바이러스 약물에 잠재적으로, 적용 될 수 있습니다. 개발입니다. 또한, 경쟁력 있는 베이스에 대 한 분석 결과의 적응은 또한 우리의 실험실의 범위 미래에. 같은 경쟁 분석 결과, 다른 C 터미널 형광 태그-는 조사는 연구의 기본 설정 같은 분열 반응에 동시에 사용할 수를 융합 두 다른 기판 각 포함 하는 다른 분열 사이트 주어진된 대상 시퀀스에 대 한 효소입니다. 또한, 96 잘 접시 적응 분석 결과 양식 (그림 8)의 사용은 또한 되 고 최적화 돌연변이 검사 수정된 분열 사이트 시퀀스 시스테인 프로 테아 제 경우 기판의 시리즈를 사용 하 여.
공개
저자는 공개 없다.
감사의 말
이 작품 GINOP-2.3.2-15-2016-00044 "PHARMPROT 팀" 프로젝트에 의해 부분적으로 지원 되었고, 또한,의 프레임 워크 내에서 고 등 교육 기관 우수 프로그램의 부의 인간 수 용량, 헝가리에 의해 융자는 데브레첸 대학의 생명 공학 주제 프로그램입니다. 저자는 실험실의 Retroviral 생화학 분석 결과 개발 하는 동안 그들의 과학적인 도움 및 또한 (특히 하 Norbert Kassay에 Joóné Matúz Vanda 톨디, 분석 결과 촬영 하는 동안 그들의 인내심에 대 한 구성원에 대 한 감사 누가 게재 동영상의 배경에서). 저자 또한 특별 감사 Gedeon 리히터 Plc., 생화학의 부 고 손님 연구원으로 분자 생물학의 Beáta Bozóki의 작동 허용을 위한 박사 졸탄 Urbányi 특히 말을 싶습니다. 저자 또한 오디오 및 비디오에 전문적인 도움을 위한 멀티미디어 및 데브레첸의 대학교의 E-러닝 기술 센터에서 죄르지 Zsadányi, Balázs Tőgyi, Balázs Pöstényi, 및 졸탄 Király 그들의 감사 하 고 싶습니다. 생산입니다.
자료
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
참고문헌
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유