Method Article
멀티 록스 PCR 및 모세관 전기 영동에 의한 어류 병원성 박테리아 Yersinia ruckeri의 다중 궤적 가변 수 탠덤 반복 분석
요약
여기에 제시된 다중 궤적 가변 수 탠덤 반복 분석(MLVA) 분석은 어류 병원성 박테리아 Yersinia ruckeri의저렴하고 견고하며 휴대용 고해상도 유전자 형질 분석이 가능합니다. 순수 한 배양에서 시작, 분석 은 다운 스트림 응용 프로그램에 대한 10 층 MLVA 프로파일을 생산하기 위해 멀티 플렉스 PCR 및 모세관 전기 영동을 사용합니다.
초록
Yersinia ruckeri는 전 세계적으로 양식 된 연어의 중요한 병원체이지만,이 박테리아의 후생 동물 조사 (감염 추적 등)에 적합한 간단한 도구가 부족했습니다. 다중 궤적 가변 수 탠덤 반복 분석 (MLVA) 분석은 따라서 회수 된 분리물의 고해상도 지질 분석을위한 쉽게 접근하고 모호한 도구로 개발되었다. 여기에 제시된 MLVA 분석의 경우, DNA는 배양된 Y. ruckeri 샘플에서 추출된 후, 물에 세균세포를 끓여서, PCR용 템플릿으로 상급제를 사용한다. Y. ruckeri 게놈 전체에 흩어져 있는 10개의 가변 수 탠덤 반복(VNTR) 로시를 대상으로 하는 프라이머 쌍은 동일한 사이클링 조건에서 실행되는 두 개의 5플렉스 PCR 반응 사이에 균등하게 분포됩니다. 전방 프라이머는 세 가지 형광 염료 중 하나에 라벨이 부착되어 있습니다. 젤 전기 동에 의한 앰플리코 확인에 따라 PCR 제품은 희석되고 모세관 전기 동극을 겪습니다. 생성된 전기 전형체 프로파일로부터, 각 VNTR 궤위를 나타내는 피크는 크기라고 하며 실리코에서 VNTR 반복 카운트를 계산하기 위해 사용된다. 결과 10자리 MLVA 프로파일은 클러스터 분석에 의한 후생학 평가를 가능하게 하는 최소 스패닝 트리를 생성하는 데 사용됩니다. 수치 MLVA 프로파일 의 형태로 휴대용 출력 데이터는 실험실 전체에서 빠르게 비교되고 시공간적 컨텍스트에 배치될 수 있습니다. 배양 된 식민지에서 상피학 평가에 이르는 전체 절차는 단일 근무일 내에 최대 48 Y. ruckeri 격리에 대해 완료 될 수 있습니다.
서문
그람 음성 박테리아이자 예르시니아과 가족의 일원인 예르시니아 루케리(Yersinia ruckeri)는전세계적으로 양식된 연어어에서 예르시니오시스를 일으킨다. 그것은 한천 매체의 많은 모형에 경작에 의해 감염한 물고기에서 쉽게 진단됩니다, 그러나 최근까지, 거의 세계에 걸쳐 그리고 다른 서식지 (호스트 종 등)에 Y. ruckeri의 인구 구조 그리고 상피학에 관하여 알려지지 않았습니다. Y. ruckeri에 대한 기존의 혈청 화 시스템은 일관성이 없으며 상호 호환성이 부족하며 낮은 역학 적 분해능을 제공합니다. 박테리아에 대한 일부 분자 연구가 수행되어 Multilocus 서열 타이핑 (MLST), 펄스 필드 젤 전기 영동 (PFGE) 또는 전체 게놈서열 (WGS) 분석 2,3,4 와 같은 기술을 채택했습니다. ,5. 그러나 MLST는 일상적인 감염 추적에 대해 충분히 높은 해상도를 제공하지 않지만 PFGE는 노동력을 요구하고 실험실 에서 쉽게 이식할 수 없는 결과를 생성합니다. WGS 분석은 거의 궁극적 인 해결책을 제공하지만, 이러한 분석의 설립 및 구현은 아직 실험실의 상대적으로 적은 수에 제한 남아 전제 기술 및 생물 정보학 기능을 것입니다.
다중 궤적 가변 수 탠덤 반복 분석 (MLVA)은 WGS 분석6,7의거의 일치하는 경우에 유전 적 분해능을 제공하는 간단하고 쉽게 접근 할 수있는 분자 타이핑 도구를 나타냅니다. 이 기술은 선택한 가변 번호 탠덤 반복(VNTR) loci의 반복 수 변화를 기반으로 하므로 전송이 용이한 출력 데이터가 생성되므로 프로파일된 격리된 프로파일을 온라인 데이터베이스와 랩 간에 간단하게 비교할 수 있습니다. MLST는 많은 세균성 병원체의 역학 적 타이핑을위한 금 본위제로 남아 있지만, 연구의 증가는 MLVA 8,9,10의상당히 높은 차별적 힘을 확인합니다. 몇몇 프로토콜은 또한 프란시스셀라 noatunensis, 에지시엘라 피시시다 및 Renibacterium salmoninarum11,12와같은 물고기 병원성 박테리아를 표적으로 하는 간행되었습니다, 13.
여기에 제시 된 10-loci MLVA 프로토콜은 최근 광범위한 Y. ruckeri 인구 연구14의기초를 형성, 한천 재배 식민지에서 DNA의 추출을 포함, 멀티 플렉스 PCR 및 모세관 전기 영동 (CE), 실리코 애플리케이션의 다운스트림이 뒤따릅니다. 각 검사된 분리에 대해, 각각의 개별 VNTR 영역을 대상으로 하는 5개의 형광 표지 프라이머 쌍(6FAM, NED 또는 VIC)을 포함하는 두 개의 멀티플렉스 PCR이 동일한 조건하에서 병렬로 실행됩니다. 겔 전기 영동 (GE)에 의한 PCR 앰플리폰의 검증에 따라, PCR 제품은 CE 분석 전에 희석되고, 각각의 VNTR 궤위를 나타내는 피크는 생성된 일렉트로로그램 파일로부터 크기라고 불린다. CE 철새 패턴의 사소한 시퀀스별 불일치를 차지하는 궤적별 수식과 함께 VNTR CE 크기 호출은 10자리 MLVA 프로파일로 연결되는 VNTR 반복 수를 계산하는 데 사용됩니다. 이들은 후생동물 평가를 위한 입력으로 사용됩니다(예: 최소 스패닝 트리(MST) 다이어그램의 클러스터 분석에 의해).
프로토콜
주의: 프로토콜 전체에 대해 실험실 코트, 일회용 장갑 및 멸균 시약 및 장비를 사용하여 모든 습식 실험실 절차를 멸균하는 것이 좋습니다. 또한 PCR 증폭 및/또는 PCR 제품(PCR 이후)의 취급에 사용되지 않는 별도의 방(사전 PCR)에서 PCR 반응을 준비하는 것이 좋습니다. 제조업체에서 권장하는 대로 모든 시약을 보관하십시오. 사용되는 시약, 장비 및 소프트웨어에 대한 자세한 내용은 재료 표를 참조하십시오.
1. 게놈 DNA의 세균 재배 및 추출
- Y. ruckeri 순수 한 분배 (저자는 5% 소 혈액 한천사용)에 뿌리고 1-2 일 동안 22 °C에서 배양하거나 3-4 일 동안 15 °C에서 배양하십시오.
- 각 한천 플레이트에서 접종 루프가있는 단일 대표 식민지를 선택하고 50 μL의 초정화 수를 포함하는 1.5 mL 원심 분리기로 옮김을 옮김. 일시 중단, 소용돌이 를 짧게 하고, 100°C에서 가열 블록상에서 7분 동안 배양한다.
- 16 000 x g에서 3 분 동안 원심 분리기를 사용하고 피펫을 사용하여 상급을 빈 1.5 mL 원심 분리튜브로 조심스럽게 옮긴다. 상급체를 템플릿 DNA로 이용하여 다음 단계로 진행하거나 그러한 시간까지 -20°C에서 저장한다.
2. 멀티플렉스 PCR 설정 및 사이클링 조건
참고: 각 멀티플렉스 PCR 반응(Y. ruckeri 분리당 2개)은 2x 멀티플렉스 PCR 플러스 마스터 믹스의 12.5 μL, 각 적절한프라이머 쌍의 0.1~0.2 μM(표 1) 및 3 μL의 템플릿 DNA를 포함해야 하며, 최종 반응 량25 μL로 조정되어야 합니다. RNase 없는 물을 추가합니다. 형광표지가 있는 전방 프라이머의 빛 노출을 최소한으로 유지하는 것을 목표로 합니다(예: 저장 튜브를 알루미늄 호일에 감싸는 경우).
- 2개의 멀티플렉스 PCR 분석(표1)의 각각에 대해, 샘플 의 수와 1개의 양성 및 1개의 음성 대조군을 더한 것에 따라 전술한 바와 같은 마스터 믹스를 준비한다(템플릿 DNA 없이). 또한 10% 잉여 볼륨을 허용합니다. 준비된 마스터가 저속으로 부드럽게 혼합합니다.
- 각 마스터 믹스의 22 μL을 샘플 수에 적합한 PCR 스트립 또는 플레이트의 개별 우물에 개별적으로 분배하고 각 웰에 3 μL의 템플릿을 추가합니다 (각각 양성 및 음성 제어를 위해 검증 된 Y. ruckeri의 DNA를 사용하십시오. 균주 및 초정화수). 밀봉 및 원심 분리기 짧게.
- 다음 프로그램으로 PCR 열 사이클러에서 모든 샘플을 실행합니다: (i) 95°C에서 0.5분, 60°C에서 1.5분, 72°C에서 1.5분, 68°C에서 60분, 4°C로 냉각한 후 95°C에서 5분(ii) 30회. 이 프로그램은 3 시간 이내에 완료됩니다.
3. 젤 전기 동동에 의한 PCR 앰플리온 확인
- 제조업체의 권장 사항에 따르면, 테스트할 PCR 반응 의 수에 적합한 1x 트리스 보레이트-EDTA(TBE) 버퍼에 1.5%(w/v) 아가로즈 젤을 준비합니다. 주조 전에, 젤 용액 50 μL당 형광 핵산 염료 5 μL을 넣고 섞는다. 트레이와 빗을 주조에 적절히 사용하여 DNA 참조 사다리에 적절한 수의 우물을 무료로 남겨 둡니다.
- 설정 후 GE 시스템에서 1x TBE 버퍼에 젤을 담급금합니다. PCR 제품 5 μL을 2 μL의 로딩 염료와 혼합하고 젤 웰로 옮김을 옮김을 섞습니다. 참조를 위해 빈 우물에 DNA 사다리 5 μL을 추가합니다.
- 약 1시간 동안 15cm당 110V에서 겔을 실행하고 UV 기반 젤 이미징/시각화 시스템을 사용하여 PCR 앰플리온을 나타내는 다중(최대 5개) 대역의 존재를 확인합니다(그림 1의 예 참조). 젤을 버리십시오. 다음 단계로 진행하거나 추가 처리가 될 때까지 나머지 PCR 제품을 4°C에서 저장합니다.
4. 모세관 전기 동동 설정 및 실행 조건
- PCR 앰플리온의 확인에 따라, PCR 제품을 정제수에서 1:10(v/v)로 희석하십시오. 밀봉, 혼합 및 원심 분리기를 간략하게.
- 연기 찬장에서 작업, 포르마 미드의 9 μL 및 PCR 제품 당 크기 표준의 0.5 μL로 구성된 마스터 믹스의 볼륨을 준비 (허용 10% 잉여 볼륨). 소용돌이는 희석된 PCR 제품의 0.5 μL을 추가하기 전에 사용 가능한 CE 시스템에 적합한 플레이트에 9.5 μL을 간략하게 분배합니다. 밀봉, 혼합 및 원심 분리기를 간략하게.
주의 사항: 조심스럽게 다루어 보시고 다루어 보시고 있습니다. 포르마미드를 물과 혼합하면 독성이 있는 포름산을 생성합니다. - PCR 열 사이클러를 사용하여 시료를 95°C에서 3분 동안 변성한 후 4°C로 무한정 냉각합니다. 원심분리기는 제조업체의 지침에 따라 교정된 CE 시스템에 플레이트를 잠시 로드합니다.
- 선택 및 이하의 설정에 적합한 시약을 이용한 단편 분석 CE 실행: 60°C; 1.6 kV에서 5 s 주사 (cm 당 32 V); 15 kV (cm 당 300 V)에서 32 분 실행 시간. 24-모세관(50cm)에 24개의 우물의 CE 단편 분석은 전형적으로 약 50분이 소요됩니다.
5. VNTR 크기 호출, 반복 카운트 계산 및 MLVA 프로파일링
참고: 5.1 단계는 재료표에 나열된 특정 소프트웨어를 사용하여 전자 페로 그램 파일에서 호출하는 Y. ruckeri VNTR CE 크기를 설명합니다. 자세한 내용 및 문제 해결은 소프트웨어 설명서를 참조하십시오. 다른 소프트웨어를 사용하시면 적절한 설명서를 참조하십시오.
-
CE 결과 파일 가져오기(Y. ruckeri 분리당 2개). 분석 방법을 마이크로위성 기본값으로 설정하고 분석 버튼을 누르기 전에 크기 표준에서 적절한 제품 선택을 선택합니다. 크기 일치 편집기를 통해 크기 표준 조각의 올바른 식별을 확인하고 눈에 띄게 잘못된 할당을 수정합니다.
- 읽을 샘플을 선택한 후 표시 플롯 단추를 누르고 Ctrl+A를 눌러 크기 조정 테이블을볼 수 있습니다. 상단 패널에있는 동안, VNTR 앰플리온을 나타내는 다섯 개의 피크를 클릭하는 동안 Ctrl을 누르고 (필요에 따라 확대 /축소 도구를 사용).
참고: 각 멀티플렉스 PCR 제품에 대해, 전기페로그램은 고용된 3개의 염료 사이에 분포된 5개의 피크를 보여줄 것이다(표 1의 5' 염료 라벨링 및 도2의 두 예 참조). - Ctrl+G를 눌러 크기 조정 테이블을필터링하고 강조 표시된 5개의 피크의 특성만 표시하고 다운스트림 응용 프로그램의 경우 각 VNTR 궤적(표 1참조)에 대한 CE 크기 호출을 기록합니다.
- 읽을 샘플을 선택한 후 표시 플롯 단추를 누르고 Ctrl+A를 눌러 크기 조정 테이블을볼 수 있습니다. 상단 패널에있는 동안, VNTR 앰플리온을 나타내는 다섯 개의 피크를 클릭하는 동안 Ctrl을 누르고 (필요에 따라 확대 /축소 도구를 사용).
- CE 동안 편향된 앰플리톤 이동성 패턴을 고려하려면 아래 제공된 공식에 따라 정확한 VNTR 반복 카운트를 계산하여 궤적별 변수와 함께 VNTR CE 크기 호출을 사용합니다(표 1참조). 효율성을 위해 이 프로세스를 자동화하는 것이 좋습니다(예: 스프레드시트 템플릿 사용).
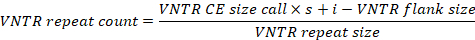
- 라운드 계산된 VNTR 반복은 가장 가까운 정수로 계산되고 각각 단일 Y. ruckeri 분리의 MLVA 프로파일을 나타내는 10자리 문자열로 연결됩니다.
6. MLVA 데이터의 최소 스패닝 트리 클러스터 분석
참고: 6단계는 재료표에 나열된 특정 소프트웨어를 사용하여 Y. ruckeri MLVA 데이터에서 MST 다이어그램생성에 대해 설명합니다. 자세한 내용 및 문제 해결은 소프트웨어 설명서를 참조하십시오. 다른 소프트웨어를 사용하시면 적절한 설명서를 참조하십시오.
- 새 데이터베이스를 만들고 MLVA 플러그인을 활성화 하도록 선택 합니다.
- 가져오기 Y. ruckeri MLVA 프로필 및 메타 데이터 뒤에 가져오기 필드 및 문자 (저장소 형식에 따라 추가 하위 선택)를 선택 합니다. 메시지가 표시되면 가져오기 파일의 내용에 따라 가져오기 규칙 지정: 대상 유형 열에서 VNTR 반복 카운트를 문자 값으로 분류합니다: VNTR및 기타 메타데이터를 항목 정보: 항목 정보 필드로 분류합니다. .
참고: 비교 및 컨텍스트를 위해, 본 MLVA 프로토콜(14)을 사용하는 원본 논문과 함께 게시된전체 데이터 세트(오픈 액세스)를 가져올 수도 있다. 해당 연구에서 면밀히 조사된 Y. ruckeri 격리제(n = 484)의 다양한 컬렉션에 대한 MLVA 프로파일 및 메타데이터는 다음 링크를 통해 보충 자료(표 S1 및 S2)에서 구할 수 https://aem.asm.org/content/84/16/e00730-18/figures-only#fig-data-additional-files - 실험 유형 패널에서 VNTR 항목을 열고 각 VNTR 궤적에 대한 최소값과 최대값을 각각 0과 100으로설정합니다. 일반설정에서 소수 자릿수를 0으로 설정하고 데이터 유형에서 숫자를 선택합니다. 부재 값을 0으로 간주합니다.
-
MST 클러스터 분석을 위해 가져온 샘플을 선택하고 비교 패널에서 새 비교 만들기 단추를 클릭합니다.
- MST의 시각적 표현이 필요한 경우 그룹 패널에서 사용할 수 있는 다양한 옵션을 사용하여 샘플을 컬러 그룹(예: 특정 메타데이터 특성에 따라)에 할당합니다.
참고: 다음 단계에 따라 그룹을 소급하여 만들 수 있습니다. - 범주형 데이터에 대한 고급 클러스터 분석 및 MST를 선택하여 선택한 샘플을 기반으로 MST 다이어그램을 생성합니다.
- MST의 시각적 표시를 기본값으로 수정합니다(예: 분할 매개 변수, 노드/분기 레이블 지정, 가교, 범례 등). 그림3의 예제를 참조하십시오.
참고: ≤4/10 비동일 VNTR 로시의 클러스터(클론 복합체) 분할 임계값은 >5/10 비동일 VNTR 로시를 나타내는 분기 연결을 숨기는 것 외에도 이전에 생성된 MLVA 데이터를 기반으로 MST 클러스터 분석에 사용되었습니다. 이 프로토콜14를사용 하 여 . 전술한 484개의 Y. ruckeri MLVA 프로파일의 데이터 집합을 가져온 경우, 이러한 샘플은 MST 클러스터 분석(위에서 설명한 대로)에 포함될 수 있습니다. 이것은 예를 들어, 이전에 설명된 클론 복합체와 관련된 모든 샘플과 아직 설명되지 않은 혈통을 나타내는 샘플의 식별을 용이하게 합니다. 사용 가능한 메타데이터에 따라 결과 MST 다이어그램을 여러 가지 방법으로 면밀히 조사하여 특정 특성(지리, 호스트, 시간 등)에 연결된 최종 클러스터링 패턴을 검색할 수 있습니다. - 필요한 경우 이미지 내보내기 선택을 사용하여 최종 화된 MST를 원하는 형식으로 내보냅니다.
- MST의 시각적 표현이 필요한 경우 그룹 패널에서 사용할 수 있는 다양한 옵션을 사용하여 샘플을 컬러 그룹(예: 특정 메타데이터 특성에 따라)에 할당합니다.
결과
여기에 설명된 바와 같이 멀티플렉스 PCR에 이어, 각 PCR 반응으로부터 다중 앰플리폰의 존재를 확인하는 전형적인 GE 이미지가 도1에 도시되어 있다. 검증된 PCR 제품에서 수행되는 다운스트림 CE 단편 분석은, 각각의 Y. ruckeri 분리검사에 대해, 각각의 VNTR 로시의 크기 호출에 사용되는 2개의 일렉트로로그램 파일을 초래한다(도 2). 484개의 다양한 Y. ruckeri 분리물의 분석으로부터, 동일한 멀티플렉스 반응에서 동일한 염료로 표지된 VNTR 로시 사이에 앰플리톤 크기 범위에서 중첩이 관찰되지 않았다(표1)14. 따라서 각 전기 동봉 피크는 색상으로 명확하게 식별될 수 있습니다.
MLVA 프로파일 및 관련 메타데이터를 선호하는 소프트웨어로 가져온 후, MST 다이어그램은 재료에 대한 모든 역학 적 패턴을 면밀히 조사할 때 설명된 대로 구성될 수 있습니다. 해당 소프트웨어에서 사용할 수 있는 추가 옵션은 해당 설명서를 참조하십시오. 예를 들어, 그림 3은 노르웨이의 5개 연어 농장과 연관된 어류로부터 회수된 Y. ruckeri 분리에 대한 MLVA 프로파일의 MST에 의한 비교를 보여줍니다.
10개의 VNTR 상소의 일관된 반복 크기뿐만 아니라 그들의 생체외 및 생체내 안정성은, 이전에 이 프로토콜14에기초하여 본래 연구에서 확인되었다. 간략하게, 이것은 Sanger 시퀀싱 (반복 크기)를 사용하여, 및 일련의 분리물의 MLVA 입력에 의해 직렬 통로 (시험관 내) 및 개별 질병 발발 (생체 내)에서 행해진 통로를 입력하여 행해왔습니다. 더욱이, 시간이 지남에 따라 로시의 환경 적 안정성은 대서양 연어에 대한 지속적으로 감염된 담수 생산 현장에서 수년 동안 회수된 여러 '집 변형'을 입력하여 조사하였다.
그림 1 : 겔 전기동동으로 여러 PCR 제품의 존재 여부를 확인할 수 있습니다. 이 이미지는 샘플을 포함하는 모든 12개의 레인에 여러 개의 PCR 앰플리곤이 존재하고, 첫 번째 차선이 사용된 DNA 사다리가 사용된 것을 확인합니다. 선택된 사다리 조각의 크기는 PCR 분석 및 변형(Gulla 등 2018년 14)의표 S1참조와 같이 각 레인의 소속으로 표시되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : VNTR 앰플리톤에 해당하는 피크를 보여주는 일렉트로로그램. 상이한 VNTR 로시의 이름은 염료 라벨과 함께 표시된다(VIC = 녹색; NED = 블랙; 괄호 안에 있는 6FAM = 파란색) 상기 2개의 일렉트로로그램(PCR 분석기 1 위; PCR 분석 2 하단) 단일 Y. ruckeri 분리의 입력에서 유래. 오렌지 봉우리 (염료 LIZ)는 채택 된 크기 표준을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : 역학 평가를 위한 최소 스패닝 트리예. 이 다이어그램은 5개의 다른 노르웨이 농장 (1-5; 전설 참조)에서 대서양 연어에서 회수된 Y. ruckeri 분리물에서 MLVA 프로파일을 기반으로 합니다. 농장 원산지와 연결된 명확한 군집 경향을 관찰할 수 있습니다. 크로스링크는 ≤1/10 비동일 VNTR 로시와 관련된 모든 가능한 연결을 표시합니다(범례 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : 더듬 과 분할 피크를 시각화 전기 페로그램. 이 경우 둘 다 동시에 발생하며 항상 발생하는 것은 아닙니다. YR1070 VNTR 궤적을 나타내는 더 길고 키가 큰 피크는 쉽게 구별할 수 있습니다. 디스플레이가 확대되고 파란색 염료 피크만 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
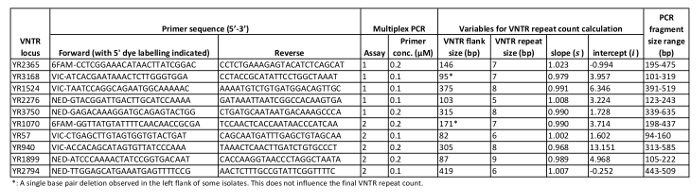
표 1: VNTR 궤적 특성. 본 MLVA 프로토콜에서 표적으로 하는 10개의 Y. ruckeri VNTR 영역의 관련 특성.
토론
여기에 제시 된 두 멀티 플렉스 PCR 가난한 템플릿 DNA 품질의 얼굴에 상대적으로 강력한 등장, 하지만 PCR 증폭의 부족은 그럼에도 불구하고 때때로 매우 높은 DNA 농도와 템플릿을 사용할 때 관찰되었다. 이러한 문제는 PCR 이전에 템플릿을 희석하여 쉽게 해결되었습니다. 여기에 채택된 것보다 DNA 추출을 위한 다른 방법(예를 들어, 상용 키트)도 사용될 수 있다.
각 멀티플렉스 PCR 반응에서 5개의 앰플리폰이 예상되지만, 동일한 반응 내의 일부(다르게 레이블이 지정된) VNTR 궤형에는 크기 범위가 겹치기 때문에 시각적으로 구별되는 5개의 대역이 항상 GE에서 기대할 수 있는 것은 아닙니다. 60 분의 최종 PCR 연장 시간은 필요한 경우 단축 될 수있다, 하지만 가능성이 후속 CE 전기 전형체에서 분할 피크의 증가 발생을 초래할 것이다 (아래 참조). 특히 GE 단계의 목적은 순전히 PCR 앰플리콘의 정성적 검증을 위한 것이므로 런타임, 전압 및/또는 겔 레시피가 선호되는 대로 조정될 수 있습니다. 특히 약한 밴드가 GE에 의해 관찰되는 경우, CE 이전에 이들 샘플의 희석 계수를 감소시키는 것이 바람직할 수 있다.
여기에 설명된 CE 프로토콜이 특정 상업용 모세관 전기 동화 장치(재료 표참조)에서 실행되었지만, 다른 CE 시스템은 서로 다른 샘플 요구 사항을 가질 수 있으며, 이로 인해 프로토콜에 대한 일부 수정이 필요할 수 있습니다. . 조각 분석을 위해 적절한 시약/장비, 교정 등에 대한 지침은 해당 CE 시스템 제조업체의 설명서를 참조하십시오. 또한 CE 동안 관찰된 편향된 앰플리톤 이동성 패턴이 다른 MLVA 프로토콜15,16에대해 문서화된 바와 같이 CE 시스템 및/또는 기계 간에 상대적으로 다를 수 있음이 있습니다. 최종(반올림) VNTR 반복 카운트가 영향을 받는 정도에 발생하는 경우 이는 VNTR 반복 수를 결정하는 데 사용되는 궤적 별 변수 s와 i(표 1)를 다시 보정해야 함을 의미합니다. 여기에는 Gulla et al. 201814에설명된 대로 정확한 시퀀스 크기와 CE 크기 호출을 비교하는 플롯의 선형 회귀를 포함합니다.
분할 피크 및 더듬 피크, CE 기반 MLVA 타이핑(17)에서 모두 잘 알려진 아티팩트는 크기 호출 동안 전기 전형체에서 관찰될 수 있다(도4). 더듬 피크는 무시해야 하지만 단일 베이스 쌍으로 분리된 분할 피크의 경우 다운스트림 응용 프로그램에 대해 더 긴 피크를 일관되게 선택해야 합니다. 더욱이, 특정 VNTR loci의 부족을 나타내는 부재 피크는 드물지만 발생할 수 있으며, 이 경우 '0'의 반복 카운트가 할당되어야 한다. DNA가 추출되는 시작 배양이 순수하지 않은 경우(즉, 하나 이상의 Y. ruckeri 하위 유형을 포함함), 동일한 궤적/궤적의 상이한 골조에 해당하는 다중 키가 큰 피크는 CE 다음에 관찰될 수 있다. 이차 재배는 다시 입력을 위한 새로운 DNA 추출의 앞에 단 하나 식민지에서 그 때 능력을 발휘해야 합니다.
프로토콜에 명시된 바와 같이, PCR에 대한 템플릿 DNA는 기본적으로 Y. ruckeri의순수한 문화에서 추출되어야한다. 그러나 몇 가지 경우에, qPCR (Ct-값 & 27)에 의해 Y. ruckeri에 대한 양성 반응을 보인 계란 유체 샘플은 이전에 배양하지 않고, 템플릿으로 증가 된 양의 게놈 DNA (상업용 키트로 추출)를 사용하여 직접 MLVA를 성공적으로 입력했습니다. 이 접근법은 광범위하게 시험되거나 검증되지 않았지만, Y. ruckeri이외에 다양한 유기체로부터 DNA를 함유하는 복잡한 생물학적 행렬의 검사를 위한 이 MLVA 분석법의 가능성을 나타낸다.
여기에 제시된 전체 MLVA 타이핑 절차는 DNA 추출에서 후생동물 학적 평가에 이르기까지 단일 작업 일에서 완료 될 수 있습니다. 그러나, 조사된 샘플의 수는 DNA 추출, PCR 및 CE에 필요한 시간과 하위 선형 관계에 있으며, 따라서 여러 샘플을 동시에 실행할 때 방법이 훨씬 더 시간 효율적입니다. 이것은 그럼에도 불구하고 대부분의 실험실 기반 방법의 경우이며 Y. ruckeri의역학 하위 화를위한 도구로서 고해상도, 단순성 및 휴대성의 조합으로 이 MLVA 분석법을 이전에 출판 된 프로토콜 4보다 우수하게만듭니다. ,5. 또한 Y. ruckeri 혈청형14의제한된 역학 관련성을 확인하는 데 사용되었습니다.
484 Y. ruckeri 분리를 포함하는 포괄적인 MLVA 기반 인구 연구를 통해, 상피학 및 인구에 관하여 우리의 이해, spatiotemporal 기원 및 서식지 (호스트 물고기, 환경 등)의 범위에서 복구했습니다 이 중요한 어류 병원균의 구조는실질적으로 14증가되었다. MLVA 타이핑은 수십 년 동안 인위적으로 전파된 클론의 추적을 가능하게 했으며, 아마도 물고기의 수송과 국부적으로 제한된 균주의 식별을 통해 서열이 되었습니다. 더욱이, 박테리아의 몇몇 클론 복합체는 명확하게 특정 물고기 호스트에 있는 질병과 연관될 수 있는 동안 (무지개 송어와 대서양 연어, 각각), 그 외는 환경 근원 및/또는 임상적으로 영향을 받지 않는 물고기에서만 복구되었습니다 표본. 이 방법의 적용성은 감염 추적에 만 국한될 뿐만 아니라, 백신 개발, 위험 평가 및 국가 생물 안전의 유지 관리와 같은 잠재적 관련성에 대한 정보도 제공할 수 있다. 그것은 현재 노르웨이 양식에서 Y. ruckeri 진단을 조사 하기 위한 도구로 노르웨이 수의 학회에서 활성 사용.
공개
저자는 공개 할 것이 없다.
감사의 말
본 연구는 노르웨이 해산물 연구 기금, FHF (프로젝트 번호 901119 및 901505)에 의해 투자되었다. 우리는 방법 개발 중에 사용되는 세균 성 분리 및 샘플의 모든 기여자에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 22°C/15°C incubator | As preferred. | NA | |
| 5' Labeled Primer, 10K PMOL, Desalted, Dry | Thermo Fisher Scientific | 450007 | Sequences and labelling in Table 1. Prepare working aliquouts in TE-buffer. |
| Agarose, universal, peqGOLD | VWR | 732-2789P/732-2788 | Used during gel electrophoresis. |
| Avant 3500xL Genetic Analyzer | Thermo Fisher Scientific | A30469 | Used for capillary electrophoresis fragment analysis. |
| BioNumerics7 modules | Applied Maths | NA | Used for generating Minimum spanning trees from MLVA data. |
| Centrifuge(s) | As preferred. | NA | |
| Custom DNA Oligo, 25N, Desalted, Dry | Thermo Fisher Scientific | A15612 | Sequences in Table 1. Prepare working aliquouts in TE-buffer. |
| DNA Gel Loading Dye (6X) | Thermo Fisher Scientific | R0611 | Loading dye used during gel electrophoresis. |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | Centrifuge tubes used during DNA extraction. |
| Freezer | As preferred. | NA | |
| Fume cupboard | As preferred. | NA | |
| Gel electrophoresis system | As preferred. | NA | |
| GelRed Nucleic Acid Stain, 10,000X in water | Biotium | 41003 | Fluorescent nucleic acid dye used during gel electrophoresis. |
| GeneMapper Software 5 | Thermo Fisher Scientific | 4475073 | Used for reading electropherograms from capillary electrophoresis. |
| GeneRuler 50 bp DNA Ladder, ready-to-use | Thermo Fisher Scientific | SM0373 | DNA ladder used during gel electrophoresis. |
| GeneScan 600 LIZ dye Size Standard v2.0 | Thermo Fisher Scientific | 4408399 | Size standard used during capillary electrophoresis. |
| Heating block | As preferred. | NA | |
| Hi-Di Formamide | Thermo Fisher Scientific | 4311320/4440753 | Deionized formamide used during capillary electrophoresis. Prepare working aliquouts. |
| Milli-Q water | NA | NA | Purified water used during PCR and capillary electrophoresis. Standard recipe; produced in-house. |
| Multiplex PCR Plus Kit | Qiagen | 206151/206152 | |
| PCR thermal cycler | As preferred. | NA | |
| POP-7 Polymer for 3500 Dx/3500xL Dx Genetic Analyzers | Thermo Fisher Scientific | A26077/4393713/4393709 | Separation matrix used during capillary electrophoresis. |
| Pure culture Yersinia ruckeri | NA | NA | E.g. cryopreserved or fresh. |
| RNase-free water | Qiagen | NA | In: Multiplex PCR Plus Kit |
| Tris-borate-EDTA (TBE) buffer | NA | NA | Standard recipe; produced in-house. |
| Trypsine soy agar/bovine blood agar | NA | NA | Standard recipe; produced in-house. |
| UV-based gel imaging/visualisation system | As preferred. | NA | |
| Vortexer | As preferred. | NA |
참고문헌
- Barnes, A. C. Enteric redmouth disease (ERM) (Yersinia ruckeri). Fish Diseases and Disorders, Vol 3: Viral, Bacterial and Fungal Infections. 3, 484-511 (2011).
- Barnes, A. C., et al. Whole genome analysis of Yersinia ruckeri isolated over 27 years in Australia and New Zealand reveals geographical endemism over multiple lineages and recent evolution under host selection. Microbial Genomics. 2 (11), 000095(2016).
- Calvez, S., Mangion, C., Douet, D. G., Daniel, P. Pulsed-field gel electrophoresis and multi locus sequence typing for characterizing genotype variability of Yersinia ruckeri isolated from farmed fish in France. Veterinary Research. 46, 73(2015).
- Bastardo, A., Ravelo, C., Romalde, J. L. Multilocus sequence typing reveals high genetic diversity and epidemic population structure for the fish pathogen Yersinia ruckeri. Environmental Microbiology. 14 (8), 1888-1897 (2012).
- Wheeler, R. W., et al. Yersinia ruckeri biotype 2 isolates from mainland Europe and the UK likely represent different clonal groups. Diseases of Aquatic Organisms. 84 (1), 25-33 (2009).
- Eyre, D. W., et al. Comparison of multilocus variable-number tandem-repeat analysis and whole-genome sequencing for investigation of Clostridium difficile transmission. Journal of Clinical Microbiology. 51 (12), 4141-4149 (2013).
- Sun, M., et al. Multiple Locus Variable-Number Tandem-Repeat and Single-Nucleotide Polymorphism-Based Brucella Typing Reveals Multiple Lineages in Brucella melitensis Currently Endemic in China. Frontiers in Veterinary Science. 4, (2017).
- Bouchouicha, R., et al. Comparison of the performances of MLVA vs. the main other typing techniques for Bartonella henselae. Clinical Microbiology and Infection. 15, SUPPL 2 104-105 (2009).
- Dahyot, S., et al. Multiple-Locus Variable Number Tandem Repeat Analysis (MLVA) and Tandem Repeat Sequence Typing (TRST), helpful tools for subtyping Staphylococcus lugdunensis. Scientific Reports. 8 (1), (2018).
- Elberse, K. E. M., Nunes, S., Sá-Leão, R., van der Heide, H. G. J., Schouls, L. M. Multiple-locus variable number tandem repeat analysis for Streptococcus pneumoniae: Comparison with PFGE and MLST. PLoS ONE. 6 (5), (2011).
- Matejusova, I., et al. Multilocus variable-number tandem-repeat genotyping of Renibacterium salmoninarum, a bacterium causing bacterial kidney disease in salmonid fish. BMC microbiology. 13, 285(2013).
- Duodu, S., et al. An improved multiple-locus variable-number of tandem repeat analysis (MLVA) for the fish pathogen Francisella noatunensis using capillary electrophoresis. BMC Veterinary Research. 9, 252(2013).
- Abayneh, T., Colquhoun, D. J., Austin, D., Sørum, H. Multilocus variable number tandem repeat analysis of Edwardsiella piscicida isolates pathogenic to fish. Journal of Fish Diseases. 37 (11), 941-948 (2014).
- Gulla, S., et al. Multilocus variable-number tandem-repeat analysis of Yersinia ruckeri confirms the existence of host specificity, geographic endemism, and anthropogenic dissemination of virulent clones. Applied and Environmental Microbiology. 84 (16), (2018).
- Pasqualotto, A. C., Denning, D. W., Anderson, M. J. A cautionary tale: Lack of consistency in allele sizes between two laboratories for a published multilocus microsatellite typing system. Journal of Clinical Microbiology. 45 (2), 522-528 (2007).
- Lista, F., et al. Genotyping of Bacillus anthracis strains based on automated capillary 25-loci multiple locus variable-number tandem repeats analysis. BMC Microbiology. 6, 33(2006).
- Thermo Fisher Scientific DNA Fragment Analysis by Capillary Electrophoresis. , Available from: https://www.thermofisher.com/content/dam/LifeTech/global/Forms/PDF/fragment-analysis-chemistry-guide.pdf (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유