Method Article
화학유전학적으로 조작된 피질 인터뉴런 선조를 출생 후 마우스 뇌로 이식
요약
여기에서 우리는 초기 출생 후 마우스의 피질로 이식된 피질 interneuron 선조의 활동을 조작하기 위하여 화학유전학 공구를 이용하기 위하여 디자인된 프로토콜을 제시합니다.
초록
신경 발달은 환경과 유전 요인의 복잡한 조합에 의해 통제됩니다. 각 성분의 상대적 기여도를 평가하는 것은 복잡한 작업이며, 이는 γ-아미노부티르산(GABA)의 발달과 관련하여 특히 어렵다. CIs는 대뇌 피질의 주요 억제 뉴런이며, 개별 피라미드 뉴런의 활동과 뉴런 앙상블의 진동 행동을 모두 조절함으로써 뉴런 네트워크에서 중요한 역할을 합니다. 그(것)들은 자궁 전기 천공 접근에서 사용하여 능되게 표적으로 하기 매우 어려운 일시적인 배아 구조물 (내측 및 꼬리 신경절 저명한 - MGE 및 CGE)에서 생성됩니다. 인터뉴런 선조는 정상적인 배아 발달 중에 피질 회로에 통합되기 전에 먼 거리를 이동합니다. 개발 네트워크에 분산하고 통합하는이 놀라운 능력은 초기 출생 후 호스트 코르티제로 배아 인터뉴런 전구체를 이식하여 납치 될 수 있습니다. 여기에서, 우리는 국소 생체 내 전기를 사용하여 배아 간 신경 세포 선조의 유전자 변형을 허용하는 프로토콜을 제시한다. 이 조작된 인터뉴런 전구체는 그 때 초기 출생 후 호스트 cortices로 이식되고, 그(것)들은 쉽게 식별 가능한 CIs로 성숙할 것입니다. 이 프로토콜은 여러 유전자 부호화 된 도구의 사용, 또는 인터 뉴런 선조에서 특정 유전자의 발현을 조절하는 능력을 허용, 성숙에 유전 적 또는 환경 적 변수중 하나의 영향을 조사하기 위해 및 C의 통합.
서문
신경 네트워크의 기능은 흥분성의 투영 뉴런과 억제 인터뉴런의 균형 잡힌 보완의 존재에 의존한다. 피질 인터뉴런 (CIs)은 포유류 코르티크의 모든 뉴런의 20 %를 나타내지만, 그 수 또는 기능의 적자는 신경 발달 장애의 발병 기전에서 중요한 역할을하는 것으로 생각됩니다1,2. CI개발연구는 CI가 접근하기 어려운 일시적인 배아 구조에서 생성되고, 팔륨에 도달하고 성숙한 해부학적 및 생리학적 으로 발전하기 전에 긴 접선 이동을 따르기 때문에 도전적입니다. 속성3. 유전적 및 환경적 기전 모두CI 개발 4를 조절하는 것으로 알려져 있지만, 여러 요인의 상대적 기여도를 연구하기는 어렵다는 것이 입증되었습니다.
CI 개발에 대한 많은 통찰은 신경절 저명5,6으로부터선조를 격리한후 시험관내 배양 시스템을 사용하여 얻어졌다. 이 방법의 큰 이점 의 한은 고립된 선조를 표지하고 유전으로 수정하고 세포 자율적인 변경을 검출하기 위하여 그들의 분화를 상세히 따르는 가능성입니다. 그러나, 이러한 방법은 인터뉴런 개발과 활성 네트워크 사이의 상호 작용에 관한 정보를 제공 할 수 없습니다. 우리는 초기 출생 후 피질에 수정 된 전구체의 이식에 의해, 이러한 프로토콜을 적응했다. 배아 신경절 전도자로부터 분리된 인터뉴런 선조는 피질7,8로이식시 생존, 분산 및 숙주 네트워크로 통합할 수 있다. 이 방법은 유전마우스 모델에서 간질 발작의 중증도를 감소시키기 위해 사용되어 왔으며, 상이한신경발달 장애9,10에대한 가능한 새로운 치료법으로 제안되고 있다. 이전 프로토콜은 이식11전에 바이러스 벡터로 이러한 전구체를 변환하는 절차를 설명합니다. 우리가 여기에서 설명하는 프로토콜은 또한 interneurons의 유전 적 변형을 허용하지만, 크게 유연성을 증가 만 플라스미드 DNA를 필요로 하는 바이러스 벡터의 생성을 필요로하지 않습니다. 몇몇 연구 결과는 꼬리 신경절 eminences (CGE)12에있는 interneuron 선조를 유전으로 수정하기 위하여 자궁 전기천공에서 사용에 있는 성공을 보고했습니다, 그러나 이 방법은 재생하기 아주 어려운 입증되었습니다.
대표적인 결과 섹션에서, 우리는 이식된 IS에서 디자이너 약물(DREADDs 13)에의해 독점적으로 활성화된 디자이너 수용체를 발현하기 위해 이 방법의 사용을 예시하고, 최근 간행물14에사용된 방법. 우리는 hM3D (Gq), 인간의 해 수용체 CHRM3에 기초하여 엔지니어링 수용체를 표현, 이는 그것의 특정 리간 클로자핀 -N-산화물 (CNO)를 결합하지 않는 한 신경 기능에 영향을미치지 않는. CNO 투여는 선택적으로 hM3D(Gq) 발현 세포의 활성화를 트리거한다. 우리는 세포 자율과 과도 탈분극이 개발14동안 CIs의 세포 사멸을 방지하기에 충분하다는 것을 보여주기 위해이 방법을 사용했다. 다른 유전자 부호화 된 도구와 결합, 이 프로토콜은 위- 또는 하향 조절 유전자 발현에 잠재력을 가지고, 인터뉴런 분화의 다른 단계 동안 세포 활동을 시각화하거나 조작.
프로토콜
동물은 영국 동물 (과학적 절차) 법 (1986)에 따라 사육 및 보관되었다.
참고: pCAG-hM3D(Gq)-IRES-RFP 구제의 생성을 위해, hM3D(Gq) 서열을 포함하는 SalI-StuI 단편은 플라스미드 50463(Addgene)으로부터 분리되고, 발현 벡터 pCAG-RFP(F. Guillemot로부터의 선물)로 소화되었다. 쇼이 에코RV.
1. 마우스 배아 피질 조각의 준비
- 실험실 장비(예: 스테레오 현미경) 및 표면(예: 벤치)을 적절한 세제 용매와 70% 에탄올(EtOH) 용액을 물에서 멸균(H2 O).
- 오토클레이브된 해부 도구를 사용하여 항상 100% EtOH로 보관하십시오.
- 1x 인산완충액(PBS)에서 4% 저겔링 온도의 3개의 20 mL aliquots를 50 mL 튜브에 준비하고 55°C에서 유지합니다.
- 임신 한 쥐를 임신 13.5 또는 14.5 일 에서 자궁 경부 탈구로 희생하십시오 (배아 일 E13.5-E14.5).
- 한 쌍의 해부 가위로 임신 한 마우스의 복부를 열고 자궁 뿔 (배아)을 제거하고 얼음 차가운 크렙스 용액(표1)에 90mm 페트리 접시에 넣습니다.
- 한 쌍의 직선 학생 미세 집게로 양수 낭을 열고 배아를 제거하고 신선한 얼음 차가운 Krebs 용액으로 새로운 90mm 페트리 접시에 옮김을 옮김을 옮김으로 옮김을 옮김을 넣습니다. 마우스 배아 뇌 (전뇌, 중뇌, 뒷뇌)를 배아 체의 나머지 부분에서 해부합니다.
- 뒷뇌에서 해부된 뇌를 잡고, 얼음으로 차가운 크렙스 용액으로 옮겨 새로운 90mm 페트리 접시에 담아 얼음위에 보관하십시오.
- 방수 펜으로, 6 개의 35mm 페트리 접시의 하단 부분의 중간에, 외부 표면에 직선을 그립니다.
- 37°C에서 4% 저겔링 아가로즈/PBS 20 mL aliquot를 5분 동안 두 개의 35 mm 페트리 접시에 즉시 10 mL로 놓고 해부된 뇌를 임베드합니다.
참고: 후각 전구는 아래쪽 (페트리 접시의 바닥)에 직면해야합니다. 페트리 접시 당 3-4 개의 두뇌를 포함하고 이전에 그려진 직선으로 정렬하십시오. 각 두 뇌 사이에 3-5 mm 의 공간을 둡니다. - 해부된 모든 뇌가 포함될 때까지 1.8 단계와 1.9 단계를 반복합니다.
- 아가로스가 굳어지도록 내장된 뇌를 4°C에 놓고, 이어서 세 뇌를 적절한 크기와 방향의 단일 블록으로 조각한다.
참고: 뇌 샘플의 가장자리 주위에 약 3mm를 둡니다. 상단에 후각 전구와 함께 뇌의 방향을 변경합니다. - 마이크로 토메 베이스의 표면에 블록을 접착제와 수술 블레이드를 사용하여 블록의 바닥을 통해 모든 방법을 잘라, 각 두 뇌 사이에, 만들기 위해 3 독립적 인 블록 (하나의 뇌를 포함하는 각 미니 블록).
- 얼음으로 차가운 크렙스 용액에서 블록을 진동 블레이드 마이크로토메를 사용하여 250 μm 두께의 조각으로 단면도합니다.
- 구부러진 평평한 마이크로 주걱으로 내측 또는 꼬리 신경절 전도 (MGE 또는 CGE)를 포함하는 슬라이스만을 수집; 그림1) 필터 멤브레인 (직경 13 μm, 8.0 μm 기공 크기)에 개별적으로 옮기고 폴리스티렌 센터 웰 오르간 배양 접시 (60mm x 15mm)에서 최소한의 필수 매체 (MEM, 표1)에 떠 있습니다.
- 접시를 CO2 조직 배양 인큐베이터에 놓고, 37°C에서, 1시간 동안, 초점 전기 천공에 대비한다.
2. 급성 뇌 슬라이스 전기 포란
- 전기 천공 절차를 시작하기 전에 100mm 페트리 접시에 1 % 아가로즈 젤 50 mL을 준비하십시오. 아가로즈 젤을 실온(RT)에서 약 30분 동안 고형화시.
- 작은 아가로즈 컬럼(직경 1mm, 길이 10mm)을 유리 파이펫(길이 225mm, 2mL 용량)으로 펀칭한 후 얼음처럼 차가운 크렙스 용액으로 옮긴다.
참고: 2 mL 파이펫에 적합한 고무 드롭퍼 전구가 파이펫에 부착되고, 이를 눌러 컬럼을 유리 파이펫에서 크렙스 용액으로 방출할 수 있다. - 수술 블레이드로, 두 가지 크기의 작은 아가로즈 블록을 잘라 : 전극의 표면에 맞는 작은 하나 (아래 참조) 더 큰 하나, 이는 뇌 슬라이스에 초점 DNA 주사를 수행하기위한 기초로 사용됩니다. 얼음처럼 차가운 크렙스 용액에 아가로즈 블록을 옮김을 옮김을 옮김을 옮김을 옮김을 드린다.
- 국초점 주사 및 급성 전기 포출을 위한셋업을 준비한다(그림 2).
참고: 주사를 위해, 다음 장비가 필요하다 : 1) 밝은 필드 해부 스테레오 현미경, 2) 공압 피코 펌프 인젝터, 3) 마이크로 조작기, 4) 자기 스탠드, 및 5) 강판. 급성 슬라이스 전기화의 경우, 다음 장비가 필요합니다 : 1) 1 정사각형 백금 10mm 페트리 접시 전극, 2) 1 정사각형 백금 10mm 커버 전극, 3) 마이크로 매니퓰레이터 및 4) 전기 포더. -
초점 DNA 주사
- 발현 벡터의 DNA 혼합물을 준비합니다: pCAGs-IRES-GFP (대조군 벡터) + pCAG-hM3D(Gq)-IRES-RFP, 각 벡터에 대해 1 μg/μL의 농도로, 1/10 희석에 빠른 녹색 용액(스톡 25 mg/mL)을 추가합니다.
- 당겨진 유리 마이크로파이펫(0.5 mm 내경 및 1 mm 외경)을 DNA 혼합물의 10 μL로 채우고 슬라이스의 선택된 영역(MGE/CGE)에 소량(25-50 nL 범위)을 주입합니다(그림1 및 그림2).
-
급성 전기 화기광
참고: 전기 포출은 초점 DNA 주입 직후에 수행되어야한다.- 페트리 접시 전극에 작은 아가로즈 블록을 놓고 평평한 마이크로 주걱의 도움으로 이동 커버 전극에 아가로즈 컬럼을 부착합니다.
- 지지 막으로 슬라이스를 아가로즈 블록에 옮기고 슬라이스의 선택된 영역(MGE/CGE) 위에 아가로즈 컬럼이 있는 상단 전극을 놓습니다.
참고 : 125 V의 충전 전압 (각각 5ms, 간격 500 ms의 두펄스)은 성공적인 전기 천공을 생성합니다 (그림 3).
- 전기 천공 후, 지지 막으로 슬라이스를 접시에 넣고 37 °C에서 CO2 조직 배양 인큐베이터에 접시를 옮김을 옮김을 옮김.
- 1시간 후, MEM 배지를 1차 뉴런 배양에 적합한 기본 배지로 교환한다(뉴런 베이직 배지; 표1) 슬라이스를 밤새 약 18-24시간 동안 배양합니다.
3. 세포 이식의 준비
- 모든 슬라이스에서 전기 개화의 효율을 확인하십시오. 허용 가능한 수의 형광 세포가 관찰되는 슬라이스만선택합니다(그림 3).
참고: 이식에 적합한 수의 세포를 획득하기 위해 실험당 약 30개의 슬라이스/전기를 사용합니다(아래 참조). - 각 슬라이스에서 선택된 영역(MGE/CGE)을 해부하고 형광해 스테레오 현미경하에 얼음 차가운 크렙스 용액의 작은 조각으로 조직을 자릅니다.
- 한편, 37°C에서 수조에 900 μL 뉴런 베이직 배지를 가진 1.5 mL 튜브를 놓는다.
- P1000 마이크로피펫으로 조직 조각을 L15/DNase 배지의 500 μL을 함유하는 1.5 mL 튜브로 옮기고 DMEM/F12 배지에 1mg/mL DNase 스톡 100 μL을 L15 배지의 900 μL로 첨가합니다. 도청하여 티슈 조각을 씻으하십시오.
- 900 μL 뉴런 기본 배지에 DNase 100 μL(DMEM/F12 배지의 스톡 1 mg/mL)을 추가합니다.
- L15/DNase 배지를 폐기하고 3.5단계에서 제조된 200 μL 뉴런 베이직/DNase 배지에서 조직 조각을 재중단하였다.
- P200 마이크로파이터를 180 μL로 설정하고 부드럽고 "크리미한" 현탁액이 얻을 때까지 20-30회 부드럽게 위아래로 파이펫팅하여 조직 조각을 기계적으로 해리합니다.
- 200 μL의 뉴런 베이직/DNase 배지(최종 총 부피 400 μL)를 추가하고 다시 일시 중단합니다.
- 세포의 4 μL 별표를 가지고 적절하게 희석하고 혈세포계에 장착하십시오.
- 밝은 필드 현미경에서, 해리의 효율성을 확인하고 세포의 수를 계산합니다.
참고: 해리가 성공하면 밝은 (살아있는) 단일 세포가 아닌 세포 응집체가 관찰됩니다. - 3.8단계에서, RT에서 1,000rpm에서, 5분 동안, 그리고 그 후, 관에서 상층부를 제거하고 적절한 L15/DNase 배지(보통 5-7 μL)를 첨가하여 세포의 최종 농도가 8 x 105-1.2 x 10 6이 되도록 하였다. 셀/μL.
참고: 재서스펜션 중에 기포를 피하는 것이 매우 중요합니다. - 얼음에 세포 알리쿼트를 놓고 주사를 위한 추가 L15/DNase 배지가 있습니다.
4. 두개내 주사
참고: 다음 절차는 애니멀 하우스 시설 내의 수속실에서 진행됩니다. 세포는 뇌를 노출하지 않고 신생아 강아지의 뇌에 직접 주입되기 때문에, 무균 조건은 70 % EtOH 용액으로 작업 공간을 살균하고 오토 클레이브 유리 바늘을 사용하여 유지됩니다. 두개내 주사에 필요한 다음 장비: 1) 밝은 필드 해부 스테레오 현미경, 2) 마이크로 인젝터, 3) 마우스 회수를 위한 가열 패드.
- 제조업체의 권장 사항에 따라 바늘을 당겨 유리 바늘을 준비하십시오. 이 프로토콜에는 80 μm 외경, 40 μm 내경 및 30° 베벨을 가진 유리 바늘이 사용됩니다.
참고: 위에서 언급 한 바와 같이, 바늘은 사용하기 전에 오토 클레이브해야합니다. - 30G, 2 인치 바늘 및 주사기를 사용하여 생물학적으로 불활성 오일로 바늘을 수동으로 백필합니다.
- 제조업체의 지침에 따라 바늘을 조립하여 인젝터 장치에 삽입합니다.
- 최대 볼륨(69nL)과 상대적인 느린 속도(23nL/s)의 주입 설정을 결정합니다.
- 플런저가 완전히 확장될 때까지 바늘을 비웁습니다.
-
바늘을 채웁니다.
- 접목 테이프에서 작은 조각을 잘라 밝은 필드 해부 스테레오 현미경 아래에 배치합니다. P10 마이크로파이펫을 사용하여 샘플(셀 aliquot)에서 5 μL을 테이프로 옮겨 구형 낙하가 형성되도록 합니다.
- 바늘 끝을 샘플에 넣고 바늘을 채웁니다 (플런저가 후퇴하고 샘플을 그립니다).
참고: 샘플은 매우 점성이 있어야하기 때문에, 샘플이 평형화되도록 작은 단계로 바늘을 채우고, 형성에서 기포를 방지 느린 속도로. 샘플은 바늘 내에서 부드럽고 균일해야합니다. 시료가 너무 점성이 있고 바늘을 채울 수 없는 경우 올바른 점도를 얻기 위해 필요한 만큼 L15/DNase 배지를 추가하십시오. 그럼에도 불구하고, 이것은 샘플의 농도를 변화시키고, 이상적으로 는 피해야한다.
- 새로 태어난 새끼를 2-5 분 동안 얼음에 마취 (출생 후 일 0-2 [P0-P2]).
참고: 강아지가 움직이지 않는지 확인하십시오. - 밝은 필드 해부 스테레오 현미경 아래에 마취 된 강아지를 놓습니다.
- 각 반구에서 각각 69 nL의 3-4 주사를 수행합니다.
참고: 사출 부위는 미드라인에 약 1 mm 측면, 그리고 브레그마에 1 mm 카그달 과 1 mm rostral 사이에 위치하여 계보 라인에. 바늘의 끝은 pial 표면에 약 1mm 깊이를 두어야합니다. 각 주입 후, 바늘은 약 30 s에 대 한 장소에 남아 있으며 기간에 철회. - 주사 직후, 가장 낮은 설정 (37 °C)에서 가열 패드에 강아지를 놓습니다. 강아지가 회복되면 어머니와 함께 케이지로 옮김을 옮김으로 옮김을 옮김이 있습니다.
참고: 새장에 새끼가없는 어머니를 떠나지 마십시오. 전체 절차 (새끼를 쓰레기에서 제거하는 것에서 돌아올 때까지)는 10 분 미만 지속되어야합니다.
5. 클로자핀-N-산화물 주사
- 용액이 반투명할 때까지 50 μL의 디메틸 설폭사이드(DMSO)에서 1 mg의 CNO를 희석하여 DREADD 리간드, CNO 스톡 솔루션을 준비합니다. CNO의 최종 농도가 0.1 mg/mL이 되도록 식염수로 최대 10 mL.
참고: DMSO는 독성이 있습니다. 0.1% 이상의 농도로 사용하지 마십시오. CNO 함유 용액과 동일한 DMSO 농도를 함유하는 식염수 용액을 대조군으로 사용한다. - 산후 일 14 및 3 구성 일 (P14-P16)에 대 한, 각 마우스에서 CNO의 두 복 강 (I.P.) 주사를 수행 (CNO 농도: 1 mg/kg) 또는 0.05% DMSO 식염수에, 하루, 12 시간 떨어져.
- 마지막 날(P17)에, 30 분-1 시간의 시간 창 내자궁 경부 탈구에 의한 단일 주사 및 희생 마우스를 수행한다.
결과
여기에 제시된 절차를 사용하여, 우리는 초기 출생 후 단계 도중 피질 interneurons의 생존이 세포 자율적인 방법으로 활동에 의해 통제되는지 시험했습니다. 우리는 pCAGs-IRES-GFP (대조군) 및 pCAGGs-hM3D (Gq)-IRES-RFP 발현 벡터를 각 구성에 대해 1 μg / μL의 농도로 3 개의 뇌 슬라이스 전기 화 출화 실험 (실험 당 12-16 배아 [E14.5 배아])을 수행했습니다. 우리의 전기 천공 실험에서, 단지 분수 (약 50 %; 그림3) GFP+ 뉴런의 hM3D(Gq)(RFP+)및 따라서 GFP+RFP-집단은 DREADD 리간드의 효과에 대한 내부 대조군으로 작용하였다. 형질감염된 피질 배아 인터뉴런은 기계적으로 해리되었고 P0-P1 야생 형 마우스의 피질에서 이식된 세포 현탁액(8 x 105 세포/μL)을 이식하였다. 우리는 수행 했다 6 뇌 당 주사. 각 실험에서, 최소 6 개의 새로운 태어난 새끼를 주입 했다. CNO의 투여는 활성 의존성 단백질 cFos의 발현에 의해 입증된 바와 같이 형질전환된 RFP+ 세포의 활성을 선택적으로 증가시켰다(도 4). 기재된 프로토콜에 따른 CNO 치료(일일 2회 P14-P17 투여)는GFP+ RFP에 비해 GFP+ RFP+의 비중이 증가하여 GFP+ RFP-세포, 비히클(식염수의 0.5% DMSO)에 비해 증가하였다. 관리 된 리터메이트(그림5).
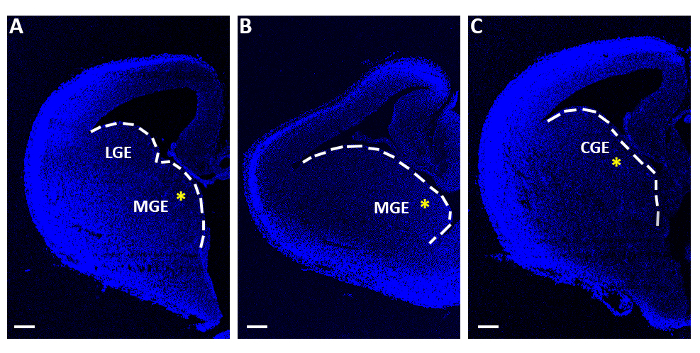
도 1: 급성 전기 포공 실험에 사용되는 대표적인 말순뇌골 슬라이스. (A-C) 3개의 명백한 순차적 로스트로-꼬마 수준에서 얻은 말뇌골 조각, 4′,6-diamidino-2-페닐린들 (DAPI)로 염색. LGE: 측면 신경절 저명한; MGE: 내측 신경절 저명한; CGE: 카달 신경절 저명한. 배율 막대 = 200 μm. 노란색 별표는 각 슬라이스의 전기 화지임을 나타냅니다. 흰색 선은 신경절 의 우수성의 가장자리를 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
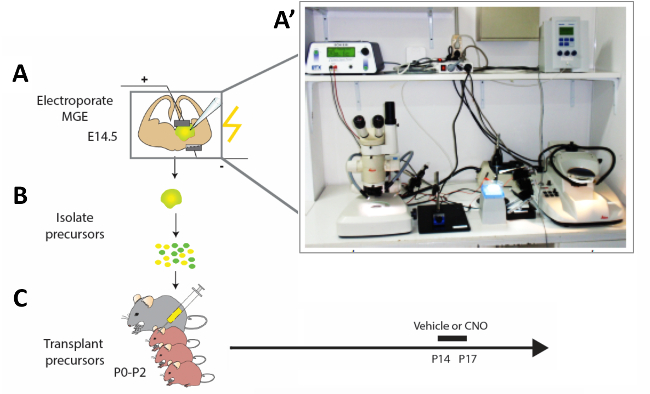
그림 2: 실험 워크플로우의 개략적 표현. (a) 마우스 뇌 슬라이스는 적절한 구성물로 전기를 공급하고, (B) 12시간 후에 수정된 피질 인터뉴런(CI) 전구체가 분리되고 (C) 신생아 마우스 새끼의 팔륨에 이식(P0−P2). 미성숙 한 CIs의 활성을 수정하기 위해, 세포 이식을 받은 P14 새끼는 제시된 프로토콜에 따라 4 일 동안 CNO 또는 비히클을 주입하였다. (A') 급성 마우스 뇌 슬라이스 전기 화기광 설정의 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
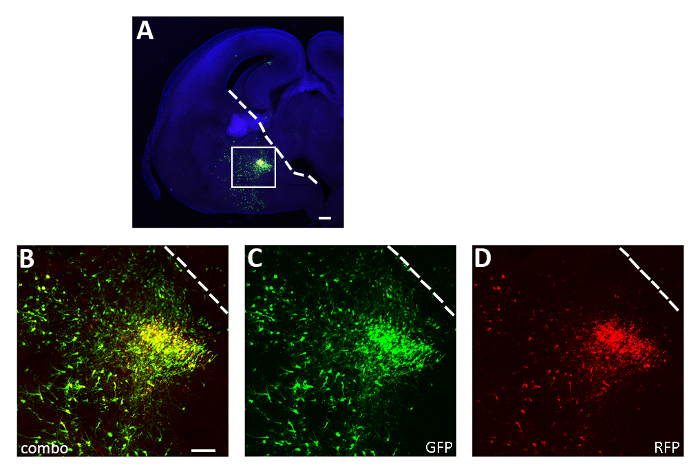
그림 3: 대표적인 급성 슬라이스 전기 화공 실험. (A) 대표적인 관상동맥 절편은 PCAGG-IRES-GFP(GFP) 및 pCAGG-hM3D(Gq)-IRES-RFP(RFP) 플라스미드와 12시간 동안 배양된 CGE에서 형질감염된 배아 뇌이다. 섹션은 GFP (A, B, C) 및 RFP (A, B, D)에 대해 면역 염색되었습니다. 패널 A의 박스형 영역은 형광 리포터(B), GFP(C) 및 RFP만(D)의발현을 나타내기 위해 확대된다. 흰색 선은 신경절 의 우수성의 가장자리를 표시합니다. B-D : 같은 사진, 다른 채널 또는 두 개의 서로 다른 채널의 조합. 배율 막대 = 200 μm (A), 100 μm (B-D). 이 수치는 Denaxa 외14에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
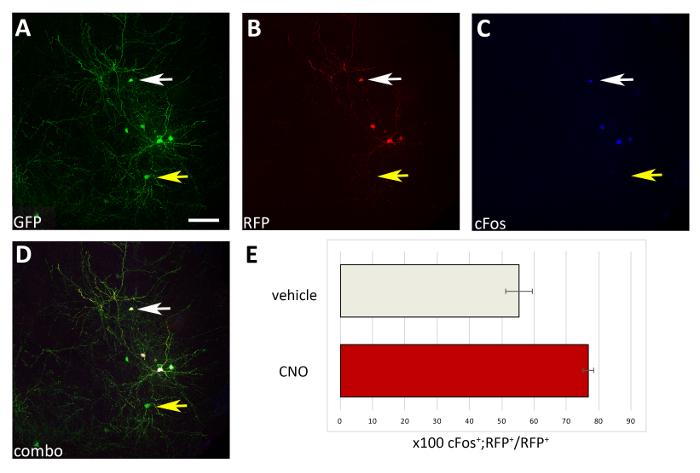
도 4: CNO 투여 시 M3D(Gq)-이식된 CIs의 활성에서 세포 자율증가. (A-D) P17 마우스의 관상동맥 부피의 대표적인 공초점 이미지는 PCAG-IRES-GFP(GFP) 및 pCAGG-hM3D(Gq)-IRES-RFP(RFP) 플라스미드와 CNO로 처리된 CI 전구체로 P1에서 이식하였다. 섹션은 GFP (A), RFP(B),및 cFos (C)에 대해 면역 염색되었습니다. (D) A, B 및 C 면역형광(콤보)의 결합된 이미지. 두 플라스미드(A-D의 흰색 화살표)를 공동 표현하는 CI만 cFos +이며 컨트롤-GFP 플라스미드(A-D의 노란색 화살표)만 표현하는 CI와 비교됩니다. (e) P1에서 이식된 P17 마우스의 파륨에서 발견되는 cFos+RFP+ 세포의 정량화(총 RFP+ 모집단으로 정규화)하고 비히클 또는 CNO(N=2)로 처리하였다. A-D: 동일한 사진, 다른 채널 또는 세 가지 다른 채널의 조합. 배율 막대 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
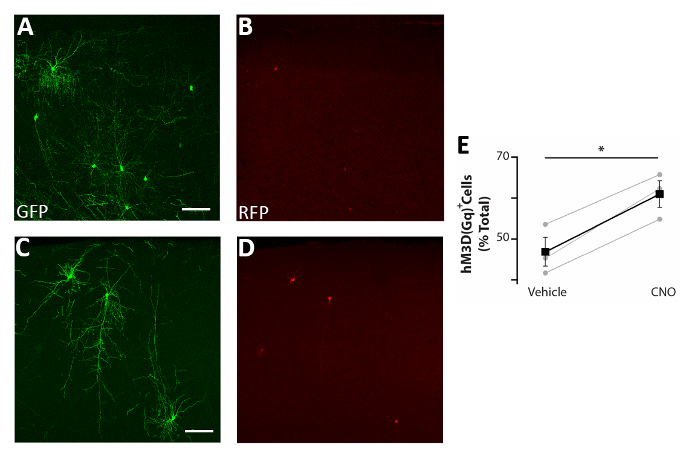
그림 5: CIs의 활성에서 세포 자율 적 증가는 생존을 향상시킵니다. . (A-D) P0-P2에서 이식된 P17 마우스의 대표적인 공초점 이미지(GFP)와 pCAGGs-IRES-GFP(Gfp) 및 pCAGGs-hM3D(Gq)-IRES-RFP(RFP) 플라스미드및 비히브로처리된CI 전구체로 이식 (C-D)를입력합니다. (E) P0-P2에서 이식된 P17 마우스의 전뇌에서 발견되는 RFP+ 세포의 정량화(총 GFP+ 집단으로 정규화). RFP+(비차량) = 47% ±3%, CNO = 61% ±3%, p=0.01, 학생의 페어링된 샘플 t 검정, n=3비컨드 및 3 CNO, 뇌당 최소 150개의 세포 계산. A와 B : 같은 사진, 다른 채널. C와 D : 같은 사진, 다른 채널. 배율 막대 = 50 μm. 이 수치는 Denaxa 외14에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
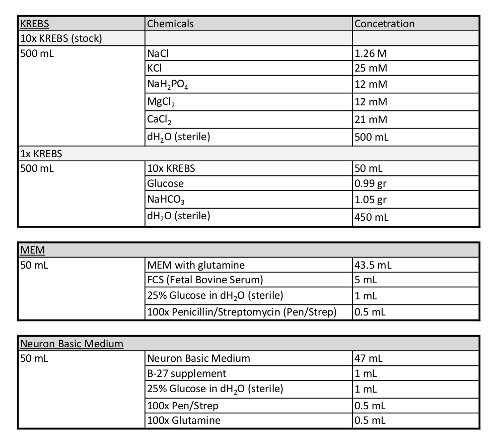
표 1: 이 프로토콜에 사용된 미디어에 관한 추가 정보입니다.
토론
여기서 우리는 CI 성숙에 대한 본질적 활동의 영향 및/또는 통합 피질의 조립/기능에 대한 활동의 영향을 연구하기 위해 CI 전구체의 활동을 유전적으로 수정하는 널리 접근가능한 방법론을 설명합니다. 회로.
과거에는, 저희를 포함하여 몇몇 실험실은, 유전적으로 투영 뉴런6을 수정하기 위하여 자궁전기 천공 실험에서 수행했습니다. 그러나, 자궁내 전기천공에서 CI 전구체를 포함하는 신경절 전도체로의 전기전도 문제는 매우 어렵다. 이 문제를 해결하기 위해 소수의 실험실에서 초음파 유도 주사를 수행하고 전기 천공에 이어 고가의 장비를 필요로하는 까다로운 기술입니다. 이 프로토콜은 대부분의 과학 커뮤니티에 액세스 할 수있는 이러한 방법론에 대한 대안을 제공합니다.
이 프로토콜의 가장 어려운 측면 중 하나는 현상형 분석이 일반적으로 수행될 때 숙주 피질에서 생존하는 세포의 수를 최대화하는 것입니다(실험 설계에 매우 의존하지만 일반적으로 P17보다 오래되다). 조사자가 주의해야 할 세 가지 주요 단계가 있습니다: (1) 전기 포공의 효율. 이것은 DNA 플라스미드의 순도를 보장함으로써 최대화될 수 있다. 이 절차에는 고품질 DNA 플라스미드(A260/A280 비율 1.9-2.0)만 사용해야 합니다. 우리는 염화 세슘 DNA 정제를 채택하여 이러한 고품질 DNA 제제를 얻습니다. 또 다른 중요한 요인은 관심 있는 유전자의 발현을 유도하는 프로모터입니다. 우리는 닭 b-액틴 프로모터로 구성된 pCAGG 벡터가 매우 강력하고 전기 천공 효율을 극적으로 증가시킬 수 있음을 발견했습니다. (2) 시작 기증자 배아의 수. 동일한 단계의 배아의 많은 수 (12-16)가 전기 화되어 있는지 확인하는 것이 중요합니다. 더 많은 실험자가 배아 해부를 수행하고 함께 단면을 수행하는 경우이 숫자를 증가 시킬 수 있습니다., 배아 피 질 조각을 얻을 하는 것이 중요 하기 때문에, 전기 및 가능한 한 빨리 인큐베이터에 전송. (3) 성숙 단계까지 이식 세포 생존의 높은 기회를 보장하기 위해 각 강아지에 많은 수의 세포가 주입되어 있는지 확인하는 것이 중요합니다. 또한 저밀도 세포 제제는 세포의 고르지 못한 혼합을 배지와 혼합하여 이식된 뇌에서 상당한 가변성을 생성하기 때문에 성공적인 이식의 가능성을 극적으로 향상시킵니다15 .
여기서 설명된 프로토콜은 세포 자율방식으로 CI 생존을 조절하는 활동의 역할을 조사하기 위해 맞춤화되었다. CNO 주사를 수행하기 위한 P14-P17 시간 윈도우는 게시된 데이터에 따라 특별히 선택되었으며, 이는 이식된 CI 전구체의 세포 사멸의 피크가 이 기간16동안 발생한다는 것을 보여준다. 따라서, 이 시간 프레임 또는 CNO 주사의 주파수는 다른 세포 유형 또는 뇌 영역에 대해 사실이 아닐 수 있으며, 조사자는 특정 실험 목적에 따라 이러한 파라미터를 조정해야 한다. 마지막으로, 여기에 설명된 CI의 두개내 주사에 대해 설명된 방법론은 P0-P5 새끼(마우스 라인 배경에 따라 다름)에 대해서만 가능합니다. 원칙적으로 P5를 통해 주사하면 두개골15의숱이 또는 제거해야합니다.
이 프로토콜의 주요 장점 중 하나는 새로운 유전자 인코딩 도구를 사용하여 개발 네트워크에 통합할 때 차별화 단계 동안 CIs의 활동을 시각화하거나 조작할 수 있다는 것입니다. 새로운 유전자 부화 전압 및 칼슘 센서의 발견 속도뿐만 아니라 새로운 화학 유전학 및 광유전학 도구로, 이 프로토콜은 연구원이 Addgene와 같은 플라스미드 저장소에 방출의 주 이내에 그들을 사용할 수 있습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 ERC 스타터 그랜트 (282047), 웰컴 트러스트 조사관 상 (095589 / Z / 11 / Z), FP7 EC DESIRE 교부금 및 JB에 리스터 연구소 상에 의해 지원되었다. V.P.의 실험실에서 일은 BBSRC (BB/L022974/1), 영국 의학 연구 위원회 (MRC), 프랜시스 크릭 연구소 (MRC, 암 연구 영국 및 웰컴 트러스트로부터 자금을 받는)에 의해 지원됩니다. M.D. 실험실에서 연구는 그리스 연구를 지원하는 재단의 이니셔티브의 일환으로 B.S.R.C. "알렉산더 플레밍"에 스타브로스 니아코스 재단의 보조금을 통해 가능하게되었다.
자료
| Name | Company | Catalog Number | Comments |
| Medium/Supplements | |||
| B-27 | GIBCO (ThermoFisher Scientific) | 175040-044 | |
| DMEM/F12 | GIBCO (ThermoFisher Scientific) | 21331-020 | |
| DNAse | SIGMA | DN15-100MG | |
| FBS | GIBCO (ThermoFisher Scientific) | 10270-098 | |
| 100x Glutamine | GIBCO (ThermoFisher Scientific) | 35050-061 | |
| L15 | GIBCO (ThermoFisher Scientific) | 11415-049 | |
| MEM alpha, GlutaMAX | GIBCO (ThermoFisher Scientific) | 32561-029 | |
| Neurobasal medium | GIBCO (ThermoFisher Scientific) | 21103-049 | Neuron basic medium |
| 100x P/S | GIBCO (ThermoFisher Scientific) | 15140-122 | |
| Equipment | |||
| Electroporator | BTX | ECM 830 generator | |
| Injector for acute slice electroporation | Eppendorf | FemtoJet Microinjector | |
| Injector for cell transplantation (I) | Visual Sonics | Vevo Injector System | |
| Injector for cell transplantation (II) | WPI | NANOLITER2010 | |
| Magnetic Stand | WPI | M10L Magnetic Stand | |
| Kite Manual Micromanipulator | WPI | KITE-M3-R | |
| Platinum Elecrode (I) | Protech International Inc. | CUY-700-1 | |
| Platinum Elecrode (II) | Protech International Inc. | CUY-700-2 | |
| Steel Base Plate | WPI | 5479 | |
| Vibratome | Leica | VT1200S | |
| Other Material | |||
| Glass capillaries for electroporation | VWR | 1B100-4 | |
| Glass capillaries for cell transplantation | Visual Sonics | provided by Visual Sonics | |
| Nuclepore 8 µm whatman membrane | SLS | 110414 | |
| Organ tissue culture dishes | BD Biosciences (Falcon) | 353037 |
참고문헌
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Review Neuroscience. 13 (2), 107-120 (2012).
- Glausier, J. R., Lewis, D. A. GABA and schizophrenia: Where we stand and where we need to go. Schizophrenia Research. 181, 2-3 (2017).
- Fishell, G., Rudy, B. Mechanisms of inhibition within the telencephalon: "where the wild things are". Annual Review Neuroscience. 34, 535-567 (2011).
- Wamsley, B., Fishell, G. Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature Review Neuroscience. 18 (5), 299-309 (2017).
- Xu, Q., Cobos, I., De La Cruz, E., Rubenstein, J. L., Anderson, S. A. Origins of cortical interneuron subtypes. Journal of Neuroscience. 24 (11), 2612-2622 (2004).
- Denaxa, M., et al. Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell Reports. 2 (5), 1351-1362 (2012).
- Wichterle, H., Garcia-Verdugo, J. M., Herrera, D. G., Alvarez-Buylla, A. Young neurons from medial ganglionic eminence disperse in adult and embryonic brain. Nature Neuroscience. 2 (5), 461-466 (1999).
- Alvarez-Dolado, M., et al. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. Journal of Neuroscience. 26 (28), 7380-7389 (2006).
- Baraban, S. C., et al. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proccedings of the National Academy of Sciences of the United States of America. 106 (36), 15472-15477 (2009).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Vogt, D., et al. Viral-mediated Labeling and Transplantation of Medial Ganglionic Eminence (MGE) Cells for In Vivo Studies. Journal of Visualized Experiments. (98), e52740 (2015).
- De Marco Garcia, N. V., Karayannis, T., Fishell, G. Neuronal activity is required for the development of specific cortical interneuron subtypes. Nature. 472 (7343), 351-355 (2011).
- Urban, D. J., Roth, B. L. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 55, 399-417 (2015).
- Denaxa, M., et al. Modulation of Apoptosis Controls Inhibitory Interneuron Number in the Cortex. Cell Reports. 22 (7), 1710-1721 (2018).
- Quatrocolo, G., et al. Homochronic Transplatation of Interneuron Precursors into Early Postnatal Mouse Brains. Journal of Visualized Experiments. (136), e57723 (2018).
- Southwell, D. G., et al. Intrinsically determined cell death of developning cortical interneurons. Nature. 491 (7422), 103-113 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유