Method Article
Aedes aegypti 모기에서 현미경 포리디안 기생충 에드hazardia aedis의 전파
요약
현미경 기생충 에드hazardia aedis를배양하는 프로토콜. 기생충은 애벌레 단계에서 수평 전송을 통해 다음에 Aedes aegypti 모기의 한 세대에서 통과하고 성인 단계에서 수직 전송에 선행됩니다. 살아있는 포포라진은 감염된 계란에서 장기적으로 살아남습니다.
초록
Edhazardia aedis는 매년 수백만 건의 질병 사례를 유발하는 여러 arboviruses를 전송하는 질병 벡터인 Aedes aegypti 모기의 현미경 기생충입니다. E. aedis는 모기 벡터에서 사망률과 생식 적합성감소를 유발하며 생물 통제 제로의 잠재력을 위해 탐구되었습니다. 우리가 E. aedis를 배양하기 위해 제시하는 프로토콜은 모기 호스트의 다른 생활 단계에서 수평 및 수직 전송을 둘 다 포함하는 자연적인 감염 주기를 기반으로 합니다. Ae. aegypti 모기는 애벌레 단계에서 포자에 노출됩니다. 이 감염된 유충은 그 때 성인으로 성숙하고 그들의 자손에 수직으로 기생충을 전송합니다. 감염된 자손은 미래의 수평 투과를 위한 포자의 근원으로 사용됩니다. 기생충의 수명 주기의 복잡성을 감안할 때 미숙한 사람에게 는 E. aedis를 배양하는 것은 어려울 수 있으며,이 프로토콜은 설명을위한 상세한 지침과 시각적 보조를 제공합니다.
서문
Aedes aegypti는 다중 arboviruses의 모기 벡터입니다 (예를 들어, 뎅기열, Zika, 황열병) 함께 매년 질병의 수억및 30,000 죽음1,2이상을차지하는 것으로 추정된다. 이러한 병원체에 의한 질환에 대한 치료는 지원 치료로 제한되며 향후3에서추가 적인 암보바이러스가 나타날 가능성이 높습니다. 모기 벡터의 제어는 따라서 현재 및 신흥 병원균4의전송을 효과적으로 방지하기 때문에 1차적인 중요성을 갖는다. 전통적으로 벡터 제어 전략은 주로 화학 살충제를 활용하지만 일반적으로 사용되는 많은 살충제에 대한 저항은 벡터 제어의 새로운 방법에 대한 수요를 주도하고 있다. Ae. aegypti에 대한 생물 통제 특성에 대해 탐구 된 잠재적 인 에이전트 중 하나는 기생충 Edhazardia aedis5,6입니다.
1930년 쿠도에 의해 노즈마 아디로 처음 확인된 E. aedis는 Ae. aegypti 모기7의현미경 기생충이다. E. aedis의 개발 및 재생은 비교적 복잡하며 수명 주기는7,8,9로여러 가지 방법으로 진행될 수 있습니다. 1개의 일반적인 발달 주기는 Becnel et al., 19897에서 깊이로 기술되고 실험실 전파를 위해 이용된다(도 1)8. 간단히 말해서, Ae. aegypti 계란이 E. aedis에 수직으로 감염된 애벌레에 부화하여 지방 체에서 단핵포자를 개발하고 일반적으로 애벌레 또는 푸파로 죽을 때 주기가 시작됩니다. 죽은 애벌레에서 방출된 단핵포레스는 서식지를 오염시키고 건강한 Ae. aegypti 애벌레에 의해 섭취됩니다. 이 포자는 주로 소화관에서 발아하여 노출 된 애벌레의 소화 조직을 감염시켜 수평 전달의 결과입니다. 수평으로 감염된 유충은 양성환 포자가 형성되는 성인(부모 세대)으로 발전합니다. 여성에서, 이 이중 핵형성 포자는 생식 기관을 침략하고 그들의 관련한 포자화는 발달 계란 세포를 감염시킵니다. 이 계란은 그 때 감염된 애벌레로 부화 (filial 생성), 기생충의 수직 전송 및 위에서 설명 한 바와 같이 주기의 연속의 결과.
여러 연구는 생물 통제를 위한 E. aedis의 잠재력을 조사했습니다. E. aedis를 가진 감염은 Ae. aegypti 여성10의감소된 생식 능력 귀착되기 위하여 입증되었습니다. 또한, 반필드 실험에서, E. aedis의 부수성 방출은 시험 Ae. aegypti 인구가 스크린 인클로저6내에 보관된 시험 Ae. aegypti 인구의 총 박멸을 초래했다. 다양한 모기 종에서 개발의 일부 단계를 겪을 수 있는 동안, E. aedis는 Ae. aegypti에서수직으로 전염되어 높은 수준의 숙주특이성(11,12)을나타낸다. 마찬가지로, E. aedis와관련된 잠재적인 환경 위험에 대한 실험실 평가에서, 현미경 기생충은 E. aedis13에감염된 Ae. aegypti 애벌레를 섭취한 육식 동물을 포함하여 비 표적 수생 동물군을 감염시키지 못했다. 이러한 결과는 자연적인 Ae. aegypti 인구를 표적으로 하는 생물학 통제 전략에 이용될 E. aedis에 대한 잠재력을 강조합니다.
E. aedis가 벡터 제어에 사용할 것이라는 약속을 보여 주지만, 이를 광범위하게 배양하고 배포하는 데 어려움이 있습니다. 즉, 아에디스 포자는 추운 온도(즉, 5°C)에서 하루 미만의 감염성을 잃습니다. 심지어 따뜻한 온도 (즉, 25 °C)에서, 포자는 3 주14의과정을 통해 감염성을 빠르게 잃는다. 또한, E. aedis는 살아있는 Ae. aegypti 모기에서 배양되어야 하며 건강한 애벌레 모기의 통제 된 주입이 라이프 사이클의 완료를 보장하고 문화8에사용되는 인구의 붕괴를 방지하기 위해 필요하다. 생체 내 배양의 요구 사항은 도전을 제시한다; 그러나, 모기 질량 사육 및 로봇 공학의 최근 발전 (예를 들어, 마사로외. 15) E. aedis 포자의 대규모 생성을 허용할 수 있습니다. 우리는 이 방법론의 시각화가 E. aedis 양육 프로토콜에 대한 접근성을 높이고 더 많은 연구원이 이 시스템의 기본 생물학 및 적용 된 잠재력을 조사 할 수 있을 것으로 예상합니다. 또한 E. aedis의대량 양육을 개선하는 데 도움이 될 수 있는 엔지니어, 로봇 공학자 및 광범위한 기술 부문과의 협력을 촉진할 것으로 예상됩니다.
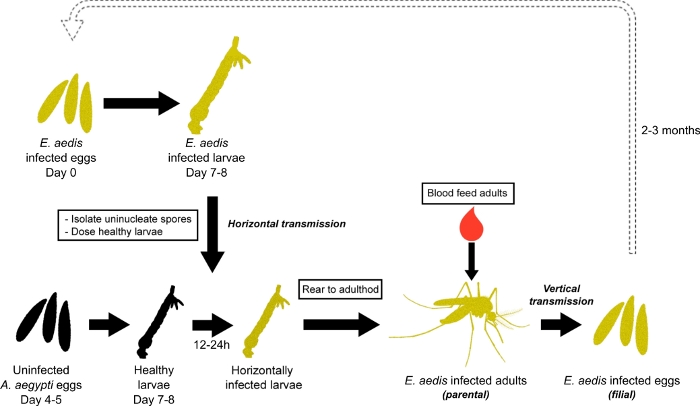
그림 1: Ae. aegypti에서의 아데디스 전파 . E. aedis의 전파는 E. aedis 감염 한 계란을 부화로 시작. 감염된 애벌레는4th instar로 사육되고, E. aedis 포자는 그 애벌레로부터 분리되고, 포자는 계란의 감염되지 않은 클러치에서 사육된 건강한 2nd/3rd 인스타 애벌레를 구두로 감염시키기 위하여 이용됩니다 (수평 전송). 이 구두로 감염된 애벌레는 그 때 성인기 (부모 세대)로 양육되고 E. aedis (수직 전송)에 감염된 계란을 낳습니다. 감염된 계란 (filial 생성) 감염 주기 및 기생충 문화를 계속 하기 위해 부화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 0일차
- 부화 Ae. aedis에 감염된 aegypti 계란은 1 L 디온화 (DI) 물로 애벌레 사육 트레이에 배치하여. 생선 음식 50 mg을 추가합니다.
참고: 발행 시, E. aedis의 실험실 균주는 기생충을 적극적으로 연구하는 실험실에서만 사용할 수 있으며, E. aedis는 장기 저장에 만 가능하지 않으며 감염된 계란은 현재 저장소에 저장되지 않습니다. E. aedis와 함께 일하는 데 관심이 있는 연구원은 감염된 계란을 요청하기 위해 해당 저자에게 연락할 수 있습니다.
참고: 많은 수의 감염된 알을 부화하는 것은 일반적으로 필요하지 않습니다. 10 E. aedis 감염 Ae. aegypti 애벌레는 ≥ 1000 건강한 애벌레를 투여하기에 충분하다.
참고 : 이 프로토콜의 모든 부분에 대해, 우리는 다음과 같은 조건에서 모기를 수용 : 14 h / 10 h 빛 / 어두운 주기, 27 ° C 온도 와 80 % 상대 습도.
2. 1일차
- 부화 후, 유충의 밀도를 트레이 당 ~100 애벌레로 줄이고 필요에 따라 새로운 트레이 (L DI 물 1 개)를 만듭니다.
- 각 트레이에 마른 고양이 사료 를 넣습니다. 고갈 될 때 음식을 보충하지만, 음식의 과잉을 제공하지 않습니다. 3일마다 1장씩 고양이 사료(~200 mg)가 충분합니다.
참고: 특정 양육 조건에 따라 식량량을 조정합니다(즉, 물이 탁탁이 되거나 유충이 죽으면 음식을 줄이고, 애벌레가 발달이 심각하게 지연되면 음식을 증가시면 음식을 증가시면). 여기에 제안된 것보다 다른 수유 요법 및/또는 양육 조건을 사용할 수 있지만 이 표준 프로토콜의 타이밍에 대한 조정이 필요할 수 있습니다.
3. 일 4\u20125
- 감염된 애벌레가3rd - 4th 별인 경우, 새로운 트레이에 건강 / 감염되지 않은 Ae. aegypti 계란을 부화합니다.
- 건강한 Ae. aegypti가 48-72 h에서 2nd - 3rd instar에 도달 하는 밀도에서 후방. 우리의 손에, 이것은 음식에 광고 리비도 액세스 와 물 1 L 당 200\u2012300 애벌레의 밀도를 사용하여 달성 될 수있다. 며칠 동안 건강한 계란을 부화하면 필요할 때 애벌레가 올바른 단계에 있음을 보장 할 수 있습니다.
4. 일 7\u20128: 수평 전송
참고: E. aedis를 가진 건강한 애벌레의 투약은 단핵포이 감염된 애벌레에 있는 높은 숫자에 있을 때까지 수행될 수 없습니다 (1 x 104 - 1 x 106 애벌레 당). 이는4일 인스타스테이지(그림 2)에서늦게 발생합니다.
- 단핵포자를 수확하고 정량화하십시오.
- 10개의 감염된 유충을 1.5mL 마이크로센트심리후지 튜브로 이동시키기 위해 이송 파이펫(팁을 더 넓은 직경으로 잘라야 할 수도 있음)을 사용합니다.
- 이송 파이프로 사육수를 제거하고 깨끗한 DI 물의 ~ 1 mL을 추가하여 한 번 세척하십시오. 파이펫으로 세척수를 제거하고, 10개의 유충에 깨끗한 DI 수의 500 μL을 추가하고, 유봉및 기계적 균질화를 사용하여 균질화합니다.
- 400배율의 혈류계를 사용하여 포자를 정량화합니다.
참고: 단핵포기포는 뚜렷한 발열 체형(즉, 배 모양)으로 식별할 수 있습니다. 그림 2A).
- E. aedis와 함께 건강한 Ae. aegypti 애벌레를 투여합니다.
- 간 분말 1.2 g, 맥주 효모 0.8 g, 물 100mL를 혼합하여 신선한 애벌레 음식 슬러리를 만듭니다.
참고: 음식은 자동 으로 사용될 때까지 4°C로 저장되는 경우 신선할 필요가 없습니다. - 100 2nd - 3rd instar 건강 Ae. aegypti 애벌레를 150 mL 비커 또는 시편 컵으로 옮기.
- 5 x 104 - 1 x 105 포자를 가진 100 애벌레의 각 비커를 투여합니다.
- 100mL의 최종 부피에 애벌레 음식 슬러리와 DI 물의 2mL를 추가합니다.
- 간 분말 1.2 g, 맥주 효모 0.8 g, 물 100mL를 혼합하여 신선한 애벌레 음식 슬러리를 만듭니다.
- 노출 12-24h 후, 노출된 유충을 사육 트레이로 옮기고 표준 양육프로토콜(16)에따라 후면으로 후면으로 옮김한다.
5. 모니터링 및 수직 전송
- 그들은 케이지에서 출현 컵으로 개발로 강아지를 전송하기 위해 애벌레를 치료 하고 전송. 설탕 사료 성인 광고 리비툼 (당 16,17). 성인을 e. aedis에감염시킬 것입니다.
- 혈액 공급 성인(당 16,17)계란을 수집합니다. E. aedis의 수직 전송은 이 단계에서 발생합니다.
참고: 추가 혈액 식사가 oviposition가 완료되는 즉시 제공되는 경우, 여성은 성인이 사망의 높은 수준을 겪기 전에 적어도 하나의 추가 계란 클러치를 낳을 수 있습니다. - E. aedis에 감염된 이 Ae. aegypti 계란을 사용하여 이 프로토콜의 1단계로 시작하여 전파를 계속합니다.
참고: 계란은 적절한 조건 하에서 2 ~ 3 개월 동안 저장할 수 있습니다16. - 오염을 방지하기 위해 10 % 표백제 및 오토클레이빙 (가능한 경우)으로 E. aedis와 접촉한 모든 재료를 청소하십시오.
결과
E. aedis 감염 Ae. aegypti 리버풀 (LVP1b12)계란은 위의 프로토콜에 설명 된 바와 같이 부화되었다. 4번째 인스타 단계에서, 감염의 시각적 징후는 감염된 애벌레의 지방 체 전체에 걸쳐 흰색 포자 낭종을 포함하여 관찰 될 수있다 (이 표현형의 예는 도 2B에표시됩니다). 유니뉴클레아테 포자는4일부터 500μL DI 수에서 10개의 애벌레를 균질화하여 수확되었다. 이 포자는 피리폼(배 모양)이었고 400x(그림2A)에서쉽게 볼 수 있었다. 혈류계를 사용하여 4.05 x 103 포자/μL의 포자 수를 계산하였다. 100개의 건강한 Ae. aegypti 애벌레는 100mL 물에서 ~50,000 포자에 수평으로 감염되어 ~500 포자/유충의 최종 투여량을 하였다. 애벌레는 성인기(부모 세대)로 사육되었고, 모시래 토끼 혈액을 사용하여 혈액을 먹이고 1% (v/v) 100 mM 아데노신 트리호스페이트하였다. 수직으로 감염된 계란을 수집(filial 생성) 및 부화하여 E. aedis 전파를 계속하고 감염 성공을 정량화하였다.
7일 후 부화후, 25마리의 포리얼 생성 애벌레가 개별 1.5mL 마이크로센트심리분리기 튜브로 옮겨지고 DI 물로 한 번 세척되었다. 개별 유충은 DI 수의 250 μL에서 균질화되었고 감염 상태및 E. aedis 하중은 혈우세포계를 사용하여 평가되었다. filial 발생에서 E. aedis의 수직 감염률은 96%로 나타났으며 7일 후 부화에서 감염된 개인의 평균 포자 부하는 3.31 x 105(범위: 3.25 x 104 – 1.47 x 106; 그림 3).
그림 2: Ae. aegypti 모기에 있는 E. aedis 감염의 시각화. (A) E. aedis 단핵화 피리폼 포자. 10 E. aedis 감염 4th instar 애벌레는 DI 물의 500 μL에서 균질화 되었다 약 7 일 포스트 부화. 동형모의 10 μL은 혈류계에 로드되어 400X로 보았다. 적색 화살표는 대표적인 단핵염 E. 아데스 포자를 나타낸다. (B) E. aedis 감염 4th instar 애벌레는 그들의 지방 체 에 걸쳐 독특한 흰색 포자 낭종을 개발18. 그(것)들은 또한 일반적으로 기형되고 배설된 복부 세그먼트가 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
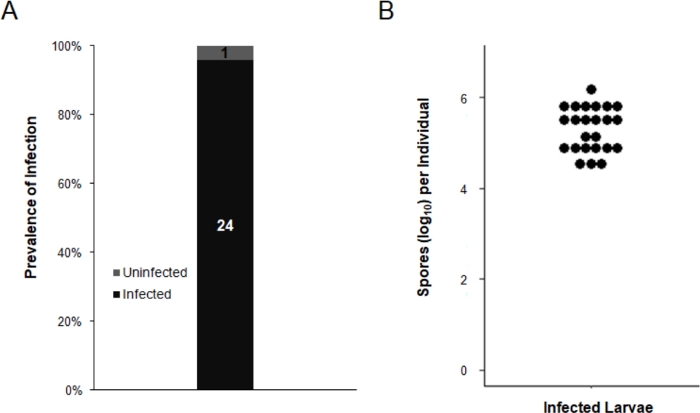
그림 3: 배양 프로토콜은 filial 생성에 효과적인 E. aedis 감염으로 이어집니다. Ae. aegypti 애벌레(n= 25)는 250 μL DI 수에서 개별적으로 균질화되었고, 호모게네이트의 10μL은 혈류계에 적재되었다. 단핵 포자의 존재는 양성 감염을 나타내고 포자는 모든 양성 샘플에 대해 정량화되었다. (A)유충 중 감염의 유병률. 회색은 감염되지 않은 애벌레에 해당하고, 감염된 검은 색. 각 세그먼트에 표시된 숫자는 각 그룹의 개인 수를 절대로 줄 수 있습니다. (B)감염된 각 개인에 대한 포자 부하. 검은 점은 각 애벌레에 대한 로그10 변형 된 단핵 포자 수를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리는 여기에 헴브리와 라이언에 설명 된 방법을 제시, 19828 Ae. aegypti 모기에서 E. aedis microsporidia를 양육. 이 연구에서 사용된 E. aedis의 균주는 1979년19년태국의 스티븐 헴브리(Stephen Hembree)의 오리지널 필드 컬렉션에서 유래되었다. 이 방법은 E. aedis7의전송 주기에서 자연적으로 발생하는 수평 전송을 활용하여 제어된 방식으로 기생충을전파합니다. 이 방법은 포자 외관, 애벌레감염 증상 또는 다단계 양육/투약 프로토콜을 성공적으로 완료하는 데 필요한 조정에 익숙하지 않은 신규 이민자에게 어려울 수 있습니다. 우리의 희망은이 프로토콜을 동반 하는 시각적 보조 E. aedis 문화를 하고자 하는 연구원에 대 한 진입 장벽을 줄일 것입니다.
우리는 위에서 설명한 대로 Ae. aegypti에서 E. aedis를 전파하고 filial 세대에서 기생주의의 성공을 정량화했습니다. 간단히, 우리는 E. aedis 감염 Ae. aegypti 계란을 부화하고, 4번째 인스타로 양육하고, 감염된 애벌레에서 단핵 E. aedis 포자를 수집했습니다. 그런 다음 구강 섭취를 통해 이 포자와 함께 건강한 애벌레를 수평으로 감염시키고 수평으로 감염된 애벌레를 성인기에 사육했습니다. 우리는 감염된 성인 (부모 세대)과 수집 된 계란 (filial 세대)을 혈액으로 먹이고, 우리는 E. aedis 기생충에 수직으로 감염 될 것이라고 가설했습니다. 우리는 포리얼 생성에서 계란을 부화하고 4번째 별이되었을 때 애벌레의 하위 집합을 수집하고 균질화했습니다. 우리는 E. aedis에 감염된 애벌레의 백분율과 모든 감염된 개별에 있는 총 포자 수를 정량화했습니다. 우리는 대다수 (96%)가 발견되었습니다. 개인의 감염 되었고 감염된 애벌레의 평균 포자 하중은 ~105. 우리는 우리의 양육 프로토콜이 Ae. aegypti 모기에서 E. aedis의 매우 성공적인 전파를 초래했다고 결론을 내렸습니다.
이 프로토콜에는 미숙한 사용자에게 특히 어려울 수 있는 여러 측면이 있습니다. 당사는 도움이 될 수 있는 몇 가지 추가 정보를 아래에 제공합니다. 일반적인 모기 사육에 관한 질문의 경우, Ae. aegypti 식민지 유지 보수에 대한 완전한 가이드는이 프로토콜의 범위를 벗어납니다. 그러나, 많은 일반적인 질문은 계란 부화, 일반적인 규정식 필요, 주거 및 환경 조건 및 혈액 공급을 포함하여16, 17의 생물 방위 및 신흥 감염 연구 자원저장소에서자원에 의해 해결될 수 있습니다. 감염의 타임 라인에 관해서는, 감염된 계란에서 부화한 애벌레는 4번째 인스타 단계에서 늦게까지 감염의 표시를 보여주지 않습니다. 단핵포는 1-2 일 의 과정을 통해 급속하게 나타납니다. 애벌레는 부화 후 6 일 동안 거의 감염되지 않은 것처럼 보일 수 있지만 7 일 또는 8 일째 부화에 의해 매우 감염됩니다. 또한, E. aedis 단핵염 포자와 유사한 크기의 다른 진핵 단세포 유기체(예를 들어, 효모)를 포함하여 전체 모기 균질화에 존재하는 많은 다른 미생물이 있기 때문에 균질화된 시료에서 포자를 시각화하는 것이 어려울 수 있다. E. aedis 포자의 독특한 모양(도 2A)은식별을위한 매우 신뢰할 수있는 방법이며 균주에서 다른 미생물과 E. aedis를 차별화하는 데 도움이됩니다. 식별 또는 정량화에 필요한 것은 아니지만, 포자 정제가 원하는 경우, 호모게네이트내다른 오염 원소로부터 E. 아디스 포자의 분리를 허용하는 콜로이드 실리카 밀도 그라데이션 원심분리를 통해 달성될 수 있다. 이 과정은 솔터 외20에서자세히 설명된다.
사육 관행에 사용되는 온도와 식단은 일반적으로 실험실마다 다르지만 변형은 여전히 성공적인 기생충 전파를 얻을 수 있습니다. 애벌레 식품 유형의 사소한 차이는 성공적인 감염을 방해하지 않지만 이 프로토콜에서 다른 식품 유형을 명시적으로 테스트하지는 않았습니다. 감염에 대한 온도의 효과가 테스트되었으며 E. aedis 감염은 광범위한 온도21에서견고한 것으로 나타났습니다. 최대 포자 생산량은 30.8°C에서 발생했지만 20°C의 낮은 기재 온도에서 여전히 견고했습니다. 포자 수는 더 높은 사육 온도 (36 °C)에서 극적으로 감소되었기 때문에이 프로토콜에 대해 이러한 온도를 피해야합니다.
오염은 기생충으로 작업할 때 항상 관심사입니다. E. aedis는 Ae. aegypti의 성공적인 기생충이므로 오염을 방지하기 위해 감염되지 않은 실험실 식민지와 분리되어 두어야합니다. 가능하면 별도의 인큐베이터에 감염된 모기를 보관하는 것이 좋습니다. 우리는 또한 마이크로 스포리디아 작업 (예 : 애벌레 트레이, 이송 파이프, 케이지, 계란 수집 컵)에 사용되는 재료는 마이크로 스포리디아 작업에 지정되어 있으며 곤충 전체에 걸쳐 더 광범위하게 사용되지 않는 것이 좋습니다. 모든 사육 재료는 사용 후 10 % 표백제로 살균되어야하며 자동 절제를 사용하여 표백제 살균을 보완할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 모기 양육에 도움을 스펜서 블랭켄십에 감사드립니다. 우리는 또한 원고에 대한 유용한 피드백에 대한 제임스 N. 래들과 M. 도미니크 마기스트라도 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 120 mL Specimen cup | McKesson | 911759 | Inexpensive alternative to beaker |
| 150 mL beakers | VWR | 10754-950 | For larval dosing |
| 2 oz round glass bottle | VWR | 10862-502 | Bottle for 10% sucrose in adult cages |
| 3 oz. emergence cup | Henry-Schein | 1201502 | For transfer of pupae to cage |
| Adult mosquito cages | Bioquip | 1462 or 1450ASV | For adult housing |
| Autoclave | For sterilization | ||
| Bleach | For sterilization | ||
| Brewer’s yeast | Solgar | For feeding larvae during dosing | |
| Controlled rearing chamber | Tritech | DT2-MP-47L | Inexpensive small rearing chamber |
| Cotton roll | VWR | 470161-446 | Wick for sugar bottles |
| Defibrinated rabbit blood | Fisher | 50863762 | For blood feeding adults |
| Disodium ATP, crystalline | Sigma-Aldrich | A26209-5G | For blood feeding adults |
| Dry cat food | 9Lives | Indoor Complete | For general larval rearing |
| Fish food flakes | TetraMin | For general larval rearing | |
| Hemocytometer | Fisher | 267110 | For counting spores |
| Homogenizer/mixer motor | VWR | 47747-370 | For homogenizing infected larvae |
| Larval rearing trays | Sterillite | 1961 | Overall dimensions are 11" x 6 5/8" x 2 3/4" |
| Liver powder | NOW foods | 2450 | For feeding larvae during dosing |
| Pipette 1 - 10µL | VWR | 89079-962 | For larval dosing |
| Pipette 100 - 1000µL | VWR | 89079-974 | For food during larval dosing |
| Pipette tips 1 - 10µL | VWR | 10017-042 | For larval dosing |
| Pipette tips 100 - 1000µL | VWR | 10017-048 | For food during larval dosing |
| Plastic pestles | VWR | 89093-446 | For homogenizing infected larvae |
| Sucrose, crystalline | Life Technologies | 15503022 | For adult feeding |
| Transfer pipet | VWR | 414004-033 | For larval transfer, must trim ends |
참고문헌
- Yellow fever. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/yellow-fever (2019)
- Dengue and severe dengue. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/dengue-and-severe-dengue (2020)
- Weaver, S. C. Prediction and prevention of urban arbovirus epidemics : A challenge for the global virology community. Antiviral Research. 156, 80-84 (2018).
- Rather, I. A., Parray, H. A., Lone, J. B., Paek, W. K., Lim, J., Bajpai, V. K., Park, Y. H. Prevention and Control Strategies to Counter Dengue Virus Infection. Frontiers In Cellular and Infection Microbiology. 7, 336 (2017).
- Becnel, J. J. Edhazardia aedis (Microsporidia: Amblysporidae) as a biocontrol agent of Aedes aegypti (Diptera: Culicidae). Proceedings and abstracts, Vth International Colloquium on Invertebrate Pathology and Microbial Control. , 20-24 (1990).
- Becnel, J. J., Johnson, M. A. Impact of Edhazardia aedis (Microsporidia: Culicosporidae) on a seminatural population of Aedes aegypti (Diptera: Culicidae). Biological Control. 18 (1), 39-48 (2000).
- Becnel, J. J., Sprague, V., Fukuda, T., Hazard, E. I. Development of Edhazardia aedis (Kudo, 1930) N. G., N. Comb. (Microsporida: Amblyosporidae) in the mosquito Aedes aegypti (L.) (Diptera: Culicidae). Journal of Protozoology. 36, 119-130 (1989).
- Hembree, S. C., Ryan, J. R. Observations on the vertical transmission of a new microsporidian pathogen of Aedes aegypti from Thailand. Mosquito News. 42, 49-54 (1982).
- Johnson, M. A., Becnel, J. J., Undeen, A. H. A new sporulation sequence in Edhazardia aedis (Microsporidia: Culicosporidae), a parasite of the mosquito Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 70 (1), 69-75 (1997).
- Becnel, J. J., Garcia, J. J., Johnson, M. A. Edhazardia aedis (Microspora: Culicosporidae) effects on the reproductive capacity of Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 32 (4), 549-553 (1995).
- Becnel, J. J., Johnson, M. A. Mosquito host range and specificity of Edhazardia aedis (Microspora: Culicosporidae). Journal of the American Mosquito Control Association. 9 (3), 269-274 (1993).
- Andreadis, T. G. Host range tests with Edhazardia aedis (Microsporida: Culicosporidae) against northern Nearctic mosquitoes. Journal of Invertebrate Pathology. 64 (1), 46-51 (1994).
- Becnel, J. J. Safety of Edhazardia aedis (Microspora: Amblyosporidae) for nontarget aquatic organisms. Journal of the American Mosquito Control Association. 8 (3), 256-260 (1992).
- Undeen, A. H., Becnel, J. J. Longevity and germination of Edhazardia aedis (Microspora: Amblyosporidae) spores. Biocontrol Science and Technology. 2, 247-256 (1992).
- Massaro, P., Sobecki, R., Behling, C., Criswell, V., Zha, T., Devenzengo, R. T. Automated mass rearing system for insect larvae. , (2018).
- Methods in Aedes Research. BEI Resources Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods_20in_20Aedes_20Research_202016.pdf (2016)
- Methods in Anopheles Research. BEI Resources Available from: https://www.beiresources.org/portals/2/MR4/MR4_Publications/Methods_20in_20Anopheles_20Research_202014/2014MethodsinAnophelesResearchManualFullVersionv2tso.pdf (2014)
- Desjardins, C. A., et al. Contrasting host-pathogen interactions and genome evolution in two generalist and specialist microsporidian pathogens of mosquitoes. Nature Communications. 6 (1), 1-12 (2015).
- Hembree, S. C. Preliminary Report of some mosquito pathogens from Thailand. Mosquito News. 39 (3), 575-582 (1979).
- Solter, L. F., Becnel, J. J., Vávra, J. Research methods for entomopathogenic microsporidia and other protists. Manual of Techniques in Invertebrate Pathology. , 329-371 (2012).
- Becnel, J. J., Undeen, A. H. Influence of temperature on developmental parameters of the parasite/host System Edhazardia aedis (Microsporidia: Amblyosporidae) and Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 60, 299-303 (1992).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유