JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
디지털 고속 섬모 비디오 현미경을 사용한 비강 칫솔질 샘플링 및 처리 – COVID-19 전염병에 대한 적응
요약
PCD 진단을 위한 성공적이고 고품질의 섬모 기능 분석을 보장하려면 호흡기 상피 샘플링 및 처리를 위한 정확하고 신중한 방법이 필수적입니다. COVID-19 팬데믹 기간 동안 PCD 진단 서비스를 계속 제공하기 위해 섬모 비디오 현미경 프로토콜이 적절한 감염 관리 조치를 포함하도록 업데이트되었습니다.
초록
원발성 섬모 운동이상증(PCD)은 유전적 운동성 섬모병증으로 심각한 이인후성 질환을 유발합니다. PCD 진단은 다양한 진단 양식의 문제로 인해 종종 놓치거나 지연됩니다. PCD의 진단 도구 중 하나인 디지털 고속 비디오현미경(DHSV)을 사용하는 섬모 비디오현미경은 섬모 박동 주파수(CBF) 및 박동 패턴(CBP) 분석으로 구성된 섬모 기능 분석(CFA)을 수행하는 최적의 방법으로 간주됩니다. 그러나 DHSV에는 샘플 처리 및 분석을 위한 표준화되고 공개된 운영 절차가 없습니다. 또한 COVID-19 대유행 기간 동안 중요한 감염 통제 문제인 살아있는 호흡기 상피를 사용합니다. 이 건강 위기 동안 진단 서비스를 계속 제공하기 위해 섬모 비디오 현미경 프로토콜은 적절한 감염 관리 조치를 포함하도록 조정되었습니다.
여기에서는 섬모 호흡기 샘플의 샘플링 및 실험실 처리를 위한 수정된 프로토콜을 설명하고 COVID-19 감염 관리 조치를 준수하기 위한 조정을 강조합니다. 이 프로토콜에 따라 처리 및 분석된 16명의 건강한 피험자로부터 얻은 비강 칫솔질 샘플에서 CFA의 대표적인 결과가 설명됩니다. 또한 품질 선택 기준을 충족하지 않는 샘플이 이제 CFA를 허용하여 잠재적으로 이 기술의 진단 신뢰성과 효율성을 감소시키기 때문에 최적의 품질의 상피 섬모 스트립을 얻고 처리하는 것의 중요성을 설명합니다.
서문
원발성 섬모 운동이상증(PCD)은 유전성 이질성 운동성 섬모병증으로, 호흡 섬모가 고정되어 있거나 느리거나 이상운동성이어서 점액섬모 청소율 장애 및 만성 이-중국-폐질환을 유발합니다 1,2,3,4. PCD의 임상 증상은 유아기 초기에 시작되는 만성 습기침 및 만성 코막힘, 기관지확장증을 유발하는 재발성 또는 만성 상기도 및 하부 호흡기 감염, 재발성 또는 만성 중이염 및 부비동염이다 5,6,7. PCD 환자의 약 절반이 좌측 또는 모호성 좌절과 같은 장기 편측성 결함을 나타냅니다. 일부 환자는 또한 남성의 고정성 정자와 여성의 나팔관의 고정성 섬모로 인한 불임 문제를 나타냅니다 1,2,8. PCD는 드물지만 유병률은 정의하기 어렵고 범위는 1:10,000에서 1:20,000 9,10입니다. 그러나 PCD의 실제 유병률은 진단의 어려움과 임상적 의심의 부족으로 인해 더 높은 것으로 생각됩니다. PCD의 증상은 다른 급성 또는 만성 호흡기 질환의 일반적인 호흡기 증상을 모방하며, 진단을 확인하는 진단적 어려움은 잘 알려져 있어 부적절한 치료 및 추적 관찰로 이어진다 2,5,9,11.
디지털 고속 비디오현미경(DHSV)을 사용하는 섬모 비디오현미경은 PCD 4,8,12,13의 진단 도구 중 하나입니다. DHSV는 섬모 박동 빈도(CBF) 및 박동 패턴(CBP) 분석 2,14,15,16을 포함하는 섬모 기능 분석(CFA)을 수행하는 최적의 방법으로 간주됩니다. DHSV는 일반적으로 비강 칫솔질에서 얻은 살아있는 호흡기 상피를 사용한다13.
현재 COVID-19 발생을 고려할 때, 근본적인 호흡기 질환이 COVID-19 감염 후 더 나쁜 결과를 초래할 수 있다는 증거가 있기 때문에 PCD 진단의 확인이 더욱 중요합니다17,18. 현재 팬데믹 기간 동안 안전하고 효율적인 PCD 진단 서비스를 통해 확인된 PCD 환자는 일반 인구에 비해 추가 보호 조치의 혜택을 받을 수 있습니다19.
COVID-19의 전파는 주로 비말 확산을 통해 발생한다20. 무증상(또는 최소 증상) 환자로부터의 높은 전염 가능성은 코 샘플(20)의 높은 바이러스 부하에 의해 시사된다. 또한 바이러스 입자가 에어로졸화되면 최소 3시간 동안 공기 중에 머무른다21. 그러므로, 호흡기 건강 관리 종사자들은 진단 기술(22)을 위한 임상 치료 및 샘플 수집을 수행하는 동안 높은 바이러스 부하의 저장고에 노출된다. 또한 살아있는 호흡기 샘플을 조작하면 기술자가 COVID-19 오염에 노출됩니다. COVID-19 환자를 돌보는 호흡기 전문의와 이비인후과 의사를 위한 모범 사례 권장 사항이 시행되고 있지만23, COVID-19 팬데믹 기간 동안 DHSV를 수행하기 위한 권장 사항이 부족합니다.
PCD 진단 서비스를 계속 제공하면서 의료 종사자(검체 채취 수행)와 기술자(검체 처리 수행)의 안전을 보장하기 위해 COVID-19 팬데믹 기간 동안 섬모 비디오 현미경 프로토콜을 조정해야 했습니다. 섬모 비디오 현미경 기술은 현재 CFA가 광범위한 교육과 경험을 필요로하기 때문에 연구 서비스 및 전문 진단 센터로 제한됩니다. 또한, 현재 DHSV 4,13을 사용하여 샘플을 처리하고 분석하기 위한 표준화 및 정확한 운영 절차가 부족합니다.
이 논문의 목적은 특히 살아있는 비강 상피를 샘플링하고 처리할 때 감염 관리 조치 및 안전성과 관련하여 DHSV에 대한 표준 운영 절차를 설명하는 것입니다. 이를 통해 현재 COVID-19 발생에도 불구하고 고품질 PCD 진단 및 치료를 계속할 수 있습니다.
프로토콜
리에주 병원-교수 윤리 위원회와 직장 위생 및 건강 보호를 위한 대학 부서의 승인을 받았습니다.
1. 호흡기 섬모 상피 샘플링
- 샘플링 전에 피험자가 최소 4-6주 동안 감염되지 않았는지, 비강 및 흡입 약물이 없는지 확인하십시오.
- 보충된 M199 제제 준비: 항생제 용액(스트렙토마이신/페니실린 5mL(50μg/mL)) 및 항진균액(암포테리신 B 5mL(2.5μg/mL))으로 보충 세포 배양 배지 199(M199)(500mL)를 보충합니다.
- 뚜껑이 있는 15mL 원뿔형 튜브 2개(각 콧구멍에 하나씩)를 준비하고 각각에 보충된 M199 3mL를 채웁니다.
- 기관지 세포학 브러시 (두께 : 2mm 및 길이 : 11mm)를 준비하십시오. 브러시 길이가 약 15cm가 되도록 와이어 끝을 자릅니다(그림 1A,B). 비강 칫솔질을 할 때 칫솔을 잡으려면 Weil-Blakesley 비강 겸자를 사용하십시오(그림 1B).
- COVID-19 적응: COVID-19에 대해 알 수 없는 상태의 살아있는 비강 상피 샘플 처리를 피하고, 섬모 비디오 현미경을 위해 비강 칫솔질 48-72시간 전에 COVID-19 환자를 검사합니다. 이 COVID-19 검사는 비인두 면봉 샘플24,25의 중합효소 연쇄 반응으로 구성됩니다. 이 시점에서 COVID-19에 대한 환자의 상태를 알 수 없기 때문에 의사와 직원은 FFP23,26 마스크, 장갑, 안면 보호대 또는 고글, 긴팔 방수 가운을 포함하여 적절하게 보호되어야합니다. PCR 검사가 불가능하거나 불가능하거나 의심스러운 경우, L2 생물 안전 실험실에서 비강 칫솔질의 모든 처리를 했습니다. COVID-19 양성 상태인 경우 PCD 진단 검사를 연기하고 환자를 관리하기 위한 대체 접근 방식을 고려하십시오.
주의: COVID-19 검사를 위한 이 비인두 면봉 샘플링은 비강 호흡기 모양체 상피를 손상시켜 이차성 모양체 운동이상증을 유발할 수 있습니다27,28. 이를 방지하려면 얇은 면봉을 엄격한 내시경 제어하에 비인두까지 비강에 삽입하여 비갑개나 중격을 손상시키지 않도록 합니다. 그런 다음 비 인두에서 샘플을 채취하여 단단한 내시경의 제어하에 면봉을 제거합니다. 적절한 장비를 사용하면 외상 없이 성인과 어린이에게 0° 강성 내시경 검사를 쉽게 수행할 수 있습니다.
2. 호흡기 섬모 상피 표본 얻기
COVID-19 적응: 환자의 COVID-19 상태가 음성이더라도 위음성률로 인해 시술 중 환자에게 수술용 마스크를 입에 대고 의사가 장갑, FFP2 마스크 및 안면 보호대를 착용합니다.
- 비강 칫솔질 준비
- 환자에게 코를 풀도록 요청하십시오.
- 비강 내시경 검사 또는 맹검 상태에서 비강 칫솔질을 수행하십시오. 비강 내시경 검사를 사용하는 경우 비강 칫솔질 전에 2개의 콧구멍을 검사합니다(COVID-19 비강 면봉에 대해 이전에 48-72를 수행한 경우 반복하지 마십시오). 검사를 통해 점막의 상태 (비강 칫솔질을 할 때 염증의 정도가 높으면 출혈을 일으킬 수 있음), 열등한 비갑개 상태 (예 : 모세 혈관 확장증의 존재를 배제하기 위해) 및 중격 비강이 직선인지 여부를 확인할 수 있습니다 (그림 1C).
- 환자에게 머리를 의자에 거꾸로 놓거나 편안하게 앉도록 요청하십시오 (비강 칫솔질로 인해 반사가 머리를 뒤로 움직이기 때문입니다). 두 번째 간병인은 특히 어린이의 경우 비강 칫솔질 중에 머리를 잡습니다.
- 비강 칫솔질 전에 보충된 M199에서 브러시를 흔듭니다(브러시를 적시면 칫솔질로 인한 자극이 감소함).
알림: 브러시는 보충된 M199 내에서 촉촉할 수 있습니다. 환자가 항생제에 알레르기가있는 경우 (페니실린과 스트렙토 마이신이 보충 된 세포 배양 배지에 존재 함) 식염수에 브러시를 적시십시오.
- 비강 칫솔질
- 국소 또는 전신 마취 없이 비강 칫솔질을 부드럽게 삽입합니다13. 비강 내시경 검사를 사용하는 경우 내시경을 코 입구에 배치하여 하비갑개를 시각화한 다음 세포학 브러시를 코에 삽입합니다. "블라인드" 비강 칫솔질을 수행하는 경우 칫솔을 비강 바닥을 따라 코에 삽입합니다(그림 1D).
참고: 일부 진단 센터에서는 나파졸린 탐폰으로 국소 마취를 사용하여 비강 칫솔질을 수행합니다. - 브러시를 하비갑개의 뒤쪽 부분 위로 앞뒤로 여러 번 움직인 다음 빼냅니다. 시술자는 칫솔이 상피를 문지르는 것을 느껴야 하며, 환자는 칫솔질 측면에서 일방적인 눈물을 느낄 수 있습니다.
참고: 비강 칫솔질을 너무 앞쪽으로 수행하면 전방 비강에 과도기적 비섬모 상피가 늘어서 있기 때문에 섬모 세포가 얻어지지 않습니다. - 샘플링 후 즉시 비강 칫솔질 표본을 배양 배지 내에 놓습니다. 수득된 호흡 상피 스트립은 보충된 M199를 함유하는 튜브에서 브러시를 교반하여 제거한 다음, 튜브를 닫는다(도 1E).
- COVID-19 적응: 샘플링 직후 보충된 M199의 브러시를 흔들어 상피 스트립을 제거하지 마십시오. 브러시를 튜브에 넣고 튜브 내부에 완전히 들어갈 수 있도록 와이어를 자른 다음 즉시 튜브를 닫습니다. 밀폐된 이중 백에 샘플을 넣습니다.
- 국소 또는 전신 마취 없이 비강 칫솔질을 부드럽게 삽입합니다13. 비강 내시경 검사를 사용하는 경우 내시경을 코 입구에 배치하여 하비갑개를 시각화한 다음 세포학 브러시를 코에 삽입합니다. "블라인드" 비강 칫솔질을 수행하는 경우 칫솔을 비강 바닥을 따라 코에 삽입합니다(그림 1D).
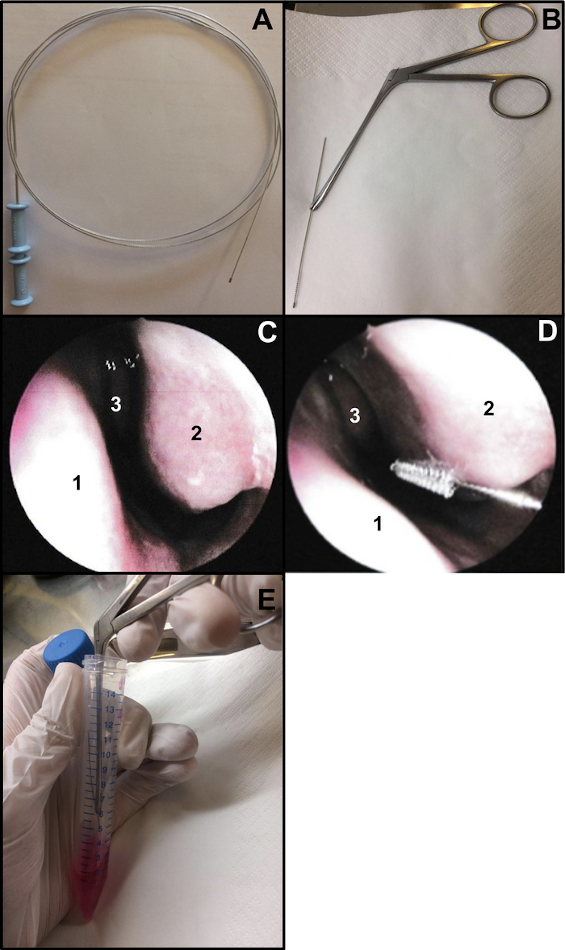
그림 1: 비강 칫솔질 기술. (A) 전체 기관지 세포학 브러시 (B) 즉시 칫솔질: 와이어의 칫솔질 끝을 절단하고(길이 약 15cm) Weil-Blakesley 비강 겸자로 고정합니다(C) 비강의 내시경 보기: 중격 (1) 하비갑개(2) 및 중간 비갑개(3) (D) 비갑개(2)의 뒤쪽 부분에 비강 칫솔질을 합니다. 비중격 (1) 중간 비갑개 (3). (E) 호흡 상피 스트립은 보충된 M199 세포 배양 배지에서 브러쉬를 흔들어 제거한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 호흡기 섬모 상피 처리
- CBF와 CBP 모두 이 기간 내에 안정적이므로 샘플링 후 9시간 이내에 현미경으로 비강 칫솔질 샘플을 분석합니다(미공개 데이터).
- x100 오일 이멀젼 위상차 또는 간섭 대비 렌즈와 함께 정립 또는 도립 광학 현미경을 사용합니다. 이상적으로는 섬모 박동이 외부 진동(예: 실험실 벤치)으로 인해 인공물이 발생할 수 있으므로 진동 방지 테이블에 현미경을 놓는 것이 좋습니다13.
COVID-19 적응: 작업자는 FFP2 마스크, 장갑 및 긴팔 방수 가운을 포함한 개인 보호 장비를 사용하여 비강 처리를 수행합니다.
- 시각화 챔버를 준비합니다.
- 섬모 상피 스트립을 실험실에서 제작한 개방형 시각화 챔버에 매달아 현미경으로 분석하는 동안 섬모가 자유롭게 박동할 수 있도록 합니다. 이 챔버는 커버 슬립(22mm x 40mm)과 유리 슬라이드를 인접한 두 개의 정사각형 커버 슬립(20mm x 20mm)으로 분리하고 15mm의 거리로 분리하여 유리 슬라이드(12 )에 접착함으로써 생성됩니다(그림 2, 그림 4A).
COVID-19 적응: 상술한 실험실-내장 챔버는 개방적이고, 샘플과 환경(13) 사이의 가스 및 습도 교환을 허용한다. COVID-19 팬데믹 상황에서는 0.25mm 깊이의 양면 스페이서를 사용하여 폐쇄형 시각화 챔버를 사용할 수 있습니다(그림 3, 그림 4B). 스페이서가 유리 슬라이드에 붙어 있고 커버 슬립(22mm x 40mm)이 스페이서 위에 붙어 있습니다.

그림 2: 실험실에서 제작한 개방형 챔버 장착. (A) 2개의 정사각형 커버슬립(20mm x 20mm)을 유리 슬라이드에 놓습니다. (B) 정사각형 커버 슬립을 약 15mm의 거리로 분리하여 유리 슬라이드에 접착합니다. (C) 챔버는 보충된 M199에 있는 섬모 상피의 작은 샘플(약 60μL)로 인접한 두 개의 정사각형 커버 슬립 사이에 채워집니다. (D) 긴 직사각형 커버슬립(22mm x 40mm)을 인접한 두 개의 정사각형 커버 슬립에 놓고 챔버를 덮습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 양면 스턱 스페이서를 사용한 밀폐형 챔버 장착. (A) 유리 슬라이드와 양면 스페이서. (B) 스페이서의 한쪽에서 보호 장치가 제거되고 스페이서가 유리 슬라이드에 붙어 있습니다. (C) 양면 고착 스페이서의 다른 쪽에서 보호 장치를 제거한 다음 보충된 M199에 포함된 섬모 상피의 작은 샘플(약 60μL)로 스페이서를 채웁니다. (D) 긴 직사각형 커버슬립(22mm x 40mm)이 스페이서에 붙어 챔버를 닫습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
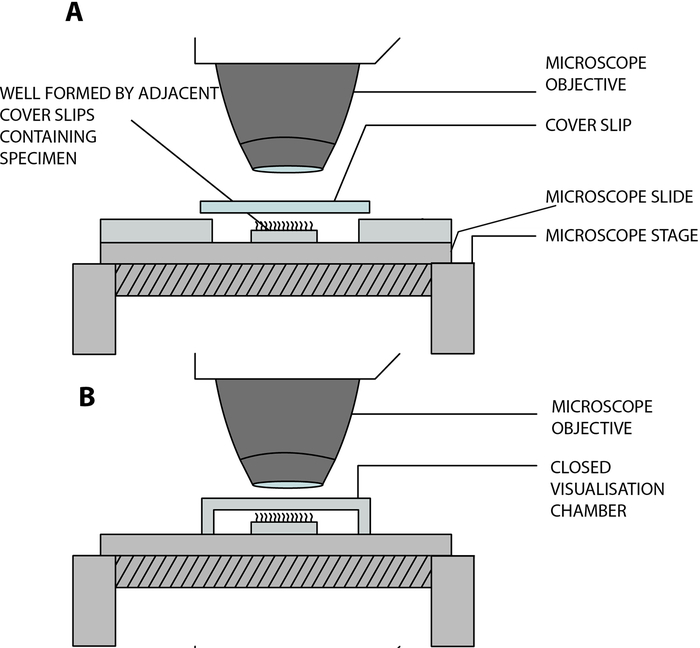
그림 4: 디지털 고속 비디오현미경(DHSV)을 사용하여 섬모 비디오현미경을 수행하는 데 사용되는 주요 시각화 챔버를 보여주는 개략도. (A) 개방형 교수형 드롭 기술: 섬모 샘플을 두 개의 인접한 커버슬립으로 커버슬립과 유리 슬라이드를 분리하여 생성된 개방형 챔버의 세포 배양 배지 한 방울에 현탁합니다. (B) 폐쇄형 행잉 드롭 기술: 섬모 샘플은 유리 측면과 커버 슬립 사이에 끼워진 스페이서에 의해 생성된 밀폐된 챔버의 세포 배양 배지 한 방울에 현탁됩니다. 스페이서는 유리 슬라이드와 커버 슬립 모두에 단단히 고정됩니다. Kempeneers et al.13에서 복제 및 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 온도 제어
- 뽁뽁이로 현미경을 둘러쌉니다(그림 5A,B).
- 벨크로 스트랩을 사용하여 대물렌즈 주위에 렌즈 히터를 부착합니다(그림 5C).
- 제어 온도 확인을 수행하기 1시간 전에 렌즈 히터 컨트롤러를 켜십시오.
- 샘플을 통과하는 빛의 양이 슬라이드의 온도를 변경할 수 있으므로 현미경을 켜고 현미경 설정이 완료되었는지 확인합니다.
- 가열식 박스 컨트롤러를 켭니다(그림 5D).
- 시작하기 전에 참조 프로브가 제대로 작동하는지 확인하십시오. 참조 프로브 팁을 손가락 사이로 잡습니다. 체온을 측정해야합니다.
- 슬라이드 중앙에 접착된 두 개의 인접한 정사각형 커버 슬립(20mm x 20mm) 사이에 여유 미디어를 넣습니다.
- 보충된 M199에 참조 프로브 팁을 놓습니다. 직사각형 커버슬립(22mm x 40mm)으로 덮습니다. 프로브가 매체로 완전히 둘러싸여 있는지 확인하십시오(그렇지 않으면 온도가 떨어질 수 있음).
- COVID-19 적응: 스페이서를 사용하여 밀폐된 챔버에서 온도 제어를 수행하려면 스페이서의 한쪽 면을 자릅니다(이 구멍은 기준 프로브와 크기가 같아야 함). 스페이서를 유리 슬라이드에 붙이고 스페이서 중앙에 여유 미디어를 놓습니다. 참조 프로브의 끝을 스페이서의 구멍을 통해 용액에 넣은 다음 스페이서에 직사각형 커버슬립(22mm x 40mm)을 붙입니다.
- 가열 된 상자의 접시에 슬라이드를 놓습니다. 가열 된 상자를 뚜껑으로 닫으십시오.
- 오일 이멀젼 대물렌즈에 오일을 추가합니다.
- 가열된 상자를 현미경 스테이지에 놓습니다.
- 플레이트와 뚜껑의 온도를 조정하여(뚜껑의 온도는 결로를 방지하기 위해 플레이트의 온도보다 2°C 높아야 함) 매체 내의 기준 프로브로 37°C를 측정합니다.
- 5분 동안 기다립니다(샘플의 온도를 37°C로 올리는 데 필요한 시간).
- 렌즈 끝으로 커버슬립에 닿을 때까지 대물렌즈를 슬라이드에 더 가깝게 이동하여 대물렌즈를 조정합니다.
- 현미경에서 프로브의 중앙을 보기 위해 대물렌즈를 움직입니다.
알림: 컴퓨터 화면에 프로브가 표시되는지 확인하십시오(섬모를 보기 전에 카메라 시스템이 작동하는지 확인하기 위해amp르). 프로브의 중앙을 볼 때 화면이 완전히 검은색입니다. - 렌즈 히터의 온도를 조정합니다(오일 이멀젼 렌즈가 커버슬립에 닿았을 때 온도 손실을 보상하기 위해). 대물렌즈가 커버 슬립에 닿을 때 매체 내의 기준 프로브로 37°C를 측정해야 합니다.
알림: 이상적으로는 온도 설정이 변경되지 않도록 온도가 제어된 실내에서 작업하는 것이 좋습니다. 실내 온도가 조절되지 않는 경우 섬모 비디오 현미경을 수행하기 전에 매일 이 온도 제어 검사를 수행해야 합니다. - 온도를 확인한 후 가열 된 상자에서 슬라이드를 꺼냅니다.
- 슬라이드와 참조 프로브의 끝을 알코올로 청소하고 치워둡니다.
- 이소프로판올로 렌즈를 청소하고 원을 그리며 렌즈 청소용 티슈를 청소합니다.

그림 5: DHSV 실험실에서 사용되는 장비. (A) 100x 오일 이멀젼 위상차 렌즈가 장착된 현미경은 외부 진동으로 인해 모양체 기능 분석을 위한 인공물이 발생하지 않도록 진동 방지 테이블에 배치됩니다. (B) 현미경은 주변 공기의 열 손실을 방지하기 위해 버블 랩으로 둘러싸여 있습니다. (C) 오일 침지 대물렌즈는 열 손실을 생성합니다. 이것은 렌즈 히터 (화살표)를 사용하여 방지 할 수 있습니다. (D) 가열 상자를 사용하여 샘플을 가열합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 호흡기 섬모 상피 시료의 제조
- 섬모가 튜브 전체에 퍼지도록 튜브를 부드럽게 흔듭니다(섬모가 다른 섬모 스트립, 점액 또는 파편에 달라붙어 자유롭게 뛰는 것을 방지하기 위해).
참고: 이 단계는 섬모 상피의 "최적 가장자리"를 얻는 데 필수적입니다(그림 12). - 피펫으로 튜브 중앙에 보충된 M199에서 약 50μL의 섬모 상피를 빼냅니다.
- 실험실에서 제작한 챔버(인접한 두 개의 정사각형 커버 슬립(20mm x 20mm) 사이)에 샘플을 놓고 직사각형 커버슬립(22mm x 40mm)으로 덮습니다. 거품을 추가하지 않도록 주의하십시오.
- COVID-19 적응: 미생물 안전 캐비닛에서 4.1-4.3단계를 수행합니다. 미생물 안전 캐비닛의 절차.
- 샘플을 준비하기 10분 전에 미생물 안전 캐비닛을 켭니다(환경이 무균 상태인지 확인하기 위해).
- 취급하기 전에 전체 미생물 안전 캐비닛을 70% 에탄올로 소독하십시오.
- 미생물 안전 캐비닛에 넣기 전에 필요한 모든 재료를 70% 에탄올로 소독하십시오.
- 미생물 안전 캐비닛 아래에서 샘플이 들어 있는 15mL 원뿔형 튜브를 한 번만 연 다음 보충된 M199에서 브러시(Weil-Blakesley 비강 집게 사용)를 저어 상피 스트립을 제거합니다.
- 유리 슬라이드에 스페이서를 붙이고 양면 스페이서에서 보호 장치를 제거합니다.
- 섬모가 튜브 전체에 퍼지도록 튜브를 부드럽게 흔듭니다.
- 보충된 M199의 섬모 상피의 작은 샘플을 피펫(약 60μL)으로 튜브 중앙에서 빼내고 스페이서를 채웁니다.
- 스페이서에 직사각형 커버슬립(22mm x 40mm)을 붙여 챔버를 닫습니다.
- 미생물 안전 캐비닛에서 나오기 전에 슬라이드를 소독하십시오.
- 미생물 안전 캐비닛에서 슬라이드를 제거합니다.
- 미생물 안전 작업대에서 나올 때는 장갑을 교체하십시오.
- 사용 후 미생물 안전 캐비닛을 끄기 전에 10분 정도 기다리십시오(문을 닫기 전에 미생물 안전 캐비닛의 환경이 멸균되었는지 확인하기 위해).
- 가열 된 상자의 접시에 슬라이드를 놓습니다. 가열 된 상자를 뚜껑으로 닫으십시오.
- 오일 이멀젼 대물렌즈에 오일을 추가합니다.
- 가열된 상자를 현미경의 스테이지에 놓습니다.
- 가열된 상자와 렌즈 히터를 켭니다.
알림: 렌즈 히터는 사용 1시간 전에 켜야 합니다. - 3.4단계에서 얻은 값에 따라 가열 상자와 렌즈 히터 컨트롤러의 온도 설정을 조정하십시오.
- 5분 동안 기다립니다(s의 온도를 상승시키는 데 필요한 시간amp가열된 상자와 대물 히터 모두에 대해 미리 결정된 설정을 사용할 때 최대 37°C).
- 렌즈 끝으로 커버슬립에 닿을 때까지 슬라이드에 대물렌즈에 접근합니다.
5. 호흡 섬모 가장자리 시각화
- 고속 비디오 카메라를 현미경에 고정하고 카메라를 컴퓨터에 연결한 다음 카메라를 켭니다.
- 컴퓨터를 켭니다.
- 디지털 고속 비디오 현미경 카메라를 컴퓨터에 연결합니다 (이미지가 ed에 view접안 렌즈를 통해 모니터에 투사됩니다) 소프트웨어를 통해.
- 소프트웨어를 열면 Main Menu(기본 메뉴 )가 자동으로 열립니다(그림 6A).
참고: 이 소프트웨어는 이미지 수집 및 처리를 위해 실험실에서 사용되는 프로그램입니다. 이 시스템을 사용하면 비디오 시퀀스를 감소된 프레임 속도 또는 프레임 단위로 녹화하고 재생할 수 있습니다. 무료로 다운로드 할 수 있습니다. - 카메라를 엽니다(그림 6A).
- 카메라 열거형 필터가 나타나면 확인을 선택합니다(그림 6B).
- 새로 고침 목록을 선택하십시오. 카메라 이름을 선택하십시오. Interface: Expert를 선택한 다음 Open을 선택합니다(그림 6C).
- 도킹된 대화 상자 메뉴의 맨 위에 있는 카메라 컨트롤 라인에서 라이브 를 선택합니다(그림 6D).
- [재생]을 선택하여 이미지를 보고 중지를 선택하여 보기를 마칩니다(그림 6D).
- 소프트웨어를 열면 Main Menu(기본 메뉴 )가 자동으로 열립니다(그림 6A).

그림 6: 소프트웨어 사용에 대한 설명: 호흡 섬모 가장자리를 모니터에 시각화합니다. (A) 메인 메뉴 는 소프트웨어를 열 때 바로 나타납니다. (b) 카메라 열거 필터를 닫습니다. (C) 카메라를 선택하고 인터페이스: 전문가를 선택합니다. (D) 라이브 모드를 사용하면 현미경을 통해 본 이미지를 모니터에 시각화 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 카메라 획득 설정(오른쪽 상단 모서리)을 조정합니다(그림 7).
- 획득 설정에서 카메라를 선택한 다음 프레임 속도를 조정합니다. 속도(Hz): 500(아래 참조)(그림 7A).
- 획득 설정에서 카메라를 선택한 다음 관심 영역(ROI)을 조정합니다(그림 7A).
알림: ROI는 눈금이 매겨진 스케일을 사용하여 계산됩니다. viewx100 오일 이멀젼 대물렌즈로 보고 모니터에 투영하여 50μm에 해당하는 픽셀 수를 정의합니다(약 50μm를 측정하는 섬모 가장자리를 기록하려는 경우(아래 참조)). - 획득 설정에서 녹화를 선택한 다음 비디오 지속 시간과 녹화된 총 프레임 수(2초 지속 시간, 선택한 프레임 속도가 5OOHz인 경우 1000프레임에 해당)를 조정합니다(그림 7B).
참고: 경험상 CBF와 CBP를 완전히 분석하려면 최소 2초의 비디오 길이가 필요합니다. - File(파일)을 선택한 다음 Save Camera Cfg(카메라 구성 저장)를 선택하여 새 획득 설정을 저장합니다(이 새 구성에 대한 이름과 필요한 경우 설명을 입력).
- 이 새 카메라 구성을 열려면 File and Load Camera Cfg (그림 7C)를 엽니다.
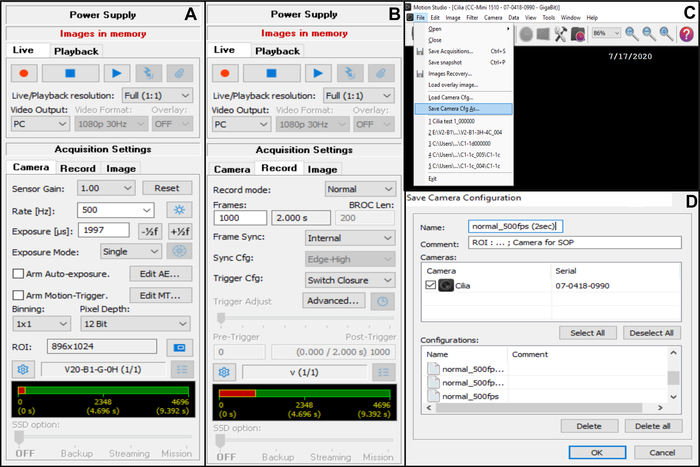
그림 7: 소프트웨어 사용에 대한 설명: 박동하는 섬모 가장자리의 비디오 녹화를 위한 카메라 획득 설정 조정. (A) 획득 설정 카메라에서 관심 영역(ROI)과 비디오 녹화를 위한 프레임 속도(속도)를 조정합니다. (B) 획득 설정 녹화에서 비디오 녹화 시간(이전에 선택한 프레임 속도에 따라 선택한 녹화 시간에 필요한 프레임 수)을 조정합니다. (C) 이 새로운 카메라 구성 설정은 Save camera Cfg 기능을 사용하여 저장할 수 있습니다. Load Camera Cfg 를 사용하면 저장된 구성 설정을 다시 열어 나중에 사용할 수 있습니다. (D) 새 카메라 구성 설정의 이름을 지정할 수 있으며 필요한 경우 설명을 추가할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 안구 렌즈를 통해 보고 샘플 내에서 세포나 파편을 검색한 다음 초점을 맞춥니다.
- 이미지가 모니터에 보이는지 확인하고 콘덴서(간섭 대비 렌즈를 사용하는 경우 DIC 프리즘)를 조정하여 이미지 품질을 개선하고 필요한 경우 초점을 조정합니다.
- 섬모 상피 스트립을 찾으십시오.
6. 호흡 섬모 가장자리 선택
참고: 실험 시스템을 통해 박동 섬모를 세 가지 별개의 평면에서 볼 수 있습니다: 측면 프로필, 관찰자를 향해 직접 박동, 바로 위에서(그림 8).
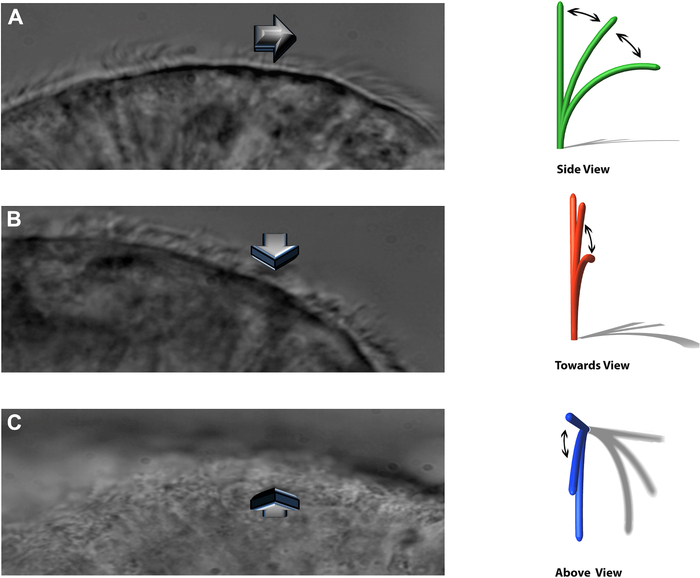
그림 8: DHSV 기술을 사용하면 박동 섬모를 세 개의 별개의 평면에서 볼 수 있습니다. (A) 옆으로 프로필에서. (B) 관찰자를 향해 직접 두드리고. (C) 바로 위에서. Kempeneers et al.16에서 재현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 길이가 최소 50μm인 손상되지 않은 손상되지 않은 섬모 상피 가장자리만 기록합니다.
- 측면 프로파일에서 만든 기록의 경우 Thomas et al.29 점수 시스템에 따라 가장자리의 품질을 결정합니다(그림 9). 섬모 기능 분석에는 일반 가장자리(그림 9A) 또는 작은 돌출부가 있는 가장자리(그림 9B)만 사용합니다. 분리된 셀을 제외합니다(그림 9E).

그림 9: 섬모 상피 가장자리의 다양한 품질에 대한 Thomas etal 29의 점수 시스템의 대표 이미지. (A) 정상 가장자리: 길이가 50μm> 온전한 균일한 섬모 상피 스트립으로 정의됨 (B) 작은 돌기가 있는 섬모 가장자리: 길이가 >50μm인 가장자리로 정의되며, 세포가 상피 가장자리 선 밖으로 돌출되어 있지만 정점 세포막의 지점이 인접 세포의 섬모 끝 위로 돌출되어 있지 않음(C) 주요 돌출부가 있는 섬모 가장자리: 가장자리>길이 50μm, 세포가 상피 가장자리선 밖으로 돌출되어 있고, 정점 세포막의 적어도 한 지점이 인접한 세포의 섬모 끝 위로 돌출되어 있음으로 정의됨) (D) 분리된 섬모 세포: 상피 가장자리>50μm 길이의 유일한 섬모 세포로 정의됨(E) 단일 세포: 자신 또는 다른 세포 유형 사이에 접촉이 없는 섬모 세포로 정의됩니다. 스케일 바: 5.5μm. Thomas et al.29에서 재현 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 점액과 파편이 없는 섬모만 사용하여 CFA를 수행하고 기록된 가장자리에 대해 선택한 프로필에서 박동합니다. 가장자리를 따라 최소 2개의 CBF 및 CBP 평가(아래 참조)를 허용하는 섬모 모서리만 선택합니다.
- CFA 샘플에만 사용 측면 프로파일에서 최소 6개의 모서리를 생성하고 위의 기준을 충족합니다. 측면 프로파일에서 최대 20개의 모서리를 분석합니다.
- CBP를 특성화하기 위해 관찰자 프로파일 위에서 최소 1개의 추가 섬모 박동 가장자리를 사용합니다.
7. 섬모 가장자리 기록
- 초당 500프레임의 카메라 프레임 속도를 사용하여 박동하는 섬모 가장자리를 녹화하고 고해상도 모니터에 투사합니다. CBF 및 CBP13 모두를 분석하려면 최소 400Hz의 프레임 속도가 필요합니다. 초당 30프레임의 프레임 속도로 한쪽 가장자리를 기록하여 미립자 제거의 효율성을 평가합니다.
- 도킹된 대화 상자 메뉴의 맨 위에 있는 카메라 제어 라인에서 라이브를 선택합니다(그림 6D).
- 재생을 선택하여 이미지를 보고 중지를 선택하여 보기를 마칩니다(그림 6D)
- 가장자리를 기록하려면 기록( Record )을 누릅니다(그림 6D). 저장하기 전에 녹화를 보려면 도킹된 대화 상자 메뉴 상단의 카메라 제어 라인으로 이동하여 재생을 선택합니다. 재생 을 선택하여 녹화된 비디오를 보고 중지 를 선택하여 보기를 마칩니다(그림 10A).
참고: 저장하기 전에 기록된 가장자리를 보기 중지하십시오.
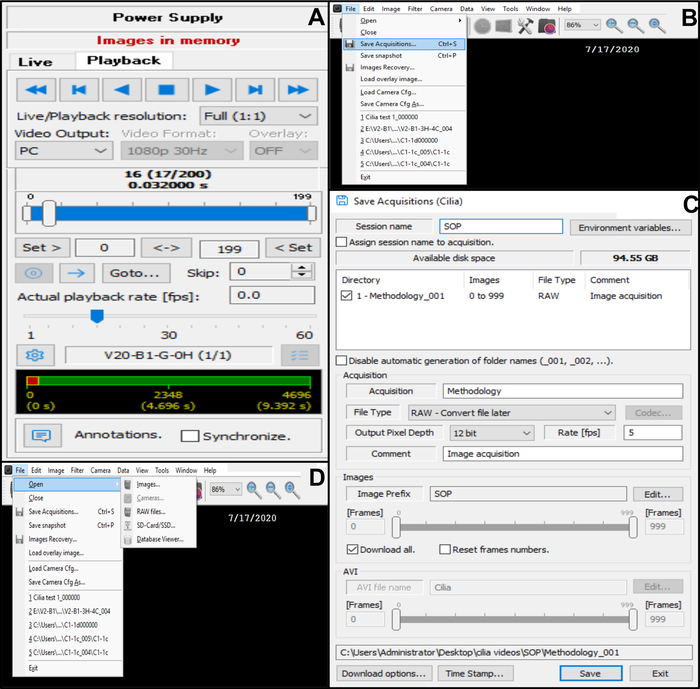
그림 10: 소프트웨어 사용에 대한 설명. (A) 재생 모드. 섬모 가장자리를 두드리는 녹화된 비디오 시퀀스를 검토하려면 재생 모드를 선택합니다. [재생 ]을 선택하여 이미지를 보고 [ 중지 ]를 선택하여 보기를 마칩니다. 모양체 기능 분석을 개선하기 위해 명성률을 조정할 수 있습니다(B, C) 섬모 가장자리를 치는 비디오 녹화 저장(B) 비디오를 저장하려면 File(파일 )을 선택한 다음 Save Acquisitions(획득 저장)를 선택합니다. (C) 녹화된 영상의 이름을 입력하고 영상이 녹화되는 배치를 선택합니다. 녹음이 . RAW 파일(D) 분석할 섬모 가장자리 박동 기록 선택: 비디오 녹화를 열려면 파일, 열기, 이미지를 차례로 선택합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 데이터베이스에 비디오를 저장합니다(그림 10B,C).
- 왼쪽 위 모서리에서 파일을 열고 획득을 저장합니다 (그림 10B).
- 획득 저장에 녹화된 비디오의 이름을 입력하고 녹화가 RAW 파일 형식 형식으로 저장되었는지 확인합니다(그림 10C).
- 비디오가 저장되면 라이브 모드로 돌아갑니다(도킹된 대화 상자 메뉴의 맨 위에 있는 카메라 제어 라인으로 돌아가서 라이브 선택)(그림 6D).
- 이 절차를 반복하여 CFA에 필요한 선택 기준을 충족하는 모서리 수를 기록합니다.
알림: 슬라이드 준비 후 최대 20분 이내에 하나의 슬라이드에서 선택 기준을 충족하는 여러 개의 박동 섬모 가장자리를 기록할 수 있습니다(건조를 방지하기 위해). 20분 후에도 선택 기준을 충족하는 모서리를 충분히 얻을 수 없으면 새 슬라이드를 준비합니다. - 가열된 상자에서 슬라이드를 제거합니다.
- 직사각형 커버슬립을 제거하고 특정 유해 의료 폐기물 용기에 버리십시오.
- 슬라이드(두 개의 정사각형 커버 슬립이 접착된 상태)를 70% 에탄올과 흡수성 종이로 청소합니다. 슬라이드가 깨끗해지면 다시 사용할 수 있습니다.
- COVID-19 적응: 커버슬립과 스페이서가 있는 슬라이드를 밀폐백에 넣고 장갑과 마스크를 벗겨 밀폐백에 넣습니다. 밀폐 봉투를 특정 유해 의료 폐기물 용기에 넣으십시오.
8. 섬모 기능 분석
- 수동 CBF 및 CBP 평가를 수행하기 위한 예비 준비
- 소프트웨어를 엽니 다.
- 왼쪽 위 모서리에 있는 파일을 열고 열기 를 순으로 하며 이미지를 엽니다(그림 10D).
- 분석할 비디오를 선택합니다.
- 도킹된 대화 상자 메뉴의 맨 위에 있는 카메라 제어 라인으로 이동하여 재생 을 선택합니다(그림 10A). 재생 을 선택하여 녹화된 비디오를 보고 중지 를 선택하여 보기를 마칩니다.
- 수동 섬모 박동 주파수(CBF) 분석
- 측면 모서리만 사용하여 CBF 평가를 수행합니다.
- 섬모 가장자리를 각각 약 10μm로 측정되는 약 5개의 인접한 영역으로 나눕니다(그림 11).
- 감소된 프레임 속도로 섬모 또는 섬모 그룹을 식별하고 시각화하며, 각 영역에서 최대 2개의 CBF 측정이 수행되어 각 가장자리를 따라 최대 10개의 CBF 측정이 수행됩니다(그림 11).
- 섬모 그룹이 5 비트 사이클을 완료하는 데 필요한 프레임 수를 기록합니다.
- 간단한 계산으로 CBF로 변환: (CBF= 녹음 프레임 속도(Hz)/(5비트의 프레임 수) x 5)13,16,30. 움직이지 않는 섬모는 0Hz13의 CBF를 갖는 것으로 보고되었습니다.
알림: 녹화된 비디오를 재생할 때 프레임 속도를 조정합니다(그림 10A). 이것은 섬모가 매우 느리게 박동할 때 특히 유용합니다. 프레임 속도를 높이면 섬모가 매우 느리게 뛰는지 또는 움직이지 않는지 정의하는 데 도움이 됩니다. - 각 샘플에 대해 정적 섬모를 포함하여 측면 프로파일에 기록된 모든 CBF의 평균(SD) 또는 (95% CI)로 평균 CBF를 계산합니다.
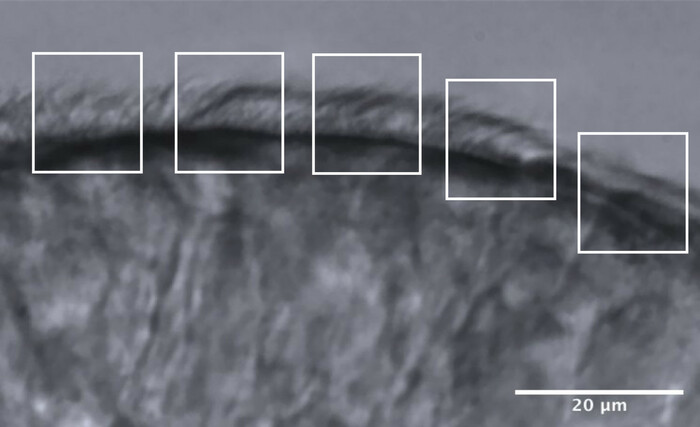
그림 11: 최적의 품질 에지의 대표 이미지 및 CFA 분석을 허용하기 위해 5개 영역으로 나눕니다. 최적의 품질의 섬모 상피 가장자리는 각각 10μm를 측정하는 5개의 인접 영역으로 단편화됩니다. 각 영역에서 최대 2개의 CBF 측정(및 2개의 CBP 평가)이 수행되므로 각 가장자리를 따라 최대 10개의 CBF 측정(및 CBP 평가)이 수행됩니다. 스케일 바 = 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 수동 섬모 박동 패턴(CBP) 분석
- 운동 이상증의 마커를 평가하려면 측면 프로파일만 사용하십시오. 관찰자쪽으로 비행기를 사용하고 위에서 CBP13의 유형을 특성화하십시오. CBP 평가를 위한 다양한 방법과 점수가 존재합니다. 아래는 운동 이상증의 마커의 정의와 함께 실험실에서 사용 된 방법을 설명합니다.
- 샘플 내 각 CBP의 백분율
- CBF 측정을 위해 확인되고 사용된 섬모의 각각의 섬모 또는 그룹에 대해(도 11), 감소된 프레임 레이트로 CBP 분석을 수행한다: DHSV 분석 상에서 관찰된 정상 CBP와 전체 비트 사이클 동안 섬모에 의해 취해진 정확한 경로를 비교한다12,30.
- 뚜렷한 CBP(정상, 움직이지 않음, 뻣뻣함, 원형, 비동기식(조정되지 않은 섬모 박동) 또는 이상운동성13)를 분석된 각 섬모 또는 섬모 그룹에 기인합니다.
- 각 샘플에 대해 샘플 내의 각 개별 CBP의 백분율을 계산합니다. 샘플에 기인하는 CBP가 관찰된 우세한 CBP입니다.
- 운동 이상증의 3 가지 마커를 계산하십시오.
- 운동 지수(IMI) 계산: 샘플 내 고정성 섬모의 백분율(CBF 수 = 0/샘플 X 100의 총 CBF 판독값 수). IMI를 평균(SD) 또는 (95% CI)1,16,31로 표현합니다.
- 운동 이상증 점수(DKS)를 계산합니다. 각 섬모 가장자리를 사분면으로 나누면 운동 이상증 (또는 비정상적으로 뛰는) 섬모가있는 사분면의 수가 결정됩니다. 이를 통해 0과 4 사이의 DKS를 계산할 수 있습니다(0: 가장자리 전체의 정상 CBP, 1: 섬모의 ≤ 25%에서 비정상적인 CBP, 2: 섬모의 ≤ 50%에서 비정상적인 CBP, 3: 섬모의 ≤ 75%에서 비정상적인 박동 패턴, 및 4: 모든 섬모에서 비정상적인 CBP). 중앙값 DKS(사분위수 범위)는 표본16,29에 대해 계산됩니다.
- 정상 박동의 백분율 계산: 샘플 내에서 정상 CBP가 있는 섬모의 백분율로 정의됩니다(샘플 x100에 대한 정상 CBP 판독값 수/총 CBP 판독값 수).
결과
이 기술의 효율성을 설명하기 위해 일련의 16명의 건강한 성인 지원자(남성 5명, 연령 범위 22-54세)에서 CFA의 결과를 제시합니다.
총 16명의 지원자 중 14명(남성 4명, 연령대 24-54세)의 비강 칫솔질 샘플은 CFA를 수행하는 데 필요한 선택 기준을 충족하는 적절한 상피 가장자리를 충분히 제공했습니다. 이 14개의 비강 칫솔질 샘플에서 총 242개의 섬모 가장자리가 기록되었고 212개의...
토론
이 문서는 COVID-19 대유행 기간 동안 적절한 감염 관리 고려 사항을 조정하여 비강 칫솔질 샘플을 사용하는 CFA에 대한 표준 운영 절차를 제공하는 것을 목표로 합니다. PCD 진단은 도전적이며 현재 비강 산화질소 측정, DHSV를 사용한 CFA, 투과 전자 현미경(TEM)을 사용한 섬모 미세 구조 분석, 면역형광을 사용한 섬모 단백질 표지, PCD 유발 유전자에 대한 유전자 검사 등 국제 권고에 따라 다양한 진단 테...
공개
이 저자는 공개 할 것이 없습니다.
감사의 말
Jean-François Papon, Bruno Louis, Estelle Escudier 및 Paris-Est PCD 진단 센터의 모든 팀원들이 PCD 진단 센터를 방문하는 동안 가용성과 진심 어린 환영을 받고 수많은 교류에 감사드립니다. 또한 로버트 허스트 (Robert Hirst)와 레스터 PCD 센터의 모든 팀원들의 환영과 시간, 조언 및 전문 지식에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
참고문헌
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유