Method Article
교모세포종의 펄스 전기장 치료를 위한 유연한 유기 전자 장치
요약
이 작업은 3D 뇌종양 모델, 즉 시험관 내 배양, 생체 내 모델 및 생체 내 쥐 모델에서 구현하기 위한 유연한 상호 디지털화 전극의 개발을 설명합니다. 제안된 방법은 상이한 수준의 복잡성에서 종양에 대한 펄스 전기장의 효과를 평가하기 위해 사용될 수 있다.
초록
교모세포종은 침습성이 높기 때문에 표준 종양 요법으로 근절하기 어렵습니다. 펄스 전기장(PEF)을 기반으로 하는 생체 전기 치료는 치료 효율성 향상에 유망합니다. 그러나 그들은 특히 뇌와 같은 연조직에서 급성 및 만성 손상을 일으키는 단단한 전극에 의존합니다. 이 작업에서는 유연한 전자 장치를 사용하여 PEF를 종양에 전달하고 생물학적 반응을 형광 현미경으로 평가했습니다. 얇고 투명한 파릴 렌 -C 기판 위에 인터 디지트 된 금 전극을 전도성 폴리머 PEDOT : PSS로 코팅하여 순응 성 및 생체 적합성 장치를 만들었습니다. 종양과 그 미세 환경에 대한 PEF의 영향은 다양한 생물학적 모델을 사용하여 조사되었습니다. 먼저, 교모세포종 세포의 단층을 전극 상부에서 배양하여 in vitro에서 현상을 조사하였다. 중간 단계로, 조작된 종양 스페로이드가 메추라기의 배아막에 이식되는 in ovo 모델이 개발되었습니다. 면역 체계가 없기 때문에 혈관이 많이 형성 된 종양이 발생했습니다. 이 발달 초기 단계에서 배아에는 면역 체계가 없으며 종양은 이물질로 인식되지 않습니다. 따라서 기존 배아 혈관계에서 자신의 혈관을 개발하면서 빠르게 발전할 수 있으며, 이는 가치 있는 3D 암 모델을 나타냅니다. 마지막으로, PEF의 유연한 전극 전달은 syngenic, orthograft (intracranial) 마우스 모델을 사용하여 기능적 면역 체계를 가진 완전한 유기체에서 평가되었습니다. 종양 스페로이드는 유연한 유기 전극 장치를 이식하기 전에 형질전환 다중 형광 마우스의 뇌에 이식되었습니다. 밀봉된 두개골 창은 몇 주 동안 PEF로 치료하는 동안 종양과 그 미세 환경의 다광자 이미징을 가능하게 했습니다.
서문
다형성 교모세포종(GBM)은 매우 침습적인 종양이므로 절제, 방사선 요법 및 화학 요법과 같은 표준 치료법으로 근절하기 어렵습니다. 복합 치료에도 불구하고 예후는 매우 좋지 않으며 대부분의 환자는 진단 후 1년 이내에 질병 진행을 경험한다 1,2. 최근 생체 전기 치료법의 개발은 기존 치료법을 개선할 수 있는 큰 잠재력을 보여주었습니다. 이러한 치료법은 일반적으로 단일 치료 세션에서 펄스 전기장(PEF)의 전달을 사용하여 세포막 무결성과 종양의 미세 환경을 방해합니다. 전기천공이라고도 하는 이 세포막 파괴는 전기장 강도와 펄스 수에 따라 가역적이거나 비가역적일 수 있습니다. 비가역적 전기천공법(Irreversible electroporation, IRE)은 비열 조직 절제 기법으로 적용되며, 전기 펄스가 세포막에 치명적인 손상을 일으켜 세포 사멸을 유도한다3. 전기화학요법(electrochemotherapy, ECT)은 암세포에서 약물 흡수를 향상시키기 위해 화학요법 약물과 함께 PEF를 전달하는 것으로 구성된 확립된 기술이다4. 또한, 최근 연구에서는 ECT의 대안으로 칼슘 전기천공법이 암 치료에 높은 효율을 보이며, 이는 또한 저렴하고 부작용을 덜 유발한다는 것을 입증했다5. 이러한 유망한 발전에도 불구하고, PEF는 일반적으로 연조직에 손상을 입히는 것으로 알려진 단단한 금속 전극을 사용하여 적용된다6. 뇌는 기계적 불일치가 염증과 성상아교세포 흉터를 유발하는 침습적 장치에 특히 민감하다7.
이러한 맥락에서, 미세 가공에서 쥐 모델에 이르기까지 교모세포종 종양의 3D 모델과 결합된 유연한 PEF 전달 시스템이 제시됩니다. 컨포멀 전극은 파릴렌-C, 금 및 pedot:PSS 8,9와 같은 연질 및 생체 적합성 재료의 사용을 포함하여 표준 박막 미세 가공 공정으로 만들어집니다. 인터디지티드 전극 설계는 전극 핑거(10) 사이의 이미징을 위한 적절한 투명성을 유지하면서 넓은 표면적을 커버하는 데 사용된다. 종양 모델의 경우, 유전적으로 암호화된 형광 리포터를 발현하는 교모세포종 세포의 3D 스페로이드는 액체 오버레이 96웰 플레이트 방법11의 변형을 사용하여 생산됩니다. 스페로이드는 메추라기 배아의 융모막에 이식되어 혈관신생 또는 약물 독성학을 연구하는 데 광범위하게 사용된 난소 모델을 생성합니다12,13. 종양은 배아 발달의 이 단계에서 면역계가 없는 상태에서 배아의 혈관 구조에 의해 이식되고 혈관화될 수 있다12. 그런 다음 유연한 전극을 혈관화된 종양 위에 배치하여 PEF 전달이 스페로이드와 혈관 구조에 미치는 영향을 연구합니다. 마지막으로, 이러한 효과는 쥐 모델14의 뇌 실질에 조작된 스페로이드를 이식하여 종양 미세 환경 및 면역 체계를 포함한 완전한 살아있는 유기체에 대해 조사됩니다. 유연한 전극을 삽입 부위 위에 놓고 개두술을 유리창으로 밀봉하여 몇 주에 걸쳐 반복적인 이광자 이미징을 허용합니다.
이러한 방법은 마이크로 일렉트로닉스 공학에서 종양학 응용 분야에 이르기까지 다양한 영역에 관심이있는 사람들에게 유용 할 것입니다. 미세 가공 프로토콜은 pedot:pss로 코팅된 박막 금속 전극이 필요한 모든 응용 분야에 사용 및 적용할 수 있습니다. 또한, 항종양 전기 치료의 평가를 위해 개발된 생물학적 모델은 이식된 물질에 대한 세포, 혈관 및 면역 반응의 분화 조사에 일반적인 관심이 될 것입니다.
프로토콜
모든 실험 절차는 프랑스 법률에 따라 수행되었으며 1986년 11월 24일 유럽 공동체 위원회 지침(86/609/EEC)에 따라 실험실 동물의 관리 및 사용에 대해 수행되었습니다. 동물에 대한 연구는 Direction Départementale des Services Vétérinaires des Bouches-du-Rhône의 승인을 받았으며 Provence Cote D' Azur 윤리위원회 (Apafis # 22689-2019100414103054)의 승인을 받았습니다.
1. 유연한 장치 미세 가공(그림 1)
- 유리 슬라이드 청소
- 유리 슬라이드를 2 % 비누 용액에서 15 분 동안 초음파 처리합니다. 물로 헹굽니다.
- 80 %의 순수 아세톤과 20 %의 순수 이소프로판올의 혼합물에서 15 분 동안 다시 초음파 처리합니다.
주의 : 이러한 용제는 유해하고 가연성입니다. 개인 보호 장비(PPE)를 착용하고 흄 후드 아래에서 취급하십시오. - 슬라이드를 이소프로판올로 헹구고 에어건으로 말립니다.
알림: 전체 공정 중에 아세톤이 기판에서 건조되지 않도록 하십시오.
- 금 전극 패터닝(그림 1A)
- 파릴렌 증착 시스템을 사용하여 3μm의 파릴렌-C(PaC) 층을 증착합니다(그림 1Aa).
- 세척된 유리 슬라이드를 증착 챔버에 놓습니다. 냉각기에 비누를 뿌리고 건조시킨 다음 증착 시스템의 지정된 콜드 트랩에 삽입합니다. 이 접착 방지제는 증착 후 냉각기에서 PaC를 쉽게 제거할 수 있도록 합니다.
주의: PaC는 자극제이며 건강에 위험을 초래합니다. 취급하는 동안 장갑을 착용하십시오. - 알루미늄 보트에 6g의 PaC를 넣고 용광로에 넣습니다. 기계를 비우고(P = 10mTorr) T냉각기 = -100°C, TFurnace = 690°C, T 기화기 = 175°C, T챔버 = 135°C 파라미터로 증착을 시작합니다.
- 증착이 완료되고 기화기의 온도가 40°C 미만이면 냉각기, 기화기 및 용광로를 끕니다. 기계를 환기시키고 샘플을 수집하십시오.
- 세척된 유리 슬라이드를 증착 챔버에 놓습니다. 냉각기에 비누를 뿌리고 건조시킨 다음 증착 시스템의 지정된 콜드 트랩에 삽입합니다. 이 접착 방지제는 증착 후 냉각기에서 PaC를 쉽게 제거할 수 있도록 합니다.
- 30초(100W, 50sccm) 동안 산소 플라즈마 처리로 시료 표면을 활성화합니다.
- 플라즈마 처리된 샘플을 40초 동안 1,000 x g 의 네거티브 포토레지스트로 스핀 코팅합니다. 샘플을 110°C의 핫 플레이트에 2분 동안 놓습니다(그림 1Ab).
주의 : 포토레지스트 용액은 가연성이며 자극을 유발합니다. PPE를 착용하고 흄 후드 아래에서 다루십시오. - UV 광대역 접점 정렬기의 빔라인에 i-line 필터를 배치하고 인터디지티드 전극 설계가 특징인 마스크를 통해 포토레지스트를 노출시킵니다(그림 1Ac).
참고: 간격이 50μm 또는 250μm인 인터디지트 전극은 레이아웃 편집기를 사용하여 설계되었으며 포토마스크는 레이저 포토플로팅으로 폴리에스터 포토마스크를 생산하는 회사에서 주문했습니다. - 위의 샘플을 핫 플레이트에서 110°C에서 3분 동안 굽고 실온에서 5분 동안 식힙니다. 시료를 금속 이온이 없는 현상액에 3분 동안 담가 비노광된 포토레지스트를 제거합니다. 샘플을 물로 헹구고 에어건으로 건조시킵니다(그림 1Ad).
주의: 현상액 용액은 자극제입니다. PPE를 착용하고 흄 후드 아래에서 다루십시오. - 60초(100W, 50sccm) 동안 산소 플라즈마 처리로 시료 표면을 활성화합니다.
- 다음과 같이 열 증발기로 20nm 크롬 접착 층과 300nm 금 층을 증착합니다(그림 1Ae).
- 증발기 기계를 환기시키고 s를 클립합니다.amp금속 나사로 상단 원형 플레이트의 파일(아래를 향함). 전용 도가니를 각각 크롬과 금으로 채웁니다. 기계를 밀봉하고 대피시켜 5·10-6 Torr 미만의 압력에 도달합니다. 샘플 홀더의 회전을 시작합니다.
- 크롬이 포함된 도가니를 선택하고 증착 속도 0.2 Å·s-1 에 도달할 때까지 크롬을 통과하는 전류를 천천히 증가시킵니다. 셔터를 열고 20nm의 크롬이 증착될 때까지 기다립니다. 셔터를 닫고 0mA가 될 때까지 전류를 천천히 낮춥니다.
- 금이 들어 있는 도가니를 선택하고 증착 속도 0.2 Å·s-1 에 도달할 때까지 금을 통과하는 전류를 천천히 증가시킵니다. 셔터를 열어 금을 증발시키고 10nm의 금이 증착될 때까지 기다린 다음 약 1.5nm가 증착될 때까지 증착 속도를 1.300Å·s-300 로 높입니다. 셔터를 닫고 전류를 0mA로 천천히 낮춥니다.
- 증착 후 샘플을 실온으로 15분 동안 식히십시오. 샘플 홀더의 회전을 중지하고 기계를 환기시킨 다음 샘플을 수집합니다.
- 샘플을 아세톤이 든 비커에 담그십시오. 110rpm으로 설정된 진탕판에 비커를 15분 동안 올려 포토레지스트를 들어 올립니다. 샘플을 이소프로판올로 헹구고 에어건으로 건조시킵니다(그림 1Af).
- 30초(100W, 50sccm) 동안 산소 플라즈마 처리로 시료 표면을 활성화합니다.
- 파릴렌 증착 시스템을 사용하여 PaC의 3μm 절연층을 증착합니다(1.2.1단계 참조)(그림 1Ag).
- 파릴렌 증착 시스템을 사용하여 3μm의 파릴렌-C(PaC) 층을 증착합니다(그림 1Aa).
- 아웃라인 개구부(그림 1B)
- 600 x g 에서 35초 동안 포지티브 포토레지스트로 샘플을 스핀 코팅합니다. 110°C의 핫플레이트에 2분 동안 놓습니다(그림 1Ba).
주의 : 포토레지스트 용액은 가연성이며 자극을 유발합니다. PPE를 착용하고 흄 후드 아래에서 다루십시오. - UV 광대역 접점 얼라이너의 빔라인에 i-라인 필터가 없는지 확인하고 UV 광대역 접점 정렬기를 사용하여 장치의 윤곽이 있는 마스크를 통해 포토레지스트를 노출시킵니다(그림 1Bb).
- 샘플을 금속 이온이 없는 현상액에 4분 동안 담그고 노출된 포토레지스트를 제거합니다. 샘플을 물로 헹구고 에어건으로 건조시킵니다(그림 1Bc).
- 반응성 이온 식각기로 PaC의 두 층을 통해 윤곽을 에칭한다 (160 W, 22 min,O2:50 sccm,CF4:10 sccm) (도 1Bd).
- 아세톤으로 남은 포토레지스트를 제거하고 이소프로판올로 헹구고 에어건으로 샘플을 건조시킵니다.
- 600 x g 에서 35초 동안 포지티브 포토레지스트로 샘플을 스핀 코팅합니다. 110°C의 핫플레이트에 2분 동안 놓습니다(그림 1Ba).
- pedot : pss 코팅 (그림 1C)
- 2% 비누 용액을 70 x g 에서 35초 동안 스핀 코팅합니다(그림 1Ca).
- 파릴렌 증착 시스템을 사용하여 PaC의 3μm 희생층을 증착합니다(단계 1.2.1 참조)(그림 1Cb).
- 600 x g 에서 35초 동안 스핀 코팅 포지티브 포토레지스트. 샘플을 110°C의 핫 플레이트에 2분 동안 놓습니다(그림 1Cc).
- UV 광대역 접점 정렬기의 빔라인에 i-라인 필터가 없는지 확인하고 전극의 활성 표면이 있는 마스크를 통해 포토레지스트를 노출시킵니다(그림 1Cd).
- 샘플을 금속 이온이 없는 현상액에 4분 동안 담그고 노출된 포토레지스트를 제거합니다. 샘플을 물로 헹구고 에어건으로 건조시킵니다(그림 1Ce).
- 반응성 이온 식각기로 PaC를 식각하여 전극의 활성 표면을 열었다(160 W, 24 min,O2:50 sccm,CF4:10 sccm). 활성 표면에 잔류 PaC가 없는지 현미경으로 확인합니다(그림 1Cf).
- 아세톤으로 남은 포토레지스트를 제거하고 이소프로판올로 헹구고 에어건으로 샘플을 건조시킵니다.
- 90초(100W, 50sccm) 동안 산소 플라즈마 처리를 사용하여 시료 표면을 활성화합니다.
- 화학적으로 중합 된 pedot : pss의 상업용 분산액을 5 부피 %의 에틸렌 글리콜 (EG) 및 0.1 부피 %의 도데 실 벤젠 술폰산 (DBSA)과 혼합한다. 15 분 동안 초음파 처리하십시오. 1 wt %의 (3- 글리시딜 옥시 프로필) 트리메틸 실록산 (GOPS)을 첨가하고 5 분 동안 초음파 처리한다. 1.2μm 필터를 통해 용액을 여과합니다.
주의 : EG는 자극제이며 건강에 위험을 초래합니다. DBSA는 자극성 및 부식성입니다. GOPS는 부식성입니다. 적절한 PPE를 착용하고 이러한 화학 물질을 흄 후드 아래에서 취급하십시오.
알림: 총 부피는 샘플 수에 따라 다릅니다. 10개의 표준 유리 슬라이드의 경우 PEDOT:PSS 18.78mL, EG 1mL, DBSA 20μL 및 GOPS 200μL의 양에 해당하는 최소 20mL를 준비합니다. - pedot:pss 용액의 4개 층을 150 x g 에서 35초 동안 스핀 코팅합니다. 각 층을 증착한 후 샘플을 핫 플레이트에서 110°C에서 60초 동안 굽고 다음 층을 회전시키기 전에 5분 동안 실온으로 냉각합니다(그림 1Cg).
- 샘플을 물에 담가 희생 PaC 층을 제거합니다(그림 1Ch).
- 샘플을 140°C에서 1시간 동안 굽습니다.
- 샘플을 탈이온수에 30분 동안 담그면 PEDOT:PSS 필름에 남아 있는 비누와 저분자량 화합물을 제거하고 유리 기판에서 샘플을 분리할 수 있습니다(그림 1Ci).
- 연결 및 패키징(그림 1D)
- 구리로 코팅된 폴리이미드 필름에 아크릴 페인트를 얇게 증착합니다(그림 1Da). 에어로졸을 사용하여 균일 한 페인트 층을 얻습니다 (그림 1Db).
- 아크릴 페인트를 레이저(75kHz, 7W, 레이저 통과 1회, 400mm·s-1)로 패터닝하여 두 개의 직사각형 접촉 패드(5mm x 15mm, 1.5mm 간격)를 얻습니다(그림 1Dc).
- 포화 30%(w/v) 염화제이철(FeCl3)을 물에 넣고 40°C에서 15분 동안 구리를 습식 식각합니다(그림 1Dd).
주의 : FeCl3 는 자극성 및 부식성입니다. 흄 후드 아래에서 장갑으로 다루십시오. - 아크릴 페인트를 천으로 살짝 문질러 아세톤으로 벗겨냅니다(그림 1De).
- 패터닝된 폴리이미드 필름을 레이저(15kHz, 30W, 30회 레이저 패스, 130mm·s-1)를 사용하여 직사각형 모양(15mm x 30mm)으로 자릅니다(그림 1Df).
- 직경 330μm 바늘(5m·min-1)을 사용하여 3bar의 압력에서 3축 디스펜싱 기계로 은 페이스트를 디스펜싱합니다(그림 1Dg).
주의 : 은 페이스트는 자극제입니다. 장갑으로 다루십시오. - 핀셋을 사용하여 쌍안경 현미경으로 PaC 프로브를 폴리이미드 필름에 정렬하고 부착합니다(그림 1Dh).
알림: 정렬 표시는 1.5.2단계에서 패턴화하여 접촉 패드에서 프로브의 위치를 용이하게 할 수 있습니다. - 오븐에서 140°C에서 2시간 동안 굽습니다.
- 접촉 패드에 1cm2 폴리이미드 보호 테이프를 붙입니다(그림 1Di).
- PaC 프로브와 폴리이미드 필름이 연결된 계면을 PDMS에 담그십시오(그림 1Dj).
- 50°C에서 2시간 동안 굽습니다.
- 보호 테이프를 분리하여 접촉 패드를 엽니다(그림 1Dk).
참고: 체외 장치의 미세 가공은 유사하지만 1.2.1, 1.3 및 1.5단계를 건너뛰어야 합니다.
2. 교모세포종 GCaMP6f 안정 세포주의 생성
- 렌티바이러스 생산
- 75cm² 플라스크에서 렌티바이러스 생산에 최적화된 HEK 293T 유래 세포주를 4.5g· 포도당, L-글루타민, 피루브산나트륨 및 중탄산나트륨의 L-1 및 10% 테트라사이클린이 없는 소 태아 혈청(FBS), 페니실린 100단위·mL-1 및 스트렙토마이신 100μg·mL-1을 80% 합류할 때까지 최소 3일 동안 보충합니다.
- 플라스크에서 배지를 꺼냅니다. 10mL의 인산염 완충 식염수(PBS)로 세포를 부드럽게 헹굽니다.
- 0.25% 트립신/EDTA 용액 1mL를 넣고 플라스크를 37°C에서 5분 동안 배양합니다.
주의 : 트립신 / EDTA 용액은 건강에 위험을 초래합니다. PPE를 착용하고 흄 후드 아래에서 다루십시오. - 배양액 8mL를 추가합니다. 세포 현탁액을 부드럽게 씻어냅니다.
- 세포를 계수하고 8mL의 배양 배지에서 페트리 접시에 4 x 106 개의 세포를 플레이트합니다.
- 다음날, GCaMP6f 유전자 및 퓨로마이신에 대한 내성을 부여하는 선별 마커를 함유하는 플라스미드 25 μg을 총 부피 600 μL의 물에 희석한다. 형질주입 시약 튜브에 추가합니다. 3,000rpm에서 10초 동안 소용돌이치고 튜브를 실온에서 10분 동안 배양하여 나노입자를 제조할 수 있도록 합니다.
- 튜브의 내용물을 HEK 293 T 세포의 배양액에 적가하고 손으로 부드럽게 흔든다. 세포를 37°C에서 최소 4시간 동안 배양합니다.
- 나노 입자 복합체를 함유하는 배지를 새로운 배지로 교체하고 37°C에서 세포를 되돌립니다.
- 3일 후, 상층액을 수집하고 500 x g 에서 10분 동안 원심분리하여 세포 파편을 제거하였다. 바이러스 입자를 포함하는 액상을 수집합니다.
참고: 상청액의 바이러스 생성은 정량적 렌티바이러스 역가 테스트를 사용하여 확인할 수 있으며 최소 80년 동안 -2°C에서 보관할 수 있습니다.
- 교모세포종 세포 형질도입
- 75 cm² 플라스크에서, 교모세포종 세포를 1 g· 포도당의 L-1, L-글루타민, 피루브산나트륨 및 중탄산나트륨 및 10% 테트라사이클린이 없는 FBS, 페니실린 100단위·mL-1, 스트렙토마이신 100μg·mL-1을 최소 4일 동안 보충합니다.
- 배지를 버리고 단계 2.1.9에서 얻은 상층액을 표적 세포에 첨가한다.
- 형질도입을 개선하기 위해 배지에 5μg·mL-1 의 헥사디메트린 브로마이드를 추가합니다. 37°C에서 6시간 동안 배양합니다. 배지를 10mL의 새로운 배지로 교체합니다.
주의: 헥사디메트린 브로마이드는 자극제입니다. 장갑으로 다루십시오.
- 안정한 세포주의 생성
- 형질도입 2-3일 후, 1g· 포도당의 L-1, L-글루타민, 피루브산나트륨, 중탄산나트륨, 10% FBS, 페니실린 100단위·mL-1, 스트렙토마이신 100μg·mL-1 및 퓨로마이신을 보충하여 형질도입되지 않은 세포를 죽입니다. 이 배지에서 세포를 최소 3일 동안 배양합니다.
주의: Puromycin은 자극제입니다. 장갑으로 다루십시오.
참고: 퓨로마이신에 대한 세포의 민감도는 다양한 농도의 퓨로마이신을 함유한 권장 배지에서 세포를 배양하여 형질도입 전에 테스트해야 합니다. 하루 후 현미경으로 세포를 확인하십시오. 항생제가 너무 독성이 없고 형질주입된 세포도 죽일 수 있도록 대부분의 세포가 죽었지만 아직 살아 있는 세포는 거의 없는 적절한 농도를 선택하십시오. - 배지를 제거하고 10mL의 PBS로 세포를 헹굽니다.
- 트립신/EDTA 용액 0.25% 1mL를 넣고 플라스크를 37°C에서 5분 동안 배양합니다.
- 배양액 8mL를 추가합니다. 세포 현탁액을 부드럽게 씻어냅니다.
- 100 μL의 세포 현탁액을 수집하고 세포 계수기로 세포 농도를 측정합니다. 60μm 센서가 있는 휴대용 자동 세포 계수기에서 50μL의 세포 현탁액을 흡인합니다.
- 1 셀/웰을 96웰 플레이트에 시드합니다. 예를 들어, mL 당 1 x 10 3 세포의 농도에 대해, 1 / (1 x 103), 즉 웰 당 0.001 mL의 세포 현탁액을 첨가한다. 성공 가능성을 높이기 위해 모든 우물에 씨를 뿌립니다. 웰당 총 부피가 200μL에 도달하도록 배양 배지로 완성합니다.
- 하루 후, 하나의 세포가 들어있는 각 웰을 찾아 형광을 확인하십시오 (λexc = 490 nm 및 λem = 530 nm). 단 하나의 형질주입된 세포를 함유하는 웰을 표시한다. 우물이 거의 합류 할 때까지 며칠 동안 성장을 계속하십시오.
- 배지를 버리고 200 μL의 PBS로 세포를 헹굽니다. 0.25% 트립신/EDTA 용액 100μL를 추가하고 96웰 플레이트를 37°C에서 5분 동안 배양합니다.
- 배지 100μL를 넣고 세포 현탁액을 부드럽게 플러시합니다. 세포 현탁액을 페트리 접시에 옮깁니다. 배지 5mL를 넣고 페트리 접시가 거의 합류할 때까지 세포가 자라도록 합니다.
- 배지를 버리고 5mL의 PBS로 세포를 헹굽니다. 0.25% 트립신/EDTA 용액 1mL를 넣고 페트리 접시를 37°C에서 5분 동안 배양합니다.
- 배지 6mL를 넣고 세포 현탁액을 부드럽게 플러시합니다. 세포 현탁액을 T25 플라스크로 옮깁니다. 플라스크가 거의 합류 할 때까지 며칠 동안 성장을 계속하십시오.
- 배지를 버리고 5mL의 PBS로 세포를 헹굽니다. 0.25% 트립신/EDTA 용액 1mL를 넣고 T25 플라스크를 37°C에서 5분 동안 배양합니다. 1g· 포도당, L-글루타민, 피루브산나트륨 및 중탄산나트륨의 L-1, 10% FBS, 페니실린 100단위·mL-1, 스트렙토마이신 100μg·mL-1로 보충. 세포 현탁액을 부드럽게 씻어냅니다.
- 세포 현탁액을 4개의 T25 플라스크(플라스크당 2mL)로 분할하고 각 플라스크에 5mL의 배지를 추가합니다. 플라스크가 거의 합류 할 때까지 세포가 며칠 동안 자라게하십시오.
- 3개의 플라스크에 대해 2.3.12단계를 반복하고 3.1.3단계의 마지막 플라스크를 유지합니다. 세포 현탁액을 15mL 원뿔형 튜브로 옮기고 150 x g 에서 5분 동안 원심분리합니다. 상청액을 버리고 세포 펠릿을 900 μL로 재현탁한다. 균질한 세포 현탁액을 유지하기 위해 세포를 부드럽게 혼합한다.
- 세포 현탁액을 극저온 저장 바이알로 옮깁니다. 디메틸 설폭사이드 100 μL를 첨가한다. 극저온 난자를 -80°C에서 밤새 두십시오. 추가 실험을 위해 냉동 세포를 액체 질소로 옮깁니다.
참고: 형질주입의 효율은 배지에 5μM 이오노마이신 칼슘염을 추가하고 형광 현미경(λexc = 490nm 및λem = 530nm)에서 유도된 형광 증가를 확인하여 평가할 수 있습니다.
- 형질도입 2-3일 후, 1g· 포도당의 L-1, L-글루타민, 피루브산나트륨, 중탄산나트륨, 10% FBS, 페니실린 100단위·mL-1, 스트렙토마이신 100μg·mL-1 및 퓨로마이신을 보충하여 형질도입되지 않은 세포를 죽입니다. 이 배지에서 세포를 최소 3일 동안 배양합니다.
3.3D 모델
- 스페로이드 문화
- 탈이온수(DI)에 1%(w/v) 아가로오스 용액을 준비합니다.
- 100 mL의 DI 물에 100 g의 아가로스 분말을 첨가하고, 모든 분말이 용해될 때까지 마이크로웨이브 오븐에서 용액을 가열한다. 덩어리를 피하기 위해 용액을 정기적으로 저어줍니다. 용액을 120°C에서 20분 동안 오토클레이브합니다.
- 오토클레이브에서 회수한 후 96웰 플레이트에 웰당 75μL의 아가로스 용액을 조심스럽게 추가합니다. 우물 측면에 증착하여 반월판을 형성하여 접착되지 않는 둥근 바닥을 만듭니다. 실온에서 15분간 굳힌다.
- 단계 2.3.14에서 얻은 플라스크에서 셀을 분리합니다(단계 2.3.12).
- 교모세포종 세포의 웰당 10,000개의 세포를 추가하고 1g· 포도당, L-글루타민, 피루브산나트륨 및 중탄산나트륨의 L-1, 10% 소 태아 혈청(FBS), 페니실린 100단위·mL-1 및 스트렙토마이신 100μg·mL-1로 보충됩니다.
- 플레이트를 이동시키지 않고 37°C에서 3일 동안 세포를 배양한다. 그런 다음 추가 실험이 있을 때까지 2일마다 다중 채널 피펫을 사용하여 배지의 절반을 새 배지로 교체합니다. 피펫 팁을 우물 상부에 보관하여 아가로스 또는 스페로이드 자체의 손상을 방지하십시오.
참고: 스페로이드의 크기는 시딩된 세포의 수와 세포주에 따라 달라지므로 실험에 따라 조정해야 합니다.
- 탈이온수(DI)에 1%(w/v) 아가로오스 용액을 준비합니다.
- in ovo 모델
- 일본 메추라기 (C. japonica)의 수정란을 인큐베이터 (37 ° C 및 57 % 습도)에 2 시간마다 알을 돌리는 자동 회전자가있는 트레이에 놓습니다. 이 날은 배아의 날(ED) 0으로 간주됩니다.
- 플라스틱 계량 보트를 70%(w/v) 에탄올에 넣어 세척합니다. 계량 보트를 꺼내 흄 후드 아래에서 건조시킵니다.
참고: 이 시점부터 실험은 무균 조건에서 수행되지 않습니다. 그러나 배아에 곰팡이가 생기는 것을 막기 위해서는 깨끗한 조건이 필요합니다. - ED3에서 70%(w/v) 에탄올로 미리 세척한 얇은 팁이 있는 핀셋을 사용하여 계란을 부드럽게 엽니다. 배아를 플라스틱 계량 보트에 붓고 다른 계량 보트로 덮고 37°C의 표준 가습 인큐베이터에 3일 동안 넣습니다.
- ED6에서 23G 바늘로 융모막(CAM)을 작게 절개합니다.
- 피펫을 사용하여 절개 부위에 7일 스페로이드를 놓고 추가 실험이 있을 때까지 배아를 3일 동안 인큐베이터로 되돌립니다.
참고: 형광 염료를 배아의 눈에 주입하여 혈관을 시각화할 수 있습니다. - 실험 당일, 미세 조작기를 사용하여 혈관 종양 위에 유연한 프로브를 놓습니다.
- 이 in vivo 모델
참고: 프로토콜의 이 부분은 이전에 참조로 게시된 부분에서 조정되었습니다14. 성인 다색 형광 AMU-Neuroinflam 마우스(B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD)를 사용했습니다. 이 마우스는 Thy1의 하위 집단에 대한 라벨을 제시합니다+ ECFP의 형질전환 발현에 의한 뉴런, 말초 LyzM의 표지+ EGFP의 형질전환 발현 및 Cd11c의 조절하에 EYFP를 발현하는 미세아교세포의 아형의 표지에 의한 염증 세포+. 간단히 말해서, 동물을 치료 또는 주사 전에 2분 동안 1.5% 이소플루란으로 가볍게 진정시킵니다. 수술 전에 동물을 케타민(120mg/kg; IP) 및 자일라진(12mg/kg; IP)입니다. 그런 다음 3% 리도카인 젤을 국소적으로 도포하여 정위 지지의 고정과 관련된 귀의 통증을 완화합니다. 그런 다음 0.25% 부피바카인 용액을 수술 부위에 투여하여 개두술로 인한 통증을 완화합니다. 마우스가 수술을 위해 준비되면 참조에 따라 직경 4mm의 개두술을 수행했습니다14. 26G 바늘로 개두술 중간의 경막에 구멍을 뚫고 참조에 설명된 주사 시스템으로 종양 스페로이드를 주입했습니다14. 추가로, 여기에 기술된 바와 같이, 유리창으로 개두술을 봉합하기 전에 유연한 전극을 GCamp6 또는 DsRed 발현 종양 스페로이드 상에 배치하였다.- Dulbecco의 인산염 완충 식염수(DPBS)를 한 방울 떨어뜨려 개두술을 덮습니다. 유연한 전극을 DPBS 드롭에 놓고 접촉 패드가 있는 프로브 뒷면을 마우스 뒷면에 부드럽게 놓습니다(그림 4B).
알림: 멸균 장갑과 "팁만" 기술을 사용하십시오. 멸균되지 않은 표면이 접촉한 경우 장갑을 교체하십시오. 이 절차 중에 열 지원을 제공합니다. - 프로브가 경막에 평평하게 놓이고 뇌의 곡률을 따를 수 있을 때까지 DPBS를 흡수하기 위해 작은 종이 조각으로 DPBS 방울을 만집니다. DPBS의 작은 층이 전극 측면에서 빠져나가지 않고 전극 아래에 남아 있는지 확인합니다. 이렇게 하면 다음 단계에서 접착제 유출을 방지할 수 있습니다.
알림: 사용하기 전에 모든 장비를 소독하십시오. - 실리콘 접착제를 프로브에 작은 방울로 떨어뜨리고 5mm 원형 커버 유리로 덮습니다. 실리콘이 고르게 분포되고 커버 유리와 프로브 사이의 거리가 최소화될 때까지 커버 유리를 아래로 누릅니다. 실리콘이 굳을 수 있도록 커버 유리를 30초 더 아래로 누릅니다.
- 커버 유리를 고정하려면 측면에 초강력 접착제를 빠르게 바르고 접착제가 단단해질 때까지 아래로 누릅니다.
- 이쑤시개를 사용하여 프로브의 목에 초강력 접착제를 바르고 초강력 접착제가 목 아래로 당겨져 안정적으로 지지되도록 합니다.
- 두개골을 치과 용 시멘트로 덮어 만성 캡을 만듭니다. 커버 유리의 가장자리만 덮도록 특별히 주의하십시오.
- 프로브 뒷면을 들어 올리고 프로브 목 아래에 시멘트를 바릅니다. 경화되기 전에 프로브를 시멘트 위에 올려 놓으십시오. 뭉툭한 집게로 프로브의 목을 부드럽게 눌러 표면이 커버 유리와 같은 높이가 되도록 하고 실험 중에 현미경 대물렌즈를 방해하지 않도록 합니다.
- 프로브 넥의 상단을 1.5mm 이하의 치과용 시멘트 층으로 덮어 프로브를 단단히 고정합니다. 커버 유리 주위에 1-2mm의 거리에 1.5mm 융기를 나타내는 시멘트 웰을 만들어 이광자 이미징을 위한 침지 유체를 위한 분지를 만듭니다(그림 4C).
- 시멘트가 경화된 후 부프레노르핀 수술 후 진통제(체중 10g당 0.05mg/kg, 0.1mL를 피하주사)를 바르고 동물이 깨어날 때까지 따뜻한 분위기에서 유지합니다. 여기에는 적외선 전구에 근접하고 동물을 종이 타월로 감싸는 것이 포함됩니다.
알림: 체온계를 마우스 높이에 놓아 온도를 모니터링합니다. - 전위차 조절기를 사용하여 1-10kHz 범위의 임피던스를 특성화합니다.
- 동물이 적어도 10 일 동안 수술에서 회복되도록하십시오. 수술 직후 항염증제를 투여하고 동물의 상태를 계속 모니터링하여 적절한 수술 후 진통을 제공합니다.
- Dulbecco의 인산염 완충 식염수(DPBS)를 한 방울 떨어뜨려 개두술을 덮습니다. 유연한 전극을 DPBS 드롭에 놓고 접촉 패드가 있는 프로브 뒷면을 마우스 뒷면에 부드럽게 놓습니다(그림 4B).
4. 펄스 전기장(PEF) 전달 및 이미징
- 표본을 형광 현미경 아래에 놓습니다. 3D 모델의 경우 종양은 위에서만 관찰 할 수 있습니다.
참고: in ovo 모델의 경우 epifluorescence microscope(이광자 현미경으로도 가능)에서 실험을 수행한 반면, in vivo 모델의 실험은 이광자 현미경으로 수행했습니다(그림 6). - 포고 핀 커넥터(in vitro) 또는 악어 클립(in vivo 및 in vivo)을 사용하여 펄스 발생기를 장치의 접촉 패드에 연결합니다(그림 4A). 원하는 매개변수(펄스 수, 전압, 펄스 지속 시간, 주파수)를 설정하고 발전기를 실행하여 PEF를 적용합니다(그림 4A). 형광을 동시에 측정하여 PEF의 효과를 실시간으로 관찰할 수 있습니다.
결과
이 프로토콜을 사용하면 유연한 PEF 전달 시스템이 통합된 두 개의 교모세포종 모델에 적용할 수 있습니다. 미세 가공 및 패키징 단계에 따라 유연한 전극은 성능을 평가하고 검증하기 위해 전기화학적 임피던스 분광법(EIS)에 의해 식염수에서 특성화됩니다. pedot:PSS 코팅 전극은 차단 주파수로 분리된 일반적인 정전 용량 및 저항 지배 영역을 보여주는 반면, 코팅되지 않은 전극은 정전 용량 거동만 표시합니다(그림 2).
액체 오버레이 96웰 플레이트 방법의 변형은 형광 세포내 칼슘 리포터를 안정적으로 발현하는 형질주입된 교모세포종 세포로 이루어진 3D 종양을 성장시키는 데 사용됩니다. 스페로이드의 성장은 명시야 현미경으로 관찰할 수 있습니다(그림 3; ED 0)입니다. 구형 및 조밀한 스페로이드를 얻기 위해서는 최소 2일 또는 3일이 필요하며, 이는 세포주와 파종된 세포의 수에 따라 다릅니다.
in ovo 모델에서 스페로이드는 메추라기 배아의 융모막에 이식됩니다(그림 3; ED 6)입니다. 이식편의 성공 여부는 며칠 후 형광 현미경으로 평가할 수 있는데, 살아있는 세포는 세포 내 칼슘을 가지고 있어 형광을 띠기 때문입니다(그림 3; ED 9)를 참조하십시오. 종양의 혈관 형성은 형광 염료를 혈관에 주입하여 형광 현미경으로 관찰할 수 있습니다(그림 3; ED9)입니다. 그러나 스페로이드가 매우 조밀하기 때문에 종양 내부의 혈관을 시각화하는 것이 항상 가능한 것은 아닙니다. 유연한 interdigitated 전극은 혈관 종양 위에 배치됩니다(그림 3; ED9)를 펄스 발생기에 연결한다. 탐침은 배아의 출혈을 피하기 위해 부드럽게 놓아야 합니다. 그렇지 않으면 형광 염료가 퍼져 이미징에 의한 관찰을 방해할 수 있습니다. 생물학적 환경으로의 펄스의 올바른 전달은 회로를 통과하는 전류를 측정하여 확인할 수 있습니다. OVO 모델에서 이들의 이미징을 통해 3D 교모세포종 종양에서 세포내 칼슘에 대한 PEF의 효과와 종양의 혈관 구조에 유도된 혈관 수축을 실시간으로 모니터링할 수 있어 면역 체계를 포함한 다른 세포 유형의 영향을 피할 수 있습니다15.
교모세포종에 대한 PEF 효과에 대한 연구는 또한 보다 완전하고 예측 가능한 모델에서 수행될 수 있다. 실제로, 상술한 생체내 모델(14 )은 마우스의 뇌 실질에 3차원 교모세포종 종양을 이식하는 것으로 구성된다(도 4). 종양의 주사 부위는 가교결합된 덱스트란 겔 헤미비드에 의해 막혀, 종양의 성장 동안 생리학적 생물물리학적 제약을 요약한다. 참고문헌14에 기재되어 있지만, 덱스트란 헤미비드가 경질막에 정확하게 초접착되는 것이 매우 중요하다는 것을 다시 강조할 가치가 있다; 그렇지 않으면 종양이 열린 경막을 통해 빠져나와 뇌를 완전히 덮어 영상 촬영이 불가능할 수 있습니다. 모든 만성 영상의 경우 두개골 창이 치유될 때 발생하는 조직 성장은 새로운 조직이 불투명하고 이미지를 흐리게 하거나 사용할 수 없게 만들기 때문에 심각한 장벽이 됩니다. 따라서 반구슬을 삽입하고 접착한 후 열린 두개골 창의 측벽은 초강력 접착제가 미끄러지거나 경막으로 흐르지 않도록 캐비티 벽 전체에 세심하게 배치된 얇은 초강력 접착제 층으로 밀봉해야 합니다. 플렉시블 프로브를 종양 주사 부위 위에 놓으면 두 가지 이유로 프로브 아래에 기포가 머무를 수 없습니다. 첫째, 기포가 있으면 이미징을 진행할 수 없습니다. 둘째, 기포는 절연체 역할을 하여 전기 자극 특성을 변화시킵니다. 위에서 설명한 예방 조치를 취한 후 개두술은 두개골에 접합된 유리창으로 밀봉되어 몇 주에 걸쳐 만성 영상이 가능합니다. 종양은 GCaMP 또는 DsRed 발현 세포로 구성되어 있으므로 형광 현미경으로 주사를 확인할 수 있습니다. 전극의 전기화학적 임피던스는 주입 후 성능을 검증하기 위해 측정되어야 합니다. 식염수의 임피던스와 비교할 때, 생물학적 환경의 존재로 인해 100Hz 이상의 주파수에서 생체 내에서 임피던스의 증가가 예상됩니다(그림 5). 혈관화된 신경 실질 및 종양 침윤은 이광자 현미경으로 몇 주에 걸쳐 투명 기질을 통해 관찰 및 특성화할 수 있습니다(그림 6). 관심 세포 (면역 세포 및 뉴런)에서 형광 단백질을 발현하는 형질전환 동물의 사용은 예를 들어 전극 이식 단독에 의해 유도된 최소 염증 과정의 입증을 허용하거나(도 6A) 성장하는 GBM 종양의 상부에 이식된 PEF 자극 전극의 이식 후 26일 후에 미세아교세포 및 단핵구의 존재를 보여줄 수 있다 (도 6B1 ). 후자의 경우, 말초-단핵구 유래 세포 및 뇌-상주 소교세포 둘 다 종양 주위 및 내부에서 발견되었다(도 6B2). PEF 전달 당일, 플렉시블 전극의 접촉 패드는 이광자 현미경 아래에서 직접 펄스 발생기에 연결할 수 있습니다. 전반적으로, 이 모델은 최대 약 500μm 깊이까지 뇌종양 발달에 관여하는 다양한 유형의 세포를 사용하여 시간 경과에 따른 생체 전기 치료의 효과를 조사하는 데 사용할 수 있습니다.
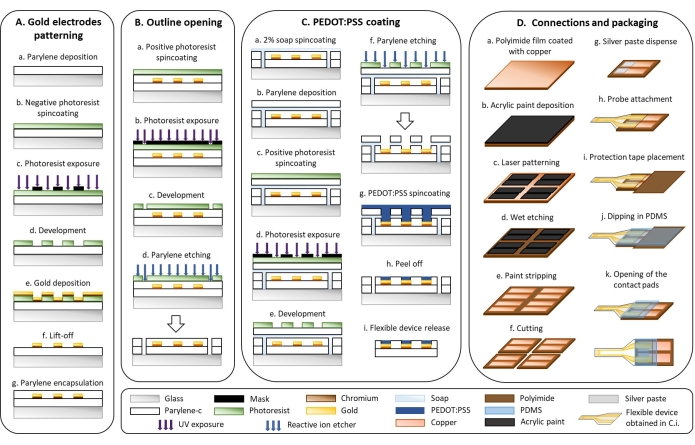
그림 1: 플렉시블 전극의 미세 가공 . (A) 금 전극 패터닝 및 파릴렌 C 기판. (B) 개관 개구부. (C) pedot : PSS 코팅. (D) 연결 및 포장. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
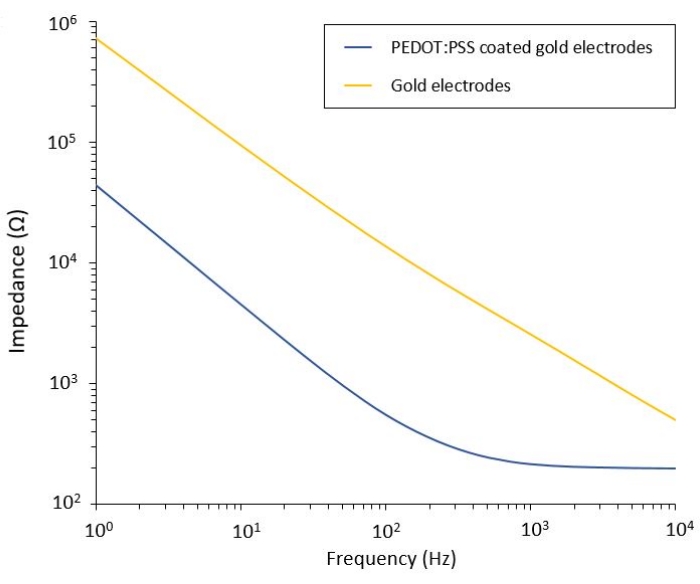
그림 2: 식염수에서 유연한 금 전극과 pedot:PSS 코팅된 저온 전극의 전기화학적 임피던스 분광법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
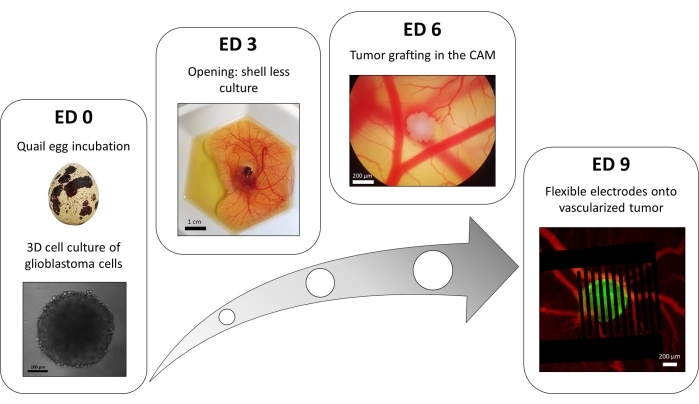
그림 3: 교모세포종의 내 난소 모델. ED 0: 명시야 현미경으로 관찰한 스페로이드. ED 3 : 개봉 후 3 일 동안 메추라기 배아의 껍질을 벗기지 않는 배양. ED 6: 명시야 현미경으로 관찰한 CAM에 이식된 종양. ED 9: 혈관화된 종양(녹색의 종양과 빨간색의 혈관)에 배치된 유연한 장치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
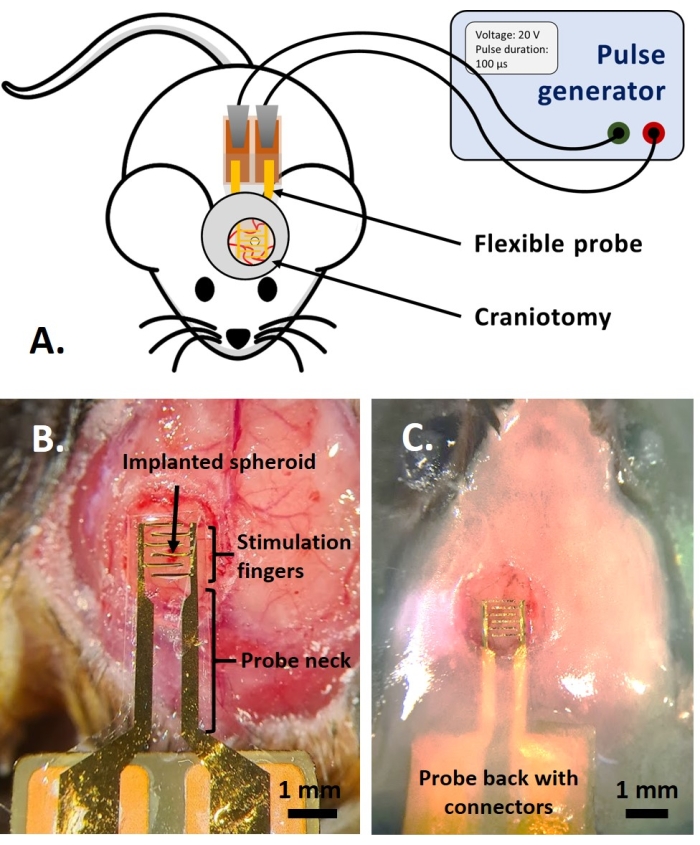
도 4: 생체 내 적용 . (A) 생체 내 실험을 위한 반응식. (B) 커버 유리와 아크릴 수지를 적용하기 전에 프로브 배치. (C) 프로브 이식 완료. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
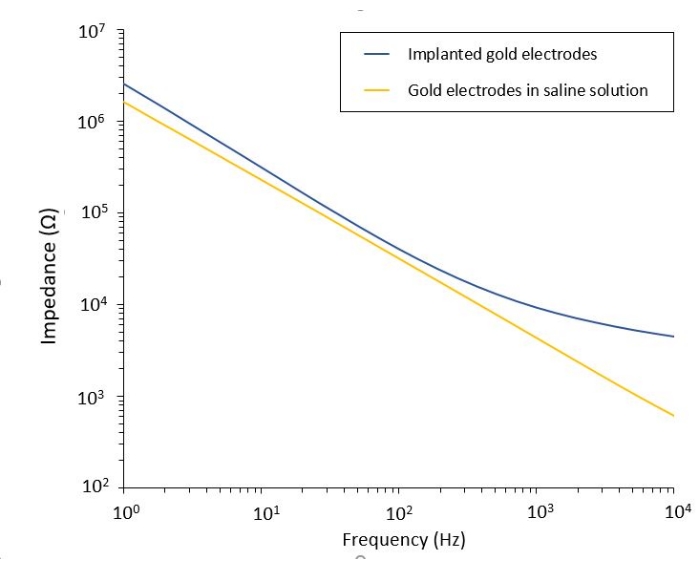
그림 5: 식염수 용액에서 이식된 프로브와 비교한 유연한 금 전극의 전기화학적 임피던스 분광법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
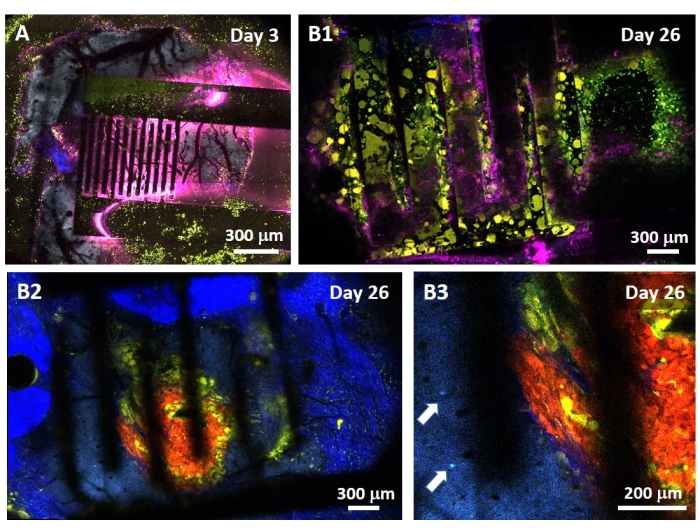
그림 6: 전극을 통한 생체 내 다분광 이광자 이미징 . (A) 전극 이식 3일 후 대조군 다형광 AMU-Neuroinflam 마우스에서 건강한 뇌 표면의 타일 이미지. 청록색은 5층 피라미드 뉴런의 수지상 수목화를 보여주고, 녹색은 모집된 과립구와 단핵구를 보여주며, 노란색은 활성화된 미세아교세포와 수지상 세포를 나타냅니다. 분홍색은 열 축적으로 인한 적외선 확산을 나타냅니다. (나1) A 에서와 유사한 이미지이지만 종양 스페로이드 이식 후 26일 후 피질 내부 200μm 깊이에 전극 이식 직후. 녹색과 노란색 면역 세포의 축적에 주목하십시오. (나2) B1 과 유사한 이미지이지만 전극 표면 아래 100μm입니다. 황색 미세 아교 세포와 수지상 세포에 의해 침윤 된 적색 종양 덩어리 자체의 주변에 청색 신경 수지상 수목이 존재한다는 점에 유의하십시오. 진한 파란색은 주위 콜라겐의 두 번째 고조파 신호를 나타냅니다. (나3) 종양 부근에 뉴런 소마(화살표로 표시)의 존재를 보여주는 B2 의 확대된 보기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 연구에서 설명된 접근 방식을 통해 통합 PEF 전달 시스템을 갖춘 뇌종양 모델은 다양한 수준의 생물학적 조직에서 PEF의 효과를 연구할 수 있습니다. 미세 가공 프로토콜은 표준 박막 공정으로 구성되며, 이는 특정 응용 분야에 적용할 수 있는 전극 설계에서 큰 자유를 제공합니다. 때때로, 추가적인 열 어닐링 단계는 제조 동안 발생한 전극의 굽힘을 감소시키기 위해 제조의 끝에서 유용할 수 있다.
형광 칼슘 지시약을 발현하는 안정한 교모세포종 세포주를 사용하면 특히 밀도가 매우 높은 3D 종양에서 염료 전달 및 유지와 관련된 모든 합병증을 피할 수 있다16. 실제로, 높은 발현 수준은 표준 화학 형광 칼슘 지시약에 비해 장기간에 걸쳐 관찰된다17. 이 프로토콜은 신경 활동을 영상화하는 데 일반적으로 사용되기 때문에 다양한 세포주에 적용될 수 있습니다11. 여기서, 인간 및 쥐 세포주를 사용하였다 (각각 면역결핍 또는 면역적격 마우스에의 이식을 위한 U87 및 Gl261). 실제로, 최근 연구에 따르면 U87 세포주는 수년간의 세포 배양을 통해 많은 돌연변이가 획득되어 실험 재현성에 영향을 미치기 때문에 원래 세포의 세포주와 다릅니다18. 3D 종양의 제조에 사용되는 방법은 처리량이 높고 재현성이 높으며 세포주, 파종 시 세포 수 및 성장 시간19에 따라 특정 크기의 스페로이드를 생성할 수 있습니다. 그러나 이러한 스페로이드는 밀도가 높기 때문에 종양의 핵심을 이미징할 때 단점이 있습니다.
in ovo 모델은 뇌에 존재하는 다른 세포 유형과의 상호 작용 없이 3D 종양 및 혈관 구조에 대한 PEF의 효과를 연구하기 위한 첫 번째 접근 방식으로 유용합니다. 이 모델은 저렴하고 빠르며 처리량이 높으며 동물 모델보다 윤리적 문제가 적습니다. 배아의 생존과 이미징의 품질에 영향을 미칠 수 있으므로 전체 실험에서 배아의 무결성을 유지하는 것이 중요합니다. 배아 막의 손상을 피하기 위해 메추라기 알을 여는 동안 특별한주의를 기울여야합니다. 배아를 죽일 수 있는 출혈을 피하기 위해 유연한 전극의 이식 및 배치도 신중하게 수행해야 합니다. 혈관에 형광 염료를 주입하면 형광 현미경으로 종양 세포와 혈관 형성을 동시에 시각화 할 수 있습니다. 안내 주사는 배아 액체로 염료가 누출되는 것을 방지하기 위해 신중하게 수행해야 하며, 이는 배경에 잔류 형광을 일으켜 이미징 품질을 저하시킬 수 있습니다. 이 모델은 순환계에 접근 할 수 있기 때문에 약물 섭취 후에도 사용할 수 있습니다. 그러나, 실험은 배아의 12일 생존 시간에 의해 제한되고, 따라서 7일의 관찰이 허용되며, 이는 생체 내 모델21보다 현저히 짧다.
생체 내 뇌종양 모델은 동물이 갑작스런 20 % 체중 감소에 의해 결정된 윤리적 실험 종점에 도달하기 전에 4-5 주 동안 모니터링 할 수 있습니다. 내약성이 좋으며 전극의 연결 꼬리가 너무 길지 않으면 제자리에 유지됩니다. 그렇지 않으면 동물이 뒤집는 커넥터를 긁는 경향이 있어 궁극적으로 찢어질 수 있으므로 자극기에 대한 후속 연결을 방지할 수 있습니다. 그럼에도 불구하고 이 4주 기간은 교모세포종 발달의 여러 단계를 다루는 데 가치가 있습니다. 상이한 시간 간격에서 동일한 관심 부피의 종양 세포 밀도를 비교할 때, 종양 성장 동역학의 진화가 관찰될 수 있다. 특히, 강화된 종양 성장은 면역스위치22시에 관찰되었다. 자극 전극이 있는 상태에서 유사한 연구는 종양 증식 속도와 면역 제거에 대한 종양 민감도에 대한 PEF의 효과에 대해 알려줄 것입니다. 생체 내 모델과 비교하여 생체 내 모델은 종양 진행에 대한 면역 세포의 영향과 PEF의 치료 효과에 대한 기여도를 연구하는 데 유용한 전임상 모델로 볼 수 있습니다. 이 프로토콜은 두개골 창(14)을 배치하기 전에 종양에 유연한 전극 장치를 추가한 이전 기사에서 채택되었습니다. 종양의 급성 및 만성 생체 전기 치료는 초기 자극이 세포 사멸을 유도하고 면역 반응의 지속적인 조절 장애를 유발할 것으로 예상된다는 점을 감안할 때 이광자 현미경을 사용한 직접 및 후속 관찰로 특징지을 수 있습니다.
플렉시블 프로브의 연결은 이광자 현미경으로 쉽게 접근할 수 있습니다. 따라서 전기 자극 매개변수는 의사가 환자의 MRI 또는 CT 이미지를 관찰하는 동안 중재적 절차를 수행하는 방법과 유사하게 신경 조직 및/또는 표적 세포에 대한 관찰된 효과를 기반으로 실시간으로 조정될 수 있습니다. 마지막으로 고려해야 할 사항은 조직 재성장을 방지하기 위해 초강력 접착제와 실리콘 접착제로 뇌의 전극을 조심스럽게 밀봉하는 것이 중요하다는 것입니다.
결론적으로, 여기에 설명된 프로토콜은 교모세포종 종양 모델에 대해 유연한 유기 폴리머 전극을 사용한 PEF 요법의 효과를 연구하기 위한 혁신적인 모델을 나타냅니다. 두 모델은 작용 메커니즘을 더 잘 이해하기 위해 세포, 혈관 또는 면역 효과를 분리할 수 있도록 서로 다른 수준의 복잡성을 나타냅니다. 등각 표면 전극은 의원성 손상을 줄이는 동시에 종양 미세 환경의 파괴를 가능하게 하여 혈관 수축 또는 세포 내 칼슘 조절 장애를 유발합니다15.
공개
저자는 경쟁하는 재정적 이익이 없다고 선언합니다.
감사의 말
여기에 보고된 작업은 프랑스 국립 연구 기관(ANR-18-CE19-0029)의 지원을 받았습니다. 저자들은 안정적인 GCaMP6f 세포주 생성에 기여한 S.M. Bardet과 in ovo 모델에 도움을 준 D. O'Connor에게 진심으로 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
참고문헌
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유