JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
혈관화된 복합 동종이식편 생명공학 연구를 위한 신뢰할 수 있는 돼지 근막-피부 피판 모델
요약
본 프로토콜은 돼지 근막-피부 피판 모델과 혈관화된 복합 조직 연구에서의 잠재적 용도를 설명합니다.
초록
손, 얼굴 또는 음경 이식과 같은 혈관 복합 동종 이식편 (VCA)은 재건 사다리의 첫 번째 단계에서 실패한 치명적인 피부 결함에 대한 최첨단 치료법을 나타냅니다. 유망한 미적 및 기능적 결과에도 불구하고, 주요 제한 요소는 과감하게 적용되는 평생 면역 억제와 잘 알려진 의학적 위험의 필요성으로 남아 있어 더 넓은 적응증을 예방합니다. 따라서 VCA의 면역 장벽을 높이는 것은 윤리적 척도를 높이고 가장 진보 된 수술 기술을 사용하여 환자의 삶의 질을 향상시키는 데 필수적입니다. 환자 특이적 이식 편의 새로운 생성 은 재건 이식에서 다가오는 돌파구입니다. 조직 공학 기술을 사용하여 VCA는 기증자 세포를 제거하고 관류-탈세포화-재세포화를 통해 수혜자에 맞게 맞춤화할 수 있습니다. 이러한 신기술을 개발하기 위해서는 대규모 동물 VCA 모델이 필요합니다. 따라서 피부, 지방, 근막 및 혈관으로 구성된 돼지 근막 피부 플랩은 VCA의 예비 연구에 이상적인 모델입니다. 그럼에도 불구하고, 문헌에 기술된 대부분의 VCA 모델은 근육 및 뼈를 포함한다. 이 연구는 다양한 연구 분야, 특히 혈관 화 된 복합 조직 공학을위한 실용적인 도구 인 돼지의 복재 근막-피부 피판 수확을위한 신뢰할 수 있고 재현 가능한 기술을보고합니다.
서문
혈관 화 된 복합 동종 이식편 (VCA)은 손, 얼굴 및 음경 1,2,3과 같이 수리하기 어려운 신체 부위 손실의 치료에 혁명을 일으켰습니다. 불행히도, 첫 번째 장기 결과4는 고용량의 면역억제제를 평생 투여하면 당뇨병, 감염, 종양 및 리노 혈관 기능 장애5를 포함한 심각한 부수적 인 의학적 상태로 이어질 수 있음을보여주었습니다. 최근 전문 VCA 팀은 이식 손실로 이어지는 만성 거부 반응의 위험을 관리하고 첫 번째 얼굴 재 이식 사례 6,7을 수행해야했습니다. VCA에서 면역억제의 한계를 극복하기 위해 다양한 전략이 설명되었습니다. 첫 번째는 동종 이식편 수용자 8,9에서 면역 혼합 키메라 상태를 유도하여 장기 이식 내성을 확립하는 데 의존합니다. 두 번째는 조직 공학을 통한 환자 특이적 이식편의 새로운 생성을 포함합니다.
최근에, 생물학적 조직의 관류 탈세포화는 천연 세포외 기질(ECM) 스캐폴드를 생성하여, 전체 장기(10)의 혈관 네트워크 및 조직 구조의 보존을 가능하게 한다. 따라서 수용자 특이적 세포로 이러한 ECM을 재세포화하면 면역 제약이 없는 맞춤형 이식편이 생성됩니다. VCA 생명공학에 대한 연구에서, 다수의 팀들이 탈세포화하여 전체 아키텍처(11,12,13)를 보존하는 그러한 ECM을 획득하였다. 그러나 재 세포 화 과정은 여전히 도전적이며 대형 동물 모델14,15에서는 성공하지 못했습니다. 이러한 획기적인 기술을 개발하려면 신뢰할 수 있고 재현 가능한 대형 동물 복합 조직 모델이 필요합니다. 돼지 모델은 돼지 피부가 인간 피부16에 가장 가까운 해부학 적 및 생리 학적 특성을 나타내기 때문에 생명 공학 발달 파이프 라인에서 최고의 선택을 나타냅니다. 근막-피부 피판(FCF)의 사용은 '맞춤형' 혈관화된 복합 조직 이식편을 만들기 위한 첫 번째 단계에서 이상적입니다. 실제로 FCF는 피부, 지방, 근막 및 내피 세포를 포함하는 기본 VCA 모델입니다. 돼지 근피판17 및 골근피부 피판18에 대한 설명은 문헌에서 찾을 수 있다. 그럼에도 불구하고 근막 피부 플랩 수확 기술에 대한 초점이 부족합니다.
따라서이 연구는 연구자에게 돼지 복재 FCF 조달 기술에 대한 자세한 설명을 제공하고 많은 연구 분야, 특히 혈관 화 복합 조직 공학에서 사용하기 위해 플랩의 모든 특성을 묘사하는 것을 목표로합니다.
프로토콜
모든 동물은 실험실 동물의 관리 및 사용에 대한 국립 보건원 가이드에 따라 인간의 보살핌을 받았습니다. 기관 동물 관리 및 사용위원회는 실험 프로토콜 (IACUC- 프로토콜 #2020N000015)을 승인했습니다. 7 마리의 암컷 요크셔 돼지 (20-25 kg)가 모든 실험에 사용되었습니다.
1. 수술 전 관리
- 수술 12 시간 전에 단단한 음식을 위해 동물을 금식하십시오.
- 4.4 mg / kg의 Telazol, 2.2 mg / kg의 자일 라진 및 0.04 mg / kg (IM)의 아트로핀 설페이트로로 동물을 진정시킵니다 ( 재료 표 참조).
- 18G의 말초 정맥 카테터를 귀 정맥에 넣습니다.
- 적절한 기관 내 튜브 (10-200 kg 돼지의 경우 6-15 mm를 사용할 수 있음)로 돼지를 삽관하고 튜브를 인공 호흡기에 연결하십시오. 부 프레 노르 핀 (0.05 mg / kg, IM)으로 수술 전 진통제를 투여하십시오 ( 재료 표 참조).
2. 수술 중 모니터링
- 1.5 L / min 산소 흐름과 3 % 이소 플루 란의 흡입 혼합물로 마취를 유지하십시오.
- 심박수, 맥박 산소 측정법 및 호기말CO2를 지속적으로 모니터링합니다. 5 분마다 혈압과 체온을 평가하십시오.
알림: 심박수의 목표 범위는 90-100 회 / 분이고 산소 포화도는 93 %보다 높아야하며 호기말 CO 2 범위는 CO2의 5 % -6 % 사이입니다. - 60mmHg와 90mmHg 사이의 평균 동맥압을 조절하기 위해 시술 전반에 걸쳐 시간당 5-10mL/kg 0.9% 식염수를 투여합니다.
3. 양측 복재 FCF 조달
- 동물을 앙와위 자세로 두십시오. 사타구니와 뒷다리를 면도하고 문지르고 수술 부위의 뒷다리 전체를 포함하고 멸균 방식으로 드레이프합니다.
- 복재 동맥의 맥박을 슬개골 내측 ~ 3 손가락 너비로 촉지하고 태그를 지정합니다.
- 플랩의 한계를 식별하고 그립니다.
참고: 상위 한계는 그 아래 3cm의 사타구니 주름과 평행한 축입니다. 측면 한계는 전방 상장골 척추에서 슬개골의 내측 부분까지의 축입니다. - 복재 척추를 중심으로 직경 10cm의 타원형 플랩을 그리고 앞서 설명한 플랩 한계에 포함됩니다 (3.3 단계).
- 플랩 랜드 마크에서 척추의 말단 부분에 대해 1.5cm 피부 절개를하십시오.
- 근막과 무딘 해부를 열어 복재 동맥과 두 개의 정맥 코미 탄트를 노출시킵니다. 이중 합자를 수행하고 하나의 번들로 분리하십시오.
- 칼날로 플랩의 나머지 피부를 절개하십시오.
- 소작을 사용하여 피하 조직과 주변 근막을 엽니 다. 양극성 겸자를 사용하여 철저한 지혈을 수행하십시오 ( 재료 표 참조).
- 플랩의 피부 구성 요소를 3-0 비 흡수성 봉합사로 기본 근막에 부착하여 부주의 한 견인 및 천공 혈관의 파손을 방지하십시오.
- 근막을 근육에서 멀리 해부하여 gracilis에서 플랩을 자유롭게하십시오.
알림: 복재 척추의 말단 부분은 gracilis 근육과 근막 사이의 평면에서 실행됩니다. 측면 가지의 적절한 긴장과 신중한 양극성 지혈은 척추 박리를 용이하게하는 중요한 요소입니다. - 메스를 사용하여 사타구니 주름을 12cm 절개하십시오. 사타구니 주름을 플랩의 근위 부분에 연결하는 수직 절개를 수행하십시오. 연결 피부를 들어 올리고 소작을 사용하여 피하 층을 엽니 다.
- 복재 혈관을 따라 대퇴 혈관쪽으로 내려가 척추 해부를 계속하십시오.
알림: 복재 척추의 근위 부분은 근육 간 중격을 통과하거나 gracilis 근육으로 다이빙 할 수 있습니다. - 대퇴 혈관을 골격화하고 두 개의 별도 묶음으로 복재 가지에 멀리 결석시킵니다. 사타구니 인대 수준에 도달 할 때까지 대퇴 혈관의 해부를 원위부에서 근위부로 계속하십시오. 양극성 겸자를 사용하여 소작 또는 혈관 클립과 2-0 실크 넥타이를 사용하여 깊은 대퇴 혈관을 닦은 다음 자릅니다.
알림: 혈관을 절단하기 전에 혈관 클립을 사용할 수도 있습니다. - 반대쪽 뒷다리에서 3.2-3.13 단계를 반복하여 두 번째 복재 플랩을 수확합니다.
- 3.16 단계 5 분 전에 정맥 내 (IV) 헤파린 주사 (100 IU / kg)로 동물을 헤파린화합니다.
- 대퇴 척추 (동맥 및 정맥)를 가능한 한 사타구니 인대에 근접하고 기증자 돼지에서 플랩을 분리하십시오.
- 대퇴 혈관 끝을 확장시키고 동맥과 정맥 모두에 20G 혈관 카테터를 삽입합니다. 3-0 실크 타이를 사용하여 카테터를 혈관에 고정하십시오.
- 명확한 정맥 유출이 관찰 될 때까지 10mL의 헤파린 식염수 (100IU / mL)로 근막 피부 피판 동맥을 천천히 씻어냅니다 (그림 1).
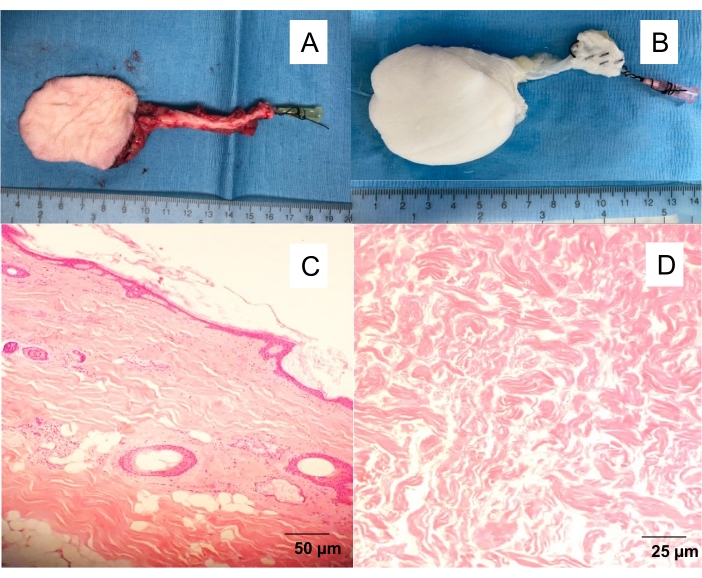
그림 1 : 네이티브 및 탈 세포 화 된 복재 근막-피부 피판. (A) 대퇴 동맥에 삽입 된 20G 혈관 카테터가있는 격리 된 피부 플랩으로 혈액에서 플랩을 씻고 다른 실험 (혈관 조영술, 관류 탈세포화)을 진행할 수 있습니다. (B) 탈세포 화 된 피부 플랩. 관류 탈세포화는 세제 관류 10일 후 흰색의 무세포 스캐폴드를 생성합니다. H & E 염색 된 (C) 네이티브 스킨 플랩 및 (D) 탈세포 화 된 스킨 플랩의 전체 두께 단면. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 페노바르비탈 나트륨 (100 mg / kg)의 IV 주사로 동물을 안락사시킵니다. 심장 박동 및 호흡 운동이없는 경우 사망을 확인하십시오.
결과
살아있는 동물에 대한이 연구는 3 개의 사체 표본에서 복재 천공체를 결정하는 것으로 선행되었습니다 (그림 2). 착색 된 충전 용액을 복재 동맥에 주입하여 동맥에서 나오는 특정 혈관 네트워크를 불투명하게했습니다. 용액은 10mL의 희석제와 혼합 된 10mL의 청색 글리세린 제로 구성됩니다 ( 재료 표 참조). 이것은 복재 동맥에 의해 혈관 화 된 피부의 색지도를생?...
토론
이 기사는 돼지 뒷다리에서 수확 한 신뢰할 수 있고 재현 가능한 근막 피판에 대해 설명합니다. 이 단계별 수술 프로토콜을 따르면 2 시간 이내에 한 마리의 동물에게만 두 개의 플랩을 조달 할 수 있습니다. 수술의 가장 중요한 단계는 gracilis 근육 섬유 내에서 혈관 척추의 골격화이며, 숙련 된 외과 의사의 철저한 해부가 필요합니다. 피부 봉합사를 사용하여 피부를 근막에 고정하는 것은 천공기?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 슈라이너스 아동 병원 보조금 #85127(BEU 및 CLC) 및 #84702(AA)의 자금 지원을 받았습니다. 저자는 "Gueules Cassées"재단이 그 프로젝트에 참여한 동료들에게 급여를 지원해 준 것에 대해 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
참고문헌
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유