JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
클라미도모나스 라인하르티이에서 파괴된 세포 모델의 재활성화
요약
운동성 세포의 시험관내 재활성화는 세포 운동성의 메카니즘을 이해하는 데 있어서 중요한 실험이다. 이 프로토콜은 실리아 / 편모를 연구하는 모델 유기체 인 Chlamydomonas reinhardtii의 탈상 된 세포 모델을 다시 활성화하는 것을 설명합니다.
초록
Szent-Györgyi가 20 세기 중반에 입증 한 ATP를 추가하여 글리세린 화 된 근육의 수축에 대한 역사적인 실험 이후, 탈embranated 세포의 시험관 내 재활성화는 세포 운동성을 조사하는 전통적이고 강력한 방법이었습니다. 이 실험 방법의 근본적인 이점은 재활성화 용액의 조성이 쉽게 변경될 수 있다는 것이다. 예를 들어, 생체 내에서 막 여기로 인해 일시적으로 발생하는 높은Ca2+ 농도 환경은 실험실에서 복제될 수 있다. 진핵 섬모 (일명 편모)는 규제 메커니즘이 여전히 명확 해져야하는 정교한 운동성 기계입니다. 단세포 녹색 alga Chlamydomonas reinhardtii는 섬모의 연구 분야에서 우수한 모델 유기체입니다. C. reinhardtii의 탈embranated 세포 모델과 단리된 섬모의 탈입된 축삭과 같은 이들의 유도체를 사용한 재활성화 실험은 섬모 운동성의 분자 메커니즘을 이해하는 데 크게 기여하였다. 이러한 실험은 ATP가 섬모 운동성에 활력을 불어 넣고Ca2+, cAMP 및 반응성 산소 종을 포함한 다양한 세포 신호가 섬모 운동을 조절한다는 것을 분명히했습니다. C. reinhardtii 세포의 탈형 및 세포 모델의 재활성화를 위한 정확한 방법이 여기에 기술되어 있다.
서문
탈embranated 운동성 세포의 시험관내 재활성화는 세포 운동성의 조절 메카니즘에 대한 분자 기초를 연구하기 위한 유용한 도구이다. Szent-Györgyi는 아데노신 트리포스페이트(ATP)1를 첨가하여 50% 글리세롤로 추출한 토끼 골격근 섬유의 시험관내 수축을 처음으로 입증했습니다. 이 실험은 ATP가 근육 수축에 활력을 불어 넣는다는 것을 증명한 최초의 실험이었습니다. 이 방법론은 곧 정자 편모2, Paramecium cilia3 및 Chlamydomonas reinhardtii cilia (편모라고도 함)4와 같은 ATP 에너지 섬모 / 편모 운동성에 대한 연구에 적용되었습니다 demembranation을위한 비 이온성 세제를 사용합니다.
단세포 녹색 알가 C. reinhardtii는 섬모를 연구하기위한 모델 유기체입니다 : 그것은 인간의 가슴 스트로크처럼 그들을 때려 두 섬모로 수영합니다 5. 섬모 운동은 마이너스 엔드 지향 미세 소관 기반 모터 단백질 6,7 인 dynein에 의해 구동됩니다. 섬모 다이닌은 바깥쪽 팔 다이닌과 안쪽 팔 다이네인으로 분류 할 수 있습니다. 각 종류의 다이닌이 결여된 돌연변이체는 서로 다른 운동성 이상을 갖는 느린 수영 돌연변이체로서 단리되었다. 이들 돌연변이체의 상세한 시험관내 운동성 분석은 상당히 진보된 다인 연구8을 갖는다.
탈embranated C. reinhardtii 세포 (세포 모델)의 시험관내 재활성화 실험이 확립 된 이래로이 방법 및 그의 유도체를 활용하여 많은 중요한 발견이 달성되었습니다. 일련의 Ca2+ 완충제에서 세포 모델의 재활성화는, 예를 들어,2개의 섬모가 서브마이크로몰Ca2+에 의해 상이하게 조절된다는 것을 9개 보여주었고, 이러한 비대칭 섬모 조절은 C. 라인하르티이10의 광전술적 배향을 가능하게 한다. 또한, 두 섬모는 순방향 수영 모드 (비대칭 파형이라고 함)에서 후진 수영 모드 (세포가 광압 또는 메카노 충격을받을 때 짧은 기간 동안 나타나는 대칭 파형이라고 함)11,12로 파형 변환을 보여줍니다. 이러한 파형 변환은 아밀리몰Ca2+에 의해 조절되며, 이는 소위 핵편모성 장치(2개의 섬모, 기저체, 기저체와 핵을 연결하는 구조, 및 핵의 잔재를 포함하는 복합체)11 또는 분리된 섬모(13)의 탈embranated 축삭체의 재활성화에 의해 나타났다. Ca2+ 이외에, 산화환원(reduction-oxidation) 포이즈는 섬모 박동 빈도를 조절하는 신호이며, 이는 환원된 글루타티온 대 산화된 글루타티온14의 상이한 비율을 함유하는 산화환원 완충제에서 세포 모델의 재활성화에 의해 나타났다. 또한, 사이클릭 아데노신 모노포스페이트(cAMP)는 두 개의 섬모를 비대칭적으로 조절하며, 이는 광절단가능한 캐싱된 cAMP15를 사용한 액소네메스의 재활성화에 의해 나타났다. 이러한 시험관 내 발견은 유전 적 발견과 결합하여 C. reinhardtii에서 섬모 조절의 분자 메커니즘에 대한 더 깊은 이해를 이끌어 냈습니다.
세포 모델을 재활성화하기 위한 프로토콜이 여기에 기술되어 있다. 이 방법은 간단하고, 다양한 변형을 허용하며, 섬모와 함께 움직이는 여러 유기체에 적용될 수 있습니다. 그러나, 탈취된 세포는 깨지기 쉽기 때문에, 붕괴를 방지하면서 좋은 효율로 세포 모델의 운동성을 재활성화하기 위한 몇 가지 팁이 필요하다.
프로토콜
클라미도모나스 라인하르티이, CC-125의 야생형 균주를 본 연구에 사용하였다. CC-125를 클라미도모나스 자원 센터(표 자료 참조)로부터 수득하고, 20-25°C에서 트리스-아세테이트-포스페이트(TAP)16, 1.5% 아가로스 배지 상에서 유지시켰다.
1. 세포 배양
- 클라미도모나스 라인하르티이(CC-125)를 TAP 배지16에서 12h/12h 광암기(광기간에 대한 광 조건: ~50 μmol 광자 m-2 s-1 백색광)에서 20-25°C에서 2일 동안 배양하였다(도 1).
참고: 세포는 중간 대수 성장 단계에 있어야 합니다(동영상 1). 긴 배양 (>4일, 후기 대수 성장 또는 정지기에서)은 탈취된 세포 모델의 재활성화 효율을 감소시킨다.

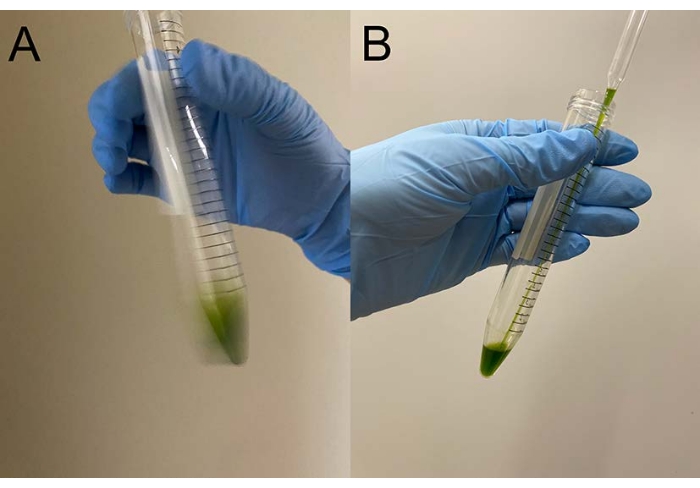
도 1: 2-일 배양 후의 액체 배양. TAP-1.5% 한천 플레이트로부터, 백금 루프를 채우기 위해 야생형 세포 덩어리를 플라스크에 ∼150 mL TAP 액체 배지에 접종하였다. 2일 배양 후의 세포 밀도는 2.3 × 106 cells/mL이었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 1 : 살아있는 세포의 수영. 세포를 10x 대물 렌즈와 오일 침지 암장 응축기로 현미경으로 관찰하였다. 스케일 바 = 100 μm. 이 동영상을 다운로드하려면 여기를 클릭하십시오.
2. 탈취된 세포 모델의 제조
참고: 실험을 시작하기 전에 세척 버퍼를 실온에서 보관하고 탈광, 희석, 재활성화 완충액 및 ATP 용액을 얼음 위에 보관하십시오. 이들 완충제의 조성은 보충 표 1에 제공된다.
- 10 mL의 액체 배양물을 1000 × g 에서 20°C에서 3분 동안 원심분리한다.
참고: 이 단계의 프로토콜 전체에서 오토클레이브 플라스틱웨어(튜브, 피펫 팁 등)를 사용하지 마십시오. 원뿔형 튜브의 경우 재사용 된 튜브가 바람직합니다. 2 일 배양 후 세포 밀도는 전형적으로 1.0-5.0 × 106 세포 / mL 일 수 있습니다. 세포 밀도가 이보다 낮을 때, 10,7 세포× ∼5를 함유하기에 충분한 배양 부피를 취한다. - 상청액을 버리고, 먼저 파스퇴르 피펫에 의해 데칸테이션한 다음, 침전물을 ~5 mL의 세척 완충액에 재현탁시킨다.
- 세포를 20°C에서 3분 동안 1000 × g 의 세척 완충액 중에서 원심분리한다.
- 피펫으로 상층액을 조심스럽게 버립니다(그림 2).
참고 : 파스퇴르 피펫이 바람직합니다. 마이크로 피펫을 사용할 때는 오토클레이브 된 피펫 팁을 사용하지 마십시오. - ~0.5 mL의 탈형 완충액을 세포 펠릿에 오버레이하고, 튜브를 손으로 부드럽게 흔들어 세포를 완충액에 대충 현탁시키고, 튜브를 얼음 위에 올려 놓는다(그림 3A).
참고 :이 순간에 펠릿을 완전히 일시 중지 할 필요는 없습니다. 세포 모델이 재활성화될 때 탈형 및 재활성화 완충액 중의 MgSO4의 농도를 15 mM로 올리고, 안정한 재활성화를 위해 최종 ATP 농도 >1 mM로17로 올린다. - 나머지 세포 펠릿을 피펫으로 부드럽게 현탁하고 튜브를 다시 얼음 위에 놓습니다(그림 3B).
- 세포 모델 5-10 μL를 취하고, 희석 완충액으로 10배 희석하고, 현미경(무비 2)으로 관찰하여 모든 세포 모델이 탈입되고 수영하지 않음을 확인하였다(도 4).
참고: 일부 세포가 여전히 수영 중(살아있는) 경우, 탈형 완충액에 사용된 비이온성 세제를 세포 모델 용액에 직접 첨가하여 최종 농도가 ~0.15%입니다. 또는 0.15%의 세제를 함유하는 탈형 용액으로 2.1-2.5단계를 반복한다.
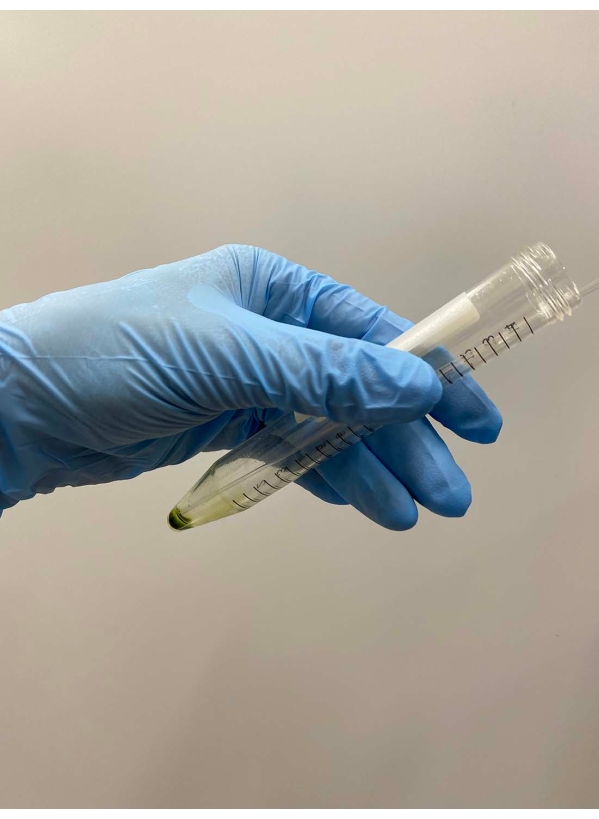
그림 2: 상청액 폐기. 나머지 상청액은 튜브의 데칸테이션에 의해 상청액을 제거한 후 파스퇴르 피펫으로 조심스럽게 제거하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 3: Demembranation . (A) 탈취액 0.5 mL를 세포 펠릿 상에 오버레이한 후, 용액을 손으로 혼합하여 세포를 거칠게 현탁시켰다. (b) 혼합 후, 나머지 세포 펠릿을 파스퇴르 피펫에 의해 용액 중에 완전히 현탁시켰다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
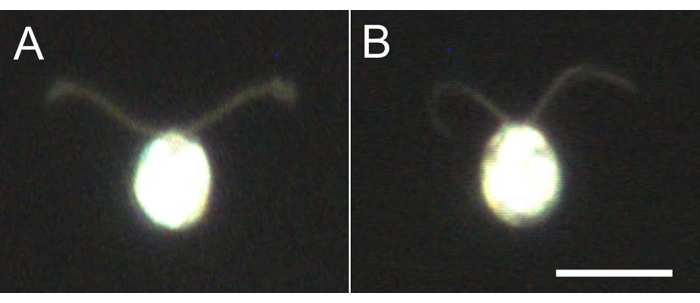
그림 4: 탈구의 효과 . (A) 유리 슬라이드에 붙어 있는 라이브 셀. (B) 유리 슬라이드에 붙어있는 셀 모델. 세포 모델에서 섬모는 약간 얇아졌습니다. 이미지는 20x 대물 렌즈와 오일 침지 암장 응축기를 사용하여 현미경으로 관찰되었습니다. 스케일 막대 = 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 2 : demembranation의 확인. 세포 모델 현탁액은 10x 대물 렌즈 및 오일 침지 암장 응축기를 사용하여 현미경으로 관찰되었다. 어떤 세포도 수영하고 있지 않았습니다. 스케일 바 = 100 μm. 이 동영상을 다운로드하려면 여기를 클릭하십시오.
3. 탈취된 세포 모델의 재활성화
- 튜브를 탭핑하여 80 μL의 재활성화 용액, 10 μL의 ATP 용액 및 10 μL의 세포 모델을 0.5 mL 튜브에 혼합한다(그림 5).
참고: 섬모 운동의 파라미터인 섬모 박동 빈도는 ATP 농도에 따라 증가하고 ATP17의 2-3mM에서 포화되기 때문에 최종 ATP 농도는 <3mM이어야 합니다.
주의: 피펫팅 또는 볼텍싱에 의한 혼합은 감소를 일으키고 재활성화 효율을 감소시킵니다.- <0.2 mM의 ATP로 재활성화하려면 70 U/mL의 크레아틴 키나제 및 5 mM의 크레아틴 포스페이트와 같은 ATP 재생 시스템을 첨가 하십시오 (자료 표 참조).
참고: 재활성화 용액은 물에 용해된 ATP를 혼합한 후, 내용물이 다음의 최종 농도에 도달하도록 희석 용액보다 더 높은 농도(1.125x, 보충 표 1)로 제조된다: 30 mM의 헤페스(pH 7.4), 5 mM의 MgSO4, 1 mM의 디티오트레이톨(DTT), 1 mM의 EGTA 및 50 mM의 아세트산칼륨(물질의 표 참조).
- <0.2 mM의 ATP로 재활성화하려면 70 U/mL의 크레아틴 키나제 및 5 mM의 크레아틴 포스페이트와 같은 ATP 재생 시스템을 첨가 하십시오 (자료 표 참조).
- ~30μL의 혼합 용액을 유리 슬라이드에 넣고 스페이서로 커버슬립을 부드럽게 올려 셀 모델에 기계적 충격을 주지 않도록 합니다(그림 6).
참고 : 백색 석유 또는 양면 접착 테이프를 사용하여 스페이서를 만들 수 있습니다. - 재활성화된 세포 모델을 현미경으로 관찰한다(영화 3).

도 5: 튜브를 탭핑하여 혼합 용액. (A) 80 μL의 재활성화 용액, 10 μL의 ATP 용액, 및 10 μL의 세포 모델을 순차적으로 첨가하였다. (b) 용액을 손가락으로 튜브를 탭핑하여 혼합하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 커버슬립 가장자리에 스페이서 만들기 . (A) 손등에 흰색 석유의 얇은 층을 적용했습니다. (B) 소량의 백색 석유가 커버슬립의 가장자리로 긁어냈다. (C) 커버 슬립의 가장자리에 스페이서가 만들어졌습니다. (D) 반대쪽 가장자리에 또 다른 스페이서가 만들어졌다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 3 : 재활성화 된 세포 모델의 수영. 세포 모델의 운동성은 1 mM의 최종 농도에서 ATP를 첨가함으로써 재활성화되었고, 10x 대물 렌즈 및 오일 침지 암장 응축기로 현미경으로 관찰되었다. 스케일 바 = 100 μm. 이 동영상을 다운로드하려면 여기를 클릭하십시오.
결과
C. 라인하르티이 야생형 균주(CC-125)에서의 탈종 및 재활성화 과정이 여기에 도시되어 있다. 접종 2일 후 배양물은 연한 녹색이 되었다(단계 1.1). 세포를 수집하고(단계 2.1), 세척하고(단계 2.2), 탈형하였다(단계 2.5). 탈메탄화 후, 모든 세포 모델은 움직이지 않게 되었다(단계 2.7). 탈embranated 섬모 (axonemes라고 함)는 세포 몸체에 부착 된 채로 남아 있으며, 이는 세포 모델?...
토론
이 프로토콜에는 두 가지 중요한 단계가 있습니다. 첫 번째는 demembranation으로 알려진 과정으로, 부드럽지만 철저하게 수행되어야합니다. 감소(즉, 세포체로부터 섬모의 분리)는 격렬한 피펫팅 또는 볼텍싱에 의해 유도되고, ATP의 첨가 후에도 세포 모델을 움직이지 않게 만든다. 전형적으로, 5 × 10,7 세포는 ~0.5 mL의 탈지 완충액에 현탁된다(최종 세포 밀도: 1 × 108 세포/mL). 세포 모델...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 일본 과학 진흥 협회 KAKENHI (https://www.jsps.go.jp/english/index.html)에서 N.U. (19K23758, 21K06295) 및 K.W. (19H03242, 20K21420, 21H00420), Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/)에서 K.W.로, 그리고 인간, 환경 및 재료 브리징을위한 동적 얼라이언스 (http://alliance.tagen.tohoku.ac.jp/english/)에서 N.U. 및 K.W.에 대한 보조금으로 지원되었습니다. 시노하라 미유키 여사(호세이 대학교)에게 피겨 준비에 도움을 주신 것에 대해 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5 mL plastic tube | QSP | 502-PLN-Q | |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sima-Aldrich | A2383 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strain CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| Creatine kinase | Merck | CK-RO | |
| Creatine phosphate | Merck | CRPHO-RO | |
| Dithiothreitol (DTT) | Nakalai tesque | 14128-46 | |
| GEDTA(EGTA) | Dojindo | G002 | |
| Hepes | Dojindo | GB70 | |
| Igepal CA-630 | Sigma-Aldrich | I8896 | IUPAC name is octylphenoxypolyethoxyethanol: IGEPAL CA-630 is a substitute for Nonidet P-40 (NP-40); NP-40 is no longer available in Sigma-Aldrich. |
| MgSO4-7H2O | Nakalai tesque | 21002-85 | |
| Microscope | Olympus | BX-53 | |
| Pasteur pipette | fisher scientific | 13-678-20C | |
| Polyethylene glycol, Mr 20,000 | Merck | 8.18897.1000 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Sodium Hydroxide | Nacalai | 31511-05 | |
| Sucrose | FUJIFILM Wako Pure Chemical Corporation | 196-00015 |
참고문헌
- Szent-Gyorgyi, A. Free-energy relations and contraction of actomyosin. Biological Bulletin. 96 (2), 140-161 (1949).
- Hoffman-Berling, H. Adenosintriphosphat als betriebsstoff von zellbewegungen. Biochimica et Biophysica Acta. 14, 182-194 (1954).
- Naitoh, Y., Kaneko, H. Reactivated Triton-extracted models of Paramecium: modification of ciliary movement by calcium ions. Science. 176 (4034), 523-524 (1972).
- Witman, G. B., Plummer, J., Sander, G. Chlamydomonas flagellar mutants lacking radial spokes and central tubules. Structure, composition, and function of specific axonemal components. Journal of Cell Biology. 76 (3), 729-747 (1978).
- Rüffer, U., Nultsch, W. Flagellar coordination in Chlamydomonas cells held on micropipettes. Cell Motility and the Cytoskeleton. 41 (4), 297-307 (1998).
- Sale, W. S., Satir, P. Direction of active sliding of microtubules in Tetrahymena cilia. Proceedings of the National Academy of Sciences of the United States of America. 74 (5), 2045-2049 (1977).
- Fox, L. A., Sale, W. S. Direction of force generated by the inner row of dynein arms on flagellar microtubules. Journal of Cell Biology. 105 (4), 1781-1787 (1987).
- Kamiya, R., Yagi, T. Functional diversity of axonemal dyneins as assessed by in vitro and in vivo motility assays of Chlamydomonas mutants. Zoolog Science. 31 (10), 633-644 (2014).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Saegusa, Y., Yoshimura, K. cAMP controls the balance of the propulsive forces generated by the two flagella of Chlamydomonas. Cytoskeleton. 72 (8), 412-421 (2015).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Takano, W., Hisabori, T., Wakabayashi, K. Rapid estimation of cytosolic ATP concentration from the ciliary beating frequency in the green alga Chlamydomonas reinhardtii. Journal of Biological Chemistry. 296, 100156 (2021).
- Wakabayashi, K., Yagi, T., Kamiya, R. Ca2+-dependent waveform conversion in the flagellar axoneme of Chlamydomonas mutants lacking the central-pair/radial spoke system. Cell Motility and the Cytoskeleton. 38 (1), 22-28 (1997).
- Yueh, Y. G., Crain, R. C. Deflagellation of Chlamydomonas reinhardtii follows a rapid transitory accumulation of inositol 1,4,5-trisphosphate and requires Ca2+ entry. Journal of Cell Biology. 123 (4), 869-875 (1993).
- Wakabayashi, K., Ide, T., Kamiya, R. Calcium-dependent flagellar motility activation in Chlamydomonas reinhardtii in response to mechanical agitation. Cell Motility and the Cytoskeleton. 66 (9), 736-742 (2009).
- Ueki, N., Wakabayashi, K. Detergent-extracted Volvox model exhibits an anterior-posterior gradient in flagellar Ca2. Proceedings of the National Academy of Sciences of the United States of America. 115 (5), 1061-1068 (2018).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유