Method Article
이광자 홀로그램 현미경을 사용한 신경 활동의 평가 및 조작
요약
우리는 비정상적인 신경 활동과 관련된 신경 정신 장애의 발병 기전을 밝히기 위해 높은 시공간 해상도를 사용하여 신경 활동을 시각화, 평가 및 조작할 수 있는 이광자 홀로그램 현미경을 개발했습니다.
초록
광학 생체 이미징 및 광유전학의 최근 발전으로 살아있는 동물의 세포 활동을 포함한 생물학적 현상의 시각화 및 조작이 가능해졌습니다. 신경과학 분야에서는 학습, 기억 등 뇌 기능과 관련된 세밀한 신경 활동이 밝혀졌고, 이 활동을 인위적으로 조작하여 뇌 기능을 발현하는 것이 가능해졌습니다. 그러나, 이광자Ca2+ 이미징에 의한 신경 활성의 종래의 평가는 낮은 시간 해상도의 문제점을 가지고 있다. 또한, 광섬유를 통한 기존의 광유전학에 의한 신경 활동의 조작은 동일한 유전적 배경을 가진 뉴런의 활동을 동시에 조절할 수 있을 뿐이므로 개별 뉴런의 활동을 제어하기 어렵습니다. 이 문제를 해결하기 위해 우리는 최근 펨토초 적외선 레이저 빔을 수정할 수 있는 디지털 홀로그램 기술과 광유전학을 결합하여 생물학적 응용을 위한 높은 시공간 해상도를 가진 현미경을 개발했습니다. 여기에서는 샘플 준비 및 이광자 홀로그램 현미경의 작동을 포함하여 신경 활동의 시각화, 평가 및 조작을 위한 프로토콜에 대해 설명합니다(그림 1). 이러한 프로토콜은 신경 활동에 대한 정확한 시공간 정보를 제공하며, 이는 신경 활동의 이상으로 이어지는 신경 정신 장애의 발병기전을 설명하는 데 유용할 수 있습니다.
서문
이광자Ca2+ 이미징은 신경 활동을 평가하는 데 유용한 기술입니다. 정상 동물 1,2의 행동 및 기억에 필요한 신경 활동뿐만 아니라 신경 정신 장애 3,4의 마우스 모델에서 발생하는 비정상적인 신경 활동을 확인하는 데 사용할 수 있습니다. 이 기술은 뇌 기능의 신경 기초를 밝히는 데 사용되었습니다. 그러나, 고해상도 및 고화질 이미지를 제공할 수 있지만, 그 시간적 해상도는 전기생리학적 방법(1,3)보다 낮다.
광유전학(Optogenetics)은 신경과학자들이 뇌 기능을 이해하는 방식을 혁신하는 데 도움을 주었다5. 기술적 한계를 감안할 때, 광유전학 연구의 대부분은 공간 분해능이 낮은 활성화 체계를 사용했기 때문에 그에 따라 수행할 수 있는 신경 활동의 조작 유형을 제한했습니다. 그러나 더 미세한 시공간 규모에서 신경 활동을 조작하는 것은 신경 계산과 신경 정신 장애의 발병 기전을 보다 완벽하게 이해하는 데 잠재적으로 유용할 수 있습니다. 펨토초 근적외선 레이저 빔을 형성할 수 있는 공간적으로 정밀한 홀로그램 기술은 이러한 도전을 극복할 것을 약속하고 이전에는 불가능했던 몇 가지 새로운 실험 클래스를 열어줍니다 6,7. 이 기술을 통해 신경 과학자들은 도달할 수 없는 감각, 인지 및 행동 신경 코드의 근본적인 측면과 병리를 밝힐 수 있습니다.
홀로그램 프로젝션은 개별 세포와 기능적 네트워크에 선택적으로 접근하기 위해 원하는 조명 패턴을 생성하는 것을 포함합니다. 생체 내 실험에는 살아있는 뇌의 표적 세포에 대한 최적의 광 투과가 필요합니다. 적외선은 생체 조직 깊숙이 침투하여 비선형 이광자 여기(2PE)8,9,10에 사용할 수 있습니다. 따라서 홀로그램 프로젝션과 2PE를 결합한 이광자 홀로그램 현미경은 생체 내에서 세포 및 기능 네트워크를 조사하기 위해 신경 활동을 평가하고 조작하는 데 사용할 수 있습니다. 이광자 홀로그램 현미경의 최근 생물학적 응용은 시각 피질 11,12, 후각 전구13 및 해마14에서 학습에 필요한 신경 활동과 회로를 설명했습니다.
전 세계의 수많은 실험실에서 홀로그램 자극 시스템 15,16,17,18,19,20,21,22,23을 사용하여 흥미로운 결과와 개선을 보고했습니다. 여기에 설명된 시스템에서, 홀로그램 자극 시스템은 종래의 현미경을 위한 애드온 장치로서 구축될 수 있다. 위상 전용 공간 광 변조기(SLM)는 평면 파면을 모든 모양으로 변조하는 핵심 장치이며 간섭 효과는 초점의 강도와 위치를 제어하는 데 사용됩니다. 그림 2는 홀로그램 자극 및 이미징 조명 경로를 보여줍니다. 첫 번째 광 경로는 포인트 스캐닝 이미징 모드용이며 스캔 헤드와 이미지 감지기로 구성됩니다. 두 번째 광 경로는 1040nm 파장의 홀로그램 자극을 위한 것으로 SLM1로 구성됩니다. 세 번째 광 경로는 920nm 파장의 홀로그램 조명용이며 SLM2와 이미지 센서로 구성됩니다. 홀로그램 이미징 모드는 샘플의 여러 지점을 조명하여 여러 관심 영역의 강도를 기록할 수 있습니다. 이러한 방식으로 녹화 속도를 초당 수백 프레임으로 높일 수 있습니다. 포인트 스캐닝 이미징 또는 홀로그램 조명 이미징을 달성하기 위해 920nm 레이저는 3:7의 고정 비율로 빔 스플리터에 의해 두 개의 경로로 분할되었습니다. 모든 광학 요소는 600mm × 600mm 크기의 광학 브레드 보드에 정렬되었습니다. 변조된 빛은 현미경 본체 측면의 광 포트를 통해 들어갔고, 포인트 스캐닝 이미징 빛은 현미경 본체 상단의 스캔 헤드를 통해 들어갔습니다. 이 조명은 대물 렌즈 바로 위에 통합되어 샘플 평면에 초점을 만들었습니다. 또한 맞춤형 소프트웨어를 통해 일반 워크플로를 간단하고 일관되게 만들 수 있었습니다.
이 기사에서는 홀로그램 자극 또는 조명을 사용하여 신경 활동을 측정하고 뉴런 간의 기능적 연결을 평가하기 위한 완전한 프로토콜을 제시합니다. 시연을 위해 여기서는 마우스 뇌의 일차 체성감각 피질(S1HL)의 뒷다리 영역을 대상으로 하는 뇌 수술과 이광자 홀로그램 현미경을 사용하여 신경 활동을 평가하고 조작하는 방법을 설명합니다. 실험 절차는 네 부분으로 나뉩니다. 먼저, 머리판을 치과용 시멘트를 이용하여 마우스의 두개골에 고정하였다. 둘째, jGCaMP8f 또는 GCaMP6m-P2A-ChRmine을 발현하는 바이러스 벡터를 S1HL에 정위 주입하였다. 셋째, 홀로그램 자극 또는 조명 시스템을 보정하였다. 넷째, 수술 후 회복 및 이들 두 단백질의 발현 후, 생체 내 Ca2+ 이미징을 수행하여 이광자 홀로그램 현미경으로 뉴런 간의 신경 활성 및 기능적 연결성을 평가하였다.
프로토콜
모든 실험 프로토콜은 나고야 대학 의과 대학원의 동물 관리 및 사용위원회 (승인 번호 : M220295-003)의 승인을 받았습니다.
1. 헤드 플레이트 이식 (그림 1A)
- 마취제(74mg/kg 케타민과 10mg/kg 자일라진의 혼합물)를 복강 내 투여하여 마우스를 마취합니다. 페달 반사를 평가하여 마우스의 마취 상태를 자주 확인하십시오.
- 마취 후 마우스를 정위 기구에 넣습니다. 머리 판을 이식할 때 각막이 건조해지는 것을 방지하기 위해 눈 연고( 재료 표 참조)를 바르십시오.
- 수술 부위를 면도하고 포비돈 요오드 또는 클로르헥시딘 스크럽을 번갈아 가며 3회 회진한 다음 70% 알코올 물티슈로 피부를 소독합니다. 두개골을 조심스럽게 노출시키고 면봉으로 닦으십시오.
알림: 모든 수술 기구는 멸균되어야 하며 모든 절차는 그에 따라 수행되어야 합니다. 남아 있는 파편(예: 머리카락 또는 마른 혈액)은 염증 반응을 일으킵니다. 따라서 멸균수 또는 70% 알코올을 적신 면봉을 사용하여 입체경 아래에서 파편을 제거해야 합니다. - 정위 좌표(전방 및 후방 = 0.5mm, 내측 및 외측 = 1.5mm)를 사용하여 개두술의 중심을 찾아 마커 펜으로 레이블을 지정합니다.
- 두개골 중앙에 맞춤형 헤드 플레이트를 놓습니다. 다음으로 치과용 시멘트( 재료 표 참조)를 바르고 두개골에 단단히 고정합니다. 머리 판이 두개골의 앞면과 뒷면에 단단히 닿을 때까지 가벼운 압력을 가합니다.
참고: 이 단계는 완료하는 데 약 20분이 소요되며 이광자 이미징 중에 뇌의 동작 아티팩트를 줄이는 데 중요합니다. 헤드 플레이트의 치수는 20mm × 40mm × 1mm이며 한쪽 가장자리가 15mm 길이, 인접한 두 면이 3mm 길이, 나머지 두 면이 10mm 길이인 홈 플레이트 모양의 개구부가 있습니다. - 아크릴계 치과용 접착 수지 시멘트를 분말 반 스푼, 액체 3방울, 촉매 1방울과 같이 혼합합니다( 재료 표 참조). 건조를 방지하기 위해 이 혼합 치과용 접착 수지 시멘트를 헤드 플레이트가 있는 마우스의 손상되지 않은 두개골 표면에 도포하십시오.
- 마취에서 회복 될 때까지 마우스를 따뜻한 케이지에 넣으십시오. 흉골 누운 자세를 유지하기에 충분한 의식을 회복할 때까지 마우스를 방치하지 마십시오.
2. 수술 및 아데노 관련 바이러스(AAV) 주사(그림 1B)
- 두개골 이식 1일 후 두개골에서 치과용 접착성 수지 시멘트를 제거하지 않고 개두술 또는 바이러스 주사를 시행합니다.
참고: 이 절차 동안 마우스에 마취(74mg/kg 케타민과 10mg/kg 자일라진의 혼합물)를 복강 투여합니다. - 뇌부종을 예방하려면 수술 1시간 전에 덱사메타손 인산나트륨(1.32mg/kg)을 복강 투여하십시오.
- 마우스를 1% 이소플루란으로 헤드플레이트로 마취시키면서 기화기(anesthesia delivery system)를 이용하여 마취시키면서 발열패드로 체온을 유지한다. 각막 건조를 방지하기 위해 눈 연고를 바르십시오.
- 입체경 아래에서 치과 용 드릴을 사용하여 직경 약 2mm의 원형 개두술을 시행하십시오. 뇌 손상을 줄이려면 치과용 드릴을 일정한 약간의 움직임과 가벼운 하향 압력으로 조심스럽게 작동하십시오.
- 흡입 시스템을 사용하여 뼈 조각을 여러 번 제거하십시오. 뼈 조각을 제거한 후 인공 척수액(ACSF) 용액을 사용하여 뇌 표면에 남아 있는 파편을 제거하고 씻어냅니다. 염증 반응을 억제하기 위해이 세척 절차를 여러 번 반복하십시오.
참고: ACSF 용액(140 mM NaCl, 2.5 mM KCl, 5 mM HEPES, 2.0 mM CaCl2, 및 1.0 mM MgCl2)을 시약을 용해시키고 여과한 후 1개월 동안 4°C에서 저장하였다(공극 크기 = 0.22 μm). - 압력 주입 시스템( 재료 표 참조)을 사용하여 적절한 압력(지속 시간 4ms의 펄스에서 약 10PSI)을 설정하여 팁 직경이 10-20μm인 유리 모세관을 통해 AAV 용액 500nL(마이크로피펫 풀러로 준비)를 10분 동안 주입합니다.
- 유리 모세관에서 AAV 용액의 수준이 점차 감소하는지 확인하여 AAV 용액이 뇌에 투여되고 있는지 확인합니다.
- 역류를 방지하기 위해 유리 모세관을 추가로 10분 동안 그대로 두십시오. 총 1.5μL의 AAV 용액을 뇌에 투여하기 위해 세 번 반복합니다.
- 레이어 2/3(L2/3) 피라미드 세포에서 신경 활동을 평가하고 조작하려면 AAV 용액(Ca 2+ 이미징의 경우: 1.28 ×10 14 벡터 게놈/mL의 AAV2/1-Syn-jGCaMP8f-WPRE, 식염수에 1:1로 희석, 광유전학을 사용한 Ca2+ 이미징의 경우: AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1-WPRE에서 1.73 ×10 14 벡터 게놈/mL, 식염수에 1:1로 희석됨)을 야생형 마우스의 일차 체감각 피질의 뒷발 영역에 주입합니다(S1, 브레그마에서 후방 0.5mm, 측면 1.5mm, 표면에서 150μm 깊이를 중심으로).
참고: AAV 용액은 jGCaMP8f 및 GCaMP6m-P2A-ChRmine 발현을 위해 이미징하기 전에 각각 2-3주 및 1-2주에 주입해야 합니다. - 마이크로피펫을 사용하여 S1의 뇌 표면에 2%(w/v) 저융점 아가로스를 적용한 후 두 개의 커버 안경으로 개두술 위에 유리창을 놓습니다. UV 경화형 접착제로 두 개의 커버 유리(직경 2.0mm, 직경 4.5mm, 재료 표 참조)를 부착합니다.
- 덮개 유리를 agarose에 대고 누르십시오. 이것은 아가로스에 기포가 형성되는 것을 방지합니다. 두개골 창의 가장자리를 치과용 및 접착성 수지 시멘트로 밀봉합니다(그림 1C).
- 정체 도구에서 마우스를 제거하고 케이지로 되돌립니다. 마우스를 따뜻한 케이지에 넣고 마취에서 완전히 회복 될 때까지 다른 동물과 함께 케이지로 돌아 가지 마십시오. 생존 수술 중 무균 상태를 조심스럽게 유지하십시오.
- 수술 후 처음 72시간 동안은 일반적인 행동을 관찰하여 마우스의 건강 상태를 확인합니다. 일반적인 행동에 이상이 있으면 항염증제와 진통제를 피하 주사하십시오.
3. 홀로그램 자극 또는 조명 시스템 준비(그림 3)
- 샘플 평면에 빨간색 형광 슬라이드(캐스트 아크릴 기판)의 표면을 배치하여 홀로그램 자극 시스템을 보정합니다. 약한 여기광이 있는 라이브 이미징 모드로 현미경을 놓고 calibration_GUI.m 파일을 실행합니다. 매개변수 창을 확인하고 저장 버튼을 클릭합니다.
- 1단계 창에서 Z 스캔 버튼을 클릭합니다. 각 평면에서 2μm 떨어진 21개의 축 평면 모두에서 3개의 무작위 지점을 자동으로 생성합니다.
- 슬라이드 바를 움직여 라이브 이미지를 확인합니다. 스폿이 가장 작고 밝게 나타나는 완벽한 평면을 찾은 다음 저장 버튼을 클릭합니다. 이렇게 하면 디지털 홀로그램에 대한 오프셋 구형 파면이 자동으로 생성됩니다.
참고: 가장 밝은 형광 스폿을 찾지 못하면 스캔 범위의 최소값과 최대값을 변경하고 다시 시도하십시오. - 2단계 창에서 이동 단추를 클릭한 다음 왼쪽 사각형에 있는 6개의 지점을 클릭합니다. 라이브 이미지를 확인합니다. 6개의 구별 가능한 형광 반점이 있는 경우 해당 x축과 y축을 편집 상자에 입력하고 저장 버튼을 클릭합니다. 이렇게 하면 아핀 변환 계수가 자동으로 생성되어 홀로그램 자극과 이미징 시스템 간의 보정을 조정합니다.
참고: 축 쌍 번호와 클릭한 스폿 번호는 순서대로 일치해야 합니다. 확실하지 않거나 이미지에 스폿이 없는 경우 다시 시도하여 고유한 스폿 패턴을 생성하거나 시야(FOV) 중심 주변의 더 작은 범위를 선택하십시오. - 클릭 주사 3단계 창에서 버튼을 클릭합니다. 441개의 디지털 홀로그램을 생성하여 21단계 × 21단계로 FOV에서 단일 스팟 스캔을 수행합니다.
- 먼저 목록 상자에서 패턴을 변경하면서 이미지를 확인합니다. 그런 다음 레이저 출력을 조정하여 이미징 장치의 동적 범위 내에서 스폿 이미지를 얻습니다(예: 지나치게 포화된 이미지를 피하기 위해).
- 그런 다음 편집 상자에서 간격 시간을 조정하십시오. 간격 시간은 녹음 간격 시간의 두 배 이상이어야 합니다. 마지막으로 이미징 장치를 녹화 모드로 전환하고 재생 버튼을 클릭합니다. 재생이 완료되면 명령 창에 "display OK" 문자열이 표시됩니다. 녹화를 중지하고 최대 강도 방법을 사용하여 녹화된 순차적 이미지를 쌓습니다.
- 4단계 창에서 WM 생성을 클릭하고 위에서 스택 이미지를 선택합니다. 그런 다음 calibration_GUI 창을 닫습니다. 각 지점의 불균형한 강도를 보정하기 위해 자동으로 가중치 맵을 생성합니다.
참고: 자세한 설명은 2를 참조하십시오. Matlab 코드는 여기(https://github.com/ZenKG/SLM_control)에서 다운로드할 수 있습니다.
4. 홀로그램 조명이 있는 이미지 센서를 사용한 Ca2+ 이미징(그림 4)
- AAV 주입 마우스를 헤드 플레이트와 함께 현미경 아래에 놓습니다(그림 1D).
참고: 이 과정에서 마우스는 깨어 있는 상태에서 구속되지만 불편한 자극에서 벗어날 수 있습니다. - 홀로그램 현미경과 25x 대물렌즈로 920nm로 조정된 모드 잠금 Ti:sapphire 레이저를 사용하여 이광자 이미징(포인트 스캐닝 모드)을 수행합니다( 재료 표 참조).
- 상업용 이미징 소프트웨어를 켭니다( 재료 표 참조). 라이브 이미징 모드에서 이미지 검출기의 전압( 재료 표 참조)과 이미징 레이저의 출력을 조정하여 jGCaMP8f를 발현하는 뉴런의 밝기를 최적화합니다. 이 단백질을 발현하는 뉴런의 이미지를 캡처합니다.
참고: 이미징 레이저(920nm)의 강도는 20-30mW입니다. FOV는 피질 표면으로부터 100-150 μm의 깊이에서 512 μm × 512 μm이었다. - 홀로그램 조명으로 jGCaMP8f를 표현하는 특정 뉴런을 비추려면 SLMcontrol.m 스크립트 파일을 실행하십시오. 참조 이미지를 클릭하고 위에서 획득한 이미지를 선택합니다. 그런 다음 스폿(Spot ) 버튼을 클릭하고 마우스를 연속적으로 클릭하여 이미지의 뉴런에 있는 특정 픽셀을 선택합니다(그림 4A). 선택이 완료되면 키보드의 Enter 버튼을 눌러 완료합니다.
참고: 디지털 홀로그램은 자동으로 계산되어 SLM에 표시됩니다. 이 패턴은 목록 상자를 클릭하여 다시 확인할 수도 있습니다. SLM에 의해 생성된 단일 스폿의 공간 분해능은 가로 방향을 따라 약 1.2μm, 광축을 따라 ~8.3μm였습니다. 우리는 보다 국소적인 홀로그램 자극을 달성하기 위해 높은 개구수(1.1) 대물 렌즈를 사용했습니다. 표 1 은 홀로그램 자극의 공간 해상도에 관한 이전 보고서와 이 시스템을 요약한 것이다. - 이미지 센서를 사용하여 높은 시간 해상도로 신경 활동을 감지하려면(재료 표 참조) 이미지 획득을 수행하기 전에 노출 시간, 이미징 영역 및 비닝(그림 4B)을 설정합니다(그림 4C).
참고: 하나의 뉴런을 지속적으로 자극하는 홀로그램 조명 레이저(920nm)의 강도는 2mW로 신경 활동을 감지하기에 충분합니다. 예를 들어, 이미징을 위한 100Hz의 프레임 속도를 달성하기 위해 노출 시간은 9ms이고, 이미징 영역은 400μm × 400μm이며, 비닝은 4입니다. - 실험이 끝나면 마우스를 홈 케이지로 되돌립니다.
5. 홀로그램 현미경을 사용한 광유전학을 사용한 이광자 이미징(포인트 스캐닝 모드)(그림 2)
- 4.1단계와 4.2단계를 반복합니다.
- 상업용 이미징 소프트웨어를 켭니다( 재료 표 참조). 라이브 이미징 모드에서 볼륨을 조정하십시오.tage 이미지 검출기( 재료 표 참조)와 이미징 레이저의 파워를 사용하여 GCaMP6m-P2A-ChRmine을 발현하는 뉴런의 밝기를 최적화합니다. 이러한 단백질을 발현하는 뉴런의 이미지를 캡처합니다(그림 1E).
- 4.4단계를 반복합니다.
- L2/3 뉴런 내의 기능적 연결성을 조사하기 위해 SLM을 사용하여 광유전학적 자극의 홀로그램 패턴(ChRmine, 1,040nm)을 생성하고 이를 이광자 Ca2+ 이미징(GCaMP6m,920nm, 512 × 512픽셀, 2Hz 또는 30Hz, 2배 디지털 줌, 포인트 스캐닝 모드; 그림 4D-H).
- 이 프로토콜의 경우 이미징 레이저의 강도를 920nm, 10-20mW로 설정하고 FOV를 피질 표면에서 100-150μm 깊이에서 측정한 256μm × 256μm로 설정합니다. 픽셀 유지 시간을 2Hz의 경우 1.5μs, 30Hz의 경우 100ns로 설정합니다.
- 단일 홀로그램 자극이 뉴런에서 칼슘 반응을 일으켰는지 확인하려면 이미징 프레임 속도로 2Hz와 30Hz를 모두 사용합니다. 신경 활동을 유도하기에 충분한 10mW에서 단일 뉴런을 자극하는 홀로그램 자극 레이저(1,040nm)의 강도를 설정합니다(그림 4D).
참고: SLM에 의해 생성된 단일 스폿의 공간 분해능은 가로 방향을 따라 약 1.2μm, 광축을 따라 ~8.3μm입니다. 측면 방향에서 접근 가능한 부피의 범위는 약 500 μm × 500 μm 및 축 방향으로 100 μm입니다. 본 발명자들은 2 Hz 또는 30 Hz 이미징 프레임 속도에서Ca2+ 이미징으로 하나의 뉴런뿐만 아니라 여러 뉴런이 동시에 홀로그램으로 자극될 수 있음을 추가로 확인하였다(도 4E).
- 다음 프로토콜로 이미지 획득 수행: 10초의 기준선 기간 후 50ms 동안 8초 간격(0.125Hz)으로 1,040nm에서 10개의 홀로그램 자극으로 920nm에서Ca2+ 응답을 동시에 이미지화합니다. 모든 실험이 완료된 후, 마우스는 안락사된다.
참고: Ca2+ 과도 현상이 있는 경우 홀로그램 자극에 의해 유발되었으며 자극 후 1초 이내에 피크가 나타납니다(그림 4F-H).
6. 기능적 연결성의 이미지 분석 및 평가(그림 4)
- ImageJ를 사용하여 4.5 또는 5.5단계에서 저장한 Raw 이미지를 엽니다. 초점면 변위를 보정하려면 ImageJ 플러그인 TurboReg를 사용합니다.
알림: TurboReg로 보정해도 충분하지 않은 경우 CaImAn(http://github.com/simonsfoundation)을 사용하여 초점면 변위를 보정하는 것이 좋습니다. - 신경 활동을 평가하려면 자동화된 알고리즘(CaImAn)을 사용하여 L2/3의 관심 영역(ROI)을 결정합니다. 기준선 형광 강도(F0) 및 임계값을 정의한 후Ca2+ 과도 현상을 검출하고 분석합니다.
참고: F0는 기준선 이미징 기간 동안 획득한 형광 강도의 35번째 백분위수 값입니다. Ca2+ 과도 현상은 ΔF/F0(ΔF = F-F0)로 표시되며, 여기서 F는 순간 형광 신호입니다. ΔF 값이 F0로부터 2S.D.를 초과하면, 유의한Ca2+ 과도 현상을 평가한다. - L2/3 뉴런에서 기능적 연결성을 정의하기 위해 표적 뉴런을 자극하고 그에 따라 자극된 뉴런과 주변 뉴런에서 GCaMP6m 반응을 측정합니다(그림 4F-H).
결과
여기에 설명된 방법을 사용하여 얻어진 대표적인 기록이 제시된다. 생체 내 홀로그램 현미경을 사용한Ca2+ 이미징은 헤드 플레이트 이식 및 AAV 주입에서 데이터 수집까지 완료하는 데 2-4주가 소요됩니다. 따라서 안정적인 결과를 얻으려면 뇌의 움직임 아티팩트를 줄이는 것이 중요합니다. 헤드 플레이트 이식 (1.5 단계)과 두개골 창 배치 (2.9 단계)는이 과정에서 매우 중요한 단계입니다. 또한 단일 뉴런에서 칼슘 지표와 옵신을 동시에 발현하는 AAV(AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1)를 선택하는 것도 중요합니다(단계 2.8).
그림 4A는 사용자 지정 MATLAB 스크립트를 사용하여 획득한 뉴런 영상의 홀로그램 조명 스폿을 보여줍니다. 홀로그램 조명이 jGCaMP8f를 발현하는 뉴런을 성공적으로 조명한 경우, 그림 4C에 도시된 바와 같이 이미지 센서(그림 4B)로Ca2+ 트레이스를 얻을 수 있습니다.
뉴런 간의 기능적 연결성은 그림 4E와 같이 홀로그램 자극(그림 4D)을 사용하여 평가되었습니다. 뉴런들 사이의 기능적 연결성은 통증 모델 마우스(24)의 발병기전에서 변경되는 신경 회로 특성들 중 하나이기 때문에, 이를 평가하기 위한 간단한 절차를 설명한다. 그림 4F는 GCaMP6m을 사용하여 시각화된 S1HL의 L2/3 뉴런의 일반적인 이미지를 보여줍니다. 한 뉴런(주황색 원)이 홀로그램으로 자극되면 다른 뉴런(빨간색 원)이 동시에 활성화되었습니다. 따라서, 뉴런 사이의 기능적 연결성의 수는 1이었다 (그림 4G).
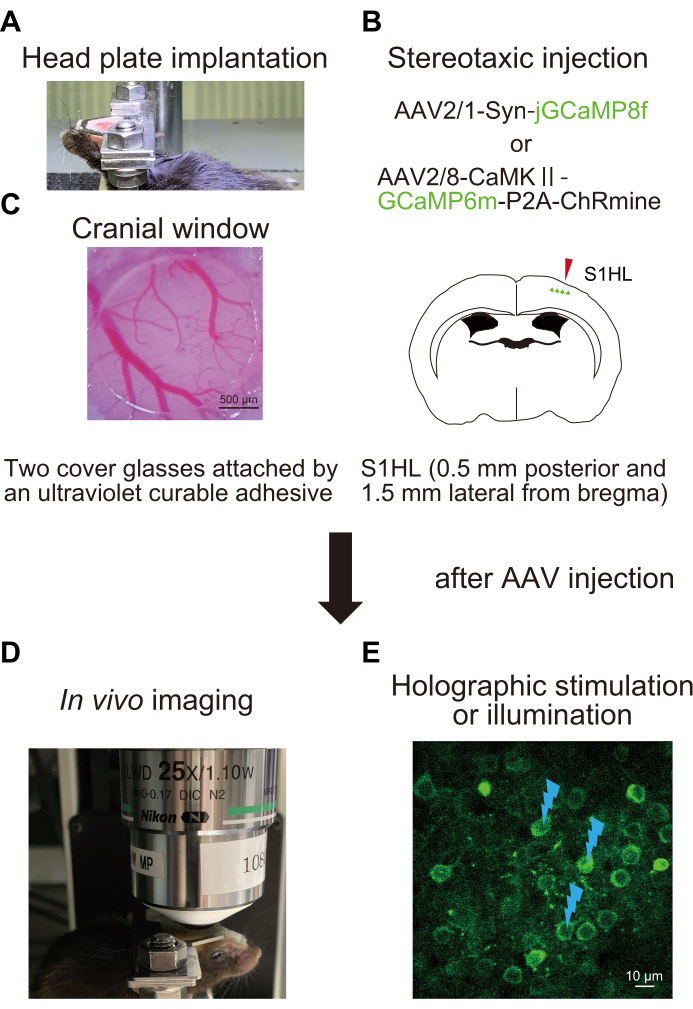
그림 1: 실험 절차의 개략도. (A) 두개골에 헤드 플레이트 고정. (B) 일차 체성 감각 피질(S1HL)의 뒷발 영역에 AAV의 정위 주입. (C) 두개골 창의 이식. 신경 활동을 평가하고 조작하기 위해, 생체내 Ca2+ 이미징은 홀로그램 자극 (E)과 함께 깨어 있는 마우스(D)에서 수행된다. 플래시 표시는 홀로그램 자극 또는 조명을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
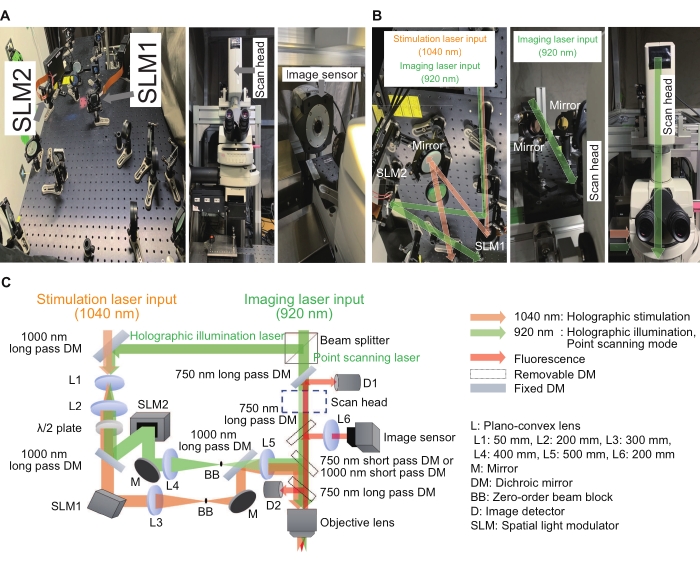
그림 2: 홀로그램 현미경에 사용되는 시스템. (A) 이미지 센서(오른쪽)가 있는 현미경(가운데) 근처의 홀로그램 자극 및 조명 광 경로(왼쪽) 이미지. (B) 각 SLM 주위의 홀로그램 자극 및 조명 광 경로(왼쪽 및 오른쪽)와 스캔 헤드 주변의 점 스캐닝 광 경로(중간 및 오른쪽)의 확대 이미지입니다. (C) 자극 및 이미징 광학 경로의 개략도. 위상 전용 SLM은 디지털 홀로그램을 표시하는 데 사용되며, 빔 확장기(L1과 L2의 조합)와 4f 릴레이 시스템(홀로그램 자극을 위한 L3과 L4와 L4의 조합, 홀로그램 조명을 위한 L4와 L5의 조합)은 각 디지털 홀로그램이 침수 대물 렌즈의 출구 동공에서 이미지화되도록 각각의 SLM 앞뒤에 배치됩니다. 약간 채워진 이미지 크기. 잔차 0차 구성요소를 억제하기 위해 빔 블록이 중간 평면에 배치됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
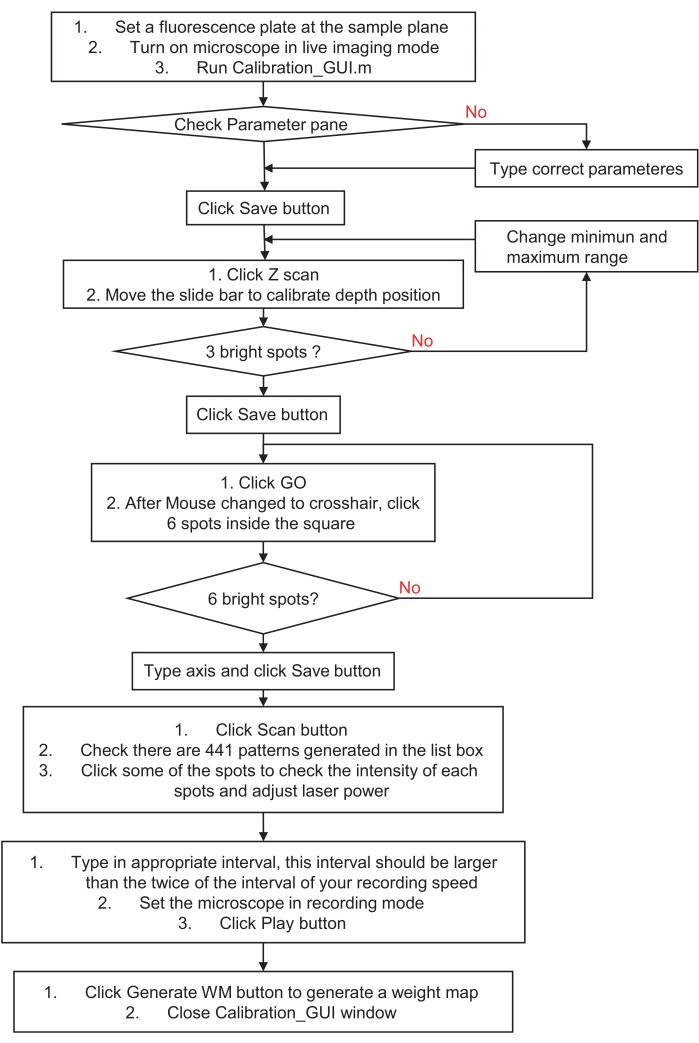
그림 3: 홀로그램 자극 또는 조명 시스템을 보정하는 방법의 흐름도. 이 순서도는 홀로그램 자극 또는 조명 시스템을 샘플 공간 및 이미징 시스템에 보정하는 단계를 설명합니다. 자세한 지침은 3단계, 홀로그램 자극 또는 조명 시스템 준비를 방문하고 샘플 프로그램을 다운로드하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
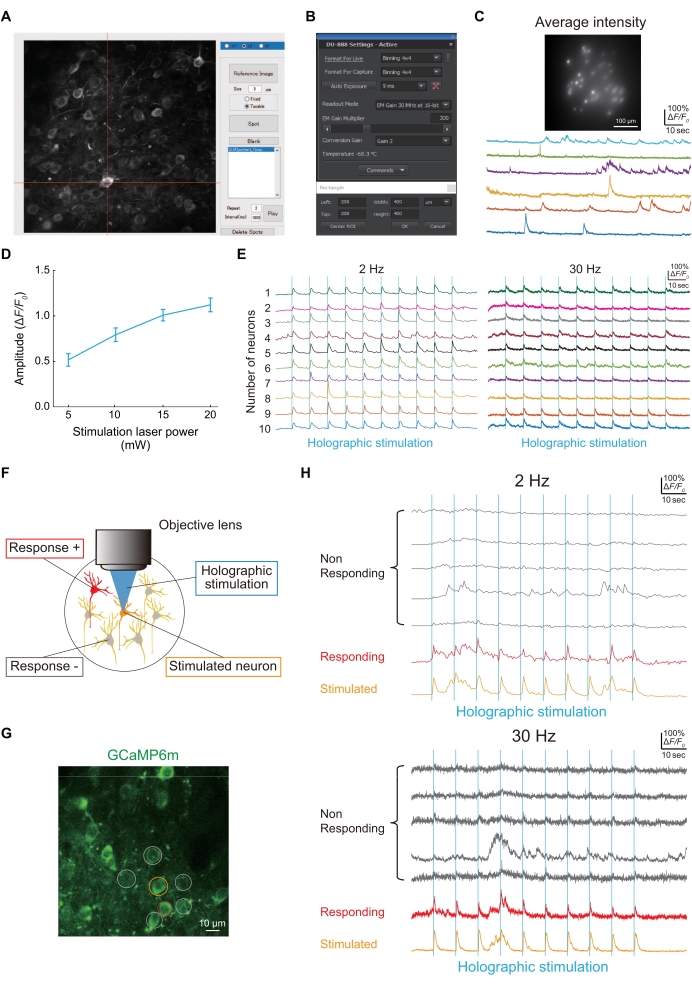
그림 4: 홀로그램 현미경을 사용한 이미징 및 기능적 연결성의 대표적인 결과 . (A) jGCaMP8f 또는 GCaMP6m-P2A-ChRmine을 발현하는 특정 뉴런을 조명하기 위해 뉴런의 이미지를 캡처한 다음 맞춤형 MATLAB 스크립트를 사용하여 뉴런에 스폿을 형성합니다. (B) 이미지 센서의 설정(노출 시간, 이미징 영역 및 비닝). (C) 홀로그램 조명과 이미지 센서를 사용한 100Hz 영상에서 jGCaMP8f를 발현하는 뉴런의 대표 이미지 및 흔적. (D) 이 그래프는 각 레이저 출력에서 홀로그램 자극(1,040nm)에 대한 신경 반응을 보여줍니다(2Hz 이미징 프레임 속도에서 뉴런을 발현하는 GCaMP6m-P2A-ChRmine의 데이터[n = 16]). 오차 막대는 평균의 표준 오차를 나타냅니다. (E) 대표적인 Ca 2+는 2Hz (왼쪽) 및 30Hz(오른쪽) 이미징 프레임 속도에서 10개의 다른 뉴런의 홀로그램 자극(파란색 수직선) 동안 추적합니다. 2 Hz 및 30 HzCa2+ 트레이스에서, 동일한 색상은 동일한 뉴런을 나타낸다. (F) 뉴런 간의 기능적 연결을 평가하는 개략도. 주황색 뉴런이 자극을 받으면 빨간색 뉴런이 동시에 반응하여 이러한 뉴런 사이에 기능적 연결이 있음을 나타냅니다. (G) WT에서 GCaMP6m을 발현하는 S1HL 뉴런의 전형적인 이미지. 스케일 바 = 10 μm. (H) 2Hz(상부) 및 30Hz(하부) 이미징 프레임 속도에서 홀로그램 자극(파란색 수직선) 동안 일반적인 Ca2+ 트레이스. 자극된 뉴런은 주황색으로 원으로 표시되고, 반응하는 뉴런은 빨간색으로 원으로 표시되며, 반응하지 않는 뉴런은 회색으로 표시됩니다. 홀로그램 자극에 대한 신경 반응성은 2Hz 및 30Hz 이미징 속도 모두에서 감지할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 우리의 설정 6 | Prakash, R. 외. 25 | Marshel, J. H. 외. 12 | 로빈슨, N. T. M. 외. 14 | |
| 측면 분해능 | 1.2 마이크로미터 | 1.27 마이크로미터 | ― | 2.22 마이크로미터 |
| 축 분해능 | 8.3 마이크로미터 | 56.86 마이크로미터 | 15.5 마이크로미터 | 10.26 마이크로미터 |
| 대물 렌즈/개구수 | 25배/1.1배 | 20배/0.5배 | 16배/0.8배 | 16배/0.8배 |
표 1: 홀로그램 자극의 공간 해상도에 대한 이전 보고서 및 이 시스템의 요약. 측면 분해능, 축 분해능 및 측정 중에 사용되는 대물 렌즈에 대해 설명합니다.
토론
뇌 기능을 이해하려면 신경 활동의 역학을 추출하여 뇌 기능의 기초가 되는 신경 회로를 정확하게 평가해야 합니다. 또한, 신경 정신 장애의 발병 기전을 밝히기 위해이 신경 회로가 어떻게 변경되는지 확인하는 것이 필수적입니다. 실제로, 알츠하이머병4 및 취약 X 증후군26 의 마우스 모델과 백질 기능이 손상된 마우스3에서 신경 활동이 증가한 것으로 알려져 있다. 또한, 염증성 통증의 마우스 모델에서, 신경 활동의 증가된 동기화와 뉴런 간의 기능적 연결성은 증상과 관련이 있다24. 이광자 홀로그램 현미경을 사용하면 신경 회로를 이해하는 데 필요한 개별 뉴런의 활동과 뉴런 간의 기능적 연결을 동시에 관찰할 수 있습니다. 우리는 1,040nm의 파장을 가진 개구수 = 1.1의 25x 대물 렌즈를 사용했습니다. 이론적 점 확산 함수는 절반 최대치에서 전폭이 측면으로 0.5μm, 축 방향으로 1.7μm인 가우스 분포입니다. 그러나 실제 개구수는 1.1 미만이고 형광 비드에서 측정된 스폿 크기는 측면으로 1.2μm, 축 방향으로 8.3μm입니다. 뉴런 직경이 약 15μm이고 보정 오차가 3μm 이내인 경우 타겟팅은 일반적으로 양호합니다. 그러나, 축 방향의 셀은 더 긴 스폿 크기(6)에 의해 영향을 받을 수 있다. 여기에서는 바이러스 주입, 수술, 홀로그램 자극 또는 조명 시스템의 보정, 현미경 시스템을 사용하여 살아있는 마우스의 신경 활동을 평가하고 조작하기 위한 이미징 프로토콜에 대해 설명했습니다.
헤드 플레이트 이식 및 바이러스 주입에서 홀로그램 현미경을 사용한 생체 내 Ca2+ 이미징을 위한 데이터 수집에 이르기까지 모든 실험 절차를 완료하는 데 2-4주가 소요됩니다. 이 과정은 복잡하고 힘들며, 실험의 궁극적인 성공 여부는 수술 후 염증의 영향을 받는 두개골 창의 상태, Ca2+ 지표 및 옵신의 적절한 선택, 획득한 이미지의 움직임 인공물을 교정할 수 있는지 여부 등 여러 요인에 따라 달라집니다. 특히 성공적인 결과를 위해서는 두 단계가 중요합니다. 첫 번째는 헤드 플레이트 고정 및 수술에 관한 것입니다. 헤드 플레이트를 치과용 시멘트로 마우스 머리에 단단히 고정하는 것이 중요합니다. 또한 수술 중 차가운 ACSF를 사용하여 뼈 조각과 응고된 혈액을 반복적으로 세척하는 것이 중요합니다. 이 절차를 준수하면 염증이 감소하기 때문에 뇌의 면역 체계를 담당하는 세포 인 미세 아교 세포의 역학을 성공적으로 관찰 할 수 있었으며 그 과정과 척추 또는 뉴런의 미세 구조를 활성화하지 않았습니다27,28. 두 번째 문제는 신경 활동의 평가와 조작입니다. 우리는 하나의 뉴런에서 Ca2+ 지표와 옵신을 동시에 발현하기 위해 AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1을 선택했습니다. 이는 하나의 뉴런을 다른 AAV 유형으로 효율적으로 감염시키는 것이 어렵 기 때문입니다. 이러한 선택의 또 다른 이유는 ChRmine이 2광자 레이저(12)를 사용하여 1,040nm에서 신경 활동을 효율적으로 활성화할 수 있기 때문이다. 최근, ChRmine은 초저온 전자 현미경에 의해 얻어진 구조 정보를 기반으로 그 구조를 변이시킴으로써, 그 기능을 향상시킨다고보고되고 있습니다29, 이는 신경 과학 분야의 표적 기능 분석에 유용하다고 여겨지고 있습니다. 이러한 문제에 비추어 볼 때, 홀로그램 현미경을 사용하여 신경 활동을 읽고 정보를 쓸 때 뉴런을 평가하고 조작하는 효과적인 방법을 공유할 필요가 있습니다.
영상 및 광유전학의 최근 발전은 학습 및 기억과 같은 뇌 기능과 관련된 상세한 신경 활동을 밝혀냈으며, 이 신경 활동을 인위적으로 조작하여 뇌 기능을 표현하는 것이 가능하다30. 그러나 신경 활동을 조작하는 기존의 방법은 뇌에 광섬유를 삽입하고 옵신 발현 세포 그룹이 동시에 자극되기 때문에 시간 및 공간 정밀도로 신경 활동을 조작하는 것이 불가능하기 때문에 매우 침습적입니다. 우리의 방법은 뇌의 특정 뉴런만을 자극하여 신경 활동을 조작할 수 있으므로 특정 자극 패턴과 높은 시공간 해상도로 신경 활동을 조작할 수 있습니다. 또한, 뉴런 간의 기능적 연결성은 뇌 절편 실험31을 사용하여 소수의 뉴런에서만 평가될 수 있다는 점에 유의하는 것이 중요합니다. 그러나 이 기술을 사용하면 살아있는 동물의 여러 뉴런을 동시에 평가할 수 있습니다.
현재 홀로그램 현미경의 주요 한계 중 하나는 마우스 머리를 고정해야 하므로 마우스의 동작이 제한된다는 것입니다. 최근에는 소형화된 이광자 현미경이 개발되었으며(32), 장치의 추가 소형화에 따라 자유롭게 움직이는 마우스에서 홀로그램 자극을 통한 생체 내 Ca2+ 이미징이 가능할 수 있습니다. 또한, 이 현미경의 잠재력은 이미징의 시간적 해상도를 개선하고 이를 고감도 전압에 민감한 형광 단백질(33)과 결합시킴으로써 확장될 수 있다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 작업은 혁신 분야에 대한 과학 연구를 위한 보조금(19H04753, 19H05219 및 25110732 to H. W.), 변형 연구 분야에 대한 보조금(A)(20H05899 H. W., 20H05886 O. M., 21H05587 to D. K.), 공동 국제 연구 육성(B)(20KK0170 to H. W.), 과학 연구 보조금(Grant-in-Aid for Scientific Research)(18H02598 to H. W.), 과학 연구 보조금 (A) (21H04663 to O. M.), 초기 경력 과학자 보조금 (20K15193 to X. Q.), JST CREST 보조금 번호 JPMJCR1755, 일본 및 JST A-STEP 보조금 번호 JPMJTR204C.
자료
| Name | Company | Catalog Number | Comments |
| 25x Objective | Nikon | N25X-APO-MP | Objective |
| A1MP | Nikon | A1MP | Microscope |
| AnesII | Bio machinery | AnesII | Anesthesia delivery system |
| C2 plus | Nikon | C2 plus | Microscope |
| DECADRON Phosphate Injection | Aspen | 21N024 | Avoid cerebral edema |
| Dental Drill | Jota | C1.HP.005 | Dental drill |
| Electric Microinjector | NARISHIGE | IM-31 | Pressure injection system |
| FEATHERS | FEARGER | FA-10 | Shaving |
| G-CEM ONE ADHESIVE ENHANCING PRIMER | GC | 2110271 | Resin cement primer for dental adhesion |
| G-CEM ONE neo | GC | 43093 | Resin cement for dental adhesion |
| Glass Capillary with Filament | NARISHIGE | GDC-1 | Glass capillary |
| Image Detector | Hamamatsu | H10770PA-40 | GaAsP photocathode photomultiplier tube |
| Imaging Software | Nikon | NISelements | Imaging software |
| Isoflurane Inhalation Solution | Pfizer | 229KAR | Anesthetics |
| iXon EMCCD Camera | Andor | iXon Life 888 | Image sensor |
| Ketamine | daiitisannkyou | s9-018506 | Anesthetics |
| Leica-M60 | Leica | M60 | Stereoscope |
| Linicon | Linicon | LV-125 | Vacuum pump |
| Mode-locked Ti:sapphire Chameleon Ultra II laser | Coherent | Chameleon Discovery NX | Femtosecond laser |
| Mos-Cure | U-VIX | mini 365 | Portable LED UV Light Source |
| PEN Bright | SHOFU INC. | PEN Bright | Dental light curing unit |
| Puller | SUTTER instaument | P-97 | Puller |
| Stereotaxic Instrument (for Mice) | NARISHIGE | SR-6M-H | Stereotaxic instrument |
| Stereotaxic Micromanipulator | NARISHIGE | SM-15R | Stereotaxic micromanipulator |
| Super-Bond CATALYST V | SUN MEDICAL | 8070 | Dental adhesive resin cement |
| Super-Bond Dental Adhesive Monomer | SUN MEDICAL | 8071 | Dental adhesive monomer |
| Super-Bond Teeth Color Polymer Powder | SUN MEDICAL | 145052000 | Teeth color polymer powder |
| Tarivid Ophthalmic Ointment 0.3% | Santen Pharmaceutical | TRN3952 | Eye ointment |
| UlTIMATE XL | NSK | Y141446 | Dental laboratory micromotor control unit |
| UV Curing Optical Adhesives | THORLABS | NOA61 | UV Curing Optical Adhesives |
| Xylazine | Bayer | KP0F2BK | Anesthetics |
참고문헌
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nature Neuroscience. 17 (7), 987-994 (2014).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Kato, D., et al. Motor learning requires myelination to reduce asynchrony and spontaneity in neural activity. Glia. 68 (1), 193-210 (2020).
- Busche, M. A., et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo. Nature Neuroscience. 22 (1), 57-64 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Quan, X., Kato, D., Daria, V., Matoba, O., Wake, H. Holographic microscope and its biological application. Neuroscience Research. 179, 57-64 (2022).
- Adesnik, H., Abdeladim, L. Probing neural codes with two-photon holographic optogenetics. Nature Neuroscience. 24 (10), 1356-1366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Svoboda, K., Denk, W., Kleinfeld, D., Tank, D. W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612), 161-165 (1997).
- Carrillo-Reid, L., Han, S., Yang, W., Akrouh, A., Yuste, R. Controlling visually guided behavior by holographic recalling of cortical ensembles. Cell. 178 (2), 447-457 (2019).
- Marshel, J. H., et al. Cortical layer-specific critical dynamics triggering perception. Science. 365 (6453), (2019).
- Gill, J. V., et al. Precise holographic manipulation of olfactory circuits reveals coding features determining perceptual detection. Neuron. 108 (2), 382-393 (2020).
- Robinson, N. T. M., et al. Targeted activation of hippocampal place cells drives memory-guided spatial behavior. Cell. 183 (6), 1586-1599 (2020).
- Packer, A. M., Russell, L. E., Dalgleish, H. W., Häusser, M. Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo. Nature Methods. 12 (2), 140-146 (2015).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nature Neuroscience. 21 (6), 881-893 (2018).
- Yang, W., Carrillo-Reid, L., Bando, Y., Peterka, D. S., Yuste, R. Simultaneous two-photon imaging and two-photon optogenetics of cortical circuits in three dimensions. Elife. 7, 32671 (2018).
- Forli, A., et al. Two-photon bidirectional control and imaging of neuronal excitability with high spatial resolution in vivo. Cell Reports. 22 (11), 3087-3098 (2018).
- Pégard, N. C., et al. Three-dimensional scanless holographic optogenetics with temporal focusing (3D-SHOT). Nature Communications. 8 (1), 1228 (2017).
- Dal Maschio, M., Donovan, J. C., Helmbrecht, T. O., Baier, H. Linking neurons to network function and behavior by two-photon holographic optogenetics and volumetric imaging. Neuron. 94 (4), 774-789 (2017).
- Russell, L. E., et al. All-optical interrogation of neural circuits in behaving mice. Nature Protocols. 17 (7), 1579-1620 (2022).
- Oron, D., Papagiakoumou, E., Anselmi, F., Emiliani, V. Two-photon optogenetics. Progress in Brain Research. 196, 119-143 (2012).
- Hernandez, O., et al. Three-dimensional spatiotemporal focusing of holographic patterns. Nature Communications. 7, 11928 (2016).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Science Advances. 7 (12), 8261 (2021).
- Prakash, R., et al. Two-photon optogenetic toolbox for fast inhibition, excitation and bistable modulation. Nature Methods. 9 (12), 1171-1179 (2012).
- Gonçalves, J. T., Anstey, J. E., Golshani, P., Portera-Cailliau, C. Circuit level defects in the developing neocortex of Fragile X mice. Nature Neuroscience. 16 (7), 903-909 (2013).
- Akiyoshi, R., et al. Microglia enhance synapse activity to promote local network synchronization. eNeuro. 5 (5), (2018).
- Haruwaka, K., et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nature Communications. 10 (1), 5816 (2019).
- Kishi, K. E., et al. Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine. Cell. 185 (4), 672-689 (2022).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Ko, H., et al. The emergence of functional microcircuits in visual cortex. Nature. 496 (7443), 96-100 (2013).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Villette, V., et al. ultrafast two-photon imaging of a high-gain voltage indicator in awake behaving mice. Cell. 179 (7), 1590-1608 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유