Method Article
구강 내 형광 카메라를 사용한 치태의 반자동 평면 정량
요약
본 연구는 구강 내 형광 카메라로 획득한 이미지를 기반으로 공개된 치태의 평면 정량화를 위한 반자동 디지털 이미지 분석 절차를 제시한다. 이 방법을 사용하면 연구 환경에서 치태를 빠르고 안정적으로 정량화할 수 있습니다.
초록
치태 축적은 임상 지표 또는 그렇지 않으면 플라크 침전물로 덮인 치아의 상대적 면적을 측정하는 평면 측정 플라크 지수(PPI)를 사용하여 정량화됩니다. 임상 지표에 비해 PPI는 판별력이 더 높지만 기존의 평면 측정법은 이미지 처리 소프트웨어를 사용하여 각 이미지에 대해 플라그로 덮인 치아 영역과 깨끗한 치아 영역을 수동으로 결정해야 하기 때문에 시간이 많이 걸리는 분석입니다. 여기에서는 최대 1,000개의 이미지를 동시에 신속하게 처리할 수 있는 치태의 반자동 평면 정량화 방법을 제시합니다. 이 방법은 구강 내 카메라로 획득한 형광 이미지에서 공개된 플라크, 건전한 치아 표면 및 연조직 사이의 향상된 대비를 활용합니다. 임상 절차의 신중한 실행과 정확한 이미지 획득은 플라크로 덮인 영역의 성공적인 반자동 식별을 위한 중요한 단계입니다. 이 방법은 건전한 안면 및 구강 치아 표면, 대부분의 복합 레진 수복물 및 교정 브래킷이 있는 치아의 평면 측정에 적합하지만 금속 수복물에는 적합하지 않습니다. 기존의 PPI 기록과 비교할 때 반자동 평면계는 분석에 소요되는 시간과 주관적인 사람의 입력을 상당히 줄여 평면 측정의 재현성을 높입니다.
서문
연구 환경에서 치태의 정량화는 임상 지표를 사용하거나 그렇지 않은 경우 평면 측정 치태 지수(PPI)1를 기록하여 수행됩니다. Turesky 수정 Quigley-Hein 플라크 지수와 같은 임상 지표는 작업자의 플라크 범위에 대한 시각적 평가와 순서 척도2에 대한 점수 할당에 의존합니다. 채점은 빠르지만 임상 지표를 사용하려면 힘든 심사관 간 및 심사관 내 보정이 필요하며 등급은 항상 어느 정도의 주관성을 겪습니다 3,4,5. 또한, 점수 수가 제한되어 있기 때문에 임상 지표는 플라크 적용 범위에서 관련 차이를 감지하지 못할 수 있다6.
평면 기록의 경우, 플라크 커버리지의 범위는 플라크 커버 영역을 치아 표면의 전체 면적으로 나누어 디지털 이미지에서 결정된다(7). 연속 척도를 사용하면 정확도가 높아지고 통계 분석 8,9,10에서 높은 판별력을 나타냅니다. 또한, 평면계는 지수가 계산되고 시험관(11)에 의해 추정되지 않기 때문에 덜 주관적이라고 주장할 수 있다. 전통적으로, 플라크-피복 및 전체 치아 영역은 이미지-프로세싱 소프트웨어(7,12)를 사용하여 각각의 이미지에서 관심의 영역을 그리는 것에 의해 PPI 기록을 위해 수동으로 결정되었다. 결과적으로, 이전에는 평면 분석에 시간이 많이 소요되어 대규모 임상 연구에 대한 적용 가능성이 떨어졌습니다 6.
전통적인 백색광 이미지에서는 플라크로 덮인 영역, 깨끗한 치아 영역 및 주변 조직 사이의 대비가 희미하므로 일반적으로 물체의 강도 기반 감지에 의존하는 자동화된 이미지 처리가 심각하게 방해를 받습니다(13,14). 형광 카메라로 촬영한 이미지는 공개된 플라그, 녹색 스펙트럼에서 강하게 자동 형광을 발하는 깨끗한 치아, 비형광 연조직 사이의 대비가 크게 향상되었음을 보여준다1.
여기에서는 기존 PPI 기록에 비해 이미지 분석에 소요되는 시간을 크게 줄이는 반자동 평면도 측정 방법을 제시합니다. 이 방법은 표준 개시 절차, 상업적으로 이용가능한 형광 카메라 및 이미지 분석 프리웨어를 사용합니다. 이미지 획득 및 이미지 분석에 중요한 매개변수와 방법의 일반적인 실수 및 한계에 대해 설명합니다.
프로토콜
이 연구는 Midtjylland 지역 윤리 위원회(1-10-72-259-21)의 승인을 받았으며 헬싱키 선언 및 그 수정안에 따라 수행되었습니다.
1. (선택) 주문 제작 스페이서의 제작
참고: 카메라 헤드의 위치를 표준화하기 위해 이미지 획득 중에 맞춤형 3D 프린팅 스페이서를 사용할 수 있습니다. 스페이서는 형광 이미지 기록에 필수가 아닙니다.
- 스페이서의 디자인
- 구강 내 형광 카메라의 카메라 헤드에 맞는 스페이서를 설계합니다. 이렇게 하려면 디지털 스캐너로 카메라 헤드를 스캔합니다. 스캔을 전용 소프트웨어로 가져옵니다.
- 카메라 헤드를 원하는 형태와 카메라 헤드까지의 위치 거리(즉, 4mm)에 맞도록 스페이서를 설계합니다. STL 파일로 내보내기(설계의 예는 보충 파일 S1로 첨부됨).
- 스페이서의 적층 제조
- 프린터와 연결된 적층 제조 소프트웨어를 열고 기본 설정을 선택합니다. 프린터 | 사용 가능한 3D 프린터 선택 | 다음 | 모양: 투명 | 다음 | 인쇄 모드: 50미크론 | 다음 | 빌드 스타일: 표준 | 다음.
- 파일 | 가져오기 | STL 파일 선택 | 열다.
- 인쇄 플랫폼에서 스페이서의 위치를 정의합니다. Transform( 변환)을 클릭하고 스페이서를 플랫폼 표면에 최대한 가깝게 플랫폼 모서리로 끕니다.
- 추가 스페이서를 인쇄하려면 복사 | 선형 패턴. 인쇄 플랫폼에 추가 개체를 맞추기 위해 개수와 거리를 조정하고 설정을 클릭합니다.
- 객체의 지지대를 설계하려면 스마트 지원 | 스타일: 일반 | 생성 | 유형: 게이트 | 지원을 만듭니다.
- 인쇄 작업을 3D 프린터로 보냅니다. 대기열에 추가를 클릭합니다. 소프트웨어는 대기열에 추가할 때 오류를 식별하기 위해 STL 파일의 품질 검사를 자동으로 수행합니다. 그런 다음 대기열에 추가 | 작업 이름 | F4X | 대기열에 추가합니다.
- 3D 프린터에 깨끗한 인쇄 플랫폼을 장착하고 적절한 수지를 추가합니다. 작업 시작을 클릭하고 수지의 QR 코드를 스캔합니다. 인쇄 플랫폼이 비어 있고 깨끗한지, 수지 트레이가 가득 찼는지, 첨가하기 전에 수지가 교반되었는지 확인합니다. 작업 시작을 클릭합니다.
- 인쇄 작업이 완료되면 인쇄 플랫폼에서 스페이서를 제거합니다.
- 이소프로판올이 있는 초음파 수조에서 스페이서를 3분 동안 세척합니다. 신선한 이소프로판올을 사용하여 청소를 반복하십시오. 스페이서를 자연 건조하십시오.
- 스페이서를 후경화 오븐에서 10분 동안 중합하여 재료의 전체 중합을 확보합니다.
- 지지대 재료를 제거하고 빛이 재료를 통해 침투하지 않도록 스페이서를 얼룩지게 합니다.
2. 명판 공개 및 이미지 획득
- 형광 카메라에 맞춤형 스페이서를 장착합니다(옵션). 구강 내 카메라를 컴퓨터에 연결하고 카메라 소프트웨어를 엽니다.
- 환자 | 시스템에서 환자를 만드는 새 환자입니다. 환자 정보를 입력합니다. 환자 | 저장: 환자 데이터를 저장합니다. 비디오를 클릭합니다. 이제 구강 내 카메라를 사용할 준비가 되었습니다.
- 실내 조명을 어둡게 합니다.
- 관심 있는 치아 표면에 면 펠릿이 있는 빨간색 공개 염료(즉, 5% 에리스로신)를 바르면 플라크를 공개합니다.
- 환자에게 과도한 염료를 제거하기 위해 10 초 동안 물로 헹구도록 지시하십시오. 면봉을 사용하여 치은 얼룩을 제거합니다. 각 치아를 3 초 동안 자연 건조시킵니다.
- 구강 내 카메라를 관심 치아 앞의 수평 위치에 놓고 스페이서가 치은/인접 치아에 닿도록 합니다. 카메라 버튼을 눌러 형광 이미지를 획득합니다.
알림: 관심 있는 전체 치아 표면에 초점이 맞춰져 있고 길항제 또는 반대쪽 치아 표면을 포함하지 않고 이미지에 캡처되어 있는지 확인하십시오. - 관심 있는 모든 치아에 대해 2.4-2.6단계를 반복합니다.
- 카메라 소프트웨어의 모든 이미지를 표시하십시오. 메뉴에서 이미지/비디오 저장을 클릭합니다.
참고: 이미지가 "caries" 모드가 아닌 "플라크" 모드로 저장되었는지 확인하십시오. 메뉴의 P/C 기호는 현재 모드를 나타냅니다. - 이미지를 내보내려면 뷰어로 이동합니다. 내보낼 이미지를 선택합니다. 파일 | 내보내기(다른 이름으로 저장...) | 환자의 모든 이미지를 이미지를 내보냅니다. 내보내기 창에서 다음 설정을 선택합니다. 모드: 표준 | 내보내기 경로: 원하는 폴더 선택 | 이미지 유형 선택: 왼쪽 상자 선택 | 이미지 상태: 원본 데이터입니다. 내보내기 창을 확장하여 더 많은 옵션을 표시합니다. 다음을 선택합니다. 파일 이름에는 다음이 포함됩니다. 카드 번호 또는 사용자 입력 OR 환자 이름 | 형식: TIF. 확인을 클릭하여 이미지를 내보냅니다.
- 또는 이미징 전에 자동 파일 내보내기를 설정합니다. 클릭 Options | 구성 표시 | 모듈 | 뷰어 | 내보내기/이메일 | 내보내기 옵션 | 모드: 자동 내보내기| 내보내기 경로: 원하는 폴더 선택 | 이미지 상태: 원본 데이터입니다. 다음을 선택합니다. 파일 이름에는 다음이 포함됩니다. 카드 번호 또는 사용자 입력 OR 환자 이름 | 형식: TIF. OK( 확인 )를 클릭하여 기본 내보내기 설정을 지정합니다. 자동 파일 내보내기가 설정되면 저장될 때 이미지가 자동으로 내보내집니다(2.8단계).
3. 디지털 이미지 분석
참고: 디지털 이미지 분석은 이미지 획득 후 언제든지 수행할 수 있습니다. 최대 1,000개의 형광 이미지 배치를 병렬로 처리할 수 있습니다. 큰 이미지 배치의 분석이 컴퓨팅 파워를 초과하는 경우, 이미지 크기는 분석 전에 감소될 수 있다.
- 전체 치아 면적의 정량화
- 모든 이미지의 이름을 순차적인 색인 번호(예: Planimetry_001, Planimetry_002,...)로 바꿉니다. File | 이미지 가져오기 | 색상으로 가져오기.
- Segment(세그먼트) | 자동 세그멘테이션 | 사용자 지정 임계값. 구강 연조직의 강도(즉, 80)보다 높은 "낮음" 임계값을 설정합니다. "높음" 임계값을 255로 둡니다. 따라서 치아(깨끗한 영역과 플라크로 덮인 영역 모두)만 소프트웨어에서 개체로 인식됩니다. Apply | 확인 | 세그먼트! 을 클릭하여 세그멘테이션을 시작합니다.
- 이미지 시리즈의 이름을 두 번 클릭하여 시각화 도우미를 엽니다. 개체 편집기(OBJ)를 입력합니다. 분할된 이미지의 시각적 품질 관리를 수행하고, 이러한 개체를 거부 및 삭제하여 아티팩트를 삭제합니다.
- 모든 이미지의 나머지 개체 병합(모든 이미지 | 선택한 객체 병합). 이제 이미지당 하나의 개체가 있습니다. 각 영상의 총 치아 면적 정량화(분석 | 객체 측정 | 모두 지우기 | 픽셀). 데이터를 내보냅니다.
- 플라크로 덮인 영역의 정량화
- 형광 이미지 시리즈를 소프트웨어로 다시 가져오고, 이번에는 빨간색, 녹색 및 파란색 채널을 분할합니다(파일 | 이미지 가져오기 | 회색으로 가져오기)를 클릭합니다. 파란색 채널 이미지를 닫습니다. RGB 이미지에서 빨간색 채널 이미지로 객체 레이어를 전송합니다(세그먼트 | 전송 객체 레이어).
- 개체 편집기를 사용하여 빨간색 채널 이미지에서 개체가 아닌 픽셀을 삭제합니다(모든 이미지 | 객체가 아닌 픽셀(복셀)을 삭제합니다. 이제 이미지에서 연조직이 제거됩니다.
- 플라그로 덮인 치아 영역과 깨끗한 치아 영역 사이의 대비를 향상시키려면 빨간색 채널 이미지 시리즈에 2배를 곱합니다(편집 | 이미지 계산기 | 곱셈 | 매개변수: 요인 2.00 | 신청 | 확인).
- 이미지에서 깨끗한 치아 영역을 제거하려면 향상된 빨간색 채널 이미지 시리즈에서 녹색 채널 이미지 시리즈를 뺍니다(편집 | 이미지 계산기 | 두 번째 피연산자 이미지: Planimetry_green | 뺄셈 | 신청 | 확인).
- 치아의 플라크로 덮인 영역을 식별하려면 결과 이미지 계열의 임계값 기반 분할을 수행합니다(세그먼트 | 자동 세그멘테이션 | 사용자 지정 임계값). 깨끗한 치아 영역의 강도(즉, 80)보다 높은 "낮음" 임계값을 설정합니다. "높음" 임계값을 255로 둡니다. 플라크로 덮인 영역만 소프트웨어에서 개체로 인식됩니다. Apply | 확인 | 세그먼트! 을 클릭하여 세그멘테이션을 시작합니다.
- 개체 편집기에서 분할된 이미지의 시각적 품질 관리를 수행하고 이러한 개체를 거부 및 삭제하여 아티팩트를 삭제합니다. 모든 이미지의 나머지 개체 병합(모든 이미지 | 선택한 객체 병합). 각 이미지에서 플라크 커버 영역을 정량화(분석 | 객체 측정 | 모두 지우기 | 픽셀). 데이터를 내보냅니다.
- 내보낸 데이터 테이블을 전용 소프트웨어에서 엽니다. 방정식 (1)에 따라 PPI를 계산합니다.
식 (1)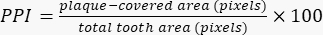
결과
제시된 방법을 사용하면 치아의 플라크로 덮인 영역의 신속한 반자동 평면 정량화가 가능합니다(그림 1). 플라크 침전물은 에리스로신(erythrosine)에 의해 가시화되는 반면, 깨끗한 치아 부위와 후천된 펠리클은 염색되지 않은 채로 남아 있다16(그림 2A). 형광 카메라로 이미지를 획득하면 깨끗한 치아 영역, 플라그로 덮인 영역 및 주변 연조직 간의 대비가 상당히 향상됩니다(그림 2B, C). 형광 카메라는 두 개의 감지 창(하나는 녹색, 다른 하나는 빨간색 스펙트럼)으로 작동합니다. 깨끗한 치아 부위와 비교하여 플라그로 덮인 부위는 빨간색 채널에서 약간 더 밝게 나타납니다(그림 2D,E). 녹색 채널에서 치아의 자가형광은 플라크로 덮인 영역에서 상당히 가려집니다(그림 2F). 이 마스킹 효과는 녹색 채널 이미지가 빨간색 채널 이미지에서 뺄 때 이미지 분석 중에 이용됩니다(그림 2G). 결과 이미지에서 깨끗한 영역과 플라크로 덮인 영역 사이의 강한 대비(그림 2H)를 통해 PPI의 강도 임계값 기반 반자동 결정이 가능합니다. 최대 1,000개의 형광 이미지를 동시에 처리할 수 있습니다.
맞춤형 3D 프린팅 스페이서를 사용하여 관심 치아와 동일한 거리에서 카메라 헤드의 표준화된 위치를 개선할 수 있습니다. 스페이서는 또한 주변광으로부터 치아를 차폐하여 획득된 이미지에서 공개된 플라크, 깨끗한 치아 영역 및 주변 연조직 사이의 대비를 향상시킵니다. 스페이서는 세 가지 고정 요소를 사용하여 카메라 헤드에 장착됩니다(그림 3).
설명된 방법은 안면 및 구강 치아 표면 모두에서 치은연상 플라크 및 치석의 평면 측정에 사용할 수 있습니다(그림 4A-D). 치열궁의 곡률에 따라 스페이서를 잇몸과 밀착시켜 카메라 헤드와 치아 사이의 거리를 동일하게 유지하기 어려울 수 있습니다. 플라크 면적 커버리지는 전체 치아 면적을 기준으로 결정되기 때문에 이러한 차이는 PPI 기록에 영향을 미치지 않을 것입니다. 다양한 치아 색 물질이 다양한 강도17,18,19로 녹색 스펙트럼에서 형광을 발합니다. 따라서 PPI는 일반적으로 유리 이오노머 시멘트 및 복합 레진 수복물을 사용한 치아에 대한 표준 이미지 분석 알고리즘을 사용하여 측정할 수 있습니다(그림 4E-H). 대조적으로, 아말감 및 주조 수복물은 일반적으로 적색 및 녹색 채널 모두에서 희미하게 방출되므로 이러한 표면의 플라크 범위를 결정할 수 없습니다(그림 4I,J). 금속 교정 브래킷의 경우에도 마찬가지이지만 브래킷 표면은 일반적으로 PPI 기록에서 제외되기 때문에 반자동 평면계는 교정 환자에게 적합합니다(그림 4K,L).
형광 이미지에서 플라크로 덮인 영역의 성공적인 반자동 식별은 임상 절차의 모든 단계를 신중하게 실행하는 데 크게 의존합니다. 주변 조명이 너무 많이 이미지에 들어오면 빨간색 채널의 배경 밝기가 증가하여 치아와 연조직을 구별하기 어려워집니다(그림 5A, B). 따라서 이미지를 캡처하는 동안 실내 조명을 어둡게 해야 합니다. 환자가 이미지 획득 중에 입을 충분히 열지 않으면 길항제 치아가 관심 있는 치아와 함께 이미지화되어 반자동 처리를 방해할 수 있습니다(그림 5C). 소구치 또는 어금니에 평면 측정을 수행할 때 교합면의 이미징 부분을 피하기 위해 카메라의 올바른 각도가 중요합니다(그림 5D, E). 플라크 침전물이 공개되면 운영자는 즉시 이미지 획득을 진행해야 합니다. 그렇지 않으면 에리스로신이 씻겨 나갈 수 있으며 플라크로 덮인 치아 부위와 깨끗한 치아 부위의 대비가 너무 희미해질 수 있습니다. 그러나 어떤 경우에는 공개 용액이 치은을 강하게 얼룩지게 할 수 있으며 다음 헹굼 중에 얼룩이 제거되지 않을 수 있습니다(그림 5F). 플라크로 덮인 부위를 과대 평가하지 않으려면 추가 헹굼이나 면봉으로 치은을 부드럽게 닦아 얼룩을 줄일 수 있습니다.
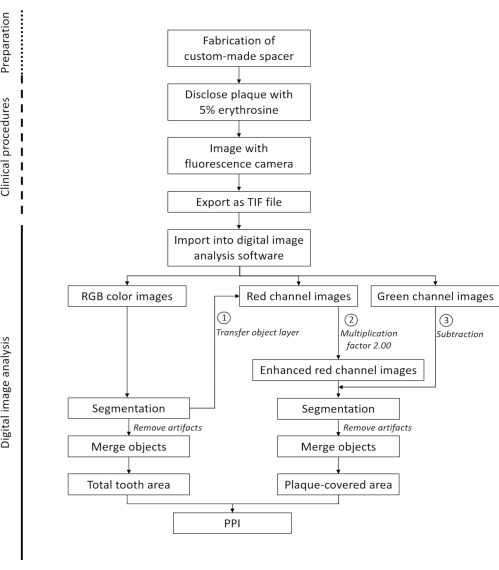
그림 1: 치아 표면의 플라크 커버리지에 대한 반자동 정량화를 위한 워크플로. 약어: PPI = 평면 플라크 지수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
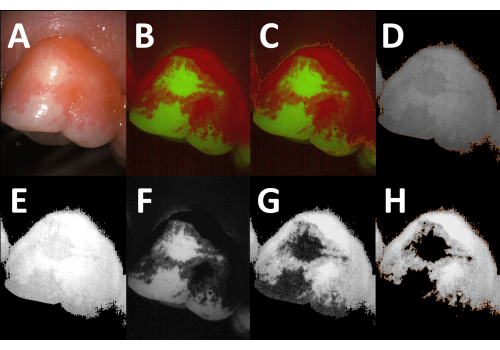
그림 2: 디지털 이미지 분석 절차. (A) 공개된 플라크의 백색광 이미지(치아 26, 안면 측면). (B) 형광 카메라(Red-Green-Blue [RGB] 모드)로 획득한 해당 이미지. 플라그로 덮인 치아 부위와 깨끗한 치아 부위 사이의 대비가 강화되었습니다. (C) 주황색 윤곽선으로 표시된 전체 치아 면적은 강도 임계값 기반 분할로 식별됩니다. (D) RGB 이미지의 객체 레이어가 빨간색 채널 이미지(주황색 윤곽선)로 전송되고 객체가 아닌 픽셀(배경, 연조직)이 삭제됩니다. (E) 적색 채널 이미지의 밝기가 2배 향상되었습니다. (F) 녹색 채널 이미지입니다. 플라크로 덮인 영역에서 감소된 자가형광에 주목하십시오. (G) 수정된 적색 채널 이미지(E)에서 녹색 채널 이미지(F)를 뺀 후 플라크 커버 영역과 깨끗한 치아 영역 사이의 대비가 분명합니다. (H) 강도 역치 기반 분할 후 플라크 피복 영역을 물체(주황색 윤곽선)로 식별하고 평면 플라크 지수(PPI)를 계산할 수 있습니다(PPI = 81.6%). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
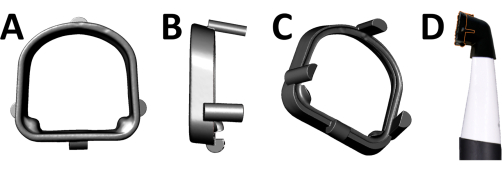
그림 3: 맞춤형 스페이서. 맞춤형 스페이서 view(A) 전면, (B) 측면 및 (C) 후면. (D) 스페이서가 장착된 형광 카메라(주황색 윤곽선). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
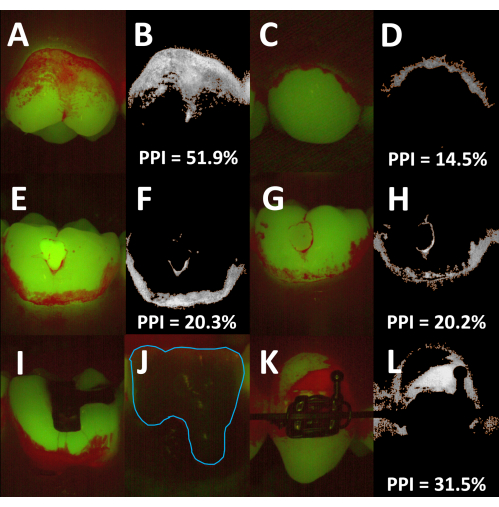
그림 4: 반자동 평면측정의 적용 및 한계. (A) 안면 치아 표면의 형광 이미지. (B) 플라크 커버 영역을 보여주는 해당 처리된 이미지(주황색 윤곽선, 평면 플라크 지수[PPI] = 51.9%). (C) 구강 치아 표면의 형광 이미지. (D) 플라크-피복된 영역을 보여주는 상응하는 처리된 이미지(주황색 윤곽선; PPI = 14.5%)입니다. (E-H) 복합 레진 수복물이 있는 치아 이미지. E의 수복물은 녹색 스펙트럼에서 강하게 형광을 발하는 반면, G의 수복물은 주변의 깨끗한 치아 영역보다 약간 희미하게 보입니다. 두 이미지 모두에서 PPI는 표준 이미지 분석 알고리즘을 사용하여 결정될 수 있습니다. (에프, 에이치) 플라크로 덮인 영역을 보여주는 처리된 이미지(주황색 윤곽선; PPI = 각각 20.3% 및 20.2%). (나,제) 아말감 수복물이 있는 치아(I)와 금속-세라믹 크라운이 있는 치아(J, 파란색 윤곽선, 수동으로 추가됨)의 형광 이미지. 두 수복물 모두 비형광성이며 플라크 침전물은 반자동 평면계로 정량화할 수 없습니다. (K) 금속 교정 브래킷이 있는 치아의 형광 이미지. 브래킷이 분석에서 제외됨에 따라 표준 이미지 분석 알고리즘(L, 주황색 윤곽선, PPI = 31.5%)을 사용하여 PPI를 결정할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
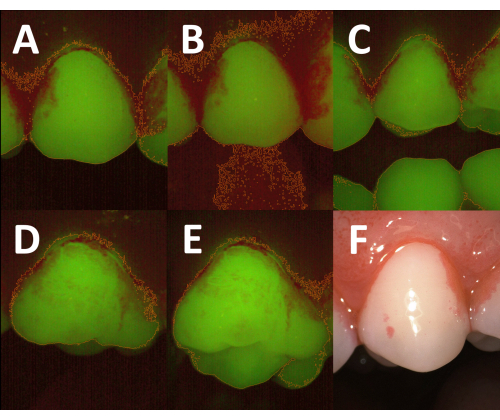
그림 5: 임상 절차가 이미지 품질 및 반자동 평면 측정 결과에 미치는 영향 . (A) 희미한 실내 조명으로 획득한 형광 이미지. 전체 치아 면적은 임계값 기반 이미지 분할(주황색 윤곽선) 후에 올바르게 결정됩니다. (B) 실내 조명을 켠 상태에서 획득한 동일한 치아의 형광 이미지. 적색 스펙트럼의 증가된 배경 방출로 인해 역치 기반 분할은 치아 표면과 주변 연조직(주황색 윤곽선)을 정확하게 구별하지 못합니다. (C) 불충분한 입 벌림으로 획득한 형광 이미지. 공개되지 않은 길항제 치아는 이미지에서 볼 수 있으므로 전체 치아 면적 (주황색 윤곽선)에 포함됩니다. 올바른 평면 플라크 지수를 얻으려면 이미지 분석 중에 수동으로 제거해야 합니다. (D) 카메라 헤드의 최적 위치로 획득한 형광 이미지. 전체 치아 면적 (주황색 윤곽선)은 얼굴 측면으로 제한됩니다. (E) 카메라 헤드의 최적이 아닌 각도로 획득한 D 의 치아 형광 이미지. 교합면의 일부가 포착되어 전체 치아 면적이 증가합니다(주황색 윤곽선). (F) 치은의 두드러진 염색이 있는 공개된 플라크의 백색광 이미지. 적색 스펙트럼의 높은 방출은 플라크로 덮인 영역의 과대 평가로 이어질 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 S1: 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
형광 이미지를 기반으로 한 반자동 평면계를 위해 제시된 방법은 기존의 평면측정법과 비교하여 연구 환경에서 건전한 치아 표면의 치태 정량화를 개선합니다20. 반자동 평면계를 사용하면 사전 결정된 후처리 알고리즘을 사용하여 최대 1,000개의 이미지에서 PPI를 동시에 측정할 수 있습니다. 따라서, 이 방법은 종래의 평면측정법보다 훨씬 더 시간-효율적이며, 여기서 전체 치아 영역 및 플라크-피복 영역은 이미지 프로세싱 소프트웨어(7,12)에서 관심 영역을 그리는 것에 의해 수동으로 결정된다. 또한 이미지 분석에서 인간의 판단 범위는 이미지 분할을 위한 밝기 임계값의 선택으로 축소됩니다. 이로써 모든 영상이 동일하게 취급되고, 시험관 주관성의 영향이 크게 줄어든다(11).
프로토콜의 중요한 단계는 주로 최적의 이미지 품질을 위해 고도로 표준화된 방식으로 수행되어야 하는 임상 절차와 관련이 있습니다. 공개 용액은 부드럽고 균일하게 도포되어야 하며, 염료의 유실 및 이미지 대비 손실을 방지하기 위해 헹굼 및 공기 건조 직후에 이미지를 획득해야 합니다. 또한, 헤모글로빈이 적색 채널(19)에서 기록 된 형광을 향상시킬 수 있기 때문에 치은 출혈을 피할 필요가 있습니다. 이미지 캡처는 주변광의 간섭을 줄이기 위해 실내 조명을 어둡게 한 상태에서 수행해야 하며, 환자는 길항제 치아가 이미지에 나타나지 않도록 입을 충분히 벌려야 합니다. 카메라 헤드는 교합면과 반대쪽 치아의 일부가 포착되지 않도록 치아 축에 수직으로 위치해야 합니다.
최적이 아닌 이미지 획득으로 인한 아티팩트는 대부분의 경우 이미지 분석 중에 제거될 수 있지만 처리 시간이 상당히 늘어납니다. 세그멘테이션 중에 오브젝트로 인식되는 일부 아티팩트는 오브젝트 편집기에서 간단히 삭제하여 지울 수 있습니다. 아티팩트가 플라크로 인식된 영역과 합류하는 경우 결과 개체를 제거하기 전에 개체 편집기에서 분할해야 합니다. 극단적인 경우, 작업자는 소프트웨어에서 관심 영역을 그려 깨끗한 치아 및 플라그로 덮인 영역을 수동으로 결정해야 할 수 있습니다. 모든 임상 절차가 정확하게 수행되는 경우 이미지 분석 중 작업자의 주관적인 입력은 임계값 기반 분할에 대한 컷오프 값을 결정하는 것뿐입니다. 일반적으로 플라그로 덮인 치아 영역과 깨끗한 치아 영역은 이미지에서 잘 정의되어 있지만 선택한 임계값의 작은 차이가 상대적으로 낮은 범위이기는 하지만 계산된 PPI 값에 영향을 미친다는 점을 언급해야 합니다. 특정 연구를 위해 획득한 모든 이미지는 동일한 임계값으로 분할될 수 있으므로 컷오프 값의 주관적인 선택은 치료 또는 환자 그룹 간의 차이에 영향을 미치지 않습니다.
수동 평면 측정과 마찬가지로 반자동 평면 측정은 공개 용액을 사용하기 때문에 플라크 축적의 세로 기록에 적합하지 않습니다. 에리스로신은 항균 활성을 통해 생물막 성장을 방해할 수 있지만21,22,23, 그러나 가장 중요한 것은 두드러진 얼룩이 환자를 집으로 보내기 전에 전문적인 플라그 제거를 필요로 한다는 것입니다. 그러나, 기술된 방법은 클리닉에서 습관성 플라크 수준의 규칙적인 정량화에 사용될 수 있다. 반자동 평면측정법의 또 다른 한계는 개별 치아 간의 크기 차이로 인해 발생합니다. 카메라와 치아 표면 사이의 거리, 따라서 시야의 크기가 표준화될 수 있지만, 획득된 이미지는 인접한 치아의 일부를 포함할 수 있습니다. 이러한 작업은 일괄 작업으로 제거할 수 없으며 분석 중에 이미지를 수동으로 잘라야만 제거할 수 있습니다. 반자동 평탄측정법은 건전한 치아 표면에서 치은연상 플라크와 치석(24)의 정량화에 적합하지만, 향후 연구는 설명된 방법이 발달 결함(25), 캐비테이션 및 비캐비테이션 우식 병변 및 심한 얼룩에 의해 어떻게 영향을 받는지를 결정해야 할 것이다.
결론적으로, 반자동 평면측정법은 형광 카메라를 사용하여 플라크 영역 커버리지를 빠르고 안정적으로 정량화할 수 있는 방법입니다. 다른 환자 그룹의 새로운 플라크 형성 또는 플라크 제거에 대한 다른 치료 요법의 효과를 평가하는 임상 시험에 사용될 수 있습니다.
공개
이 연구는 Novozymes A/S와 덴마크 혁신 기금(보조금 번호 9065-00244B)의 자금 지원을 받았습니다. 자금 제공자는 데이터 수집, 분석 및 해석 또는 보고서 작성에 아무런 역할도 하지 않았습니다.
감사의 말
저자는 맞춤형 스페이서의 적층 제조에 탁월한 도움을 준 Dirk Leonhardt에게 감사를 표합니다. Lene Grønkjær, Javier E. Garcia, Charlotte K. Vindbjerg 및 Sussi B. Eriksen은 연구 기간 동안 기술 지원을 인정 받았습니다. 또한 형광 카메라 사용에 대한 기술 지원을 해준 Matthias Beck과 유익한 토론을 해준 Mette R. Jørgensen에게도 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| 3D Sprint Basic | 3D systems | Additive manufacturing software | |
| 5% erythrosine; Top Dent Rondell Röd | Top Dent Lifco Dental AB | 6327 | Disclosing solution |
| D1000 lab scanner | 3 Shape | Lab scanner used to scan the camera head | |
| DBSWIN 5.17.0 | Dürr Dental | Software for VistaCam | |
| Digital image analysis in microbial ecology (Daime), version 2.2.2 | Freeware for image analysis | ||
| LC-3D Print Box | NextDent | Polymerization unit | |
| Meshmixer 3.5 | Autodesk | Freeware for designing custom-made spacer | |
| NextDent 5100 | 3D systems | 3D-printer | |
| NextDent Ortho IBT | 3D systems | Material for spacer | |
| Ultrasound bath T660/H | Elma Schmidbauer GmbH | ||
| VistaCam iX HD Smart intraoral camera | Dürr Dental | Coupled with a fluorescence camera head |
참고문헌
- Pretty, I. A., Edgar, W. M., Smith, P. W., Higham, S. M. Quantification of dental plaque in the research environment. Journal of Dentistry. 33 (3), 193-207 (2005).
- Turesky, S., Gilmore, N. D., Glickman, I. Reduced plaque formation by the chloromethyl analogue of victamine C. Journal of Periodontology. 41 (1), 41-43 (1970).
- Marks, R. G., et al. Evaluation of reliability and reproducibility of dental indices. Journal of Clinical Periodontology. 20 (1), 54-58 (1993).
- Matthijs, S., Sabzevar, M. M., Adriaens, P. A. Intra-examiner reproducibility of 4 dental plaque indices: Dental plaque indices. Journal of Clinical Periodontology. 28 (3), 250-254 (2001).
- Shaloub, A., Addy, M. Evaluation of accuracy and variability of scoring-area-based plaque indices. Journal of Clinical Periodontology. 27 (1), 16-21 (2000).
- Söder, P. -. &. #. 2. 1. 4. ;., Jin, L. J., Söder, B. Computerized planimetric method for clinical plaque measurement. European Journal of Oral Sciences. 101 (1), 21-25 (1993).
- Lang, N. P., Ostergaard, E., Loe, H. A fluorescent plaque disclosing agent. Journal of Periodontal Research. 7 (1), 59-67 (1972).
- Staudt, C. B., et al. Computer-based intraoral image analysis of the clinical plaque removing capacity of 3 manual toothbrushes. Journal of Clinical Periodontology. 28 (8), 746-752 (2001).
- Smith, M. R. Parametric vs. nonparametric. Analyzing the periodontal and gingival indicies. Journal of Periodontal Research. 17 (5), 514-517 (1982).
- Quirynen, M., Dekeyser, C., van Steenberghe, D. Discriminating power of five plaque indices. Journal of Periodontology. 62 (2), 100-105 (1991).
- Al-Anezi, S. A., Harradine, N. W. T. Quantifying plaque during orthodontic treatment. The Angle Orthodontist. 82 (4), 748-753 (2012).
- Smith, R. N., Brook, A. H., Elcock, C. The quantification of dental plaque using an image analysis system: reliability and validation. Journal of Clinical Periodontology. 28 (12), 1158-1162 (2001).
- Kang, J., Ji, Z., Gong, C. Segmentation and quantification of dental plaque using modified kernelized fuzzy C-means clustering algorithm. 2010 Chinese Control and Decision Conference. , 788-791 (2010).
- Klaus, K., Glanz, T., Glanz, A. G., Ganss, C., Ruf, S. Comparison of quantitative light-induced fluorescence-digital (QLF-D) images and images of disclosed plaque for planimetric quantification of dental plaque in multibracket appliance patients. Scientific Reports. 10 (1), 4478 (2020).
- Daims, H., Lücker, S., Wagner, M. Daime, a novel image analysis program for microbial ecology and biofilm research. Environmental Microbiology. 8 (2), 200-213 (2006).
- Arnim, S. S. The use of disclosing agents for measuring tooth cleanliness. Journal of Periodontology. 34 (3), 227-245 (1963).
- Meller, C., Klein, C. Fluorescence properties of commercial composite resin restorative materials in dentistry. Dental Materials Journal. 31 (6), 916-923 (2012).
- Kiran, R., Chapman, J., Tennant, M., Forrest, A., Walsh, L. J. Detection of tooth-colored restorative materials for forensic purposes based on their optical properties: An in vitro comparative study. Journal of Forensic Sciences. 64 (1), 254-259 (2019).
- Shakibaie, F., Walsh, L. J. Fluorescence imaging of dental restorations using the VistaCam intra-oral camera. Australian Journal of Forensic Sciences. 51 (1), 3-11 (2019).
- Rey, Y. C. D., Rikvold, P. D., Johnsen, K. K., Schlafer, S. A fast and reliable method for semi-automated planimetric quantification of dental plaque in clinical trials. Journal of Clinical Periodontology. , (2022).
- Baab, D. A., Broadwell, A. H., Williams, B. L. A comparison of antimicrobial activity of four disclosant dyes. Journal of Dental Research. 62 (7), 837-841 (1983).
- Begue, W. J., Bard, R. C., Koehne, G. W. Microbial inhibition by erythrosin. Journal of Dental Research. 45 (5), 1464-1467 (1966).
- Marsh, P. D., et al. Antibacterial activity of some plaque-disclosing agents and dyes (short communication). Caries Research. 23 (5), 348-350 (1989).
- Shakibaie, F., Walsh, L. J. Dental calculus detection using the VistaCam. Clinical and Experimental Dental Research. 2 (3), 226-229 (2016).
- Seow, W. Developmental defects of enamel and dentine: Challenges for basic science research and clinical management. Australian Dental Journal. 59, 143-154 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유