ATG9A, Multi-Spanning Membrane 단백질 이미징
요약
이 프로토콜은 면역형광 후 이미지 분석, 일시적인 과발현 고려 사항, 웨스턴 블롯을 사용한 ATG9A 당화 상태 조사를 포함하여 ATG9A 생물학 연구에 도움이 될 수 있는 다양한 방법을 설명합니다.
초록
자가포식은 세포가 항상성을 유지하고, 손상된 세포소기관을 분해하고, 침입하는 병원균과 싸우고, 병리학적 조건에서 살아남기 위해 사용하는 고도로 보존된 경로입니다. ATG 단백질이라고 하는 단백질 집합은 핵심 자가포식 메커니즘을 구성하며 정의된 계층 구조에서 함께 작동합니다. 최근 몇 년 동안의 연구는 자가포식 경로에 대한 우리의 지식을 향상시켰습니다. 가장 최근에는 ATG9A 소포가 식체(phagophore)라고 불리는 세포소기관의 빠른 신 생 합성을 제어하기 때문에 자가포식의 핵심이라는 것이 제안되었습니다. ATG9A는 막관통 단백질이고 다른 막 구획에 존재하기 때문에 ATG9A에 대한 연구는 어려운 것으로 입증되었습니다. 따라서 자가포식을 이해하는 것은 자가포식을 이해하는 데 중요한 요소입니다. 여기에서는 ATG9A를 연구하는 데 사용할 수 있는 자세한 방법을 제시하며, 특히 평가 및 정량화할 수 있는 면역형광 기술을 사용하여 국소화를 수행합니다. 일시적인 과잉 표현의 함정도 해결됩니다. ATG9A 기능의 정확한 특성화와 그 트래피킹을 분석하기 위한 기법의 표준화는 자가포식 개시를 지배하는 사건을 더욱 특성화하는 데 매우 중요합니다.
서문
ATG9A는 핵심 자가포식 기계의 유일한 막관통 단백질이며 골지체와 세포질 ATG9A 소포 구획 사이를 이동하며 엔도솜 구획1을 통과합니다. 오랫동안 수수께끼로 여겨졌던 ATG9A는 최근 막 이중층 2,3에서 지질을 평형화하기 때문에 지질 스크램블레이즈로 기능하는 것으로 설명되었습니다. 이제 ATG9A가 자가포식 형성에서 계층의 최상위에 존재한다는 것이 분명해졌으며, 따라서 ATG9A에 대한 연구는 자가포식 4,5를 이해하는 데 매우 중요합니다. 이와 같이, ATG9A 소포는 최근 자가포식 6,7의 "종자"로 제안되었습니다. 그러나, 이전 연구들은 ATG9A가 형성되는 자가포식체와 그것의 성숙의 다른 단계들에서 일시적으로만 상호작용하고 자가포식 막 6,8,9,10,11에 통합되지 않는다는 것을 보여주었다. 따라서 자가포식 형성에서 ATG9A의 역할과 잠재적인 다중 기능을 완전히 밝히기 위해서는 추가 조사가 필요합니다. 그러나 현재 모델과 이전 데이터 간의 불일치는 검증된 정량적 접근 방식과 세포 내 마커를 사용하여 ATG9A의 이동을 다루는 표적 실험을 통해서만 해결할 수 있습니다.
ATG9A를 연구하는 데 사용되는 다양한 도구가 있으며 각각 장점과 단점이 있으며 이러한 도구의 사용은 ATG9A의 구조, 분자 기능 및 세포 이동으로 인해 복잡합니다 2,8,12. ATG9A는 호모트라이머(homotrimer)를 형성하고, 당화(glycosylated)되며, 세포 전체에서 골지체(Golgi), 엔도솜(endosome) 및 원형질막(plasma membrane)과 같은 구획으로 이동한다(13,14). 복잡한 여정을 감안할 때 특정 치료 또는 자극(예: 영양 및 혈청 결핍)에 대한 골지로부터의 ATG9A 분산과 같은 판독값을 해석하는 데 몇 가지 어려움이 있습니다. ATG9A는 소포 밀매 측면에서 매우 역동적입니다. 실제로, ATG9A 함유 소포는 기아 유발 자가포식의 맥락에서 ATG9A 구획으로 정의되었습니다. 이러한 동적 소포에 의해 형성된 ATG9A 구획은 여러 세포 내 소기관 8,15,16,17과 일시적으로 상호 작용합니다. 면역형광, 실시간 이미징 및 당화(glycosylation) 분석을 포함하여 여기에 설명된 기술은 ATG9A 생물학의 검출 및 이해에 도움이 될 것입니다. 특히, 이 기사에서 설명하는 접근법은 특정 세포 구획에 대한 국소화 및 특정 단백질 파트너 및/또는 막 구획과의 상호 작용에 대한 질문을 해결하는 데 도움이 될 것입니다. ATG9A 소수성 보존 코어 도메인(PFAM 도메인 PF04109)은 여러 멤브레인 구획 사이의 고유한 토폴로지와 ATG9A 주기를 가지고 있기 때문에 연구자들은 소포체(ER) 유지를 포함하되 이에 국한되지 않는 ATG9A를 일시적으로 과발현할 때 특정 함정과 인공물을 인식해야 합니다. 단백질의 잘못된 접힘, 정상적인 성장 조건에서의 인공물 응집 또는 면역 형광을 위한 최적이 아닌 투과화 프로토콜로 인한 소포 구획의 불충분한 검출로 인해 다른 가능한 문제가 발생할 수 있습니다.
내인성 ATG9A를 이미징할 때 후속 정량 분석의 품질과 데이터의 올바른 해석을 보장하기 위해 샘플 준비 및 이미지 획득에 주의를 기울여야 합니다. 이 기사에서 설명한 기술을 표준 생화학적 접근 방식(예: 면역침전 또는 풀다운 실험)과 결합하면 ATG9A 기능에 대한 이해가 향상될 것입니다. 이 실험 툴킷은 새로운 연구자들이 생물학적 시스템에서 ATG9A의 기능을 결정하는 데 필요한 일부 분석을 탐색하는 데 도움을 주기 위한 것입니다.
프로토콜
이 연구에 사용된 모든 시약은 요청 시 제공되는 ATG9A DNA 구조체 및 홈메이드 STO-215 항체( 재료 표 참조)를 제외하고 상업적으로 이용 가능합니다. 여기에 설명된 분석 도구는 오픈 소스 소프트웨어(FIJI/ImageJ)18를 기반으로 합니다.
1. 세포 배양
- 10% FBS(소 태아 혈청) 및 4mM L-글루타민이 보충된 고포도당 DMEM(Dulbecco's Modified Eagle Medium)에서 T150 조직 배양 처리된 플라스크의 HEK293A 세포를 80%-4% 합류로 유지합니다( 재료 표 참조). 37 ° C에서 10 % CO2 의 가습 조직 배양 인큐베이터에서 세포를 배양합니다.
참고: HEK293A 세포는 아미노산 결핍 시 강력한 표준 자가포식 반응을 가지며, 특히 지질화, 막 관련 LC3 1,9,19의 증가에 의해 감지되고 이미징에 적합하기 때문에 본 연구에서 사용됩니다. - 혈청학적 피펫을 사용하여 플라스크에서 배지를 흡인하여 세포를 통과시킵니다. 1x PBS(인산염 완충 식염수) 또는 이와 유사한 용액 15mL로 세포를 한 번 세척한 후 2mL의 트립신-EDTA(에틸렌디아민테트라아세트산) 용액을 추가하여 세포를 분리합니다. 8mL의 DMEM으로 분리된 세포를 수집하고 여기에 설명된 실험을 위해 2일 후에 80%-90% 밀도에 도달하도록 여러 세포를 다시 시드합니다.
2. ATG9A의 내인성 염색
- 멸균 No. 1.5 유리 커버슬립에 HEK293A 세포(또는 선택한 세포)를 24웰 플레이트에 넣어 다음날 ~80%가 합류하도록 합니다. 이것은 일반적으로 500μL의 DMEM에서 7 x 104 세포/웰을 제공합니다.
참고: HEK293A 세포 또는 기타 느슨하게 부착된 세포주의 경우 커버슬립을 탈이온수에서 0.1mg/mL의 폴리-D-라이신으로 코팅해야 합니다. 실온(RT)에서 10분 동안 웰에 넣은 커버슬립 상단에 500μL의 폴리-D-라이신( 재료 표 참조)을 추가한 다음 탈이온수로 세 번 세척하고 DMEM에서 마지막으로 세척합니다. 코팅 후 세포를 파종하고 배양 접시에 고르게 퍼지도록 주의하십시오. - 특정 실험 조건(즉, EBSS[Earle's Balanced Salt Solution]에서 2시간 동안 굶주림)에 따라 세포를 처리합니다.
참고: EBSS 조성은 증류수에 용해된 1g/L D-글루코스, 6.8g/L NaCl, 0.4g/L KCl, 0.151g/L CaCl 2.2H 2O, 0.2g/L mM MgSO 4.7H 2O, 0.124g/LNaH2HPO4.2H 2O 및 2.2g/LNaHCO3(재료 표 참조)입니다. - 배지를 흡인하고 0.1mM CaCl 2 및 0.1mM MgCl2 가 보충 된 PBS의 4 % 포름 알데히드 용액 500 μL로 조심스럽게 교체하여 RT에서 20 분 동안 세포를 고정시킵니다.
- 각 웰에서 4% 포름알데히드 용액을 흡인하여 500μL의 PBS로 교체합니다. 이 세탁 단계를 세 번 반복합니다. 커버슬립이 마르거나 액체 없이 방치되지 않도록 하십시오.
- RT에서 10분 동안 PBS에서 500μL의 50mM NH4Cl용액을 사용하여 유리 알데히드 그룹을 담금질합니다.
- PBS를 흡인하고 PBS의 50μg/mL 디지토닌 용액 500μL(탈이온수에 1mg/mL의 원액 1mg/mL, 재료 표 참조)로 교체하여 세포를 투과시킵니다.
- 각 웰에서 디지토닌 용액을 흡인하고 500μL의 PBS로 교체합니다. 이 세탁 단계를 세 번 반복합니다.
- 각 웰에서 PBS를 흡인하고 RT에서 30분 동안 500μL의 차단 용액(PBS에 희석된 5% BSA[소 혈청 알부민])으로 교체합니다.
- 차단 용액을 흡인하고 500μL의 PBS로 교체합니다.
- 핀셋을 사용하여 웰에서 커버슬립을 수집하고, 얇은 티슈 와이프 또는 셀룰로오스 여과지를 사용하여 여분의 PBS 용액을 조심스럽게 제거하고, 각 커버슬립을 세포 면이 아래로 향하게 하여 50μL 1차 항체 용액 위에 부드럽게 놓습니다(예: 1% BSA/PBS 용액에서 0.9μg/mL로 희석된 Armenian Hamster 14F2, 재료 표 참조). 가습 챔버에서 RT에서 1시간 동안 배양합니다.
참고: 취급이 용이하도록 항체 용액 방울을 단단한 표면에 직접 놓는 대신 다른 용기 내의 자체 밀봉 열가소성 필름 시트( 재료 표 참조)에 놓을 수 있습니다. - 핀셋을 사용하여 커버슬립을 채취하고 얇은 티슈 와이프를 사용하여 여분의 1차 항체 용액을 부드럽게 배출한 후 24웰 플레이트의 커버슬립(셀 면이 위로)을 교체하고 PBS로 3회 세척합니다.
- 2.10단계를 반복합니다. 핀셋을 사용하여 각 웰에서 커버슬립을 수집하고, 얇은 티슈 와이프를 사용하여 과잉 PBS를 조심스럽게 배출하고, 각 커버슬립(세포 면이 아래로)을 1% BSA/PBS 용액에 1:1,000으로 희석된 50μL 방울의 2차 항체 용액(예: 소, 인간, mouse, rabbit, and rat serum proteins, see Table of Materials(마우스, 토끼 및 쥐 혈청 단백질, 자료표 참조). 가습 챔버에서 RT에서 1시간 동안 배양합니다.
참고: 선택 사항: 후속 이미지 분석을 위해 2차 항체 외에 세포골격 마커를 사용할 수 있습니다(예: 1:1,000으로 희석된 Alexa Fluor 647 Phalloidin, 재료 표 참조). 취급이 용이하기 때문에 항체 용액 방울을 단단한 표면에 직접 놓는 대신 다른 용기 내의 밀봉 필름 시트에 놓을 수 있습니다. - 핀셋을 사용하여 커버슬립을 수집하고, 과잉의 2차 항체 용액을 배출한 후 커버슬립을 24웰 플레이트(셀 면이 위로)에 넣고 500μL PBS로 3회 세척합니다.
- 핀셋을 사용하여 커버슬립을 수집하고 얇은 티슈 와이프를 사용하여 여분의 PBS를 조심스럽게 배출한 다음 PBS의 1:4,000 Hoechst 용액(Hoechst 33342)의 50μL 방울에 각 커버슬립(셀 면이 아래로)을 부드럽게 놓습니다. 습도 챔버에서 상온에서 5분 동안 배양합니다.
참고: 취급이 용이하도록 항체 용액 방울을 단단한 표면에 직접 놓는 대신 다른 용기 내의 밀봉 필름 시트에 놓을 수 있습니다. - 핀셋을 사용하여 커버슬립을 모으고 얇은 티슈 물티슈를 사용하여 여분의 Hoechst 용액을 부드럽게 배출한 후 24웰 플레이트의 커버슬립을 교체하고 PBS로 세 번, 탈이온수(세탁당 500μL)로 한 번 세척합니다.
- 얇은 티슈 물티슈를 사용하여 과도한 탈이온수를 조심스럽게 배출하고 기포가 형성되지 않도록 면역형광용 현미경 슬라이드에 얼룩진 10-20μL 장착 용액( 재료 표 참조)에 각 커버슬립(셀 면이 아래로)을 부드럽게 놓습니다.
알림: 여기에 사용된 장착 매체는 이멀젼 오일과 굴절률이 동일하며 RT에서 몇 시간 또는 4°C에서 밤새 경화됩니다. 경화되지 않는 장착 솔루션을 사용할 수 있지만 매니큐어로 커버슬립을 밀봉하도록 주의해야 합니다. - 흡인으로 초과 장착 용액을 제거하고 샘플을 슬라이드 홀더 또는 알루미늄 호일로 덮은 어두운 곳에서 밤새 RT에서 평평하게 눕혀 건조시킵니다.
3. 이미지 취득
- 컨포칼 현미경을 켭니다. 이미징 소프트웨어( 재료 표 참조)를 열어 이미지 획득 설정을 시작합니다.
- 기능 탭에서 Plan-Apochromat 63x/1.4 Oil DIC M27 대물 렌즈를 선택하여 분석할 이미지를 캡처합니다.
- 획득 기능 탭에서 제어판의 레이저 영역(Argon, Diode-405-30, DPSS 561-10 및 HeNe633)에서 적절한 레이저를 켭니다.
- 제어판의 이미징 설정 영역에서 4개의 트랙을 만들고 각 트랙은 하나의 채널에 해당하여 순차적 획득을 수행합니다.
- Acquisition Mode 창에서 이미지의 적절한 해상도를 설정합니다. 해상도를 1,024 x 1,024(프레임 크기)로 설정하고 비트 심도를 16비트로 선택합니다.
- 각 채널에 대해 레이저 출력과 게인을 조정하여 이미지 강도 분석을 방해할 수 있는 포화된 픽셀 없이 좋은 신호를 얻습니다. Live 버튼을 사용하여 레이저 출력 레벨 과 게인(마스터)을 설정합니다.
알림: 범위 표시기 옵션은 포화 픽셀 감지를 위해 사용하는 것이 좋습니다. 배경 소음을 피하기 위해 레이저 출력을 1%에서 10% 사이로 유지하고 게인(마스터)을 850 미만으로 유지하십시오. - 제어판의 채널 영역에서 파장이 가장 높은 채널에 대해 1AU(Airy Unit)를 고려하여 각 채널에 대해 동일한 핀홀 조리개를 설정합니다.
- 비슷한 양의 셀을 포함하는 10개의 무작위 필드를 획득합니다(필드당 20-30개 셀). 조건당 100-200개의 세포를 획득하면 이후 이미지 분석에 좋은 전력을 제공할 수 있습니다.
4. ATG9A 분산 이미지 분석
- 인터넷에서 FIJI 소프트웨어를 다운로드합니다(자료표 참조). Plugins > Bio-Formats > BioFormats Importer를 클릭하여 FIJI가 있는 이미지를 엽니다.
- 분석( Analyse) > 측정 설정(Set measurements)을 클릭하고 강도 분석을 위해 측정 창에서 평균 회색 값을 선택합니다.
- Image > Color > Split Channels를 클릭하고 채널을 세 개의 이미지(Golgi marker, cytoskeleton, ATG9A 신호)로 분리합니다.
- Image > Adjust > Threshold로 이동하여 골지 마커에 해당하는 채널에 임계값을 정의합니다.
- Edit > Selection(선택 항목 편집) > Create Selection(선택 항목 만들기)을 클릭하고 이진 이미지에서 선택 영역을 만듭니다.
- 선택 영역 편집 >> 관리자 > 이름 바꾸기(Golgi)에 추가 이동하여 선택 항목을 ROI 관리자에 저장한 다음 이름을 Golgi로 바꿉니다.
- Image > Adjust > Threshold를 클릭하고 세포골격 마커에 해당하는 채널에 임계값을 정의하여 세포 윤곽을 정의합니다.
- Edit > Selection(선택 영역 편집) > Create Selection(선택 영역 만들기)으로 이동하여 이진 이미지에서 선택 영역을 만듭니다.
- Edit > Selection(선택 편집) > Add to Manager(관리자에 추가) > Rename (Total)(이름 바꾸기(총계))을 클릭하고 선택 항목을 ROI 관리자에 저장한 다음 이름을 Total로 바꿉니다.
- ATG9A 염색에 해당하는 이미지를 선택합니다.
- 분석 > 측정에서 ROI 골지가를 클릭하여 적용하고 골지 영역의 강도를 측정합니다.
- 분석 > 측정을 클릭하고 클릭하여 ROI 합계를 적용한 다음 합계 영역의 강도를 측정합니다.
- 모든 이미지에서 절차를 반복하고, 결과를 .csv 파일로 저장하고, 다음 수식을 사용하여 데이터를 처리합니다.
ATG9A 분산율 = 골지강도 / 총 강도
5. ATG9A 구조체의 라이브 셀 이미징
- 2mL의 배지에 HEK293A 세포(또는 선택한 세포)를 60mm 조직 배양 접시에 파종하여 다음날 ~65%-70% 밀도에 도달하도록 합니다. 이것은 일반적으로 1 x 10 6-2 x 106 셀을 제공합니다.
- 다음 날, 다음과 같이 Lipofectamine:DNA 혼합물(또는 적절한 대체 DNA 형질주입 시약, 재료 표 참조)을 준비합니다.
- 구성 발현 효율에 따라 0.5-2 μg의 플라스미드 DNA를 100 μL의 적절한 무혈청 배지에 희석하고 피펫팅하여 용액을 위아래로 부드럽게 혼합합니다. 혼합물을 상온에서 5분 동안 배양합니다.
참고: 플라스미드 DNA 구조체는 실험에 따라 다릅니다. 연구자들은 스스로 복제하거나 요청 시 저자로부터 얻을 수 있습니다. - Lipofectamine 2000 transfection 시약을 3:1 Lipofectamine:DNA의 비율로 100μL의 적절한 무혈청 배지에 희석하고 피펫팅하여 용액을 위아래로 부드럽게 혼합합니다. 이 혼합물을 RT에서 5분 동안 배양합니다.
- 두 용액을 위아래로 부드럽게 피펫팅하고 RT에서 20분 동안 배양하여 함께 혼합합니다.
- 구성 발현 효율에 따라 0.5-2 μg의 플라스미드 DNA를 100 μL의 적절한 무혈청 배지에 희석하고 피펫팅하여 용액을 위아래로 부드럽게 혼합합니다. 혼합물을 상온에서 5분 동안 배양합니다.
- 4mL의 성장 배지가 들어 있는 각 세포 배양 플레이트에 Lipofectamine:DNA 혼합물을 추가하고 플레이트를 앞뒤로 부드럽게 흔들어 혼합물이 고르게 분포되도록 합니다. 37°C에서 10%CO2의 가습 세포 배양 인큐베이터에서 세포를 배양합니다.
- 형질주입 4시간 후 배지를 신선한 성장 배지로 교체하고 37°C의 가습된 세포 배양 인큐베이터에서 10%CO2 의 가습 세포 배양 인큐베이터에서 밤새 세포를 배양합니다.
- 다음 날, 트립신화하고, 계수하고, 살아있는 세포 현미경 검사에 적합한 배양 접시(No. 1.5 유리 커버슬립이 있는 배양 접시, 재료 표 참조)에 세포를 다시 파종합니다. 0.4 x 10 6-0.7 x 106 세포를 접시에 뿌려 이미징 시 커버슬립의 ~60%-75% 밀도에 도달합니다.
알림: 2.1단계에서 설명한 대로 폴리-D-라이신으로 코팅하는 것이 HEK293A 세포에 권장됩니다. - 다음 날(형질주입 후 48시간) 세포를 이미지화합니다.
6. ATG9A의 당화(glycosylation) 상태 조사
- 일반적으로 10mL에 1.5 x 10 6-2.5 x 106 세포를 제공하는 내인성 ATG9A를 조사할 계획인 경우 10cm 조직 배양 접시에 HEK293A 세포(또는 선택한 세포)를 파종하여 다음날 ~80% 밀도에 도달하도록 합니다. 또는 일반적으로 10mL에 1 x 10 6-1.5 x 106 세포를 제공하는 ATG9A 구조를 transfection하는 경우 세포를 ~65%-70% 밀도에 도달하도록 세포를 시드합니다.
- 다음날 100μg/mL 사이클로헥사미드(CHX, 재료 표 참조) 또는 차량으로 세포를 처리합니다. 24시간 동안(또는 원하는 시점까지) 배양합니다.
- 인큐베이터에서 세포를 제거하고 배지를 흡인한 다음 얼음 위에 놓습니다. 5mL의 얼음처럼 차가운 1x PBS로 교체합니다. 셀 스크레이퍼를 사용하여 접시에서 세포를 물리적으로 분리하고 PBS 세포 용액을 15mL 원뿔형 바닥 튜브에 피펫팅합니다. 800 x g 에서 4°C에서 5분 동안 원심분리하여 세포를 펠릿화합니다.
- 상층액을 흡인하고 프로테아제 억제제 칵테일 정제( 재료 표 참조)가 보충된 얼음처럼 차가운 TNTE 용해 완충액(1% Triton, 150mM NaCl, 20mM Tris-HCl, pH 7.4, 0.5mM EDTA)의 ~100μL(세포 펠릿의 크기에 따라 다름)에 세포를 재현탁시키고 1.5mL 미세 원심분리 튜브로 옮깁니다.
- 용해물을 얼음 위에서 15분 동안 배양합니다. 그 후, 용해물을 20,000 x g 에서 4 °C에서 10 분 동안 원심 분리하여 핵과 불용성 파편을 침전시키고 상층액을 새로운 마이크로 원심 분리 튜브로 옮깁니다.
- Bradford Method20 및 595nm의 파장에서 측정할 수 있는 분광 광도계를 사용하여 용해물의 단백질 농도를 정량화합니다.
- 단백질 양을 정규화하고 1μL의 PNGase F 효소를 추가하기 전에 제조업체의 지침에 따라 16μL의 용해물(총 단백질 100μg 이하)을 5x PNGase F(펩타이드:N-글리코시다아제 F) 완충액과 결합합니다( 재료 표 참조). PNGase F 제조업체의 지시에 따라 배양합니다.
- 1x 농도를 얻기 위해 3x Laemmli 샘플 버퍼를 추가하고 단백질 분리를 최대화하기 위해 Tris-acetate 겔을 사용하여 전기 영동을 위해 로딩하기 전에 65°C에서 5분 동안 배양합니다. 표준 웨스턴 블롯 프로토콜21 (재료 표 참조)을 사용하여 겔로부터 적절한 막(즉, PVDF[폴리비닐리덴 디플루오라이드])으로 단백질을 이동시킨다.
알림: 샘플을 95°C에서 끓이면 ATG9A가 응집되어 ATG9A의 검출이 줄어듭니다. - ATG9A에 대한 특이 항체(STO-215 항체, 자체 생산1)를 사용하여 웨스턴 블롯을 수행합니다( 재료 표 참조). 멤브레인의 고분자량 부분을 절단하지 않고 그대로 두어 더 높은 ATG9A 분자량 종을 시각화합니다.
대표적 결과
ATG9A는 여러 세포내 막 구획 8,17,22,23,24와 관련된 막관통 단백질입니다. 기저 조건에서 ATG9A는 주로 내인성 단백질의 면역형광 및 시스-골지 마커인 GM130과의 중첩(그림 1A)으로 알 수 있듯이 트랜스 골지 네트워크(TGN)와 내포성 재활용 구획(ERC)과 부분적으로 중첩되는 작은 소포에 국한됩니다(23). 골지체의 ATG9A 국소화는 다양한 면역형광 프로토콜을 사용하여 검출할 수 있습니다. 그러나 ATG9A의 수포 분율과 국소화의 변화, 특히 영양분 및 혈청 결핍과 같은 특정 자극에 대한 반응으로 수포 풀의 증가는 강도가 매우 다양할 수 있으며 기존 이미징 접근 방식으로는 시각화하기 어려울 수 있습니다. 골지(Golgi)에 국한된 ATG9A와 소포 분획에 국한된 ATG9A의 비율을 ATG9A 분산률이라고 합니다. 예를 들어 혈청과 아미노산을 모두 고갈시키는 데 사용되는 EBSS 처리 시 ATG9A 분산 속도의 변화를 감지하기 위해 GM130 또는 TGN46과 같은 골지 마커와 세포 윤곽25를 염색하는 Phalloidin과 같은 세포골격 마커는 ATG9A 분산을 쉽게 정량화하는 데 유용합니다(그림 1B). 중요한 것은 평균 형광 비율 분석이 고정된 분산률이 아닌 조건 간의 비교 측정으로만 해석될 수 있다는 것입니다. 구획 간의 비율은 사용된 세포주, 염색 품질 또는 적용된 임계값 방법과 같은 생물학적 및 비생물학적 요인에 따라 크게 달라집니다(그림 1B). 이러한 이유로 연구자는 특정 실험 조건에서 ATG9A 골지 농축을 검출할 수 있는 파이프라인을 설정한 다음 동일한 매개변수로 분석을 분석할 세트의 모든 이미지로 확장해야 합니다. ATG9A 평균 형광 분석을 위해 선택된 대표적인 바이너리 이미지와 영역이 그림 1B에 가이드로 나와 있습니다.
ATG9A는 비교적 유연하고 구조화되지 않은 두 개의 N- 말단 및 C-말단 도메인이 측면에 있는 여러 막관통 도메인을 보유하고 있으며, 그 중 C-말단 서열은 단백질12의 거의 절반을 포함합니다. 중요한 것은 과발현된 ATG9A의 국소화 패턴이 어떤 단백질 말단이 태그되는지에 따라 영향을 받을 수 있다는 것입니다(그림 2A). 특히, 일시적인 발현 시스템을 사용하고 형광 태그(예: eGFP, mRFP 또는 유도체)를 사용하여 N-말단에 ATG9A를 직접 태깅할 때 골지체 국소화가 부분적으로 손상될 수 있으며, ATG9A 소포는 여전히 쉽게 볼 수 있는 반면 기저(즉, 공급) 조건에서 농축이 덜 나타날 수 있습니다(그림 2A). C-말단에 ATG9A를 태그하면 집계될 수 있는 더 큰 GFP 양성 클러스터가 약간 유도되는 것으로 보입니다. 마지막으로, mRFP-ATG9A의 단량체 버전은 과발현 세포에서 유사한 형광 소포 클러스터와 작은 골지 염색을 보여줍니다(그림 2A).
ATG9A는 골지체(Golgi) 및 ATG9A 소포(vesicles)로 이동하기 전에 응급실막(ER막)에서 접힙니다. 응급실에 머무는 동안 ATG9A는 아스파라긴 99의 N-결합 글라이칸에 의해 변형된 다음 골지체에 도달하면 복잡하고 성숙한 N-결합 글라이칸 1,14를 획득합니다. 당화(glycosylation)에 의한 이러한 변형은 이중 띠(double band)(14)의 출현에 의해 웨스턴 블롯(western blot)을 통해 검출될 수 있다. 세포 내 국소화와 일관되게 대부분의 내인성 ATG9A는 복잡한 N-결합 글라이칸을 보유하고 있으므로 고분자량 대역이 우세하며 희미한 저분자량 대역도 볼 수 있습니다(그림 2B). 이중 밴드의 존재는 고분자량 단백질의 분리능을 개선하기 위해 Tris-acetate 겔을 사용할 때 가장 쉽게 볼 수 있습니다(그림 2B, 대조군, t = 0). 내인성 단백질이 PNGase F(펩타이드:N-글리코시다아제 F) 처리를 거쳐 대부분의 복잡한 N-결합 글라이칸을 제거하면, 단백질은 단일 밴드로 실행됩니다(그림 2B, PNGase F, t = 0). 따라서 ATG9A의 N-결합 당화(glycosylation) 상태는 ER에서 골지(Golgi)로 ATG9A가 나가는 것을 모니터링하기 위한 프록시로 사용할 수 있으며, 이는 두 대역 간의 상대 비율에 의해 반영됩니다.
mRFP-ATG9A 구조체를 일시적으로 transfection할 때, 과발현된 단백질은 초기에 ER에 축적되는데, 이는 잠재적으로 trafficking 기계가 모든 ATG9A를 접어서 trafficing할 수 없고 저분자량 대역이 우세하기 때문입니다(그림 2C, 대조군 t = 0). 특히, mRFP-ATG9A가 발현된 지 24시간 후, 상부 대역과 하부 대역 사이에 거의 동일한 분포가 나타나 mRFP-ATG9A 풀이 골지체로 이동하고 있음을 시사한다(그림 2C, 대조군, t=24). 세포가 de novo 단백질 합성26을 차단하는 cycloheximide(CHX)로 처리되면 ER에서 ATG9A의 접힘 및 출구를 명확히 할 수 있습니다. 내인성 단백질이 접히고 당화되어 골지체에 상주하기 때문에 CHX로 처리해도 저분자량 및 고분자량 밴드의 비율이 크게 변하지 않습니다(그림 2B, 대조군). 그러나 mRFP-ATG9A의 일시적인 발현을 이용하여 CHX 처리는 고분자량 대역의 축적을 촉진한다(그림 2C, 대조군, CHX t = 24). 고분자량 과발현 mRFP-ATG9A 대역은 PNGase F로 처리한 후 하위 대역으로 붕괴됩니다(그림 2C, PNGase F, t=24). 이러한 데이터는 내인성 단백질이 고분자량 대역의 우세에 의해 반영된 것처럼 성숙한 글라이칸을 빠르게 획득하고 CHX 체이스가 이중 대역의 비율에 영향을 미치지 않는다는 것을 보여줍니다(그림 2B). 일시적으로 과발현된 mRFP-ATG9A의 경우, CHX 처리는 상부 밴드의 축적을 유도하며, 이는 ER 풀이 접히고 ER에서 골지체로 빠져나갈 때 더 성숙한 글라이칸이 획득됨을 나타냅니다(그림 2C).
ATG9A 서열과 형광 태그 사이에 링커를 추가하면 단백질의 생리학적 국소화 및 이동을 촉진하는 데 도움이 될 수 있습니다. N-말단 형광단과 ATG9A 사이에 3x-FLAG 서열(24개의 아미노산)을 융합하면 과발현된 단백질이 내인성 단백질과 유사하게 작용할 수 있습니다(그림 3). 실제로, 과발현된 mCherry-3xFLAG-ATG9A는 공급 조건에서 Golgi 마커 GM130과 공동 국소화됩니다(그림 3A). 중요한 것은 이 국소화와 ATG9A 소포 구획이 시간이 지남에 따라 보존되어 ATG9A의 이동에 대한 시공간 연구가 가능하다는 것입니다(그림 3B).
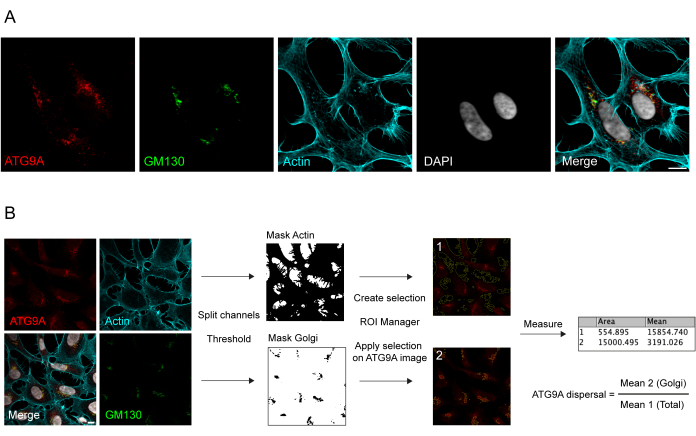
그림 1: 내인성 ATG9A 국소화의 이미지 분석. (A) 내인성 ATG9A(빨간색), 골지 마커로서의 GM130(녹색) 및 액틴 세포골격(청록색)을 시각화하기 위한 Phalloidin의 대표적인 면역형광 이미지. 눈금 막대 = 10μm. (B) 골지(Golgi) 영역에서 국소화되는 내인성 ATG9A의 분율을 결정하기 위한 이미지 분석의 워크플로우. 눈금 막대 = 10μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
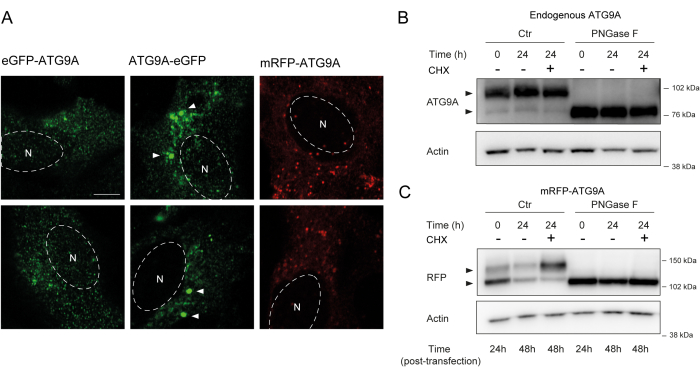
그림 2: 국소화 및 당화(glycosylation)에 의한 형광 표지 ATG9A 구조 분석. (A) eGFP N-말단 표지 ATG9A는 골지체에서 덜 국소화되어 있으며 주로 소포에 상주합니다. eGFP C-말단 태그가 부착된 ATG9A는 세포 내에서 응집체를 나타냅니다(일부 예는 흰색 화살촉으로 표시됨, eGFP-ATG9A 및 ATG9A-eGFP는 녹색으로 표시됨). mRFP N-말단 태그가 부착된 ATG9A는 골지체에 덜 국한되어 있으며 주로 소포에 상주합니다. N은 세포핵의 대략적인 위치를 나타내며 mRFP-ATG9A는 빨간색입니다. 눈금 막대 = 5μm. (B) 내인성 ATG9A는 웨스턴 블롯(화살촉)으로 분석할 때 두 개의 띠로 나타납니다: 상부 띠(복합 N-결합 글라이칸)와 하부 띠(성숙한 N-결합 글라이칸 없음). 사이클로헥사미드(CHX)를 사용한 치료는 상부 밴드와 하부 밴드의 비율에 영향을 미치지 않습니다. PNGase F로 처리하면 상부 밴드가 소실됩니다. (C) HEK293A 세포에서 mRFP 표지 ATG9A의 일시적인 transfection 후, 웨스턴 블롯(화살촉)에서 두 개의 두드러진 띠가 보입니다. PNGase F로 처리하면 상부 밴드가 소실됩니다. transfection 후 CHX로 처리하면 transfection된 ATG9A 풀이 ER에서 Golgi로 이동함에 따라 당화(glycosylation)가 증가합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
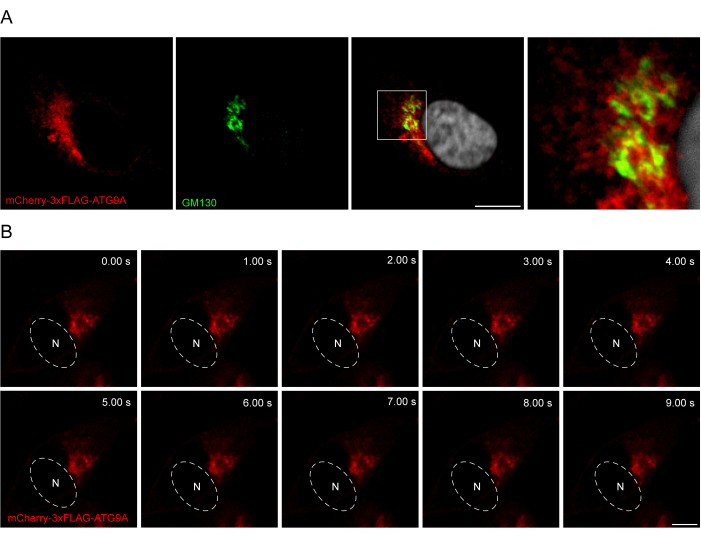
그림 3: 면역형광 및 실시간 이미징에 의한 mCherry-3xFLAG-ATG9A 국소화 분석. (A) mCherry-3xFLAG-ATG9A를 일시적으로 과발현하고 골지 마커 GM130으로 염색한 HEK293A 세포의 면역형광 실험. 눈금 막대 = 10μm. mCherry-3xFLAG-ATG9A는 빨간색이고 GM130 Golgi 마커는 녹색입니다. (B) mCherry-3xFLAG-ATG9A를 일시적으로 과발현하는 HEK293A 세포의 실시간 이미징 실험의 몽타주. N은 핵의 대략적인 위치를 나타냅니다. 시간 프레임 = 1fps. 눈금 막대 = 10μm. mCherry-3xFLAG-ATG9A는 빨간색입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 연구는 ATG9A 현지화를 조사하는 데 사용할 수 있는 다양한 도구를 보여줍니다. 첫째, 이 연구는 ATG9A가 면역형광으로 시각화되는 방법과 이를 정량화할 수 있는 방법을 설명합니다. 둘째, 고정 세포 또는 살아있는 세포에서 시각화를 위해 형광 마커로 ATG9A를 태그하는 데 사용할 수 있는 전략을 비교합니다. 마지막으로, 이 연구는 ATG9A가 ER을 빠져나와 골지체를 통해 트래피킹되었는지 확인하기 위해 ATG9A의 당화(glycosylation) 상태를 조사하고 사용하는 방법을 설명합니다.
면역형광에 의한 내인성 ATG9A 국소화의 특성화와 관련하여 실험에 사용되는 고정 및 투과화 방법에 주의를 기울여야 합니다. 여기에 설명된 표준 절차에 따르면, 디지토닌 투과화와 결합된 파라포름알데히드 고정은 골지-연관 ATG9A 및 ATG9A-양성 소포를 모두 시각화하기에 좋은 조건이다7. 고정 및 투과와 함께 1차 항체 용액을 사용한 배양 시기도 중요합니다. 1차 항체 용액의 농도가 높고 배양 시간이 길어지면 ATG9A의 골지체 염색이 잘못 증가할 수 있으며, 이는 결국 다른 막 구획으로의 ATG9A 재분포 검출을 손상시킬 수 있다는 것을 관찰했지만 문서화되지는 않았습니다. 또한 ATG9A는 많은 세포 내 구획 1,13,17,22,23,24,27,28에 존재하기 때문에 ATG9A가 위치한 위치를 식별하기 위해 ATG9A와 함께 특정 막 마커를 사용하는 것이 중요합니다. ATG9A 국소화를 정량화하기 위해 과거에 여러 접근법이 사용되었는데, 여기에는 공동 국소화에 대한 Pearson의 상관 계수29가 포함된다. 그러나 ATG9A와 골지(Golgi) 및 뚜렷한 소포 구획(vesicular compartment)의 부분적 중첩은 많은 수의 픽셀 이상치로 이어지며, 이는 상관 계수의 해석을 편향시킬 수 있습니다. 이러한 이유로, 분석할 두 구획의 평균 형광 비율을 기반으로 하는 보다 단순한 접근 방식이 선호되며, 이 접근 방식은 세포별 변동성에 덜 민감합니다. 현미경을 통한 이미지 분석에 대한 자세한 내용은 이 책30장을 참조하십시오.
ATG9A의 당화(glycosylation) 상태를 조사할 때 웨스턴 블롯을 실행하기 위한 겔의 선택이 중요합니다. 이 프로토콜의 경우 3%-8% 트리스-아세테이트 겔이 더 큰 단백질에 대해 가장 높은 분해능을 제공하기 때문에 선호되지만 고분자량 단백질의 우수한 분리를 제공하는 대체 겔 조성물 또는 러닝 버퍼도 사용할 수 있습니다. 실험자는 전기영동 시간을 늘려 단백질의 최대 분리를 보장할 수 있습니다.
웨스턴 블롯에서 ATG9A를 시각화하기 위해 샘플을 준비할 때 Laemmli 버퍼를 추가한 후 샘플을 끓이지 않도록 주의해야 합니다. 95°C에서 끓이면 ATG9A 응집체의 형성이 유도되고, 그 후 ATG9A는 겔1로 효율적으로 이동하지 않는다. 샘플을 65°C에서 5분 동안 가열하는 것이 좋습니다27.
높은 수준의 transfection은 일반적으로 ER에서 ATG9A의 더 높은 축적으로 이어지는 반면, 중간 수준의 발현은 단백질의 생리학적 국소화에 도움이 됩니다. 일화적으로, 48시간 대신 72시간의 배양 시간은 종종 ER 국소화 아티팩트를 줄이는 데 도움이 됩니다. 특히, mRFP-ATG9A는 발현 수준을 통해 또는 안정된 세포주를 사용하여 ATG9A 트래킹 및 기능을 정확하게 보고할 수 있다(8,9,22,27).
과발현된 ATG9A 집단이 성숙한 N-결합 글라이칸을 획득하지 못하는 것은 교란된 ATG9A 트래피킹에 대한 판독값으로 사용할 수 있습니다. ATG9A의 특정 영역을 돌연변이시키거나 삭제할 때 ER 머무름이 증가할 위험이 있으며, 이는 성숙한 N-결합 글라이칸을 획득하지 못하여 웨스턴 블롯에서 더 빠르게 이동하는 ATG9A 밴드를 획득하지 못할 수 있습니다. 잘린 ATG9A 구조체를 사용하는 연구원은 ER 머무름, 당화 상태 및 골지 국소화를 확인해야 합니다.
ATG9A의 라이브 셀 이미징을 위해 고속 Airyscan 기능에 의존하는 Airyscan 현미경은 일반적으로 약 120nm의 최적 해상도를 제공합니다. 위치 파악 정확도를 위해 초고해상도 모드에서 초당 약 1-2프레임(fps)의 프레임 속도는 이미징되는 채널 수에 따라 최적입니다. 고속으로 이미징할 수 있는 유사한 컨포칼 현미경은 ATG9A 소포의 이미징에도 사용할 수 있습니다. 그러나 이미징 속도는 이벤트 감지에 직접적인 영향을 미칠 수 있으므로 데이터 해석에 영향을 미칠 수 있습니다.
요약하면, 제시된 프로토콜은 면역형광, 살아있는 세포 현미경 및 당화 상태를 통해 ATG9A 국소화를 정량화하고 특성화하는 방법을 설명합니다. 이러한 프로토콜은 ATG9A로 작업하는 연구원을 지원하고 몇 가지 함정을 피하는 데 도움이 될 수 있습니다.
공개
S.A.T.는 Casma Therapeutics의 과학 자문 위원회에서 활동하고 있습니다.
감사의 말
저자들은 원고의 교정을 해준 Rocco D'Antuono와 이러한 프로토콜의 개선을 이끈 논의에 대해 MCBA(Molecular Cell Biology of Autophagy) 실험실의 모든 현재 및 과거 구성원에게 감사를 표합니다. A. V.V., S.D.T., E.A., S.A.T.는 영국 암 연구(Cancer Research UK, CC2134), 영국 의학 연구 위원회(UK Medical Research Council, CC2134)로부터 핵심 자금을 지원받는 프랜시스 크릭 연구소(Francis Crick Institute)의 지원을 받았습니다. 이 연구는 웰컴 트러스트(Wellcome Trust, CC2134)의 자금 지원을 받았습니다. 오픈 액세스를 위해, 저자는 이 투고에서 발생하는 모든 저자 수락 원고 버전에 CC BY 공개 저작권 라이선스를 적용했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 24 multiwell plates | Falcon | 353047 | For tissue culture |
| 35 mm Dish | No. 1.5 Coverslip | 14 mm Glass Diameter | Uncoated | MATTEK | P35G-1.5-14-C | Cell culture dish for live-cell microscopy |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 60 mm tissue culture dish | Thermofischer Scientific | 10099170 | For tissue culture |
| Alexa Fluor 647 Phalloidin | Thermofischer Scientific | A22287 | Actin stain |
| anti-ATG9A antibody | home made | STO-215 | Rabbit anti N-terminal peptide ATG9A |
| anti-Rabbit IgG, peroxidase-linked | Invitrogen | 10794347/NA934-1ml | Secondary antibody for rabbit polyclonal STO-215 |
| anti-RFP antibody | Evrogen | AB233 | for Western Blot |
| ATG9A Monoclonal Antibody (14F2 8B1), Invitrogen | Invitrogen | 15232826 | Antibody for immunofluorescence |
| ATG9A-eGFP | home made | Construct which expresses tagged ATG9A | |
| Bemis Parafilm | Thermofischer Scientific | 11747487 | self-sealing thermoplastic film |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | For determining protein concentration |
| Bovine serum albumin (BSA) | Merck | 10735086001 | For blocking non-specific labelling |
| CaCl2.2H2O | / | For PBS and EBSS | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | Supplement in lysis buffer to prevent protein degradation |
| Cy3 AffiniPure Goat Anti-Armenian Hamster IgG | Jackson ImmunoResearch | 127-165-099 | Secondary antibody for i14F2 8B1 antibody for mmunofluorescence |
| Cyclohexamide | Sigma Aldrich | 66-81-9 | To stop protein translation |
| D-Glucose | / | For EBSS | |
| Digitonin | Merck | 300410 | For permeabilizing cells |
| DMEM | Merck | D6546-6x500ml | For tissue culture |
| eGFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Fetal Bovine Serum | Gibco | 10270-106 | Supplement for DMEM for cell culture |
| FIJI (ImageJ) | / | https:/fiji.sc/ | Open source image analysis software |
| Hoechst | Thermofischer Scientific | H3570 | Stains the nucleus |
| KCl | / | For EBSS | |
| L-glutamine | Sigma | 67513 | For tissue culture |
| Lipofectamine 2000 | Invitrogen | 11668-019 | For Cell Transfection |
| LSM880 Airyscan microscope | Zeiss | / | Confocal microscopy |
| MgCl2 | / | For PBS | |
| MgSO4.7H2O | / | For EBSS | |
| Mowiol mounting solution | Millipore | 475904 | for permanent mounting glass coverslips |
| NaCl | / | For EBSS | |
| NaH2PO4.2H2O | / | For EBSS | |
| NaHCO3 | / | For EBSS | |
| NuPAGE 3 to 8%, Tris-Acetate, 1.5 mm, Mini Protein Gels | Thermofischer Scientific | EA0378BOX | for Western Blotting |
| NuPAGE MES SDS Running Buffer (20x) | Life Tech | NP0002 | for Western Blotting |
| Opti-MEM I Reduced Serum Medium | Thermo | 31985062 | For Cell Transfection |
| Paraformaldehyde | Agar Scientific | R1026 | For fixing cells |
| pcDNA3.1-mCherry-3xFlag-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Phosphate Buffered Saline (PBS) | / | For tissue culture | |
| PNGaseF | NEB | P0710S | To remove N-linked glycans |
| Poly-D-lysine hydrobromide mol wt 70,000-150,000 | Merck | P0899 | For coating coverslips |
| Rapid PNGase F enzyme | NEB | P07105 | To remove N-linked glycans |
| RFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Triton X-100 | Thermofischer Scientific | 13454259 | Detergent for Cell lysis |
| Trypsin-EDTA solution | Sigma | T4049 | For tissue culture |
| Whatman Filter Paper | Merck | WHA1001325 | For Western Blot and IF |
| XCell SureLock Mini-Cell Electrophoresis System | Invitrogen | EI0001 | For Western Blotting |
| Zen Black edition | Zeiss | / | Used to operate the LSM 880 |
참고문헌
- Young, A. R., et al. Starvation and ULK1-dependent cycling of mammalian Atg9 between the TGN and endosomes. Journal of Cell Science. 119, 3888-3900 (2006).
- Maeda, S., et al. lipid scrambling activity and role in autophagosome formation of ATG9A. Nature Structural & Molecular Biology. 27 (12), 1194-1201 (2020).
- Matoba, K., et al. Atg9 is a lipid scramblase that mediates autophagosomal membrane expansion. Nature Structural & Molecular Biology. 27 (12), 1185-1193 (2020).
- Mercer, T. J., Gubas, A., Tooze, S. A. A molecular perspective of mammalian autophagosome biogenesis. Journal of Biological Chemistry. 293 (15), 5386-5395 (2018).
- Yamamoto, H., Zhang, S., Mizushima, N. Autophagy genes in biology and disease. Nature Reviews: Genetics. , (2023).
- Sawa-Makarska, J., et al. Reconstitution of autophagosome nucleation defines Atg9 vesicles as seeds for membrane formation. Science. 369 (6508), (2020).
- Melia, T. J., Lystad, A. H., Simonsen, A. Autophagosome biogenesis: From membrane growth to closure. Journal of Cell Biology. 219 (6), 202002085 (2020).
- Orsi, A., et al. Dynamic and transient interactions of Atg9 with autophagosomes, but not membrane integration, are required for autophagy. Molecular Biology of the Cell. 23 (10), 1860-1873 (2012).
- Judith, D., et al. ATG9A shapes the forming autophagosome through Arfaptin 2 and phosphatidylinositol 4-kinase IIIbeta. Journal of Cell Biology. 218 (5), 1634-1652 (2019).
- Karanasios, E., et al. Autophagy initiation by ULK complex assembly on ER tubulovesicular regions marked by ATG9 vesicles. Nature Communications. 7, 12420 (2016).
- Koyama-Honda, I., Itakura, E., Fujiwara, T. K., Mizushima, N. Temporal analysis of recruitment of mammalian ATG proteins to the autophagosome formation site. Autophagy. 9 (10), 1491-1499 (2013).
- Guardia, C. M., et al. Structure of human ATG9A, the only transmembrane protein of the core autophagy machinery. Cell Reports. 31 (13), 107837 (2020).
- Soreng, K., et al. SNX18 regulates ATG9A trafficking from recycling endosomes by recruiting Dynamin-2. EMBO Reports. 19 (4), e44837 (2018).
- Staudt, C., Gilis, F., Boonen, M., Jadot, M. Molecular determinants that mediate the sorting of human ATG9A from the endoplasmic reticulum. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1863 (9), 2299-2310 (2016).
- Knaevelsrud, H., Carlsson, S. R., Simonsen, A. SNX18 tubulates recycling endosomes for autophagosome biogenesis. Autophagy. 9 (10), 1639-1641 (2013).
- Takahashi, Y., et al. The Bif-1-Dynamin 2 membrane fission machinery regulates Atg9-containing vesicle generation at the Rab11-positive reservoirs. Oncotarget. 7 (15), 20855-20868 (2016).
- Imai, K., et al. Atg9A trafficking through the recycling endosomes is required for autophagosome formation. Journal of Cell Science. 129 (20), 3781-3791 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- van Vliet, A. R., et al. ATG9A and ATG2A form a heteromeric complex essential for autophagosome formation. Molecular Cell. 82 (22), 4324-4339 (2022).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Bradford assay for determining protein concentration. Cold Spring Harbor Protocols. 2020 (4), 102269 (2020).
- Kurien, B. T., Scofield, R. H. Validating antibody specificities for immunohistochemistry by protein blotting. Methods in Molecular Biology. 2593, 21-33 (2023).
- Lamb, C. A., et al. TBC1D14 regulates autophagy via the TRAPP complex and ATG9 traffic. EMBO Journal. 35 (3), 281-301 (2016).
- Longatti, A., et al. TBC1D14 regulates autophagosome formation via Rab11- and ULK1-positive recycling endosomes. Journal of Cell Biology. 197 (5), 659-675 (2012).
- Ravussin, A., Brech, A., Tooze, S. A., Stenmark, H. The phosphatidylinositol 3-phosphate-binding protein SNX4 controls ATG9A recycling and autophagy. Journal of Cell Science. 134 (3), (2021).
- DesMarais, V., Eddy, R. J., Sharma, V. P., Stone, O., Condeelis, J. S. Optimizing leading edge F-actin labeling using multiple actin probes, fixation methods and imaging modalities. BioTechniques. 66 (3), 113-119 (2019).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of inhibition of protein synthesis in mammalian cells. Science. 146 (3650), 1474-1476 (1964).
- Webber, J. L., Tooze, S. A. Coordinated regulation of autophagy by p38alpha MAPK through mAtg9 and p38IP. EMBO Journal. 29 (1), 27-40 (2010).
- Claude-Taupin, A., et al. ATG9A protects the plasma membrane from programmed and incidental permeabilization. Nature Cell Biology. 23 (8), 846-858 (2021).
- Aaron, J. S., Taylor, A. B., Chew, T. L. Image co-localization - Co-occurrence versus correlation. Journal of Cell Science. 131 (3), 211847 (2018).
- D'Antuono, R., Nechyporuk-Zloy, V. Basic digital image acquisition, design, processing, analysis, management, and presentation. Principles of Light Microscopy: From Basic to Advanced. , 77-104 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유