성인 자가면역 뇌척수염 마우스에서 주요 중추 신경계 상주 세포 유형의 동시 분리
* 이 저자들은 동등하게 기여했습니다
요약
현재까지 동일한 마우스에서 모든 주요 중추 신경계 상주 세포 유형을 동시에 분리하기 위한 프로토콜은 충족되지 않은 수요입니다. 이 프로토콜은 신경 염증 중에 복잡한 세포 네트워크를 조사하고 동시에 필요한 마우스 수를 줄이기 위해 순진하고 실험적인 자가면역 뇌척수염 마우스에 적용할 수 있는 절차를 보여줍니다.
초록
실험적 자가면역 뇌척수염(EAE)은 다발성 경화증(MS)에 대한 가장 흔한 쥐 모델이며 새로운 치료 전략을 개발하기 위해 아직 알려지지 않은 다발성경화증의 원인을 추가로 설명하는 데 자주 사용됩니다. 미엘린 희소돌기아교세포 당단백질 펩타이드 35-55(MOG35-55) EAE 모델은 면역 후 10일 이내에 상행 마비와 함께 자가 제한 단상 질환 경과를 재현합니다. 생쥐는 임상 점수 시스템을 사용하여 매일 검사됩니다. 다발성경화증은 특정 시간적 패턴을 가진 다양한 병리기전에 의해 유발되므로 질병 진행 중 중추신경계(CNS)에 상주하는 세포 유형의 역할에 대한 연구는 매우 중요합니다. 이 프로토콜의 독특한 특징은 성체 EAE 및 건강한 마우스에 적용할 수 있는 모든 주요 CNS 상주 세포 유형(미세아교세포, 희소돌기아교세포, 성상교세포 및 뉴런)을 동시에 분리하는 것입니다. 성체 쥐에서 뇌와 척수를 분리한 후 자기 활성화 세포 분류(MACS)를 통해 미세아교세포, 희소돌기아교세포, 성상교세포, 뉴런을 분리합니다. 유세포 분석은 정제된 단일 세포 현탁액의 품질 분석을 수행하는 데 사용되었으며, 세포 분리 후 생존력을 확인하고 각 세포 유형의 순도를 약 90%로 표시했습니다. 결론적으로, 이 프로토콜은 건강한 마우스와 EAE 마우스의 복잡한 세포 네트워크를 분석하는 정확하고 포괄적인 방법을 제공합니다. 더욱이, 필요한 마우스 수는 4가지 세포 유형 모두가 동일한 마우스로부터 분리되기 때문에 실질적으로 감소될 수 있다.
서문
다발성 경화증(MS)은 탈수초화, 축삭 손상, 신경교증 및 신경 퇴행을 특징으로 하는 중추신경계(CNS)의 만성 염증성 자가면역 질환입니다. 이 분야의 수많은 연구 접근에도 불구하고 다발성경화증의 병태생리학은 여전히 완전히 이해되지 않고있다 1,2,3,4. 다발성경화증을 조사하기 위한 가장 일반적인 동물 모델은 미엘린 희소돌기아교세포 당단백질 펩타이드 35-55(MOG35-55)-유발 실험적 자가면역 뇌척수염(EAE)으로, 임상적 및 병태생리학적 특징을 많이 공유합니다 5,6,7,8,9 . 이는 염증, 탈수초화 및 신경 축삭 변성을 유발하는 CNS 특이적 항원에 대한 면역 체계의 반응을 기반으로 합니다. 실험적 자가면역 뇌척수염(EAE)은 다발성경화증에서 발견되는 신경염증 경로 및 신호 전달 캐스케이드를 조사하는 데 적합한 모델입니다.
다발성경화증에 대한 현재의 치료법은 부분적으로만 효과적이며 주로 질병의 초기 염증 단계에 초점을 맞춥니다. 그러나 다발성경화증의 신경퇴행성 성분은 장기적인 치료 접근법의 주요 과제인 것 같습니다. 따라서 자가면역 질환의 분자 및 세포 메커니즘을 포괄적으로 조사하기 위해서는 재현 가능하고 정밀한 세포 분리 프로토콜이 필요합니다. 하나의 단일 세포 유형의 분리를 위한 일부 프로토콜이 10,11,12,13,14,15 존재하더라도, 한 번에 여러 CNS 상주 세포 집단의 동시 분리에 대한 충족되지 않은 요구가 있습니다. 중추신경계 상주 세포의 분리를 위한 이전의 프로토콜은 세포 기능 및 순도를 보존하는 데 부족하여, 인접 세포와의 공동 배양 16,17,18 또는 생체 외 세포 내 네트워크의 복잡한 분석에 부적합하였다 19,20,21,22.
이 프로토콜의 목적은 성인 건강 및 EAE 마우스에 적용 가능한 모든 주요 CNS-상주 세포 유형의 순수 생존 가능한 단일 세포 현탁액의 동시 분리를 위한 재현 가능하고 포괄적인 방법을 확립하는 것이었습니다. 서로 다른 세포 유형은 자기 활성화 세포 분류(MACS)를 사용하여 분리되었습니다(23). 세포 분리는 positive selection, 즉 세포 유형별 표면 마커의 자기 표지 또는 비오틴화 및 원하지 않는 모든 세포의 고갈을 통한 negative selection에 의해 수행될 수 있습니다. 90% 이상의 순도와 분리된 단일 세포 현탁액의 최소 80%의 생존율을 보장하기 위해 유세포 분석이 적용되었습니다.
결론적으로, 주요 목표는 건강한 EAE 마우스의 복잡한 세포 네트워크 및 생화학적 신호 캐스케이드의 포괄적이고 정확한 분석을 제공하는 신경 염증 경로 조사를 위한 다목적 도구로서 모든 주요 CNS 상주 세포 유형의 동시 분리를 위한 프로토콜을 설정하는 것이었습니다.
프로토콜
모든 EAE 실험은 생후 10-12주에 암컷 C57BL/6J 마우스에서 유도되었으며 현지 당국(Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen)의 승인을 받았습니다. 독일 및 EU 동물 보호법 준수도 실험 시 언제든지 보장되었습니다. 모든 마우스는 개별적으로 환기되는 케이지 동물 사육 조건에서 사육되었습니다.
참고: 다음 시약 부피는 성인 쥐의 뇌 및 척수 1개를 지칭하며, 다음에서는 CNS 세포 현탁액으로 명명되며 무게는 약 20mg에서 500mg입니다. 두 개 이상의 CNS 세포 현탁액의 해리를 계획하는 경우 모든 시약의 부피와 물질을 그에 따라 확장해야 합니다. Dulbecco의 인산염 완충 식염수(D-PBS; 1x)를 칼슘 및 마그네슘과 함께 1g/L 포도당 및 36mg/L 피루브산 나트륨으로 보충하여 전체 실험 동안 얼음 위에 지속적으로 보관하는 것이 좋습니다. 나중에 세포 배양을 계획하는 경우 후드를 사용하여 멸균 상태에서 모든 단계를 수행하십시오. 그렇지 않으면 다음 프로토콜 섹션 중 어느 것도 내부적으로 수행할 필요가 없습니다. 버퍼를 얼음에 보관하십시오. 사전 냉각된 용액만 사용하고 전체 실험에서 와류를 피하십시오. 전체 워크플로에 대해서는 그림 1 을 참조하십시오.
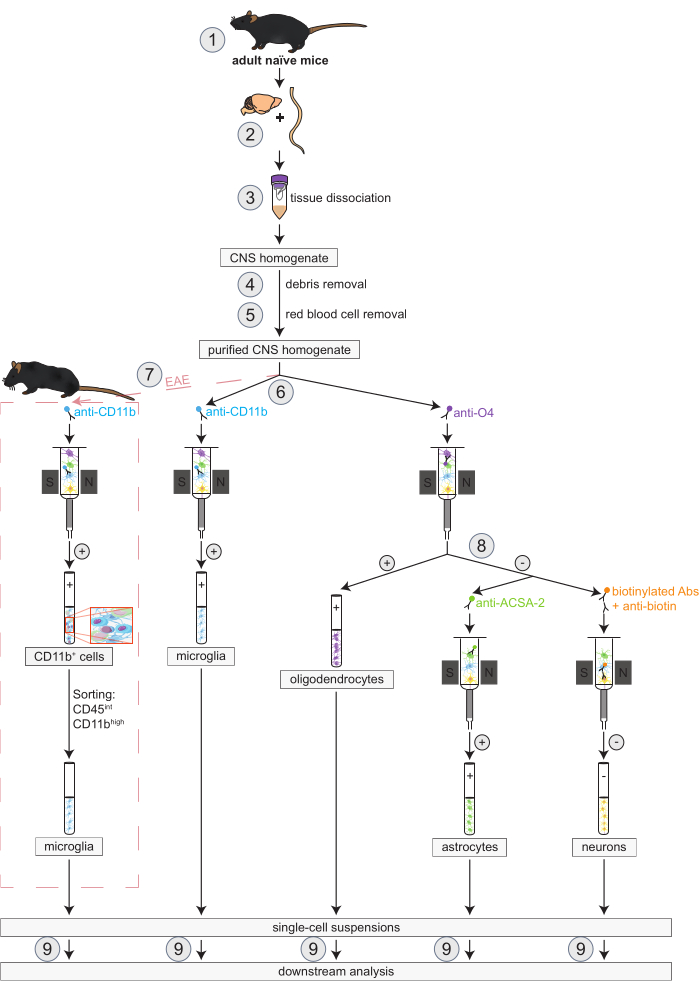
그림 1: naive 마우스와 EAE 마우스에서 희소돌기아교세포, 미세아교세포, 성상교세포, 뉴런을 동시에 분리하기 위한 워크플로우. 워크플로의 첫 번째 단계는 순진한 마우스와 EAE 마우스 모두에 대해 동일합니다. EAE 복제로 작업하려는 경우 EAE 유도를 미리 수행해야 합니다(1). 간단히 말해서, 프로토콜은 쥐 뇌와 척수의 해부(2)와 해리(3)로 시작하여 파편(4)과 적혈구(5)를 제거합니다. 그 후, 정제된 CNS 세포 현탁액은 MACS를 통해 희소돌기아교세포와 미세아교세포를 동시에 분리하기 위해 두 개의 분획으로 분할됩니다(6). 미세아교세포는 항-CD11b 마이크로비드를 통해 검출되는 반면, 희소돌기아교세포는 항-O4 마이크로비드(positive selection)를 사용하여 분리됩니다. 희소돌기아교세포(8)의 음성 흐름에서 성상교세포는 항 ACSA-2 마이크로 비드(양성 선택)를 통해 분리되고 비오틴 표지 및 모든 비신경 세포의 고갈(음성 선택)에 의해 신경 세포가 분리됩니다. EAE 마우스에서는, CD11b+ 세포의 고립은 EAE 과정 도중 neuroinflammation 과정에 관여하기 위하여 알려져 있는 대식세포, 수지상 세포, 단핵구, 과립구 및 자연 살해자 세포 같이 다른 CD11b+ 면역 세포를 삭제하기 위하여 CD45intCD11b높은 세포의 형광 활성화한 세포 분류에 선행됩니다 (7)27,28,48. 다양한 CNS 상주 세포 유형을 분리한 후 순도 분석을 수행할 수 있습니다(9). 약어: Abs = 항체; ACSA-2 = 성상교세포 세포 표면 항원-2; CD11b = 사이클린 의존성 키나아제 11B; CD45 = 수용체형 티로신-단백질 인산가수분해효소 C; CNS = 중추 신경계; EAE = 실험적 자가면역 뇌척수염; MACS = 자기 활성화 세포 분류; O4 = 희소돌기아교세포 마커 O4. 이 수치는49에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 활성 EAE의 유도
- 시약의 준비
- 세포 분리용: PB 완충액을 준비하고 최대 2-8°C에서 최대 1주일 동안 보관합니다. 원액을 준비하려면 보충제 없이 1x PBS(pH 7.2) 475mL + 0.5% 소 혈청 알부민(BSA) 25mL를 추가합니다. BSA에서 준비한 1:20 희석액을 사용하십시오.
- 유세포 분석 및 형광 활성화 세포 분류(FACS)의 경우: 2% 태아 송아지 혈청(FCS) 및 2mM EDTA가 포함된 FACS 완충액, PBS를 준비하고 2-8°C에서 보관합니다. 보충제 없이 1x PBS 500mL와 FCS + 2mL EDTA 10mL(0.5M EDTA 재고에서)를 추가합니다.
- Bittner et al. 5의 프로토콜에 따라 예방 접종을 수행합니다. 간단히 말해서, 200 μg MOG35-55 펩타이드와 200 μg Mycobacterium tuberculosis를 포함한 완전한 프로이트 보조제 200 μL를 함유 한 에멀젼의 피하 주사로 EAE를 유도합니다.
- 이소플루란 기화기가 있는 마취실을 사용하여 2% 이소플루란으로 마우스를 마취합니다. 마취 상태에서 건조함을 방지하기 위해 동물의 눈에 수의사 연고를 사용하십시오.
- 2시간 후 Huntemann et al.24의 프로토콜에 따라 1x PBS의 100μL에 용해된 100ng 백일해 독소(PTx)의 복강내 주사를 주사합니다. 예방 접종 후 2일째에 PTx 주사를 반복합니다.
주의 : 흉골 누운 자세를 유지하기에 충분한 의식을 회복 할 때까지 각 동물을 관찰하십시오. 주사 시술을 받은 마우스는 완전히 회복될 때까지 다른 마우스의 회사로 돌아가지 않습니다. 결핵균(Mycobacterium tuberculosis) 및 PTx의 경우: 흡입, 섭취 및 피부와 눈과의 접촉을 피하십시오. 결핵균(Mycobacterium tuberculosis) 은 선천성 면역 체계의 활성화제입니다. PTx는 많은 생물학적 효과를 가지고 있습니다. - 체중을 모니터링하고 생쥐를 임상적으로 검사하는 두 명의 맹검 조사관이 수행하는 EAE 진행을 매일 모니터링합니다.
- 이를 위해 0등급-EAE의 임상 징후 없음, 1등급-부분 꼬리 마비, 2등급-완전한 꼬리 마비, 3등급-중등도의 뒷다리 약화, 4등급-완전한 뒷다리 약화 및 운동 실조증, 5등급-경미한 하반신 마비, 6등급-하반신 마비, 7등급-하반신 마비, 8등급-사지 마비, 9등급-사지 마비, 그리고 10 등급 죽음.
- 실험에 대한 추가 참여, 임상 점수 > 7 또는 초기 체중의 20%를 초과하는 체중 감량에 대해 다음 제외 기준을 사용하십시오.
- 뇌와 척수의 해부를 위해, EAE 유도 후 16 일에 EAE 마우스를 안락사시킵니다.
2. 중추신경계 조직 준비 (소요시간: 마우스당 약 10분)
- 생쥐에 이산화탄소를 희생시킨 후 20mL의 1x PBS로 각 생쥐의 심내경 관류로 시작합니다. 20mL의 1x PBS로 다시 관류를 반복합니다.
- 마우스를 누운 자세에 놓고 캐뉼라로 팔다리를 고정합니다. 동물의 앞몸에 75% 에탄올을 바릅니다. 이 시점에서는 추가 멸균 조치가 필요하지 않습니다.
- 가위를 사용하여 피부와 근막을 통해 세로 부분을 만들어 복부와 흉부를 엽니다.
- 갈비뼈를 옆으로 자르고 흉부를 접어 심장에 자유롭게 접근할 수 있도록 합니다. 캐뉼라로 위쪽으로 접힌 흉부를 고정합니다.
- 가위를 사용하여 오른쪽 아트리움을 엽니다. 캐뉼라를 사용하여 좌심실에 1x PBS 20mL를 도포하여 절개된 우심방을 통해 혈액을 씻어냅니다.
- 세로로 단면을 통해 쥐 머리 위의 피부를 잘라 두개골을 노출시키고 집게를 사용하여 머리 주위의 피부를 이동합니다. 시상 봉합사를 따라 가위를 사용하여 두개골을 절개합니다.
- 절개선을 따라 집게의 끝을 삽입하여 칼로트를 엽니다. 뇌가 완전히 노출되도록 집게로 칼로트의 나머지 부분을 제거합니다.
- 뇌를 조심스럽게 꺼내 쥐 뇌 매트릭스에 넣습니다. 면도날을 사용하여 뇌를 1mm 두께의 시상 조각으로 자릅니다.
- 주사기가 척추관에 삽입될 수 있도록 장골능 바로 위의 가위를 사용하여 척추를 자릅니다.
알림: 척수를 제거하는 가장 쉬운 방법은 PBS를 사용하여 척수를 척수 밖으로 씻어내는 것입니다. 그렇지 않으면 가위로 척추 아치를 개별적으로 연 다음 척수를 제거 할 수 있습니다. - 1x PBS가 포함된 20G 바늘이 있는 20mL 주사기를 사용하여 꼬리에서 두개골까지 척수를 척수에서 씻어냅니다. 메스를 사용하여 척수를 0.5cm 길이로 자릅니다.
- 뇌와 해당 척수로 구성된 각 CNS 세포 현탁액을 약 3mL의 차가운 D-PBS로 채워진 마우스당 하나의 별도 페트리 접시에 보관합니다. 추가 처리가 될 때까지 접시를 얼음에 보관하십시오.
3. 중추신경계 조직 해리 (지속 시간: 중추신경계 세포 현탁액의 수에 따라 약 1-1.5시간)
참고: 성체 마우스의 신경 조직은 기계적 해리와 세포외 기질의 효소적 분해를 결합하여 해리됩니다. 이에 의해, 구조적 무결성이 유지되고, 세포 현탁액은 추가적인 세포 분리 절차에 사용될 수 있다.
- CNS 세포 현탁액당 50μL의 효소 P와 1,900μL의 완충액 Z로 구성된 적절한 부피의 효소 믹스 1을 준비합니다. 두 시약 모두 성인 뇌 해리 키트에 속합니다.
- CNS 세포 현탁액당 10μL의 효소 A와 20μL의 완충액 Y로 구성된 적절한 부피의 효소 믹스 2를 준비합니다. 두 시약 모두 성인 뇌 해리 키트에 속합니다.
- 효소 믹스 1 1,950μL를 C 튜브에 옮기고 그 후 CNS 세포 현탁액 1개의 조직 조각을 추가합니다. 마우스당 하나의 C 튜브를 사용하십시오.
- 각 C 튜브에 30μL의 효소 믹스 2를 추가합니다. C 튜브를 단단히 닫고 히터가 있는 셀 해리기의 슬리브에 거꾸로 부착합니다.
- 37C_ABDK_01라는 적절한 프로그램을 실행합니다(30분 소요). 모든 튜브가 동일한 속도로 회전하는지 확인하기 위해 프로그램의 처음 5분 이상을 관찰하십시오. 실행 중에 오류가 발생할 수 있습니다. 그런 다음 6단계로 이동합니다.
- 프로그램의 마지막 2분 동안 해리된 각 CNS 세포 현탁액에 대해 50mL 튜브에 70μm 스트레이너 하나를 놓습니다. 이 스트레이너를 2mL의 D-PBS로 미리 적십니다.
- 프로그램 종료 후 해리기에서 C 튜브를 부착하고 원심 분리기에 넣습니다. 샘플을 300 x g 및 4°C에서 1분 동안 원심분리하여 튜브 바닥에서 샘플을 수집합니다.
- 샘플을 재현탁하고 미리 적신 스트레이너에 적용합니다. 빈 C 튜브에 차가운 D-PBS 10mL를 넣고 닫습니다. 부드럽게 흔들어 서스펜션을 해당 스트레이너에 바릅니다.
- 스트레이너를 버리고 50mL 튜브를 닫습니다. 셀 현탁액을 300 x g 및 4°C에서 10분 동안 다시 원심분리합니다. 그런 다음 전체 상층액을 매우 조심스럽게 흡인하십시오.
4. 파편 제거 (지속 시간: CNS 세포 현탁액의 수에 따라 약 1.5-2시간)
참고: 조직 해리는 종종 다운스트림 분석을 손상시킬 수 있는 미엘린 및 세포 파편으로 이어집니다. 이물질 제거 용액을 추가하면 이 이물질을 CNS 세포 현탁액에서 효율적으로 제거할 수 있습니다.
- 각 CNS 세포 현탁액에 대해 3,100μL의 D-PBS로 세포 펠릿을 조심스럽게 재현탁시킵니다. 소용돌이치지 마십시오.
- 두 개 이상의 CNS 세포 현탁액으로 작업하는 경우, 하나의 조건 또는 실험군에서 파생된 최대 2개의 CNS 세포 현탁액을 하나의 15mL 튜브에 모으십시오.
- 성인 뇌 해리 키트의 잔해물 제거 용액 900μL를 CNS 세포 현탁액 1개에 추가하거나 1,800μL의 파편 제거 용액을 합친 CNS 세포 현탁액 2개에 추가합니다.
- 튜브를 뒤집고 서스펜션을 혼합합니다. 그런 다음 4mL의 차가운 D-PBS를 아주 부드럽게 덧바릅니다. 명확한 그래디언트가 보여야 합니다(그림 2A).
- 브레이크 없이 최대 가속 상태에서 3000 x g 및 4 °C에서 10분 동안 튜브를 원심분리합니다.
- 의도한 대로 분리가 발생하면 3상이 형성됩니다(그림 2C). 두 개의 상단 상을 완전히 흡입하고(그림 2C-1,2) 폐기합니다. 미엘린 잔류물이 남지 않는 것이 중요합니다(그림 2E).
알림: 그라디언트가 작동하지 않고 셀이 긴급하게 필요한 경우 두 개의 상단 단계를 빨아들이지 마십시오. 대신 15mL 튜브에 최대 15mL의 차가운 D-PBS를 채우고 여러 번 뒤집습니다. 브레이크 없이 최대 가속 상태에서 4°C에서 10분 동안 1000 x g 에서 다시 원심분리합니다. 상층액을 빨아들이고 4.1-4.4단계를 반복합니다. - 최대 14mL의 차가운 D-PBS로 튜브를 채우고 닫습니다. 셀 펠릿이 튜브 바닥에서 분리될 때까지 작업대에서 튜브를 강력하게 뒤집습니다. 소용돌이치지 마십시오.
- 샘플을 1000 x g 및 4°C에서 10분 동안 다시 원심분리합니다. 최대 가속 및 최대 브레이크를 설정합니다. 상층액을 조심스럽게 완전히 흡입하십시오.

그림 2: 이물질 제거 중 해야 할 일과 하지 말아야 할 일. (A) 4mL의 PBS로 오버레이한 후의 그래디언트에 대한 양성 예. 4mL의 PBS로 구성된 상부상은 이물질 제거 용액이 있는 CNS 세포 현탁액으로 구성된 하부상과 명확하게 구별할 수 있습니다. (B) 4mL의 PBS로 오버레이한 후의 그래디언트에 대한 음성 예. 그래디언트는 PBS와 아래의 셀 현탁액 사이에 명확한 분리가 없습니다. PBS의 일부가 세포 현탁액으로 확산됩니다. (C) 원심분리 후의 그래디언트에 대한 긍정적인 예. 세 가지 개별 단계를 쉽게 구별할 수 있습니다. 기울기의 상부(1) 또는 하부(3)에는 미엘린 잔기가 보이지 않습니다. 중간 단계에는 모든 미엘린이 포함되어 있습니다(2). 세포 펠릿은 15mL 튜브의 바닥에서 볼 수 있습니다. (D) 원심분리 후의 그래디언트에 대한 음의 예. 세 단계 사이에는 정확한 분리가 불가능합니다. 일부 미엘린 잔기는 구배의 상부(1)와 하부(3)에서 볼 수 있습니다. (E) 두 개의 최상위 단계를 흡인한 후의 기울기에 대한 긍정적인 예. 결과 샘플에는 세포 펠릿과 위의 투명한 상층액만 포함되어 있습니다. 미엘린 잔여물이 남지 않습니다. (F) 두 개의 상단 상을 흡인한 후의 기울기에 대한 음의 예. 샘플에는 여전히 일부 미엘린 잔기(검은색 화살표)가 포함되어 있습니다. 약어: CNS = 중추 신경계; PBS = 인산염 완충 식염수 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 적혈구 제거 (지속 시간: CNS 세포 현탁액의 수에 따라 약 1시간)
참고: 이 단계는 나중에 적혈구에 의한 오염을 방지하고 중추신경계 조직에서 분리된 다른 세포 유형에 미치는 영향을 최소화하면서 적혈구의 최적 용해를 보장합니다. 다음 부피는 2개의 성인 마우스 뇌 및 척수에 해당하는 100mg 내지 1g 신경 조직에서 유래한 세포 현탁액에 대해 표시됩니다. 두 개 이상의 CNS 세포 현탁액으로 작업하는 경우 그에 따라 모든 시약과 총 부피를 확대하십시오.
- 적혈구 제거 용액(RBCRS)의 준비로 시작: 2개의 통합 CNS 세포 현탁액당 성인 뇌 해리 키트에서 100μL의 적혈구 제거 원액(10x)을ddH900μL의 2O에 희석하여 최종 희석액을 1:10으로 희석합니다.
- RBCRS를 사용할 때까지 2-8°C에서 보관하십시오. 하루가 끝나면 사용하지 않은 잔해를 버리십시오.
- RBCRS 1mL에 최대 2개의 CNS 세포 현탁액의 세포 펠릿을 재현탁시킵니다. 소용돌이를 피하십시오. 용액을 4°C에서 10분 동안 배양합니다.
- 10mL의 콜드 PB 완충액을 2개의 풀링된 세포 현탁액에 추가합니다. 샘플을 300 x g 및 4°C에서 10분 동안 원심분리하고 그 후 상층액을 완전히 흡인합니다.
- 위아래로 천천히 피펫팅하여 80μL의 PB 완충액에 하나의 CNS 세포 현탁액에서 각 세포 펠릿을 재현탁시킵니다. 따라서 160μL를 사용하여 2개의 CNS 세포 현탁액에서 유래한 세포 펠릿을 재현탁시킵니다.
- 동일한 실험 조건에서 여러 CNS 세포 현탁액으로 작업할 때 이러한 모든 세포 현탁액을 통합합니다.
- 예를 들어, 개선된 계수 챔버를 사용하여 세포 수를 결정합니다. 세포 현탁액을 일반적으로 PB 완충액에서 1:50으로 희석한 후 0.4% 트리판 블루 용액에서 1:10으로 추가로 희석했습니다.
6. 순진한 EAE 마우스의 마그네틱 비드 프로토콜 (지속 시간: 약 1시간)
- 표면 항원에 특이적인 MicroBeads를 사용하여 다양한 CNS 세포 유형을 자기적으로 라벨링합니다. 그런 다음 세포 현탁액을 컬럼에 배치하고 컬럼 내에 남아 있는 표지된 세포와 통과하는 표지되지 않은 세포를 자기적으로 분리합니다.
- 자기장에서 컬럼을 제거한 후, 자기적으로 표지된 세포를 양성으로 선택된 세포 분획으로 컬럼에서 튜브로 플러시합니다.
알림: 마그네틱 라벨링 프로세스의 부피는 최대 1 x 107 개의 총 셀에 대해 계산됩니다. 더 많은 세포가 확보되면 그에 따라 모든 시약과 총 부피를 확대합니다. 세포 표면의 항체 캡핑과 비특이적 세포 라벨링을 방지하고 분리된 세포 집단의 높은 생존율을 보장하기 위해 빠르게 작업하고 사전 냉각된 용액만 사용하는 것이 좋습니다. 또한 컬럼이 건조되지 않도록 PB 버퍼를 추가하여 컬럼 저장소가 비워지는 즉시 세척 단계를 수행하는 것이 중요합니다. - 정제된 희석되지 않은 CNS 세포 현탁액을 미세아교세포와 희소돌기아교세포의 다음 분리를 위해 두 개의 분획으로 나눕니다. 두 분획의 비율은 각 세포 유형의 원하는 세포 수에 따라 다릅니다.
참고: 자세한 내용(배양 기간, 자세한 프로토콜 단계, 부피, 시약 및 세포 계수 방법)은 표 1에 나와 있습니다.
표 1: naive 마우스와 EAE 마우스에서 희소돌기아교세포와 미세아교세포의 동시 자기 표지 및 분리를 위한 워크플로우. 두 세포 유형 모두 양성 선택을 통해 분리됩니다. 동일한 행에 나열된 단계는 한 번에 수행되도록 표시됩니다. 약어: CD11b = 사이클린 의존성 키나아제 11B; EAE = 실험적 자가면역 뇌척수염; FcR = Fc 수용체 유사 단백질; O4 = 희소돌기아교세포 마커 O4. 이 표를 다운로드하려면 여기를 클릭하십시오.
7. 프로토콜 개정: EAE 마우스에서 미세아교세포의 분리를 위한 추가 분류(내시간: 약 1.5-2시간)
참고: EAE 마우스로 작업할 때 CD11b+ 세포 분획에서 미세아교세포 이외의 CD11b+ 세포 집단(예: 단핵구, 대식세포, 자연살해세포, 과립구 또는 수지상세포)을 제거하기 위해 FACS에 의한 MACS 기반 세포 분리 프로토콜을 보완해야 합니다. 그렇지 않으면 이 단계를 무시할 수 있습니다.
- CD11b FITC(클론 M1/70, 1:50) 및 CD45 APC/Cy7(클론 30-F11, 1:200)이 보충된 1x PBS를 포함하는 염색 마스터 믹스를 준비합니다. 5 x 106 세포당 100μL의 염색 마스터 믹스를 사용합니다. 사용하기 전에 모든 항체를 소용돌이치십시오.
- 미세아교세포 현탁액을 300 x g 및 4°C에서 10분 동안 원심분리하고 상층액을 조심스럽게 흡인합니다.
- 5 x 106 세포당 준비된 염색 마스터 믹스 100μL로 세포 펠릿을 재현탁시킵니다. 실온(RT)의 어두운 곳에서 15분 동안 배양합니다.
- 500μL의 PBS를 첨가하여 반응을 중지하고 샘플을 300 x g 및 4°C에서 10분 동안 다시 원심분리합니다.
- 상층액을 조심스럽게 흡인하고 10μg/mL DNAse가 보충된 1x PBS로 세포 펠릿을 재현탁시켜 mL당 1 x 107 세포의 최종 농도에 도달합니다. 분류가 시작될 때까지 세포를 4°C에서 보관합니다.
- 분류를 시작하기 직전에 새 FACS 튜브에 놓인 100μm 스트레이너에 셀 현탁액을 적용합니다.
- 유량을 초당 1000개 이벤트로 설정하고 100μm 노즐을 사용합니다. CD45intCD11bhigh cell의 원하는 세포 집단을 RT에서 1x PBS로 준비된 새로운 15mL 튜브로 분류합니다.
8. 뉴런과 성상교세포의 분리를 위한 희소돌기아교세포의 음성 유동 준비(소요시간: 약 1시간)
참고: 6단계에서 희소돌기아교세포의 음성 흐름은 뉴런과 성상교세포의 추가 분리를 위해 수집됩니다. 이를 위해, 셀 현탁액은 두 부분으로 나뉩니다. 이전에 중추신경계 세포 현탁액에서 희소돌기아교세포를 분리했기 때문에 O4+ 세포에 의한 오염이 최소화되어 관찰될 수 있습니다.
- 희소돌기아교세포의 음성 유동을 300 x g 및 4°C에서 10분 동안 원심분리하고 상층액을 조심스럽게 흡인합니다.
- 희소돌기아교세포 양성 분획의 분리를 위해 이전에 사용된 풀링된 CNS 세포 현탁액당 80μL의 PB 완충액에 세포 펠릿을 재현탁시킵니다.
- 셀을 셉니다. 세포 현탁액을 PB 완충액에서 1:50으로 희석한 후 0.4% 트리판 블루에서 추가로 1:10으로 희석한 후 개선된 계수 챔버를 사용하여 O4- 로 가정되는 세포의 계수를 수행합니다.
- 정제된 희석되지 않은 세포 현탁액을 두 개의 분획으로 분할하여 뉴런과 성상세포를 동시에 분리합니다. 두 분획의 비율은 각 세포 유형의 선호 양에 따라 다릅니다.
참고: 자세한 내용(배양 기간, 자세한 프로토콜 단계, 부피, 시약 및 세포 계수 방법)은 표 2에 나와 있습니다.
표 2: naive 마우스와 EAE 마우스의 뉴런과 성상세포의 동시 자기 표지 및 분리를 위한 워크플로우. 두 세포 유형 모두 희소돌기아교세포의 음성 흐름에서 분리됩니다. 성상세포는 항-ACSA-2 마이크로 비드를 통한 양성 선택으로 분리되는 반면, 뉴런은 비오틴화(biotinylation)를 통해 정제되고 모든 비신경 세포의 고갈(depletion)은 음성 선택(negative selection)으로 분리됩니다. 동일한 행에 나열된 단계는 한 번에 수행되도록 표시됩니다. 약어: 항-ACSA-2 = 성상교세포 세포 표면 항원-2; EAE = 실험적 자가면역 뇌척수염; FcR = Fc 수용체 유사 단백질; MACS = 자기 활성화 세포 분류. 이 표를 다운로드하려면 여기를 클릭하십시오.
9. 분리된 CNS 상주 세포 유형의 순도 분석(소요시간: 약 2시간)
참고: 4개의 분리된 CNS 상주 세포 집단 모두에 대한 유세포 분석을 수행하여 순도와 생존율을 측정하고 비교하는 것이 좋습니다. 따라서 형광단으로 표지된 항체로 모든 세포 유형을 염색해야 합니다. 살아있는 세포/죽은 세포 염색은 고정 가능한 생존도 염료(1:10,000)를 사용하여 구현됩니다.
- Purity panel - 세포외 염색 프로토콜
- 염색당 50μL의 PBS에 용해된 1 x 105 세포를 사용합니다.
- 세포 유형별 표면 마커를 표적으로 하는 다음 형광 크롬 접합 단클론 항체로 구성된 2% FCS/2mM EDTA로 PBS에 용해된 염색 마스터 믹스를 준비합니다: CD11b FITC (클론 1/70, 1:100)25,26,27,28, 비오틴-PE (클론 Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (클론 REA-969, 1:200)33,34,35, O4 APC (클론 REA-576, 1 : 400) 및 CD45 BV510 (클론 30-F11, 1 : 150) 36,37. Fc 수용체3 8,39를 차단하기 위해 1 x 106 세포당 1μg의 anti-CD16/32를 추가합니다. 사용하기 전에 모든 항체를 소용돌이치십시오.
- 세포 현탁액을 540 x g 및 4°C에서 5분 동안 원심분리하고 상층액을 조심스럽게 흡입합니다.
- 세포 펠릿을 각 마스터 믹스 100μL에 재현탁시키고 어두운 곳에서 RT에서 15분 동안 샘플을 배양합니다.
- 2% FCS/2mM EDTA가 포함된 500μL의 1x PBS로 세포를 세척하고 540 x g 및 4°C에서 5분 동안 샘플을 원심분리합니다.
- 상층액을 흡인하고 2% FCS/2mM EDTA로 70μL의 1x PBS로 세포 펠릿을 재현탁시킵니다.
- 세포 펠릿을 완전히 해리시키기 위해 샘플을 소용돌이치게하십시오. 그 후, 샘플은 유세포 분석을 위한 준비가 됩니다.
- 순도 패널 - NeuN을 사용한 세포 내 염색 프로토콜
- 뉴런 특이적 핵 마커(40,41)인 NeuN의 세포내 염색을 위해 각 세포 집단의 1 x 105 세포를 사용합니다. 이것은 생존 가능한 뉴런을 염색하는 또 다른 방법입니다.
- 각 세포 집단의 1 x 105 세포를 FACS 튜브에 전달합니다. 튜브당 2% FCS/2mM EDTA로 PBS 1mL를 추가합니다. 튜브를 540 x g 및 4°C에서 5분 동안 원심분리합니다.
- 한편, 세포 유형 특이적 표면 마커를 표적으로 하는 다음 형광 크롬 접합 단클론 항체로 구성된 2% FCS/2mM EDTA로 PBS에 용해된 마스터 믹스를 준비합니다: CD11b FITC (클론 M1/70, 1:100)25,26,27,28, 비오틴-PE (클론 Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (클론 REA-969, 1:200)33,34,35 및 CD45 BV510 (클론 30-F11, 1:150)36,37.
- 준비된 마스터 믹스 100μL에서 상층액을 흡인하고 세포를 재현탁시키고 어두운 곳에서 RT에서 10분 동안 샘플을 배양합니다.
- 2% FCS/2mM EDTA가 포함된 100μL의 PBS로 세포를 세척하고 5분 동안 540 x g 및 4°C에서 다시 원심분리합니다.
- 그 동안 200μL의 고정/투과화 용액을 준비합니다: 150μL의 고정/투과화 희석제에 농축된 고정/투과화 농축액 50μL를 추가하여 최종 희석액을 1:4로 만듭니다.
- 상층액을 흡인하고 100μL의 1x 고정/투과화 용액에 세포를 재현탁시킵니다. 샘플을 4°C에서 30분 동안 배양합니다.
- 그 동안 1:10의 최종 희석에 ddH2O의 900μL에 투과화 완충액 스톡 100μL를 첨가하여 1x 투과화/세척 완충액 1mL를 준비합니다.
- 100μL의 1x 투과화/세척 완충액으로 세포를 1x 세척하고 540 x g 및 4°C에서 5분 동안 샘플을 원심분리합니다.
- 그 동안 Fc 수용체를 차단하기 위해 106 세포당 NeuN(NeuN AF647, 클론 EPR12763, 1:200) 및 1μg의 anti-CD16/32로만 구성된 1x 투과화/세척 완충액에 또 다른 마스터 믹스를 준비합니다.
- 상층액을 흡인합니다. 두 번째 마스터 믹스의 50μL에 고정 및 투과화된 세포를 재현탁시키고 4°C에서 30분 동안 배양합니다.
- 100μL의 1x 투과화/세척 완충액으로 시료를 세척하고 540 x g 및 4°C에서 5분 동안 원심분리합니다.
- 상층액을 버리고 2% FCS/2mM EDTA로 70μL의 PBS에 세포 펠릿을 재현탁시킵니다. 그 후, 샘플은 유세포 분석을 위한 준비가 됩니다.
- 유세포 분석기에 패널을 설정한 후 유세포 분석 소프트웨어를 사용하여 순도 분석을 위한 세포를 획득합니다.
10. 통계 분석
- 통계 분석을 수행하고 그래픽 분석 프로그램으로 그래프를 설계합니다. 데이터는 SEM± 평균으로 표시됩니다.
대표적 결과
현재 프로토콜은 모든 주요 중추신경계 상주 세포, 즉 미세아교세포, 희소돌기아교세포, 성상교세포 및 뉴런을 하나의 단일 중추신경계 복제에서 동시에 분리할 수 있는 가능성을 제공합니다. 이는 이러한 종류의 실험에 필요한 마우스 수를 줄이고 세포 수준에서 분자 및 생화학 분석의 비교 가능성을 보장하는 데 중요합니다. 개별 세포 유형이 서로 다른 CNS 복제에서 분리되는 경우 세포 상호 작용을 진실하게 매핑할 수 없으며 분리 프로세스 중 잠재적인 기술적 편차로 인해 추가 다운스트림 분석이 편향될 수 있습니다. 더하여, 각 세포 유형에서 분자와 생화확적인 발견은 동일한 EAE 문맥에서 파생되지 않기 때문에 서로 비교되지 않을 것입니다. 상용 시스템/키트를 사용하는 기존 MACS 프로토콜은 위에서 언급한 세포 유형의 동시 분리를 가능하게 하도록 조정되었습니다.
미세아교세포의 분리는 anti-CD11b micro-beads를 이용하여 수행하였고, oligodendrocyte는 anti-O4 micro-beads를 통해 분리하였으며(표 1), astrocyte를 분리하기 위하여 anti-ACSA-2 micro-beads를 사용하였다(Table 2). 대조적으로, 뉴런의 분리는 negative selection을 나타내며 모든 non-neuronal cell의 biotinylation 및 magnetic labeling에 의해 달성되었습니다(표 2). 혈액 세포를 제외한 모든 비신경 세포(예: 희소돌기아교세포, 미세아교세포, 성상교세포, 내피세포 및 섬유아세포)는 이러한 비신경 세포에서 발현되는 표면 항원에 대해 특이적으로 지시되는 비오틴-접합 항체를 사용하여 자기적으로 표지할 수 있습니다(표 2). 이러한 자기적으로 표지된 비신경 세포의 고갈에 의해, 매우 순수하고 생존 가능한 신경 세포 집단은 30,42,43을 생성할 수 있습니다.
생성된 단일 세포 현탁액의 순도 분석을 위한 두 개의 새로운 유세포 분석 패널이 설계되었습니다. 여기서는 세포 유형별 표면 및 핵 마커와 살아있는/죽은 세포 구별을 결합했습니다.
그 결과 생쥐 및 세포 유형(그림 3A)당 세포 수율을 분석한 결과 평균 8이 나왔습니다. 4 x 105 ± 3 x 104 미세아교세포, 3.23 x 106 ± 1 x 105 희소돌기아교세포, 8.6 x 105 ± 2 x 104 성상교세포, 4.5 x 105 ± 1 x 104 뉴런.
neuroinflammation의 질병 모형을 조사하는 목표의 문맥에서는, 의정서는 EAE의 쥐 모형에 또한 적용되었습니다. 마우스는 EAE 유도 후 16 일째에 질병 최대치를 나타내는 안락사되었습니다. 이 EAE 설정에서, 대략 2.9 x 106 ± 6.7 x 105 희소돌기아교세포, 5.2 x 105 ± 9 x 104 성상교세포 및 4.4 x 105 ± 4 x 104 뉴런을 분리하였다. 미세아교세포 수율은 MACS 단계 후 추가 세포 분류로 인해 EAE 마우스당 약 1.7 x 105 ± 4 x 104 미세아교세포로 감소했습니다(그림 3A).
분리 후, 유세포 분석을 통해 다양한 세포 집단의 표현형 특성 분석을 통해 모든 주요 CNS 상주 세포 유형에 대해 약 90%의 순도를 가진 생존 가능한 단일 세포 현탁액을 달성할 수 있음을 입증했습니다(그림 3B). 미세아교세포는 문헌44,45,46,47에 정의된 바와 같이CD45 intCD11b 높이인 것으로 게이트되었다.
EAE에서는, microglia는 neuroinflammation 27,28,48 도중 중추신경계로 이동하는 단핵구, 호중구, 자연살해세포, 과립구 및 대식세포와 같은 다른 CD11b+ 면역 세포에서 그(것)들을 분화하기 위하여 모든 CD11b+ 세포에서 분류되어야 했습니다. 따라서, 미세아교세포는 CD11b+ 세포 현탁액으로부터 CD45intCD11high cell로 분류되었습니다. 전체 미세아교세포 분류 전략은 그림 4에 나와 있습니다. 순진한 마우스에서 미세아교세포 집단은 모든 살아있는 단일 세포의 91.16%(전체 CD11b+ 집단의 96%)였습니다(그림 4A). EAE 마우스에서 미세아교세포 집단은 모든 살아있는 단일 세포의 46.85%(전체 CD11b+ 집단의 55%)였습니다(그림 4B). MACS 및 FACS 절차 모두 단일 세포에 기계적 응력을 가하지만, 분류된 정제된 미세아교세포의 75.41% ± 8.63%가 생존 가능했습니다(그림 3B).
초기 중추신경계 세포 현탁액에서 직접 분리된 성상교세포와 뉴런은 희소돌기아교세포와 관련된 오염을 보였으며, 이는 희소돌기아교세포의 음성 흐름으로부터 뉴런과 성상교세포를 동시에 분리하면 이러한 오염을 방지할 수 있다는 가정으로 이어졌습니다. 유세포 분석 결과 희소돌기아교세포의 음성 유동에서 분리된 성상교세포는 순도 89.23% ± 2.78%를 가지며 80.56% ± 1.41%의 생존율을 보였습니다. 이러한 결과와 유사하게, O4 세포 분획에서 분리된 뉴런의 순도는 81.25% ± 3.31%였고, 생존율은 83.90% ± 2.61%였습니다(그림 3B). 이러한 발견은 또한 희소돌기아교세포의 분리에 뒤이어 이 두 세포 유형의 동시 분리가 생존 가능한 기능성 세포의 양에 영향을 미치지 않는다는 것을 확인합니다.
분리된 단세포 현탁액의 생존력 및 순도에 관한 결과는 순진한 마우스에서 받은 결과와 비교하여 EAE 마우스에서 매우 유사했으며, 이는 이 프로토콜이 EAE의 맥락뿐만 아니라 건강한 마우스에 적합하다는 것을 확인했습니다(그림 3B).
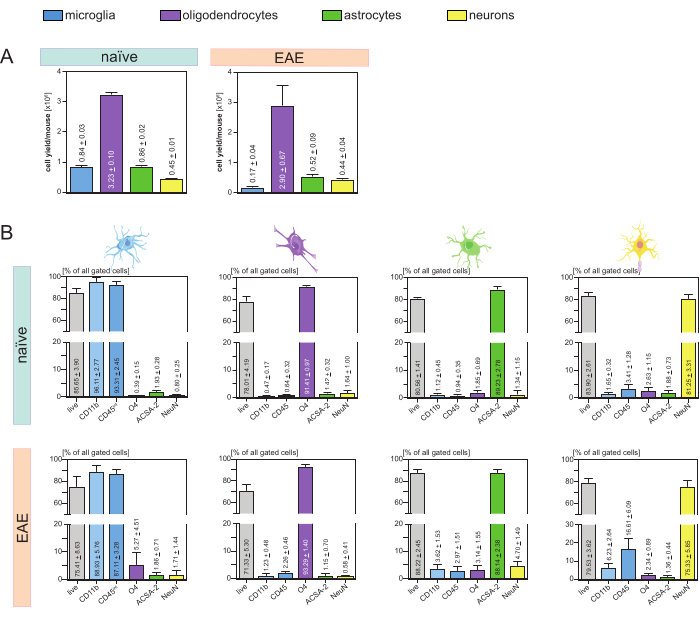
그림 3: 분리된 CNS 상주 세포의 세포 수율 및 유세포 분석 기반 검증. (A) naive 및 EAE 마우스에서 CNS 상주 세포를 분리한 후 마우스 및 세포 유형당 세포 수율. 막대 그래프는 제시된 프로토콜의 구현 후 마우스 및 세포 유형당 세포 수율의 양을 시각화합니다. 순진한 마우스에서 결과를 위해 5개의 생물학적 복제물을 처리하고, EAE 마우스에서 4개의 생물학적 복제물을 분석했습니다. SEM± 각각의 수단이 표시됩니다. (B) 정제된 세포 분획의 해당 순도 및 생존도 분석. 막대 그래프는 세포 유형별 마커의 발현을 기반으로 생성된 단일 세포 현탁액의 생존력과 순도를 나타냅니다. NeuN은 뉴런에 대한 세포 유형 특이적 핵 마커로 사용되었습니다. 5개의 생물학적 복제물을 획득하여 건강한 마우스와 EAE 마우스 모두에 대해 각 세포 유형에 대해 비교했습니다. SEM± 각각의 수단이 표시됩니다. 약어: 항-ACSA-2 = 성상교세포 세포 표면 항원-2; CD11b = 사이클린 의존성 키나아제 11B; CD45 = 수용체형 티로신-단백질 인산가수분해효소 C; CNS = 중추 신경계; EAE = 실험적 자가면역 뇌척수염; MACS = 자기 활성화 세포 분류; NeuN = RNA 결합 단백질 fox-1 상동체 3; O4 = 희소돌기아교세포 마커 O4; SEM = 평균의 표준 오차. 이 수치는49에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
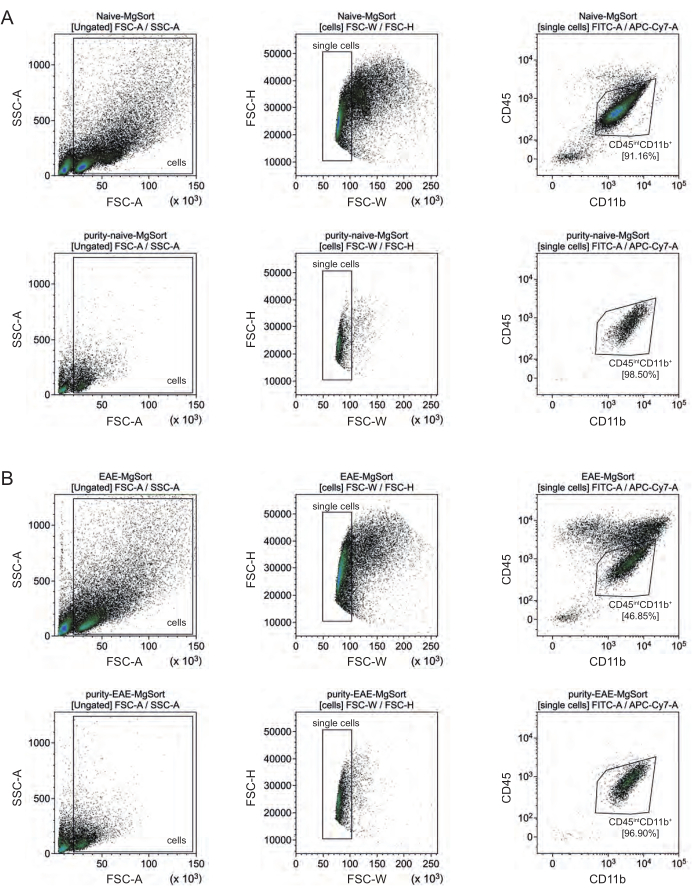
그림 4: CD11b+ 세포 분리 후 미세아교세포의 세포 분류를 위한 게이팅 전략. (A) 순진한 및 (B) EAE 마우스의 게이팅 전략. 각 패널의 위쪽 행에는 정렬 전의 점도표가 표시되고 정렬 후의 아래쪽 행에는 점도표가 표시됩니다. 생세포(SSC-A/FSC-A) 및 단일세포(FCS-H/FSC-W)를 선택한 후, CD45intCD11b+ 세포의 집단을 미세아교세포(microglia) 집단으로 분류하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
지금까지, 질량 분석법과 RNA 시퀀싱을 결합하여 생체 외 CNS 상주 세포를 매핑하는 방법은 건강과 질병에서 매우 정확한 세포 프로파일링을 제공하지만, 이 분야에 대한 야심찬 기술 지식과 전문 지식을 필요로 한다50,51. 또한 기능 분석을 허용하지 않으며 비용이 많이 듭니다. 저것외에, microfluidic 두뇌에 칩 체계는 질병 기계장치를 급속하고 적당한 검열 및 세포 성장과 이동의 제한과 가진 새로운 치료 접근의 시험을 제공한다 52,53,54,55. CNS 오가노이드는 또한 향후 세포 모델링, 세포 간 연결 및 질병 과정 중 상호 작용 조사를 위한 동등한 대안이 될 수 있습니다 56,57,58,59. 그러나 형광 및 자기 활성화 세포 분류는 현재 순수하고 생존 가능한 단일 세포 현탁액을 생체 외 35,60,61을 생성하는 가장 효과적인 방법입니다. CNS-상주 세포 유형의 분리를 위해 확립된 다른 제조 프로토콜이 자기 분리 및 이전 세포 해리의 개별 단계와 관련하여 유사하더라도, 각 세포 유형에 대해 개별적으로 수행되도록 의도되었습니다. 대조적으로, 현재 프로토콜은 각 CNS 상주 셀 유형에 대해 서로 다른 분리 방법을 논리적 컨텍스트에 통합하여 한 번에 동시에 그리고 하나의 단일 CNS 셀 현탁액에서 수행할 수 있습니다(표 1, 표 2). 따라서 단일 CNS 세포 현탁액에서 다중 오믹스 분석을 가능하게 하고 궁극적으로 복잡한 신경 네트워크의 탐색을 가능하게 합니다. 이 프로토콜을 수행하기 위해 여러 동물의 여러 조직을 풀링해야 하는 것은 아니지만, 이 풀링은 추가 다운스트림 분석을 위해 적절한 수의 분리된 세포를 보장합니다. 단일 세포 유형의 분리를 위해 다른 마우스를 사용하는 것은 잠재적인 세포 상호 작용을 분석할 가능성을 배제합니다. 그 외에도 이전 CNS 분리를 따르는 다양한 CNS 세포 유형에 대한 개별 분리 방법을 결합하면 이후의 모든 자기 분리 단계에 대해 하나의 해리된 CNS 세포 현탁액을 사용하여 재료 비용을 절감할 수 있습니다. 또한 다른 마우스의 사용으로 인한 잠재적인 기술적 편향이 최소화됩니다.
프로토콜의 한 가지 한계는 암컷 C57BL/6J 마우스를 거의 독점적으로 사용할 수 있다는 것입니다. EAE 면역 프로토콜은 암컷 마우스를 위해 설계 및 설정되었으므로 이 세포 분리 프로토콜은 암컷 C57BL/6J 마우스에서도 구현되었습니다. 그럼에도 불구하고, 순진한 수컷 마우스는 또한 이 프로토콜의 개발 중에 사용되었으며, 결과 세포 수 또는 순도에 대한 어떠한 영향도 인식하지 못했습니다. 또 다른 제한은 뉴런의 자성 세포 분리에 영향을 미치는데, 이는 양성 선택의 관점에서 뉴런의 분리를 위한 특정 마이크로 비드가 존재하지 않기 때문입니다. 순수한 단세포 현탁액은 모든 비신경 세포의 비오틴 라벨링 및 고갈을 통해 얻을 수 있다고 가정했습니다(표 2). 이 가정은 언급된 유세포 분석 순도 패널에 통합된 뉴런에 대한 특정 핵 마커로 NeuN을 사용하여 확인되었습니다. 또 다른 한계는 EAE 마우스에서 미세아교세포의 분리에 관한 것입니다. 여기서, MACS 프로토콜 이후의 추가적인 분류 단계 때문에 다른 셀 타입에 비해 결과적인 셀 수율이 감소한다. 더욱이, 분류가 다른 세포 집단에 비해 미세아교세포의 기계적 스트레스를 증가시킨다고 주장할 수 있습니다. 개별 분류 전략에 따라 세포 수율의 양이 달라질 수 있습니다. 격리된 셀 수가 예상보다 적거나 원하는 경우 게이팅 설정을 조정하거나 살아있는/죽은 판별을 개선하는 것이 좋습니다.
프로토콜의 중요한 단계는 잔해물 제거입니다. 그래디언트는 원하는 세 개의 개별 위상을 만들기 위해 매우 천천히 부드럽게 계층화되어야 합니다(그림 2A). 두 개의 최상위 단계에서 미엘린 및 기타 이물질 잔류물이 완전히 제거되는 경우에만 (그림 2E) 순수한 단일 세포 현탁액을 생성할 수 있으며 추가 오염을 줄일 수 있습니다. 생성된 세포 현탁액에 순도가 부족한 경우, 이는 모든 마이크로 비드의 올바른 사용을 보장하기 위해 가장 먼저 개선되어야 하는 프로토콜 섹션일 수 있습니다.
이러한 유형의 실험에서는 높은 수준의 순도와 생존율을 얻는 것이 어려울 수 있습니다. 문제 해결을 위한 몇 가지 권장 사항은 다음과 같습니다.
-멸균 조건에서 작업하는 것은 다양한 마이크로 비드의 오염을 방지하고 특히 후속 배양을 위해 반복 사용을 가능하게 하는 데 필수입니다.
- 혼동을 방지하기 위해 각 튜브에 라벨을 부착하는 것이 좋습니다.
- 냉각되지 않은 시약/완충액의 사용을 피하십시오. 높은 생존력을 보장하기 위해 전체 실험 동안 모든 세포 현탁액을 얼음 위에 보관하십시오.
- 서로 다른 작업 단계 사이의 시간을 가능한 한 짧게 유지하십시오. 프로토콜에는 실험 일시 중지를 권장하는 특정 부분이 없습니다.
-지정된 잠복기를 준수하는 것이 매우 중요합니다.
결론적으로, 하나의 CNS 복제에서 모든 주요 CNS 상주 세포 유형을 동시에 분리하기 위한 이 현재 프로토콜은 하나의 CNS 세포 현탁액에서 복잡한 신경 네트워크 및 신경 염증 경로를 생체 외 에서 분석할 수 있는 가능성을 제공합니다. 따라서, 중추신경계 상주 세포는 질병 과정의 여러 단계 동안, 예를 들어, 신경 염증, 신경 퇴행 및/또는 EAE의 관해 동안에 조사될 수 있습니다. 또한 세포 간 상호 작용 및 생화학적 경로를 개별 수준에서 연구할 수 있으며 실험 그룹 내의 변동성을 줄일 수 있습니다. 또한 추가 기능 분석 및 검증을 위해 단일 배양에서 분리된 CNS 세포의 분획을 배양할 수 있는 기회도 있습니다. 전체적으로 이 프로토콜은 전임상 및 임상 연구 접근 방식에 잠재적으로 영향을 미칠 수 있는 상당한 발전을 제공합니다.
공개
모든 저자는 이해 상충이 없음을 선언합니다.
감사의 말
피규어는 Adobe Illustrator(버전 2023) 및 Servier Medical Art (https://smart.servier.com)를 사용하여 생성되었습니다. Antonia Henes는 Jürgen Manchot Stiftung의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
참고문헌
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유