Ex 생체 내 흑색종 관련 연수막 질환을 연구하기 위한 흑색종 환자의 대뇌 척수액 내 순환 종양 세포 배양
요약
이 논문에서는 M-LMD를 연구하기 위한 전임상 모델을 개발하기 위해 흑색종 관련 연수막 질환(M-LMD) 환자로부터 수집한 뇌척수액순환종양세포(CSF-CTC)의 증식을 위한 프로토콜에 대해 설명합니다.
초록
흑색종 관련 연수막 질환(M-LMD)은 순환 종양 세포(CTC)가 뇌척수액(CSF)으로 들어가 뇌와 척수를 보호하는 막층인 수막에 서식할 때 발생합니다. 일단 확진 판정을 받으면 M-LMD 환자의 예후는 암울하며 전체 생존 기간은 몇 주에서 몇 달까지 다양합니다. 이는 주로 질병에 대한 이해가 부족하고 결과적으로 효과적인 치료 옵션을 사용할 수 없기 때문입니다. M-LMD의 근본적인 생물학을 정의하면 M-LMD 치료에 사용 가능한 치료법을 적용하거나 보편적으로 치명적인 이 질병에 대한 새로운 억제제를 설계하는 능력이 크게 향상될 것입니다. 그러나 가장 큰 장벽은 분자 특성화, 기능 분석 및 생체 내 효능 연구와 같은 전임상 실험을 수행하기 위해 환자 유래 뇌척수액(CSF-CTC)에서 충분한 양의 CTC를 얻는 데 있습니다. CSF-CTC를 체외(ex vivo )에서 배양하는 것도 어려운 것으로 입증되었습니다. 이를 해결하기 위해 환자 유래 M-LMD CSF-CTC 체외 및 체내 배양을 위한 새로운 프로토콜이 개발되었습니다. 인간 수막 세포(HMC)에 의해 생성된 조건화된 배지의 통합은 절차에 중요한 것으로 밝혀졌습니다. 사이토카인 어레이 분석은 인슐린 유사 성장 인자 결합 단백질(IGFBP) 및 혈관 내피 성장 인자-A(VEGF-A)와 같은 HMC에 의해 생성되는 인자가 CSF-CTC 생체 외 생존을 지원하는 데 중요하다는 것을 보여줍니다. 여기에서 인슐린 유사 성장 인자(IGF) 및 미토겐 활성화 단백질 키나아제(MAPK) 신호 경로를 표적으로 하는 억제제의 효능을 결정하는 데 있어 분리된 환자 유래 CSF-CTC 라인의 유용성이 입증되었습니다. 또한, 승인된 또는 새로운 치료법의 전임상 시험에 사용할 수 있는 M-LMD의 쥐 모델을 확립하기 위해 이러한 세포를 생체 내에서 접종할 수 있는 능력이 입증되었습니다. 이러한 도구는 뇌수막에서 CSF-CTC 확립을 주도하는 근본적인 생물학을 밝히고 M-LMD와 관련된 이환율 및 사망률을 줄이기 위한 새로운 치료법을 식별하는 데 도움이 될 수 있습니다.
서문
연수막 질환(LMD)은 순환 종양 세포(CTC)가 뇌척수액(CSF)으로 퍼져 뇌와 척수를 둘러싸고 있는 막인 수막에 자리 잡을 때 발생합니다 1,2. LMD는 여러 암에서 발생할 수 있지만 특히 흑색종에서 많이 발생합니다. 흑색종이 진행된 단계에서는 약 5%의 환자에서 흑색종 관련 M-LMD 2,3이 발생합니다. 다른 전이 부위에 비해 상대적으로 낮지만, M-LMD의 결과는 치명적이며, 전체 생존율은 몇 주에서 몇 개월에 이르며, 환자 이환율에 크게 기여한다 1,3,4. 이는 주로 효과적인 치료 옵션의 부족과 연수막이 흑색종 세포에 의해 어떻게 집락화되는지에 대한 지식의 주요 격차에 기인합니다2. 따라서 M-LMD의 생물학을 이해하면 임상 결과를 개선하기 위한 새로운 치료법을 설계하는 데 도움이 될 것입니다.
최근 보고서에 따르면 CTC가 어떻게 독특한 CSF 미세환경을 식민지화하는지 알 수 있습니다. 예를 들어, Complement C3는 뇌의 각 심실에 있는 복잡한 혈관 네트워크인 맥락총(choroid plexus)을 통해 종양 세포가 뇌척수액으로 침입하는 것을 촉진한다5. 또한, 뇌척수액의 부족한 미량 영양소에 대응하여 CTC는 철분 제거 단백질인 리포칼린-2와 그 수용체 SLC22A17 상향 조절하여 생존율을 높일 수 있습니다6. 우리 연구팀은 뇌척수액에 대한 오믹 기반 분석을 사용하여 뇌척수액이 인슐린 유사 성장 인자(IGF) 신호 전달을 조절하는 단백질과 선천성 면역이 풍부하다는 것을 발견했다3. 이러한 데이터는 M-LMD를 연구하기 위한 액체 생검의 CSF-CTC의 가치를 강조합니다.
뇌척수액-CTC는 때때로 요추 천자, 옴마야 저장소 또는 신속한 부검을 통해 환자 뇌척수액을 샘플링하여 식별할 수 있지만, 이러한 희귀하고 취약한 세포를 충분한 수로 확보하는 것이 주요 제한 사항입니다 1,7. 예를 들어, CTC 계수 기법을 사용하면 환자 CSF 검체7당 수백 개에서 수천 개의 종양 세포만 식별할 수 있어 in vitro 또는 in vivo에서 분자 및 기능 분석을 수행하기 어렵습니다. 말초 혈액(즉, 유방암 CTC)에서 체외(ex-vivo)로 CTC를 잠시 성장시키는 데 성공했다는 보고가 있었지만8,9,10 이러한 세포는 일반적으로 단기적으로만 성장하며 뇌척수액에서 흑색종 CTC를 성장시킬 수 있는 사례는 보고된 적이 없습니다. 따라서 흑색종 CSF-CTC 또는 일반적으로 CTC를 전파하는 방법을 찾는 것은 M-LMD 7,11의 생물학을 연구하는 데 매우 유익할 것입니다.
처음으로 M-LMD 환자의 CSF-CTC를 체외(ex vivo)로 증식시키는 새로운 기법이 기술되었습니다. 이 보고서에서는 M-LMD 환자로부터 CSF-CTC의 배양 및 확장을 허용하는 자세한 프로토콜이 개발되었습니다. 수막은 주변 환경 12,13,14,15,16을 둘러싼 성장을 지원하는 FGF, IGF, VEGF-A 및 IGFBP와 같은 다양한 성장 인자를 분비하기 때문에 CSF-CTC는 이러한 구성 요소가 생체 외 조건에서 성장해야 할 수 있음을 합리화했습니다. 따라서 이 프로토콜은 in vitro에서 인간 수막 세포(HMCs-)를 배양하여 생성된 조건화된 배지를 사용합니다. in vivo 접종의 경우, 환자 유래 세포를 면역결핍 마우스에 접종하여 환자 유래 CSF-CTC(PD-CSF-CTC) 라인을 생성합니다. 환자 유래 M-LMD 세포의 가용성은 M-LMD를 연구하고 이 치명적인 질병에 대한 새로운 치료 전략을 제안하기 위한 세포, 분자 및 기능 분석을 지원할 것입니다.
프로토콜
비식별화된 환자 CSF 검체 수집은 University of South Florida의 IRB(Institutional Review Board)의 승인을 받았습니다(MCC 50103, 50172 및 19332). M-LMD 환자는 뇌척수액 양성 세포검사, 뇌 및/또는 척추의 특징적인 자기공명영상(MRI) 또는 임상 소견과 암시적 MRI 소견의 조합을 포함한 여러 가지 방법으로 진단할 수 있습니다. 이러한 M-LMD 환자의 뇌척수액은 표준 임상 치료의 일환으로 정기적으로 수집되었습니다. 임상적 징후가 없는 한 어떠한 시술도 수행되지 않습니다. 샘플 수집을 위해 환자로부터 정보에 입각한 동의를 얻어 연구 및 출판에 사용했습니다. in vivo murine-LMD 모델의 생성은 University of South Florida Institutional Animal Care and Use Committee(IACUC# IS00010398)의 승인을 받았습니다. 이 프로토콜의 전체 체계는 그림 1에 요약되어 있습니다. 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. HMC 컨디셔닝 매체 준비
- T175 플라스크에 2 μg/cm에서 poly-l-lysine으로 사전 코팅2.
- 플라스크를 37°C 인큐베이터에 1시간 동안 넣습니다.
- 멸균 혈청학적 피펫을 사용하여 poly-l-lysine 용액을 흡입합니다. 플라스크를 헹굴 필요가 없으며 HMC 배양에 사용할 수 있습니다.
- 플라스크당 5% 소 태아 혈청, 1% 수막 세포 성장 보충제 및 100 I.U./mL 페니실린-스트렙토마이신 항생제 용액이 포함된 MenCM(Complete Meningeal Culture Medium) 30mL에 약 1.0 x 106 HMC를 배양합니다. 세포 배양 인큐베이터에서 세포를 37 °C 및 5 % CO2의 표준 조직 배양 조건에서 배양합니다.
- 3일마다 미디어를 교체하십시오.
- 세포가 약 75%-80% 밀도에 도달하면 HMC 배양 배지를 50mL 코니컬 튜브에 수집하여 저장합니다.
- 더 많은 HMC 배양 배지가 필요한 경우 HMC를 새로운 T175 플라스크와 새로운 완전한 MenCM으로 분할합니다.
- HMC 배양 매체에 완전한 MenCM의 1:1 비율을 추가합니다.
- 20ng/mL 섬유아세포 성장 인자(FGF) 및 20ng/mL 표피 성장 인자(EGF)를 추가하면 CSF-CTC를 위한 HMC 컨디셔닝 배지가 됩니다.
참고: CTC가 배양할 준비가 되면 새로운 FGF 및 EGF를 추가하는 것이 좋습니다. - HMC 컨디셔닝된 배지를 4°C에서 50mL 부분 표본에 담아 보관합니다.
참고: 부분 표본의 HMC 컨디셔닝 매체는 4°C에서 보관하는 것이 좋지만 4주를 넘지 않는 것이 좋습니다.
2. CSF 채취 및 시료 처리
- 원심분리기를 4°C로 설정하여 사전 냉각합니다.
- 환자로부터 채취한 후 CSF 검체를 15mL 원뿔형 튜브에 넣고 즉시 얼음 위에 올려 시원하게 유지합니다.
참고: 당사의 IRB 승인 프로토콜은 동의한 환자로부터 7.5mL CSF를 채취할 수 있습니다. - 257 x g 에서 뇌척수액을 4°C에서 5분 동안 원심분리합니다.
- 바닥의 세포 펠릿을 방해하지 않고 CSF 상층액을 제거, 저장 및 분취하십시오. CSF 상층액 부분 표본은 추가 분석을 위해 필요한 경우 -80°C에서 냉동 보관할 수 있습니다.
알림: 펠릿은 육안으로 보이지 않을 수 있습니다. 따라서 튜브 바닥에 ~ 40-50 μL를 남겨 두는 것이 좋습니다. - 동일한 튜브에 1mL의 멸균 인산염 완충 식염수(PBS)를 첨가하여 세포를 재현탁 및 헹구고 4°C에서 5분 동안 257 x g 에서 스핀을 반복합니다.
참고: (선택 사항) 샘플에 혈액 오염이 포함된 경우 적혈구(RBC) 용해를 수행합니다. 그러나 CTC를 포함한 일부 세포는 과정 중에 손실될 수 있음을 명심하십시오. CTC는 RBC 용해 절차 없이 증식할 수 있습니다. - 세포 펠릿을 방해하지 않고 PBS를 제거 및 버리고 바닥에 ~50μL를 남겨 둡니다.
- 세포 생존율을 결정하기 위해 세포 계수를 수행합니다. 여기에서 CSF-CTC를 성장시키는 두 가지 옵션이 있습니다: in vitro culture(3단계) 또는 in vivo 환자 유래 이종이식 확장 시도(4단계).
참고: CSF-CTC를 나중에 배양해야 하는 경우 증식 준비가 될 때까지 세포 배양 냉동 배지에서 세포를 냉동 보존하십시오. 세포 배양 동결 배지는 90% FBS + 10% DMSO를 사용하여 만들 수 있습니다. 과도한 뇌척수액이 가능한 경우(즉, 환자로부터 두 개 이상의 뇌척수액을 채취하거나 부검 시 뇌척수액을 채취하는 경우), CTC의 양과 생존 가능성에 대한 통찰력을 제공할 수 있는 흑색종 마커(즉, 항-MLANA)에 대한 면역형광(IF) 염색 또는 CTC 열거 분석17을 위해 검체를 제출하여 CTC를 평가할 수 있습니다. 이러한 실험을 수행한 후에는 세포를 회수할 수 없습니다. 따라서 환자의 백업 뇌척수액 샘플이 없는 경우 권장되지 않습니다.
3. CSF-CTC의 시험관내 배양 및 확대
- HMC 컨디셔닝된 매체에서 CSF-CTC를 다시 중단하십시오. CSF-CTC가 동결 보존된 경우 세포를 해동하고 회전시킨 다음 PBS로 부드럽게 세척합니다.
- 웰당 150 μL 부피의 96웰 플레이트에서 3개의 웰로 모든 세포를 분할합니다. 생존 가능한 세포만 하룻밤 동안 표면에 가볍게 부착됩니다.
참고: CSF-CTC의 수는 단일 환자 검체마다 크게 다를 수 있습니다(표 1). CTC 수치가 낮은 환자의 경우 96웰 플레이트를 배양의 시작점으로 사용하며, CTC 손실에 대한 두려움 때문에 전체 펠릿을 카운팅 없이 플레이트합니다. 그러나 뇌척수액의 양이 더 많으면(즉, 부검에서 얻은 경우) 세포를 셀 수 있습니다. 모든 종양 세포가 체외에서 성장할 수 있는 것은 아닙니다. 일부는 정적이 되기 전에 여러 구절에 걸쳐 천천히 확장됩니다. 현재 흑색종 CSF-CTC의 체외 성장 성공 확률은 약 60%입니다7. - 3일마다 새로운 HMC 컨디셔닝 배지를 추가하여 보충하거나 웰 바닥을 방해하지 않고 약간의 액체를 남기고 피펫 팁을 웰 측면에 놓아 배지를 부드럽게 제거한 다음 새로운 HMC 컨디셔닝 배지로 교체합니다.
- ex vivo CSF-CTC가 팽창하여 90% 합류하게 되면 트립신화하여 전체 웰을 24웰 플레이트의 새 웰로 옮깁니다. 24-웰의 웰이 합류하면 12-웰 플레이트로 옮긴 다음 6-웰 플레이트로 옮깁니다.
참고: 트립신화 후에는 백업으로 도금하기 전에 세포 배양 동결 매체(10% DMSO + 90% FBS)에서 CTC의 작은 하위 집합을 동결 보존하는 것이 좋습니다. - CTC를 계속 육성합니다. 일부 세포는 단기간 동안 증식할 수 있으며 결국 정적인 상태가 될 수 있습니다. 그러나 하나 이상의 클론이 기하급수적으로 변형되고 확장될 수 있습니다(그림 2A). in vitro 환자 유래 CSF-CTC(PD-CSF-CTC) 배양이 될 이러한 클론을 선택합니다.
참고: 이러한 클론이 과밀하거나 군집하게 되면 세포를 트립신화하고 새로운 조직 배양 플레이트/플라스크에 다시 플레이트합니다.
4. 세포주 유래 이종이식(CDX) 또는 환자 유래 이종이식(PDX) 모델을 생성하기 위한 CSF-CTC의 생체 내 접종
참고: PDX 모델은 암 환자로부터 직접 암세포를 생착( 체외 배양 없이)하는 반면, CDX 모델은 암 세포주 또는 이 경우 증식되어 불멸화된 CTC를 사용합니다18.
- CSF-CTC 접종에는 6-8주 암컷 면역결핍 NOD SCID 감마(NSG) 마우스를 사용합니다. NSG는 심각한 면역 결핍이 있고 인간 종양 세포 생착에 매우 잘 견디기 때문에 사용된다19. 면역 결핍으로 인해 이러한 마우스는 엄격하게 통제된 위생 환경에서 보관해야 하며 다른 마우스 균주와 격리되어 보관해야 합니다. murine-LMD를 렌더링하는 방법은 다른 문헌20에서 상세히 설명되었다.
참고: 생체 외 세포(배양 없이 2단계에서만 처리된 환자의 CSF-CTC)는 PDX 모델을 생성하는 데 사용됩니다. LMD 진행을 결정하기 위해서는 동물의 신체 관찰과 뇌의 MRI가 필요합니다. 한편, in vitro 를 이용한 CDX 모델의 경우, PD-CSF-CTC를 루시페라아제 리포터로 라벨링할 수 있으며, 생물발광 이미징(BLI)으로 LMD의 상태를 평가할 수 있습니다. 이 보고서에 사용된 세포 라벨링 시스템은 푸리마진을 기질로 사용하는 NanoLuc(NL) 리포터로, 종양 성장에 비례하여 민감도를 증가시키는 것으로 나타났습니다21. NL 발현에 의한 CTC 세포 성장(in vitro 또는 in vivo)의 간섭은 관찰되지 않았습니다. - 신체 관찰: 체중 감소, 머리 기울기, 허리 굽기 등의 방법을 사용하여 LMD 진행의 징후를 확인합니다. MRI: 심실 비대와 수두증의 징후(그림 2B). BLI: CNS 영역의 양성 생물 발광 신호(그림 2C).
5. 후속 클론 확장을 위해 LMD를 사용한 마우스에서 CSF 수집
- NSG 마우스에 4% 이소플루란이 함유된 LMD를 마취하고(기관에서 승인한 프로토콜에 따름) 오른쪽 반사의 징후가 나타나지 않을 때까지 마취합니다.
- 머리의 전체 복부 표면의 털을 면도하여 마우스를 준비하고 멸균 기술을 사용하여 피부를 준비합니다.
- 정위 장치의 수정된 L자형 노즈 콘을 사용하여 코를 배치하여 콧구멍이 막히지 않도록 합니다. 테이프로 양쪽 귓바퀴의 복부 표면을 가로질러 부드럽게 앞으로 당겨 노즈콘에 부착한 다음 목을 고정한 후 약 90° 각도로 구부려 피부를 고정합니다. 마취를 유지하기 위해 1.5%-3% 이소플루란을 투여합니다.
- 목을 완전히 펴고 귓바퀴 바로 사이에서 시작하여 약간의 압력으로 수술용 가위 끝을 후두골을 가로질러 아래쪽으로 안내합니다.
알림: 이 정중선 위치에서는 가위 끝이 수조 마그나 위의 오목한 부분에 들어갈 때 미묘한 함몰을 식별할 수 있습니다. - 촉진된 오목한 부분 바로 위에 5-7mm 크기의 작은 정중선 절개를 만듭니다.
- 끝이 1-2mm인 뭉툭한 집게를 사용하여 수조 마그나에 부드럽게 압력을 가합니다. 닫힌 위치에 팁을 삽입하고 경막에 아래쪽 압력을 가하면서 엽니다.
- 경막막이 명확하게 식별되고 관련 혈관이 노출된 부위 내에서 보일 때까지 6단계에서 설명한 대로 둔기 박리 과정을 반복합니다.
- 주위 근육을 수축시키기 위해 겸자를 열린 상태에서 경막 아래에 1mL 주사기에 부착된 27-29G 바늘을 삽입하여 베벨을 시각화합니다. 바늘이 베벨 바로 너머를 관통하는지 확인하십시오. 주사기 플런저를 점차적으로 집어넣습니다.
- 마우스 안락사 전에 가능한 한 많은 CSF(보통 15-30 μL 사이)를 수집하십시오.
참고: 안락사는 기관에서 승인한 프로토콜에 따라 피험자를 압축CO2 가스의 농도 증가에 노출시킴으로써 달성됩니다. 예를 들어, 분당 챔버 부피의 30%에서 70%까지의 변위율이 불편이나 고통을 예방하거나 줄이기 위해 사용됩니다. 그 다음에는 실내 공기에서 10분 이상 장기간 관찰하여 심혈관 및 호흡 운동의 정지를 보장합니다. - 주사기의 CSF를 마이크로 원심분리기 튜브에 배치하고 얼음 위에 놓습니다.
- 4°C에서 5분 동안 257 x g 으로 시료를 회전시키고 세포 펠릿을 방해하지 않고 액체를 조심스럽게 제거합니다(추가 분석을 위해 필요한 경우 마우스 CSF 시료를 -80°C에서 동결).
- 500μL의 멸균 PBS를 추가하고 세포 펠릿을 세척합니다. 실온에서 257분 동안 5 x g 로 스핀을 반복합니다.
- 96웰 플레이트에서 HMC 컨디셔닝된 매체의 세포를 재현탁시킵니다.
참고: in vivo 생착되어 LMD로 성공적으로 성장한 CSF-CTC는 일반 세포 배양처럼 성장할 수 있어야 합니다. 3일마다 미디어를 교체하여 계속 확장하십시오. 세포가 합류할 때 세포를 트립신화하고 더 큰 세포 배양 장치로 전달합니다. 이 세포는 in vivo PD-CSF-CTC 배양이 됩니다. 현재 보고서에서 CDX 모델은 100%의 성공률을 보였으며 아직 PDX M-LMD를 생성하지 않았습니다.
대표적 결과
성공적인 CSF-CTC의 체외 성장을 위한 요구 사항을 이해하는 것은 지속적인 노력입니다. 이를 위해서는 뇌척수액 미세환경을 모방하는 필수 요소를 제공하는 것이 매우 중요하다고 생각된다22. 인간 수막세포(HMC)는 FGF-2, EGF, IGFBP2 및 IGFBP6를 포함한 다양한 성장 인자를 CSF로 분비하며 CTC 세포 12,13,14,23,24의 성장을 지원하는 것으로 알려져 있습니다. 따라서 CTC 생존에 필요한 잠재적으로 중요한 구성 요소를 식별하기 위해 HMC 조건화 배지에 대해 인간 사이토카인 어레이 분석을 수행했습니다. 실제로, HMC로 배양된 배지에서 몇 가지 성장 인자가 상향 조절되었습니다(그림 3A). 예를 들어, 과립구-대식세포 콜로니 자극 인자(GM-CSF), VEGF-A 및 IGFBP(IGFBP2, 3, 4 및 6)가 있습니다.
환자의 CSF 세포 구성 요소는 CTC, 면역 세포 및 섬유아세포와 같은 여러 세포 유형으로 구성될 수 있습니다. CTC가 아닌 사람들은 결국 초과 근무를 중단하게 될 것입니다. 일반적으로 성공적으로 증식하고 증식 상태를 유지하는 세포가 암(M-LMD) 세포입니다. 배양에서 성장하는 세포의 검증은 실제로 M-LMD 세포이며, 이는 이전에 나타난MLANA 발현의 IF 검출 및 전사체 분석을 통해 수행할 수 있습니다 7.
확립된 in vitro 및 in vivo PD-CSF-CTC 라인의 잠재적 사용 및 응용을 보여주기 위한 개념 증명으로 단일세포 RNA-염기서열분석(scRNA-seq) 분석이 사용되었으며, 그 결과 비배양 환자 CSF-CTC에서 농축되고 유지된 여러 유전자가 밝혀졌습니다7. 그 중 2개는 수용체 티로신 단백질 키나아제 ErbB3 및 IGF-1R을 포함하며, 이는 흑색종 진행 및 화학요법 내성에 영향을 미칩니다 25,26,27.
CSF-CTC 생존에 어떤 역할을 하는지 여부를 시험하기 위해, ErbB28 및 IGF-1R 7,29를 각각 표적으로 하는 FDA 승인 약물인 투카티닙 및 세리티닙으로 처리된 PD-CSF-CTC에 대해 결정 보라색 증식 분석을 수행했습니다. Anti-IGFBP2 항체는 PD-CSF-CTC 배양균의 성장을 방해할 수 있는 양성 대조군으로 포함되었습니다. 그 결과 IGFBP2 또는 IGF-1R의 부재가 PD-CSF-CTC의 증식을 줄이는 데 효과적임을 보여주었습니다(그림 3B). MAPK 신호전달이 IGF-1R의 다운스트림이라는 점을 감안할 때, 칼세인-AM 생세포 염색 및 MTT 세포 생존 분석은 세리티닙 또는 MAPK 억제제, 다브라페닙 및 트라메티닙 또는 세 가지 모두의 조합으로 처리하여 3개의 M-LMD PD-CSF-CTC 라인에서도 수행되었습니다. 이 데이터는 세리티닙에 의해 세 세포주 모두의 생존력이 유의하게 감소한 반면, 다브라페닙과 트라메티닙은 혼합된 효과를 나타냈다는 것을 보여주었습니다(그림 3C). 데브라페닙(debrafenib)과 트라메티닙(trametinib) 치료의 결과는 놀라웠다. 세 가지 PD-CSF-CTC 라인은 모두 BRAFV600E 돌연변이7을 보유한 M-LMD 환자에서 유래했습니다. 이는 CSF-CTC의 후천적 화학저항성 효과를 시사하는 것일 수 있으며, 이는 향후 연구가 필요한 사항이다.
다음으로, PD-CSF-CTC가 in vivo 활용 방법의 예로, 다양한 수의 PD-CSF-CTC를 척수강내 접종하여 murine-M-LMD 모델을 확립했습니다. 생쥐의 평균 생존 시간을 측정했습니다(그림 3D). M-LMD 진행을 시각화하기 위해 PD-CSF-CTC 라인에 NL 리포터 시스템(21)과 같은 생물 발광 마커를 태그하고 BLI로 캡처했습니다(그림 2C). LMD 전이의 위치는 또한 흑색종 세포의 마커로 단백질 melan-A(MLANA)30를 사용한 면역조직화학을 사용하여 입증되었습니다(그림 3E). 생체 내에서 M-LMD에 대한 치료 전략을 테스트하기 위한 개념 증명으로, murine-M-LMD 코호트는 세리티닙 또는 트라메티닙의 일일 경구 단독요법 또는 다브라페닙과 트라메티닙 또는 세리티닙과 트라메티닙의 병용요법을 투여받았습니다. 대조군(치료되지 않은) 코호트는 비교로 구강 식염수를 받았습니다. 그 결과, 세리티닙과 트라메티닙을 투여한 코호트에서 생존 기간이 유의하게 연장되고(그림 3F) 질병 검출이 지연된 것으로 나타났습니다(미치료 M-LMD 생존기간 중앙값: 28.5일 vs. 세리티닙 및 트라메티닙 투여 M-LMD 중앙값 생존기간: 38.5일; P 값 = 0.0052). 이러한 데이터는 새로운 치료제의 효능을 결정하기 위한 전임상 연구를 수행하기 위해 개발된 M-LMD PD-CSF-CTC 라인의 잠재적인 유용성을 강조합니다.
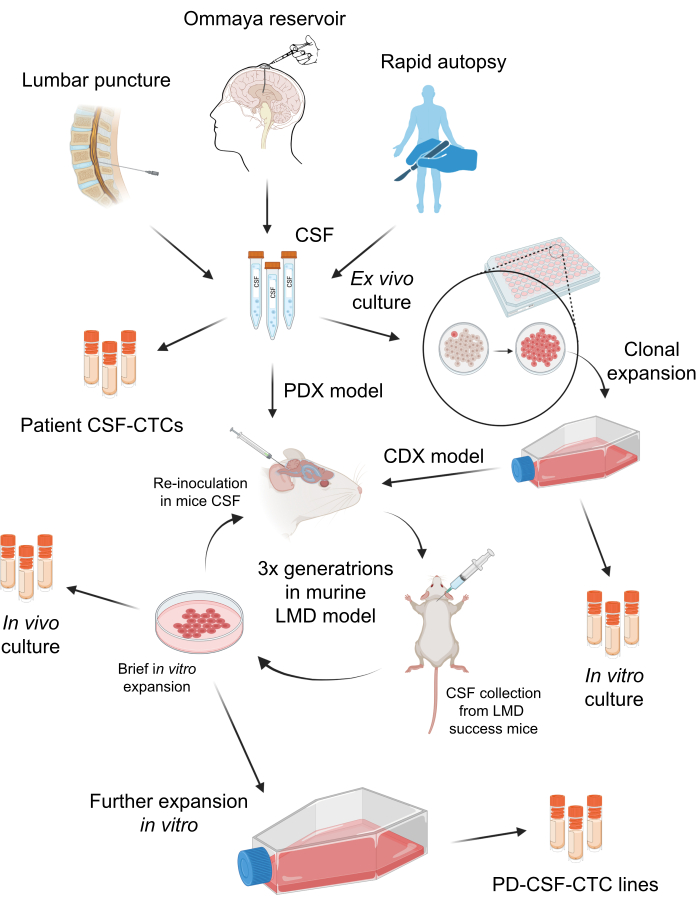
그림 1: 환자 유래 뇌척수액 순환 종양 세포(PD-CSF-CTC)를 확립하는 과정에 대한 개략도. 환자의 뇌척수액은 요추 천자, 옴마야 저장소 또는 신속한 부검을 통해 샘플링할 수 있습니다. 일련의 in vitro 및 in vivo 증식을 통해 각 단계는 PD-CSF-CTC 라인을 확립할 때까지 중간 CSF-CTC 배양(즉, 환자 CSF-CTC, in vitro 배양, in vivo 배양)을 생성합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
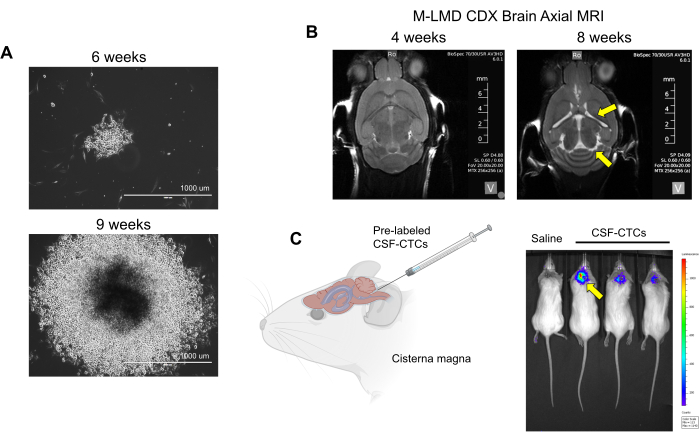
그림 2: M-LMD 환자에서 유래한 CSF-CTC의 in vitro 및 in vivo 배양의 예. (A) HMC 컨디셔닝 배지에서 6주 및 9주에 M-LMD CSF-CTC 콜로니의 체외 성장을 보여주는 대표적인 명시야 이미지. 척도 막대: 1000 μm. (B) PD-CSF-CTC를 척수강내 접종한 후 4주 및 8주의 MRI 이미지; M-LMD의 쥐 모델을 성공적으로 구축했습니다. 노란색 화살표는 이 M-LMD 마우스에서 심실이 커지고 수두증이 있을 수 있음을 나타냅니다. (C) 마우스의 M-LMD 발달을 대표하는 BLI 시각화. 이 그림은 Law et al.7에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
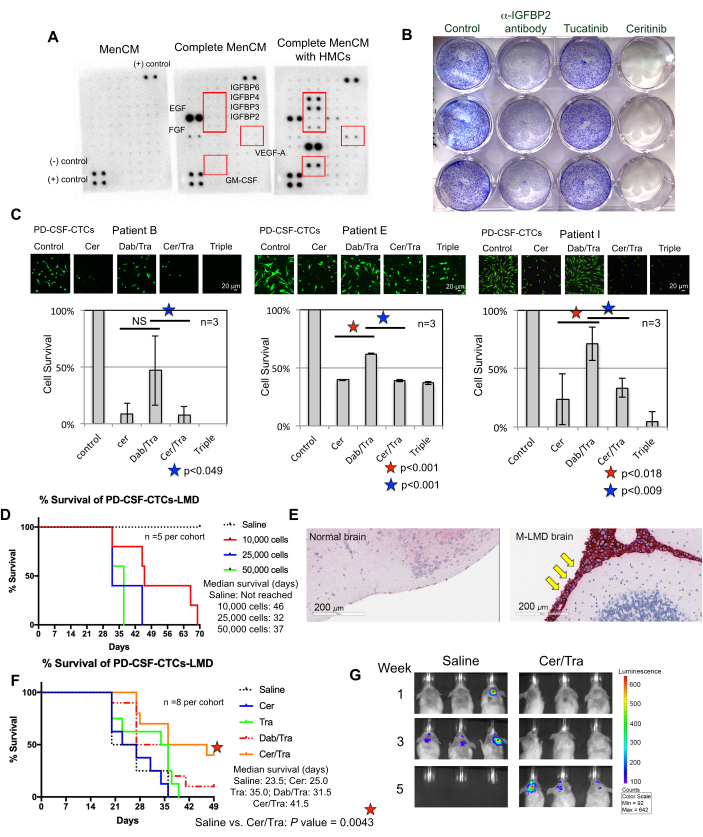
그림 3: PD-CSF-CTC 라인은 M-LMD를 연구하기 위한 다양한 전임상 실험에 사용됩니다. (A) 인간 수막 세포(HMC)가 있는 경우 배양 배지(MenCM)에서 다양한 분비 성장 인자(즉, IGFBP, VEGF-A 및 GM-CSF)의 증가를 보여주는 인간 사이토카인 어레이. (B) PD-CSF-CTC 라인 중 하나에 대한 항-IGFBP2 항체, 투카티닙 및 세리티닙의 효능을 결정하기 위한 결정 보라색 세포 증식 분석의 스캔 이미지. 제어 조건은 차량 처리를 받았습니다. 실험은 세 번에 걸쳐 수행되었습니다. (C) 시험관 내에서 세 가지 다른 확립된 PD-CSF-CTC 라인(환자 09, 12 및 16)의 세포 생존 분석. 세포는 세리티닙(cer), 다브라페닙(dab) + 트라메티닙(tra), cer + tra, 또는 세 가지 모두로 처리하였다. 처리 후 72시간에 세포를 수집하였다. Calcein-AM 염색을 사용하여 세포 생존율을 시각화하고 MTT 분석을 사용하여 세포 생존을 측정했습니다. 통계 분석을 위해 쌍체 표본 t-검정을 사용했습니다. 스케일 바: 20 μm. (D) murine M-LMD 모델의 생존 곡선. NSG 마우스는 10,000, 20,000 및 50,000 세포에서 PD-CSF-CTC 라인 중 하나를 척수강내(수조 마그나를 통해 )로 접종했습니다. M-LMD 마우스의 생존 중앙값을 측정하였다. (E) M-LMD 마우스의 뇌 섹션에서 흑색종의 마커인 MLANA에 대한 IHC 검출. 양성 MLANA는 수막에서 발견되었지만(빨간색으로 염색됨, 노란색 화살표가 가리킴), 정상(건강한) 뇌에서는 암 성장이 나타나지 않았습니다(MLANA에 대해 음성). 스케일 바: 200 μm. (F) 매일 경구 식염수, cer, tra, dab/tra 또는 cer/tra를 투여한 쥐 M-LMD 코호트의 대표적인 효능 실험. 생쥐의 생존이 결정되었다. 로그 순위(Mantel-Cox) 검정을 통계 분석에 사용했습니다. (G) 5주 동안의 M-LMD 진행에 대한 대표적인 BLI 이미지, 대조군(식염수) 처리 와 비교. CER/TRA 처리된 쥐 M-LMD 코호트. 그림의 패널 (C)는 Law et al.7에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: M-LMD 환자의 체외 배양을 위해 얻은 임상 CSF-CTC의 요약. CSF-CTC가 전파를 시도한 11명의 M-LMD 환자에 대한 요약 표. 표의 환자는 이전에 Law et al.7에서 특성화되었습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
M-LMD는 치명적이고 보편적으로 치명적인 질병이며 더 나은 치료 전략을 찾는 것이 시급합니다. M-LMD 연구의 주요 장벽 중 하나는 분자 및 기능 연구를 수행하기에 충분한 CSF-CTC를 얻을 수 없다는 것입니다 1,7. 유방암 및 난소암과 같은 다른 유형의 말초 혈액 및 뇌척수액에서 CTC를 배양하는 기존 방법이 있지만11,31,32 이러한 CTC 증식 방법은 일반적으로 단기적이며, 흑색종에서 뇌척수액-CTC를 배양하는 데 성공한 사례는 보고된 바 없다. 또한, CTC를 증식하기 위한 현재의 방법론은 단기적인 ex vivo 환경에서 존재하며 아직 환자 LMD 세포에서 파생된 in vivo LMD 모델을 생성하지 못했습니다. 여기에서 이러한 세포를 in vitro 및 in vivo에서 배양하기 위한 새로운 프로토콜을 제시하여 고유한 환자 유래 세포주를 생성합니다. 현재 연구에 참여한 11명의 M-LMD 환자 중 M-LMD CSF-CTC의 체외 증식에 성공할 확률은 약 60%(11명 중 7명)였으며, CDX 방법7을 사용하여 생체 내에서 이 확률을 ~20%(11명 중 2명)로 낮췄습니다.
in vitro 조건이 CSF 미세환경을 재현하지 않는다는 것은 분명합니다. 그러나 뇌척수액의 단백질 성분을 연구하기 위해 이전에 단백질체학 접근법이 수행되었으며 CTC ex vivo3 성장에 필요한 핵심 요인에 대한 몇 가지 통찰력을 제공했습니다. 예를 들어, M-LMD 환자에서 CTC 생존을 촉진하는 주요 경로 중 하나가 IGF 관련 활동 증가와 관련이 있음이 확인되었습니다 3,7. 또한, 연구에 따르면 렙토메닝은 FGF-2, EGF, GM-CSF 및 IGF 신호전달과 관련된 단백질을 포함하여 다양한 사이토카인/성장 인자를 CSF로 분비합니다12. 실제로, 이는 HMC와 함께 배양된 미디어에서 요약되었으며, CSF-CTC의 성장을 촉진하는 데 있어 이러한 성장 요인의 잠재적 역할을 뒷받침합니다.
PDX(또는 CDX) 모델 생성의 주요 이점은 체외 조건에서는 부족한 질병의 병리학에 대한 더 깊은 통찰력을 얻을 수 있다는 것입니다. 이상적으로는 PDX 접근법이 선호되는데, 그 이유는 CSF-CTC가 체외 배양 없이 환자로부터 직접 채취하기 때문입니다. 처음에는 이 방법을 사용하여 M-LMD를 만들려는 시도가 있었지만 지금까지 성공하지 못했습니다. PDX 마우스 생성의 어려움은 시작 물질의 풍부도 및 무결성과 관련이 있을 수 있습니다(즉, 클리닉에서 정기적으로 수집할 때 환자 CSF에서 생존 가능한 CTC가 매우 적음). 이는 부검7에서 수집된 뇌척수액에서 CTC를 성장시키는 데 탁월한 성공을 거둔 이유를 설명할 수 있습니다. in vivo propagation의 확률을 높이기 위해 이 프로토콜은 대체 CDX 접근 방식을 제공하도록 수정되었습니다. CSF-CTC는 먼저 in vitro (3단계)로 확장하여 장기적이고 더 큰 성장 잠재력을 가진 PD-CSF-CTC 라인을 생성할 수 있습니다. 그런 다음 이 세포를 마우스에 접종하여 M-LMD를 생성합니다. 현재 방법은 제한된 수의 in vivo CDX M-LMD (~ 20%) 모델을 생성했지만, 이는 CSF-CTC의 전사 다양성, CSF 미세환경의 복잡성 및 일반적으로 이러한 세포 배양의 어려움을 반영할 수 있습니다. 우리는 인간화 마우스 모델의 미래 개발이 암세포 생존력을 지원하는 미세환경의 중요성을 감안할 때 생착 성공률을 향상시킬 수 있다고 가정합니다33.
CDX 접근법의 한계는 환자 샘플에서 특정 클론만 선택되었으며 체외 배양을 통한 암세포의 유전적 부동이 더 이상 원래 소스의 전사 프로필을 반영하지 않을 수 있다는 것입니다. 그러나 체외 배양에도 불구하고 PD-CSF-CTC 라인은 분리된 비배양 환자 CSF-CTC와 약 97%의 유전자 발현 유사성을 유지하는 것으로 보고되었습니다7. 이 연구에서 scRNA-seq 분석은 SOX9, ErbB3 및 IGF-1R7과 같은 비배양 in vitro PD-CSF-CTC와 in vivo PD-CSF-CTC 간에 중복되는 농축 유전자 서명을 밝혀냈으며, 이는 잠재적인 치료 표적이 될 수 있음을 시사합니다. 또한, 이러한 일반적으로 농축된 유전자는 전사 조절 및 신진대사와 관련된 생물학적 경로에 관여한다7. 이는 종합적으로 M-LMD의 생물학을 더 잘 이해하고, 표적화 가능한 분자 메커니즘 및 질병을 유발하는 경로를 식별하고, 향후 연구에서 합리적인 치료법을 설계하기 위한 PD-CSF-CTC 배양의 중개적 가치를 강조합니다.
M-LMD 환자에서 CSF-CTC의 상태와 생존 가능성을 미리 확인할 수 있는 방법이 없기 때문에 현재 방법론은 불완전하지만, CTC의 수가 적고 매우 취약하기 때문에 성공 가능성을 높일 수 있는 몇 가지 관찰이 이루어졌습니다. 이러한 중요한 단계에는 CSF 샘플을 채취하는 즉시 얼음 위에 놓고 세포 무결성을 유지하기 위해 실험실로 신속하게 운송하기 위해 클리닉과 협력하는 것이 포함됩니다. 그 후, CSF-CTC는 배양액에 도금하거나 세포를 동결 보존하여 즉시 처리해야 합니다.
전반적으로 CSF-CTC의 배양 및 확장은 시행착오가 필요한 과정이었지만, 환자 유래 M-LMD 세포를 생성하기 위한 이 프로토콜의 확립은 연구자들에게 이전에는 수행할 수 없었던 환자 샘플로 실험을 수행하는 데 필요한 리소스를 제공할 것입니다. 앞으로의 주요 목표는 M-LMD PD-CSF-CTC를 활용하여 분자 특성 분석, 고처리량 약물 스크리닝 및 생체 내 약물 효능 연구를 수행하여 M-LMD 치료를 위한 합리적인 치료법을 설계하는 것입니다. 이 접근법은 진행성 전이성 흑색종의 현재 치명적인 측면과 관련된 이환율과 사망률을 크게 줄이는 치료 전략으로 이어질 것으로 믿어집니다.
공개
피터 포사이스(Peter Forsyth)는 Abvie Inc, Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen, Ziopharm의 자문 위원회에서 활동하고 있습니다. 다른 모든 저자는 공개할 것이 없습니다.
감사의 말
우리는 이 과학적 연구를 위해 조직을 기증하는 데 있어 특별한 관대함을 보여준 환자와 가족들에게 감사하고 싶습니다. 이 연구는 미국 국립보건원(National Institutes of Health)의 보조금 P50 CA168536, R21 CA256289, R21 CA216756(KSMS 및 PAF) K99 CA226679(IS)의 보조금으로 지원되었습니다. Moffitt Foundation Research Acceleration Fund (BC 및 PAF에), Moffitt 화학 생물학 및 분자 의학 프로그램 (PAF 및 DD), Moffitt Foundation (PAF). Moffitt의 분자 유전체학, 조직, 생물 정보학 및 생물 통계학 공유 리소스 코어는 암 센터 지원 보조금 (P30-CA076292) 및 Moffitt Foundation을 통해 National Cancer Institute에서 부분적으로 지원합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
참고문헌
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유