조합 플러그 생산을 위한 이중층 미세유체 장치
요약
여기에서는 수중수(water-in-oil) 에멀젼(플러그)의 조합 라이브러리를 생산하기 위한 폴리디메틸실록산(PDMS) 기반 이중층 장치의 제조를 소개합니다. 플러그 생산을 자동화하는 데 필요한 하드웨어 및 소프트웨어는 프로토콜에 자세히 설명되어 있으며 형광 플러그의 정량적 라이브러리 생산도 시연됩니다.
초록
액적 미세유체역학은 화학적으로 구별되는 나노리터 구획에서 많은 수의 반응을 실행할 수 있는 다목적 도구입니다. 이러한 시스템은 단일 세포의 배양에서 PCR 반응의 구현, 유전체학에서 화학 합성에 이르기까지 다양한 생화학 반응을 캡슐화하는 데 사용되었습니다. 미세유체 채널을 조절 밸브와 결합하면 개폐를 제어할 수 있으므로 고유한 조성을 가진 액적 집단으로 구성된 대규모 조합 라이브러리를 신속하게 생산할 수 있습니다. 이 논문에서는 플러그라고 하는 유중수(water-in-oil) 에멀젼의 조합 라이브러리를 생성하는 데 사용할 수 있는 압력 구동식 PDMS 기반 이중층 미세유체 장치의 제조 및 작동을 위한 프로토콜을 제시합니다. 소프트웨어 프로그램과 미세유체 하드웨어를 통합함으로써 장치에서 원하는 유체의 흐름을 제어 및 조작하여 조합 플러그 라이브러리를 생성하고 구성 플러그 집단의 구성 및 수량을 제어할 수 있습니다. 이러한 프로토콜은 특히 암 환자 생검에서 세포의 약물 반응을 연구하기 위해 조합 스크리닝을 생성하는 프로세스를 가속화할 것입니다.
서문
Microfluidics는 마이크로 채널1에서 소량의 유체를 조작 할 수 있습니다. 일반적인 미세유체 장치의 작동 규모는 수십 내지 수백 마이크로미터에 이르며, 이는 화학적 및 생물학적 반응을 소형화할 수 있게 해주어 상대적으로 적은 양의 시약으로 이러한 반응을 수행할 수 있게 한다. 처음에 미세 유체 장치는 실리콘2 및 유리3과 같은 재료로 제작되었습니다. 비록 그것들이여전히 사용되고 있지만4, 용매 호환성, 높은 제조 비용, 유체 흐름 5,6에 대한 제어 장치 통합의 어려움과 같은 특정 문제를 제기한다. 소프트 리소그래피(soft-lithography)라고 불리는 PDMS 기반 제조 방법론은 소자7의 신속한 프로토타이핑을 위한 저렴한 대안이자 복잡한 다층 소자8를 제조할 수 있는 방법을 제공한다. PDMS 장치에 밸브 및 펌프를 추가하면 장치(9,10)에서 유체의 라우팅 및 속도를 제어할 수 있습니다. 가역적 또는 비가역적 방식으로 마이크로밸브를 설계하고 작동시키는 여러 가지 방법이 개발되었다 - 예를 들어, 열적으로 작동되는 실리콘과 알루미늄으로 만들어진 바이메탈 밸브(11) 또는 전기화학적 반응에서 생성된 가스를 사용하여 실리콘 질화물막(12)을 편향시킨다. Gu et al.은 점자 디스플레이의 기계적 핀을 사용하여 마이크로채널에 압력을 가하여 흐름을 조절하는 방법을 보여줍니다13. 인기를 얻은 마이크로 밸브 중 하나는 Stephen Quake14 그룹이 개척한 공압 PDMS 기반 밸브입니다. 일반적으로 이러한 밸브는 두 개의 직교 마이크로 채널, 즉 흐름 채널과 제어 채널로 구성됩니다. 제어 채널이 가압되면 얇은 PDMS 멤브레인이 흐름 채널에서 편향되어 채널을 차단하여 유체 흐름을 차단합니다. 감압되면 멤브레인이 이완되어 유동 채널이 열리고 유체 흐름이 재개될 수 있습니다. 따라서 PDMS 밸브는 제어 채널이 여러 번 가압 및 감압될 수 있기 때문에 견고하고 가역적인 방식으로 유량 조절을 허용합니다15. 또한, 이러한 밸브는 압력의 인가에 의해 작동될 수 있기 때문에, 디지털 제어 및 자동화를 위한 길을 열어준다16. 더욱이, 이들은 동일한 재료로 되어 있기 때문에, 소프트 리소그래피 기법(soft-lithography techniques) 8,17,18을 사용하여 PDMS 기반 소자의 제조에 완벽하게 통합될 수 있다. 이러한 특징 덕분에 PDMS 밸브는 미세유체 장치의 유량 조절을 위한 매력적인 선택입니다. Thorsen et al.은 이러한 밸브의 원리를 사용하여 유체 멀티플렉서(공압 밸브의 조합 어레이)를 설계하여 20개의 제어 채널(19)이 있는 거의 천 개의 입력 흐름 채널을 처리했습니다. 이 원리는 유체를 인칩 미세유체 화학작용제로 선택적으로 라우팅하도록 확장되어 각 반응기(20,21,22,23)에서 독특한 반응이 동시에 수행될 수 있다. 그러나 이러한 마이크로 반응기는 제한된 시약의 사용을 최적화하는 데 유용하지만 여러 반응을 병렬화할 수 없으며 고처리량 연구에는 충분하지 않습니다.
액적 미세유체학(Droplet microfluidics)은 미세유체역학(microfluidic)의 하위 범주로, 미세유체 장치(24)에서 혼합되지 않는 다상 액체 흐름의 조작을 통해 액적의 생성을 포함한다. 액적 형성은 비혼화성 유체의 도입에 의한 연속적인 유체의 분해를 포함하며, 그 결과 계면 에너지의 불안정성과 에멀젼(25)의 형성으로 인한 핀치 오프(pinch-off)가 발생한다. 계면활성제는 계면 에너지를 안정화시킴으로써 에멀젼이 마이크로채널을 떠날 때 둥근 액적의 형성을 돕는다(26). 플러그(plug)라고 불리는 더 큰 액적은 덜 안정적이며, 하나 이상의 비혼화성 액체(27)에 의해 양쪽에 이격된 수성 격실의 배열로서 (예컨대, 튜빙의 길이와) 보관 격실에 수집될 수 있다. 소형화 및 구획화 외에도 액적 미세유체역학은 많은 수의 단분산 액적을 생성할 수 있으므로 생물학적 반응의 처리량을 증가시킵니다(각각 나노 반응기(28) 역할을 합니다). 물방울은, 일단 생성되면, 또한 분할(29,30), 융합(31,32), 분류(33,34) 및 고차원 구조(35,36)로의 조립과 같은 추가적인 조작을 받을 수 있다. 액적 미세유체역학은 PCR37에서 단세포 전사체학(38), 약물 발견(39,40)에서 바이러스학(41), 차세대 염기서열 분석(42)에서 화학 합성(43)에 이르기까지 여러 과학 분야와 기술에 혁명을 일으켰습니다.
PDMS 기반 소프트 리소그래피 및 마이크로 밸브와 액적 기술의 통합은 마이크로 채널의 유체 흐름을 조절하고 액적 함량을 지속적으로 제어할 수 있는 강력한 조합입니다. 채널의 개폐에 따라 각각 특정 구성을 가진 뚜렷한 액적 집단을 생성할 수 있습니다. 이러한 플랫폼은 생화학 반응을 소형화, 구획화 및 병렬화할 수 있으므로 조합 스크리닝(44)에 유용한 기술이 될 수 있다. 조합 스크리닝은 선택된 시약의 수만 가지 조합을 생성하여 알려진 조성의 개별 모집단으로 구성된 라이브러리를 생성하는 고처리량 방법입니다. 조합 스크리닝은 세균 성장 억제에 대한 약물과 항생제 간의 시너지 효과를 발견하는 데 사용되어 왔다45. 암 치료 분야에서는 조합 스크리닝을 사용하여 특정 환자에 대한 항암 약물 조합을 테스트하여 개인 맞춤형 치료를 발전시켜왔습니다 46,47. Mathur et al.은 고처리량 약물 스크리닝에서 전사체 변화를 평가하기 위해 조합 DNA 바코드 접근 방식을 통합함으로써 이 기술을 구축했습니다48. 따라서, 조합 스크리닝은 강력하면서도 초기 단계의 기술이며, 이러한 스크리닝 절차를 실행하고 용이하게 하기 위해 다양한 미세유체 기술을 개발할 필요가 있습니다.
이 원고의 목표는 수분 내 오일 플러그의 조합 라이브러리를 생성할 수 있는 이중층 미세유체 장치의 제조를 위한 완전한 프로토콜 세트를 제시하고 이러한 장치의 작동에 필요한 하드웨어 및 소프트웨어를 설명하는 것입니다. 유체 흐름은 압력 제어되는 PDMS 기반 공압 밸브를 사용하여 조절되며, 이 밸브는 다시 맞춤형 LabVIEW 프로그램에 의해 제어됩니다. 장치의 시약 흐름은 시중에서 판매되는 압력 펌프를 사용하여 이루어집니다. 8 개의 입구 프로토 타입이 제시되며, 여기서 플러그는 각각 수성 시약을 포함하는 3 개의 입구의 내용물로 형성됩니다. 수성 상은 연속 오일 상을 만나고 플러그는 0.33Hz의 주파수를 가진 T 접합에서 생산됩니다. 이 시스템의 기능은 세 가지 별개의 형광 플러그 모집단을 포함하는 정량적 라이브러리를 생성함으로써 입증됩니다. 이 기술과 프로토콜 세트는 고처리량 스크리닝 목적을 위한 조합 라이브러리의 생산을 촉진하는 데 도움이 될 것입니다.
프로토콜
1. 소프트 리소그래피
참고: 미세유체 장치는 유동층과 제어층(그림 1A)의 두 층으로 구성되며, 각 층은 각각 포지티브 및 네거티브 포토레지스트를 사용하여 개별적으로 패턴화된 웨이퍼로 성형됩니다(포토레지스트 및 현상액에 대한 자세한 내용은 재료 표 참조).
- 아래 설명된 대로 유동층에 대한 웨이퍼 제작을 수행합니다.
- 실리콘 웨이퍼(직경 100mm, <1-0-0> 방향, 525)를 250°C에서 하룻밤(12-16시간) 탈수합니다.
- 스핀 코팅을 진행하기 전에 웨이퍼를 식히십시오. 3-4mL의 포지티브 포토레지스트를 웨이퍼 중앙에 도포합니다.
- 1400rpm(344rpm/s)에서 40초 동안 회전하여 45μm의 피처 높이를 얻습니다.
- 온도 램프를 사용하여 핫플레이트에서 소프트 베이킹하여 35°C에서 105°C로 450°C/h의 속도로 증가시킵니다. 이 단계는 직접 접촉을 방지하고 포토레지스트의 기포를 최소화하기 위해 극세사 조직에서도 수행할 수 있습니다. 핫플레이트에서 웨이퍼를 제거하고 극세사 조직에서 식히십시오.
- 유동층(에멀젼 면이 아래로)에 해당하는 포토마스크(상업적으로 생산됨)를 레지스트 코팅된 실리콘 웨이퍼에 놓고 총 노출이 200mJ/cm2에 도달할 때까지 10mW/cm2의 UV 램프 아래에 노출시킵니다.
- 65 °C와 95 °C에 각각 1 분 및 7 분 동안 노출 후 베이킹을 수행하는 두 개의 핫 플레이트를 사용하십시오.
- 웨이퍼를 포지티브 포토레지스트용 현상액으로 채워진 페트리 접시로 옮겨 현상액을 개발합니다. 웨이퍼가 완전히 잠긴 벤치탑 셰이커에 페트리 접시를 흔들어 휘젓고 웨이퍼가 완전히 현상되고 특징이 명확하게 보일 때까지 현상액을 주기적으로 새로 고칩니다.
- 탈염수를 사용하여 웨이퍼의 잔류 레지스트를 헹구고 실체 현미경으로 채널 내부에 잔류물이 있는지 확인합니다. 웨이퍼를 현상액에 되돌려 놓거나 마이크로피펫으로 웨이퍼에 현상액을 조심스럽게 추가하여 잔류물을 제거합니다. 완료되면 질소 스프레이 건을 사용하여 웨이퍼를 건조시킵니다.
- 웨이퍼를 110°C로 설정된 핫플레이트에 25분 동안 올려 놓습니다. 이 프로세스로 인해 피쳐가 둥글게 생성됩니다.
- 단계 1.3에 설명된 대로 웨이퍼의 실란화를 진행합니다.
참고: 헥사메틸디실라잔(HMDS) 증착은 레지스트와 웨이퍼 사이의 접착력을 향상시키기 위해 레지스트를 적용하기 전에 실리콘 웨이퍼에 수행할 수도 있습니다.
- 아래에 설명된 대로 제어 계층에 대한 Wafer fabrication을 수행합니다.
- 다른 실리콘 웨이퍼를 110°C로 설정된 핫플레이트에 놓고 15분 동안 탈수합니다.
- 웨이퍼를 제거하고 스핀 코팅을 진행하기 전에 실온으로 냉각시키십시오.
- 5mL의 네거티브 포토레지스트를 웨이퍼 중앙에 도포합니다.
- 다음 스핀 프로토콜을 사용하여 40μm의 피처 높이를 얻습니다: 500rpm(100rpm/s 가속)에서 5초, 1400rpm(300rpm/s)에서 33초, 마지막으로 300rpm/s에서 5초 동안 0rpm으로 감속합니다.
- 65 °C 및 95 °C로 설정된 두 개의 별도 핫플레이트를 사용하여 각각 1분 및 15분 동안 소프트 베이킹합니다. 핫플레이트에서 웨이퍼를 제거하고 극세사 조직에서 식히십시오.
- 제어층(에멀젼 면이 아래로)에 해당하는 포토마스크(상업적으로 생산됨)를 레지스트 코팅된 웨이퍼에 놓고 총 노출이 250mJ/cm2에 도달할 때까지 15mW/cm2로 설정된 UV 램프 아래에 웨이퍼를 노출시킵니다.
- 65 °C와 95 °C에서 각각 두 개의 핫플레이트를 사용하고 웨이퍼의 노출 후 베이크를 각각 2분과 5분 동안 수행합니다. 핫플레이트에서 웨이퍼를 제거하고 극세사 조직에서 식히십시오.
- 웨이퍼를 네거티브 포토레지스트용 현상액으로 채워진 페트리 접시에 옮겨 4분 동안 현상합니다. 개발자를 새로 고치고 4 분 더 프로세스를 계속하십시오.
- 웨이퍼를 이소프로판올로 헹구어 잔류 감광액을 제거하고 실체 현미경을 사용하여 웨이퍼에 채널 내부에 잔류물이 있는지 확인합니다.
- 웨이퍼를 현상액에 되돌려 놓거나 마이크로피펫으로 웨이퍼에 현상액을 조심스럽게 추가하여 잔류물을 제거합니다. 완료되면 질소 스프레이 건을 사용하여 웨이퍼를 건조시킵니다.
- 현상이 완전히 완료되면 웨이퍼를 95°C로 설정된 핫플레이트에 10분 동안 올려 포토레지스트를 하드 베이킹합니다.
- 1.3단계에서 설명한 대로 실란화를 진행합니다.
- 아래 설명에 따라 실루니화를 수행합니다.
- 웨이퍼를 데시케이터에 놓습니다. 데시케이터에 유리병을 넣고 1,1,3,3 테트라메틸디실록산 4-5방울을 추가합니다.
주의: 1,1,3,3 테트라메틸디실록산은 독성이 없지만 가연성입니다. 다른 실란을 사용할 수 있지만 독성이 있을 수 있습니다. 실험실 가운, 안경, 니트릴 장갑과 같은 필요한 개인 보호 장비(PPE)를 착용하면서 흄 후드에서 실란화를 수행하는 것이 좋습니다. - 진공을 15분 동안 당기고 데시케이터를 12-16시간 동안 밀봉하여 실란이 웨이퍼에 침착할 수 있도록 합니다.
- 데시케이터를 열고 유리병을 버리십시오. 웨이퍼를 깨끗한 페트리 접시에 놓습니다.
- 웨이퍼를 데시케이터에 놓습니다. 데시케이터에 유리병을 넣고 1,1,3,3 테트라메틸디실록산 4-5방울을 추가합니다.
- 아래 설명된 대로 미세유체 장치 제작을 수행합니다.
참고: 다음 프로토콜은 이전 작업23에서 채택되었습니다.- 두 개의 개별 PDMS 솔루션을 준비합니다 - 하나는 유동 계층용이고 다른 하나는 제어 계층용입니다. 각 용액에 대해 PDMS 키트의 베이스 에이전트와 경화제를 비커에 혼합하고 믹싱 로드를 사용하여 저어줍니다. 제어층에는 10g의 기재제와 0.5g의 경화제(20:1 비율)가 필요하고, 유동층에는 40g의 기재제와 8g의 경화제(5:1 비율)가 필요합니다.
- 용액에 가스가 없을 때까지 데시케이터에서 PDMS 용액의 가스를 제거합니다.
- 실란화된 유동층 웨이퍼를 호일로 덮인 페트리 접시에 놓고 해당 PDMS 용액을 웨이퍼 위에 붓습니다. 페트리 접시를 데시케이터에 다시 놓고 진공 청소기를 당겨 가스를 더 제거합니다(약 20분 동안).
- 실란화된 제어층 웨이퍼를 해당 PDMS 솔루션으로 스핀 코팅합니다. 용액 3-4mL를 웨이퍼 중앙에 붓고 408rpm/s에서 1500rpm으로 20초 동안 회전시킵니다. 웨이퍼를 닫힌 페트리 접시의 평평한 표면에 20분 동안 놓습니다.
- 흐름 층과 제어 층을 모두 80°C의 오븐에 18-20분 동안 놓습니다. 두 층을 주기적으로 모니터링하여 경화되었는지 확인하십시오. 층은 가단성이 있지만 약간 끈적거릴 만큼 충분히 단단할 때 준비되며, 이는 두 층 사이의 결합을 향상시키기 때문입니다.
- 메스로 유동층 웨이퍼의 각 장치 주위의 PDMS를 잘라냅니다. 피처에 너무 가깝게 자르지 않도록 하고 피처와 PDMS의 가장자리 사이에 약 2cm의 공간을 남겨 두십시오. 실리콘 웨이퍼에서 분리되면 PDMS 블록을 피처 쪽의 테이프로 덮어 먼지 오염을 방지합니다.
- 모든 PDMS 블록이 절단되면 해당 제어 레이어 웨이퍼에 하나씩 놓고 눈으로 대략적인 정렬을 수행합니다.
- 모든 블록을 제어 계층의 해당 영역에 배치한 후 제어 밸브가 해당 흐름 채널 위로 겹치도록 각 블록의 위치를 조정하여 정렬을 완료합니다. 이것은 또한 실체 현미경의 도움으로 수행 할 수 있습니다.
- 압력을 가하여 두 층 사이의 공기 주머니를 제거합니다. 에어 포켓이 피처 위에 있거나 근처에 있는 경우 압력을 가하는 동안 채널이 무너지지 않도록 주의하십시오.
- 장치를 80°C 오븐에 넣고 12-16시간 동안 접착되도록 둡니다. 각 장치에 100g의 무게를 놓아 두 층 사이의 접착을 개선합니다.
- 웨이퍼를 꺼내 각 개별 장치를 잘라냅니다. 제어층 웨이퍼에서 장치를 떼어내고 피처 쪽을 테이프로 덮습니다.
- 형상 면이 위쪽을 향하도록 하여 각 개별 장치를 절단 매트에 놓고 형상 면이 위쪽을 향하도록 0.75mm 생검 펀치를 사용하여 8개의 유동층 입구, 8개의 제어 층 채널 입구, 오일 주입구 및 배출구 각각에 구멍을 뚫습니다.
- 플라즈마 asher에 현미경 슬라이드와 테이프를 제거하고 형상 면이 위쪽을 향하게 한 단일 장치를 로드합니다. 20초 동안 30W의 전력으로 산소 플라즈마 애싱을 수행합니다.
- 애싱이 완료되는 즉시 장치와 유리 슬라이드를 꺼내고 피처 면이 아래로 향하도록 장치를 슬라이드에 놓습니다. PDMS와 유리 사이의 접착력은 육안으로 즉시 볼 수 있어야 합니다. 공기 주머니가 있는 모든 영역에 압력을 가하여 공기를 짜냅니다.
- 110°C로 설정된 핫플레이트에 장치를 놓고 60분 동안 무게를 싣고 PDMS와 유리의 접착을 개선합니다.
2. 하드웨어 설정
참고: 미세유체 장치에 대한 연결의 개략도는 그림 1B 에 나와 있으며 필요한 하드웨어를 사용하여 이러한 계획을 실현하는 것이 그림 2에 나와 있습니다.
- 아래 설명된 대로 공압 밸브를 설정합니다.
참고: 칩의 PDMS 밸브를 조절하는 각 제어 채널은 차례로 단일 솔레노이드 밸브에 의해 제어됩니다. 여기에 제시된 프로토타입은 8개의 제어 채널(그림 1A)로 구성되어 있으므로 8개의 솔레노이드 밸브가 필요합니다.- 솔레노이드 밸브는 맞춤형 LabVIEW 소프트웨어 프로그램(Main Interface Program; 그림 3 및 보충 파일 1, 보충 파일 2, 보충 파일 3, 보충 파일 4). 이 프로그램은 TCP 연결(보충 파일 5, 보충 파일 6)을 통해 MODBUS 명령을 WAGO 컨트롤러로 보냅니다. 이더넷 케이블을 사용하여 LabVIEW 프로그램이 설치된 컴퓨터에 WAGO 디바이스를 연결합니다. 솔레노이드 밸브를 WAGO 컨트롤러의 포트에 순차적으로 연결합니다. 보다 상세한 설명은 앞서 설명한 프로토콜23을 참조하기 바란다.
- 1/4인치 튜브를 사용하여 솔레노이드 밸브 어레이를 압축 공기 소스에 연결하고 밸브 어레이의 압력을 3.5bar로 설정합니다. 이 시스템에서는 9-16으로 표시된 8개의 밸브가 사용되었습니다.
- 아래 설명된 대로 압력 조절기를 설정합니다.
참고: 시중에서 판매되는 압력 펌프는 유체 흐름을 제어하는 데 사용됩니다(그림 2). 8포트 및 4포트 펌프 세트를 사용하여 장치에 8개의 수성 유입구와 2개의 오일 유입구를 수용했습니다. 각 포트의 압력은 제조업체에서 제공하는 소프트웨어를 통해 조절됩니다.- 압력 펌프를 압축 공기 소스에 연결하여 공급 압력이 펌프에서 허용하는 최대 압력(8포트 및 4포트 컨트롤러 모두에 대해 2.2bar)을 초과하지 않도록 합니다.
- USB 커넥터를 사용하여 압력 펌프를 컴퓨터에 연결합니다.
- 펌프가 켜지면 해당 소프트웨어에서 볼 수 있어야 합니다. 펌프를 설정하는 동안 압력을 0으로 설정하십시오.
- 수 루어를 3/32인치 바브 커넥터에 컨트롤러의 12개의 암 루어 잠금 출력 포트 각각에 연결합니다.
- 부드러운 튜브 조각(OD: 3mm, ID: 1mm, L: 15cm)을 미늘에 연결합니다. 다른 수 루어를 3/32인치 미늘 커넥터에 부드러운 튜브의 다른 쪽 끝에 연결합니다.
- 루어 스텁(23G, 0.5인치)을 미늘 커넥터에 연결합니다. 이 시점에서 압력 조절기가 설정되고 사용할 준비가 되었습니다.
3. 미세유체 장치 설정
- 아래 설명된 대로 제어 채널 튜브를 연결합니다(그림 2).
- 각 제어 채널에 대해 폴리테트라플루오로에틸렌(PTFE) 튜브의 길이를 절단합니다(OD: 0.042인치, ID: 0.022인치). 23G, 0.5의 핀을 루어 스텁의 한쪽 끝에 삽입합니다.
- 루어 스텁을 3/32인치 미늘 나일론 커넥터에 수 루어에 연결합니다. 커넥터의 미늘을 폴리우레탄 튜브 길이(OD: 4mm, ID: 2.5mm)에 삽입합니다. 폴리우레탄 튜브의 다른 쪽 끝을 솔레노이드 밸브에 직접 연결합니다.
- 주사기에 물을 채우고 끝에 23G, 0.5인치 루어 스텁을 연결합니다.
- PTFE 튜브의 다른 쪽 끝을 이 주사기에 연결하고 튜브의 대략 절반까지 물을 주입합니다.
- 주사기에서 튜브를 분리하고 튜브의 다른 쪽 끝을 해당 제어 채널의 천공 구멍에 삽입합니다(그림 1A-C 1-8). 각 제어 채널이 해당 솔레노이드 밸브에 연결될 때까지 반복합니다.
참고: 본 논문에서는 솔레노이드 밸브 9-16을 각각C1 내지C8 에 해당하는 제어 채널에 연결하였다. 이들은 어떤 방식으로든 연결할 수 있지만 특히 메인 인터페이스 프로그램을 작동하는 동안 연결 순서와 순서를 기억하는 것이 중요합니다. - 메인 인터페이스 프로그램(그림 3)을 사용하여 모든 솔레노이드 밸브를 엽니다 (모든 제어 채널 가압). 이렇게 하면 튜브의 유체가 미세유체 장치의 제어 채널로 밀려나 채워집니다. 가압 및 감압 밸브의 예는 그림 4에 나와 있습니다.
- 아래 설명된 대로 시약을 연결하고 장치를 프라이밍합니다.
- Main Interface 프로그램에서 Pressurize all Control Channels 버튼을 눌러 모든 제어 채널에 압력이 가해졌는지 확인합니다(그림 3).
- 각 수성 시약에 대해 PTFE 튜브 세그먼트(OD: 0.042인치, ID: 0.022인치)를 펌프를 미세유체 장치 입구의 입구에 연결할 수 있을 만큼 충분히 길게 자릅니다. 튜빙 중 하나를 2.2.6 단계에서 루어 스텁에 연결합니다.
- 주사기에 필요한 시약을 채우고 끝에 23G, 0.5인치 루어 스텁을 연결합니다.
- 튜브가 가득 찰 때까지 해당 PTFE 튜브에 시약을 주입합니다. 시약이 펌프 세트의 출력 포트에 들어가지 않도록 주의하십시오.
- 튜브의 다른 쪽 끝을 미세 유체 칩의 해당 입구에 삽입합니다.
- 제공된 소프트웨어를 사용하여 각 주입구 수성 시약에 400mbar의 압력을 가합니다.
- Main Interface 프로그램(그림 3)을 사용하여 제어 채널을 개별적으로 순차적으로 감압하여 모든 시약이 장치의 T-junction에 도달했는지 확인합니다. 개별 밸브를 작동시키십시오 , 필요한 경우 Control Channels Manual Pressurization 상자의 프로그램에서 해당 버튼을 누릅니다.
- 오일 시약에 대해 3.2.3-3.2.5단계를 반복합니다. 각 주입구 오일 시약에 400mbar의 압력을 가합니다.
- 장치에서 모든 공기가 제거될 때까지 Depressurize All Control Channels(모든 제어 채널 감압 )(그림 3)를 눌러 모든 제어 채널을 동시에 감압합니다. 이것은 육안으로 또는 현미경으로 관찰할 수 있습니다.
- Pressurize All Control Channels 버튼을 눌러 모든 제어 채널에 압력을 가합니다(그림 3). 이 단계에서 모든 시약이 연결되고 장치가 준비되어 사용할 준비가 되었습니다.
- 아래 설명된 대로 실험을 프로그래밍하고 실행합니다.
- 메인 인터페이스 프로그램의 자동 실험에 대한 입력 역할을 하는 보충 파일 7에 표시된 대로 .csv 파일에서 생성할 각 플러그 모집단의 구성, 시퀀스 및 반복을 인코딩합니다(그림 3). 입구에 해당하는 채널을 열어야 하는 경우 0으로 표시하고 닫아야 하는 경우 1로 표시합니다. .csv 파일의 각 행은 하나의 고유한 플러그 모집단에 해당합니다.
- Experiment File 탭에서 Folder 버튼을 클릭하여 .csv Main Interface 프로그램에 로드합니다.
- 실험 반복(주어진 플러그 시퀀스가 얼마나 많이 생성되는지 결정하기 위해), 감압 시간(입구 채널을 열어야 하는 시간과 해당 제어 채널을 밀리초 단위로 감압해야 하는 시간을 결정하기 위해), 가압 시간(플러그 채우기 시퀀스 사이에서 입구를 닫아야 하는 시간을 밀리초 단위로 결정하기 위해)과 같은 관련 필드를 프로그램에 입력합니다.
- 바코드 입구(최대 3개 채널) 섹션에서 바코드 생산에 해당하는 입구 채널을 열어야 하는 시간(바코드 입력 시간(ms))과 함께 선택합니다. 또는 이러한 바코드를 보충 파일 7에 표시된 대로 입력 .csv 파일에 하드코딩할 수도 있습니다.
- 주입구 오일 시약의 압력을 200mbar로 줄입니다.
- 원하는 길이의 PTFE 튜브(OD: 0.042인치, ID: 0.022인치)를 콘센트에 연결하여 플러그를 모읍니다. 균일한 플러그 생산을 보장하기 위해 수거용 플러그로 미리 채워진 약 100cm의 튜브를 사용하십시오. 이것은 튜브의 플러그 수집에 의해 가해지는 배출구의 압력 차이를 중화하기 위한 것입니다.
- Run Experiment(실험 실행)를 눌러 프로그램을 시작하고 프로덕션을 연결합니다.
- 아래 설명된 대로 데이터 기록 및 분석을 수행합니다( 그림 5 참조).
참고: 이 섹션에서는 형광 플러그를 분석하는 방법에 대해 구체적으로 설명합니다. 생성된 플러그의 특성에 따라 이 섹션은 필요에 따라 변경할 수 있습니다.- 주사기에 오일(미네랄 오일 또는 불소화유)을 채우고 끝에 23G 0.5를 루어 스텁에 연결합니다. 주사기를 펌프에 고정합니다.
- 채워진 수집 튜브의 끝 부분 중 하나를 주사기의 루어 스텁에 연결합니다. 채워진 수집 튜브의 다른 쪽 끝을 현미경의 대물 렌즈 위에 부착합니다.
- 대물렌즈 근처의 튜브 끝 아래에 폐기물 저장소를 놓습니다.
- 튜브의 주어진 영역에 현미경의 초점을 맞추고 원하는 채널에서 형광을 기록하도록 설정합니다.
- 펌프를 50μL/min의 유속으로 설정합니다.
- 형광등의 비디오를 .avi 파일로 녹화합니다.
- 제공된 Python 스크립트(보충 파일 8)를 사용하여 .avi 파일을 분석하여 .avi 파일의 프레임당 사전 정의된 관심 영역(ROI)의 평균 형광을 추출합니다(예는 보충 파일 9에 제공됨).
- 제공된 사용자 지정 R 스크립트(추가 파일 10)를 사용하여 조건을 추출하고 원시 데이터와 최대 높이를 플로팅합니다.
참고: 보충 파일 10의 R 스크립트는 이 문서의 분석을 위해 사용되었습니다. 이 스크립트에서 데이터를 절단하고, 바코드를 사용하여 조건을 감지하고, 개별 플러그 및 플로팅의 피크 높이를 분석하는 데 사용되는 맞춤형 R 함수는 보충 파일 11에 제공됩니다.
대표적 결과
미세유체 칩의 중요한 특징 중 하나는 PDMS 밸브이며, 유체 흐름을 조절하는 기능은 장치의 작동 패러다임에 영향을 미치기 때문에 특성화되었습니다. 이를 위해 유입 채널을 통과하는 증류수의 유량(상용 유량 센서를 사용하여 측정)을 PDMS 밸브를 주기적으로 가압(2000ms당 3.5bar) 및 감압(1000ms)하는 동안 다양한 입력 압력의 함수로 기록되었습니다(그림 6A). 밸브가 작동될 때 유량이 0으로 떨어지는 것으로 표시된 바와 같이 밸브는 입력 압력의 약 800mbar까지 유체 흐름을 조절할 수 있는 것으로 관찰되었습니다(그림 6 B-D). 이는 채널 내부의 시약 흐름을 조절하기 위해 이러한 PDMS 기반 밸브의 사용을 검증합니다. 또한 1200mbar에서는 입력 압력이 너무 높아 밸브가 유량을 조절할 수 없으며, 이는 유량이 0으로 감소하지 않는 것으로 입증됩니다(그림 6E). PDMS 밸브의 가압 및 감압 시간은 수정할 수 있지만 현재 가압(2000ms) 및 감압(1000ms) 조건에서 유체 흐름의 변화율을 계산했습니다. 입력 압력이 400mbar인 경우 각각 1.26Hz 및 1.44Hz의 속도로 유량을 켜고 끌 수 있습니다(그림 6C).
유사한 조합 고처리량 미세유체 장치의 이전 반복은 또한 모든 흐름 채널46,47에 결합된 폐기물 채널을 통합했습니다. 이러한 장치는 일정한 유량 체계(시약이 일정한 압력이 아닌 일정한 유량으로 장치에 주입됨)에서 작동되었으며, 압력 상승을 완화하기 위해 해당 입구 채널이 닫힐 때 폐기물 채널이 열리도록 프로그래밍되었습니다. 이러한 채널은 유용하지만 폐기물 채널의 내용물이 플러그 형성에 기여하지 않기 때문에 시약의 손실을 초래합니다. 또한 추가 제어 채널과 그에 따른 추가 펌프는 폐기물 채널의 개폐를 조절하기 위해 필요합니다. 여기에 제시된 프로토타입에서는 폐기물 채널이 제거되었으며 시약의 낭비를 줄이고 설계 및 운영 복잡성을 축소할 수 있는 운영 패러다임이 확립되었습니다. 여기에는 정속 모드가 아닌 정압 모드에서 수성 시약을 주입하는 것이 포함됩니다. 두 가지 방식을 더 잘 이해하기 위해 밸브 작동 중 채널의 압력과 유량 간의 관계를 각 경우(그림 6A와 동일한 설정 사용)에서 평가했으며, 그 결과는 그림 7에 나와 있습니다. 그림 7A에서 일정한 압력(300mbar)에서 주입되는 동안 증류수의 유량을 측정한 결과, 밸브 작동 중에는 유량이 0으로 떨어지고 밸브 감압 시 유량이 작동 전 수준으로 회복되는 것이 관찰되었습니다. 그러나, 일정한 유량 체계에서, 증류수를 일정한 유속(2.5 μL/min; 그림 7B), 밸브 작동으로 인해 입구가 완전히 닫히지 않았으며(유속이 0으로 떨어지지 않음으로 입증됨) 채널의 압력 상승이 관찰되었습니다. 이것은 폐기물 채널의 개방으로 완화되는 압력입니다. 일정한 입력 압력 체제는 밸브 작동 시 배압 없이 장치를 작동할 수 있도록 하여 폐기물 채널의 필요성을 무효화하기 때문에 이 체제는 미세유체 칩의 작동에 채택되었습니다.
미세유체 장치의 기능을 입증하기 위해 형광 플러그의 정량적 조합 라이브러리가 생성되었습니다. 장치의 8 개 입구에 3 개의 수성 시약 - 4 개의 입구 (I1나는3, 나는5, 나는7), 3개의 유입구에 있는 증류수(I4나는6, 나는8), 파란색 염료가 있는 하나의 주입구(I2; 바코드 역할을 함) - 및 두 개의 오일 시약 - 유입구 O의 불소화유(FC-40) 및 광유(MO)1 및 O2, 각각 - 연결되었습니다(그림 1A, 그림 8A). 플루오르화 오일은 수성 플러그가 분산되는 운반상 역할을 하며, 광유는 플러그 안정성을 돕고 벽에 대한 플러그 내용물의 접착을 최소화하여 플러그 간의 교차 오염을 최소화합니다46. 단일 플러그 집단의 구성에 기여하는 3개의 입구를 통해 이 구성은 3개의 뚜렷한 형광 집단을 생성할 수 있습니다: FFF - 3개 채널의 플루오레세인으로 구성, FFW - 2개의 채널의 플루오레세인과 1개의 채널의 물, FWW - 1개의 채널에서 플루오레세인과 2개의 채널에서 물로 구성. 이 설정을 사용하면 FWW 플러그를 생성할 수 있는 12개의 고유한 조건(3개의 입구의 고유한 조합으로 생성된 플러그 모집단), FFW 플러그를 생성할 수 있는 18개의 고유한 조건 및 FFF 플러그를 생성할 수 있는 4개의 고유한 조건이 있습니다. 따라서 칩은 각각 5개의 서로 다른 복제 플러그와 이를 분리하는 5개의 바코드 플러그 복제를 사용하여 이러한 34개의 서로 다른 조건을 생성하도록 프로그래밍되었습니다. 형광 플러그 집단을 바코드 집단, 즉 육안으로 볼 수 있는 유색(이상적으로는 비형광) 플러그 세트(이 경우 청색 염료와 두 개의 증류수 채널에 해당하는 입구 채널을 열어 형성됨)와 함께 산재하는 것이 좋습니다. 이를 통해 사용자는 플러그 파손 또는 융합과 같은 문제에 대해 플러그 생산을 모니터링할 수 있으며 플러그의 다운스트림 분석에 도움이 됩니다. 따라서 총 340개의 플러그(서로 다른 조건을 분리하는 170개의 실험용 플러그와 170개의 바코드 플러그)가 생성되어 PTFE 튜브에서 수집되었으며, 그 샘플은 다음과 같습니다. 그림 8B. 감압 시간과 가압 시간은 각각 1000ms 및 2000ms로 설정되었습니다. 플러그의 형광과 다양한 실험 조건 내 및 전반에 걸친 변동성을 분석했으며, 그 결과는 다음과 같습니다. 그림 8C,D. 그림 8C 3.4.6단계에서 생성된 .avi 파일의 프레임당 형광을 보여주며, 이는 고려 중인 34개의 실험 조건(파란색 선으로 구분)을 강조 표시합니다. 조건 내 피크의 평균 형광 값은 빨간색으로 표시되고 점선은 해당 조건 내의 표준 오차를 나타냅니다. 각 피크에서 검출된 최대 형광에서 기준선 형광을 빼서 얻은 각 모집단의 모든 플러그 피크 높이는 다음과 같이 표시되었습니다. 그림 8D. 각 조건의 마지막 피크는 T-접합에서 시약의 혼합으로 인해 오염된 플러그였기 때문에 계산에서 무시되었습니다(플러그의 형광은 플러그 생산의 역순으로 기록되었기 때문에 생산 중 모집단의 첫 번째 플러그는 분석 중 모집단의 마지막 플러그임). FWW 플러그의 높이는 FFF 플러그 높이의 약 1/3(평균 = 40.9, 표준 편차 = 3.1)이고 FFW 플러그의 높이는 FFF 플러그 높이(평균 = 117, 표준 편차 = 10)의 약 2/3(평균 = 78.4, 표준 편차 = 5)인 것이 분명했습니다. 이러한 결과는 FFF/FFW/FWW 플러그의 다양한 모집단에서 예상되는 형광 비율과 일치하며, 이는 장치의 견고성과 기능을 강조합니다.
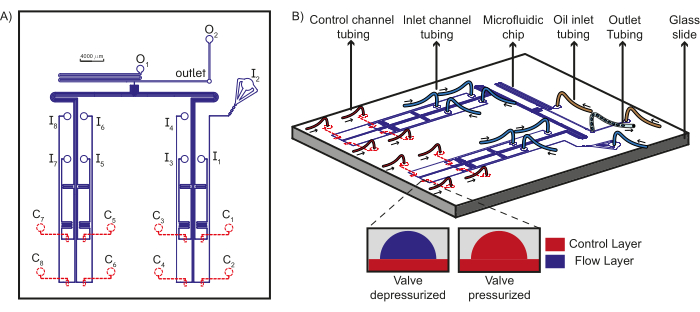
그림 1: 장치 설계 및 미세유체 설정 개략도. (A) 칩의 흐름층은 파란색으로 표시되고 제어층은 빨간색으로 표시됩니다. 총 8개의 고유한 수성 시약이 유입구(I1-8)를 통해 T-접합을 향해 흐를 수 있으며, 여기서 유입구(O1-2)에서 유상과 만나 배출구에서 수집되는 플러그를 형성할 수 있습니다. 각 입구 흐름 채널은 고유한 제어 채널(C1-8)의 제어하에 있습니다. (B) 입구, 제어 채널 및 오일 시약에 대한 튜브 연결과 함께 미세 유체 칩의 개략도가 출구 튜브와 함께 표시됩니다. 화살표는 튜브의 유체 흐름 방향을 나타냅니다. 삽입물은 PDMS 밸브의 작동 원리를 보여줍니다. 점선은 제어 계층이 흐름 계층 아래에 있음을 나타냅니다. 이 수치는 Dubuc et al49에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
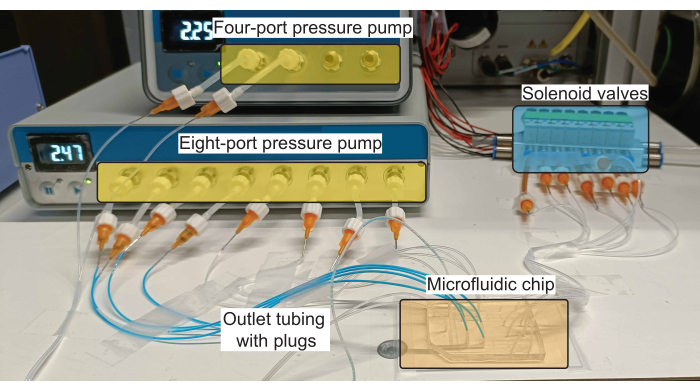
그림 2: 플러그 생산을 위한 하드웨어 설정 개략도. 압력 펌프는 입구 채널에서 시약(수성 및 오일 모두)의 흐름을 제어하고 솔레노이드 밸브는 PDMS 밸브의 작동을 제어합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 미세유체 장치를 제어하기 위한 기본 인터페이스 프로그램. 이 맞춤형 프로그램을 사용하면 개별 공압 밸브(흰색 패널)의 수동 가압이 가능합니다. 또한 원하는 플러그 모집단과 밸브 가압 및 감압 시간과 같은 필요한 매개변수가 포함된 .csv 파일을 수락하고 가압 및 가압되지 않은 제어 채널을 포함하여 실험 실행 상태를 실시간으로 표시하는 완전한 실험(블루 패널)을 실행할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 압력 구동 밸브 작동. (A) PDMS 밸브(수평)가 감압되고 입구 채널(수직)이 열려 있는 모습과 (B) PDMS 밸브가 가압되어 입구 채널을 닫는 모습의 명시야 현미경 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
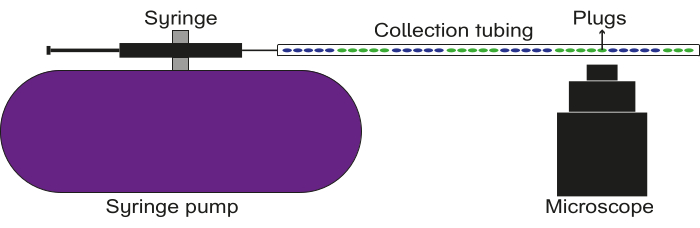
그림 5: 데이터 기록 설정의 개략도. 수집 튜브는 펌프에 부착 된 오일이있는 주사기에 연결됩니다. 플러그는 수집 튜브를 통해 날아가고 이미지/비디오는 형광 현미경을 사용하여 캡처됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
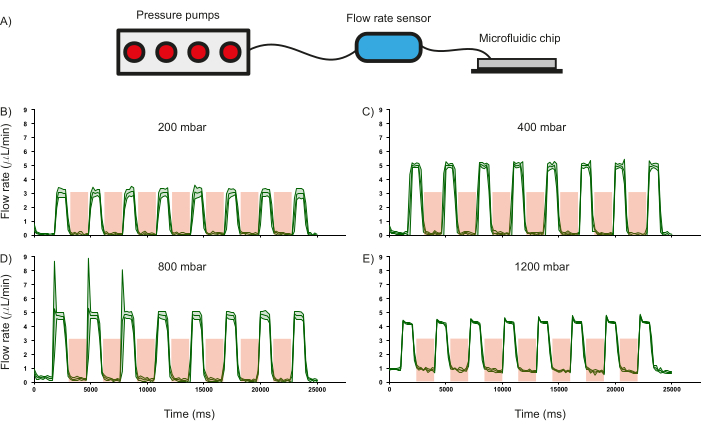
그림 6: 주어진 입력 압력에서 유량에 대한 밸브 작동의 영향. (A) 미세유체 채널의 유량을 모니터링하는 데 사용되는 하드웨어 설정의 개략도. (B) 200 mbar, (C) 400 mbar, (D) 800 mbar 및 (E) 1200 mbar의 서로 다른 입력 압력에서 작동할 때 채널의 유량 응답. 밸브 작동 시간은 빨간색 음영 영역으로 표시됩니다. 모든 실험에는 증류수가 사용되었습니다. 세 가지 독립적인 측정의 표준 편차는 녹색 음영 영역으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
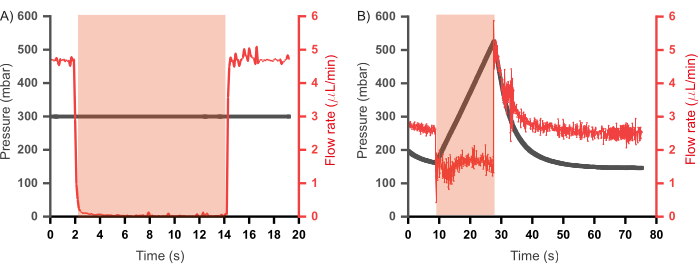
그림 7: 밸브 작동 시 입구 채널에 있는 시약의 압력과 유속 간의 관계. (A) 일정한 입력 압력 영역(300mbar) 밸브에서는 밸브 작동 시 유량이 0으로 감소합니다. (B) 일정한 유량 체계(2.5μL/min)에서 밸브 작동으로 인해 밸브가 감압될 때까지 채널에 압력이 급격히 증가합니다. 밸브 작동 시간은 빨간색 음영 영역으로 표시됩니다. 모든 실험에는 증류수가 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
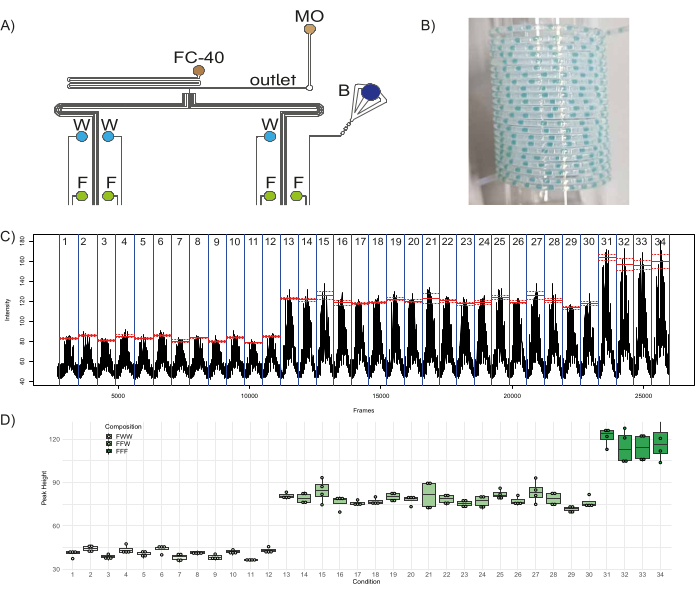
그림 8: 형광 플러그 집단의 생산. (A) 장치에 대한 다양한 시약의 연결을 보여주는 실험 설정의 개략도. 약어: F = 플루오르세인, W = 증류수, B = 블루 식용 염료, FC-40 = 불소화유, MO = 미네랄 오일. (B) 플러그가 포함된 수집 튜브의 샘플 사진. (C) 분석에서 얻은 원시 데이터는 비디오 파일의 프레임 번호와 비교하여 지정된 관심 영역(ROI)에서 측정된 평균 형광 강도를 보여줍니다. 빨간색 선은 각 조건(3개의 입구의 특정 조합으로 생성된 플러그 모집단)에 대한 피크 형광의 평균을 나타내고 점선은 해당 표준 오차를 나타냅니다. (D) 다양한 조건에서 피크 높이의 상자 그림. 점은 개별 피크에 해당하고, 각 조건에 대한 상자의 범위는 해당 피크 분포의 첫 번째 사분위수까지이며, 두꺼운 선은 중앙값에 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 장치 작동을 위한 기본 인터페이스 프로그램입니다. 제어 채널의 수동 가압 및 8개의 입구 장치에서 자동 실험 실행을 위한 제어 인터페이스. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 장치 작동을 위한 대체 기본 인터페이스 프로그램. 바코드 기능 없이 8개의 입구 장치를 실행하기 위한 제어 인터페이스입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: 글로벌 변수가 있는 LabVIEW 서브 프로그램. 메인 인터페이스 프로그램의 SubVI는 메인 인터페이스 프로그램의 전역 변수, 즉 제어 채널의 상태를 나열하고 표시합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 4 : 전역 변수의 값을 저장하는 LabVIEW 프로그램. 밸브의 현재 상태를 어레이로 저장하는 메인 인터페이스 프로그램의 SubVI는 사용자가 30초 이상 비활성 상태인 경우 밸브의 동일한 상태를 유지하는 데 사용됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 5: TCP(Transmission Control Protocol) LabVIEW 프로그램. 메인 인터페이스 프로그램과 WAGO 컨트롤러 간의 TCP 연결을 유지하기 위한 SubVI. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 6: TCP 전역 변수 LabVIEW 하위 프로그램. TCP 출력 변수를 저장하는 프로그램입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 7: 자동 실험을 수행하기 위한 입력. 이 문서에 자세히 설명된 대로 정량적 형광 플러그를 생산하기 위한 실험을 수행하기 위한 플러그 집단의 구성, 시퀀스 및 복제본을 인코딩하는 .csv 파일입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 8: 형광 플러그 집단 분석을 위한 Python 스크립트. 플러그 기록에서 형광 값을 판독하는 사용자 지정 Python 스크립트(.avi 파일). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 9: 플러그의 형광 분석 출력. 플러그 기록의 5x5 ROI에 대한 형광 값을 포함하는 Python 스크립트의 출력입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 10 : 출력 파일을 읽는 R 프로그램. 이 작업에 사용되는 사용자 정의 프로그램은 출력 형광 값을 읽고 원시 데이터, 피크 높이 및 표준 편차를 플롯합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 11: 형광 데이터를 분석하고 플로팅하기 위한 R 함수. 1에 사용되는 사용자 정의 R 함수. 형광 값의 원시 데이터를 자르고, 2. 다양한 실험 조건을 정의하고, 3. 주어진 조건에서 피크를 식별하고, 4.원시 데이터와 중첩된 감지된 조건을 플로팅하고, 5. 식별된 피크와 겹쳐진 원시 데이터를 플로팅합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 논문에서는 플러그라고 하는 수중유 구획에서 조합 라이브러리의 자동 생성을 위한 PDMS 기반 미세유체 장치의 제조 및 작동을 위한 일련의 프로토콜이 제시되었습니다. microfluidics와 액적 기술의 조합은 많은 수의 구획에 소량의 시약을 캡슐화하는 강력한 기술을 제공하여 대규모 조합 스크리닝을 위한 길을 엽니다.
이전에는 미세유체역학을 사용하여 화학적으로 구별되는 구획을 생성하기 위해 여러 기술이 설명되었으며, 각 기술에는 장점과 한계가 있습니다. Kulesa et al.50은 마이크로타이터 플레이트를 사용하여 액적의 바코드로 세포를 캡슐화하고 전기장을 사용하여 이러한 액적을 병합하여 조합 라이브러리를 만드는 전략을 설명했습니다. 이러한 접근 방식은 많은 액적 조합을 생성할 수 있지만 워크플로우에서 수동 처리 단계가 필요하다는 한계가 있습니다. Tomasi et al.51 은 스페로이드(free floating cell aggregates) 함유 액적을 자극 액적과 병합하는 미세유체 플랫폼을 개발하여 스페로이드 미세환경을 조작할 수 있도록 했습니다. 이 방법을 사용하면 세포 간 상호 작용 및 약물의 효과와 같은 중요한 현상을 연구할 수 있지만 처리량이 상대적으로 낮습니다. Eduati et al.46 및 Utharala et al.47 은 자동화된 방식으로 고처리량 조합 라이브러리를 생성할 수 있는 미세유체 밸브 기반 플랫폼을 개발했습니다. 그러나 이러한 연구에서 밸브는 점자 장치를 사용하여 작동되며, 이는 마이크로 밸브와 미세 유체 칩 사이의 번거로운 정렬 단계를 필요로 합니다. 이 백서에서 설명하는 시스템의 주요 특징은 입력 채널의 유체 흐름을 조절하기 위해 공압 PDMS 밸브를 구현하는 것입니다. 이 밸브는 PDMS 기반이기 때문에 미세유체 칩의 제조 단계에 다소 원활하게 통합될 수 있습니다. 또한 외부 가스 소스를 통해 압력을 가하여 작동할 수 있으므로 입구 채널에서 액체의 흐름을 제어하는 비교적 간단한 옵션입니다. 마지막으로, 이러한 밸브의 가압 및 감압 기간과 순서를 프로그래밍할 수 있으며, 이를 통해 고처리량 방식으로 고유한 플러그 집단의 생산을 자동화할 수 있습니다. 또 다른 중요한 특징은 주입구를 통한 시약 주입을 위해 일정한 압력 방식을 사용하는 것인데, 이를 통해 일정한 유속 영역에서 발생하는 압력 축적을 완화하기 위해 폐기물 채널을 통합하지 않도록 선택할 수 있습니다. 이는 장치 설계를 단순화하고, 폐기물 채널의 밸브를 제어하기 위한 추가 밸브 및 하드웨어의 필요성을 줄이며, 시약 낭비를 최소화합니다.
PDMS를 이용한 소자의 제조는 비교적 복잡하지 않지만, 이러한 소자를 구현하기 위해서는 공압 솔레노이드 밸브(PDMS 밸브의 작동 제어), 압력 펌프(흡입구 및 오일 시약의 흐름 제어) 및 소프트웨어 프로그램(솔레노이드 밸브 제어)과 같은 광범위한 하드웨어 도구를 사용해야 합니다. 상당한 투자가 필요하지만 이러한 설정은 장치의 성공적인 작동을 위한 일관성과 신뢰성을 제공합니다. 또한 이 프로토콜에 설명된 하드웨어 구성 요소와 아키텍처는 모듈식 방식으로 설정됩니다. 따라서 일부 모듈에 대한 대안을 사용하여 비용을 절감하거나 특정 요구 사항에 맞게 조정할 수 있습니다. 예를 들어, 유용성, 예산, 가용성 및 편의성(52,53,54)에 기초하여 사용될 수 있는 다양한 펌프가 존재한다. 유체 저장용기 및 온도 조절기와 같은 추가 구성 요소는 민감한 입구 시약(23)을 위해 통합될 수 있습니다. 또한 이 설계는 특정 과학적 요구 사항을 해결하기 위해 확장하거나 축소할 수 있습니다. 예를 들어, 이 논문에서는 8개의 고유한 시약을 결합하여 플러그를 생산할 수 있는 8개의 입구 프로토타입에 대해 설명합니다. 이것은 더 많은 수의 입구와 더 큰 조합을 허용하는 16-입구 장치로 확장할 수 있습니다. 결과적으로, 입구를 처리하기 위해 추가 제어 채널과 솔레노이드 밸브가 필요하지만 이러한 프로토 타입을 사용하면 더 크고 다양한 조합 라이브러리를 생성 할 수 있습니다. 마지막으로, 이 논문에서 각 플러그 모집단은 미세유체 장치의 8개 수성 입구 중 3개가 열리면서 생성됩니다. 이러한 구성의 경우 오일 시약의 경우 약 200mbar, 수성 시약의 경우 약 400mbar의 압력이 밸브 작동에 의해서만 구동되는 플러그 생산 체제에 해당하는 것으로 관찰되었습니다. 오일에 더 높은 압력이 가해지면 플러그가 파손되는 것이 관찰되고 더 낮은 압력이 가해지면 플러그가 융합됩니다. 플러그 생산을 위한 최적의 압력 체계는 플러그 형성에 기여하는 입구의 수, 유체의 특성 및 점도, 채널 크기와 같은 광범위한 요인에 따라 달라지며 필요에 따라 최적화해야 합니다.
정압 영역에서 작동하는 경우의 단점 중 하나는 점도가 다른 유체가 일정한 압력에서 다른 유속을 갖는다는 것입니다. 따라서 입구를 통해 흐르는 수성 시약의 점도가 비슷한지 확인해야 합니다. 점도가 다른 유체를 사용하면 입구 채널의 유체 흐름뿐만 아니라 T-접합에서의 플러그 형성에도 영향을 미치므로 플러그 집단의 구성이 손상됩니다. 또 다른 단점은 T-접합의 잔류 시약으로 인한 플러그 집단의 오염입니다. 장치가 서로 다른 플러그 집단의 생산 사이를 전환할 때 각 집단의 순서에 있는 첫 번째/마지막 플러그는 이전 또는 다음 집단에 의해 오염되는 경향이 있습니다. 이는 각 모집단의 추가 반복실험을 생성하고 분석 중에 오염된 플러그를 할인함으로써 극복할 수 있습니다. 마지막으로, 제조 및/또는 외부 소스(압력 변동)의 불일치로 인해 개별 장치 간에 변동이 발생할 가능성도 있습니다. 이 문제는 단일 미세유체 칩을 여러 번 재사용하고 이러한 불일치의 영향을 최소화하기 위해 단일 칩에서 조합 라이브러리의 전체 실행이 수행되도록 함으로써 완화할 수 있습니다.
이 논문에 제시된 미세유체 장치와 동반되는 작동 프로토콜 세트는 플러그의 정량적 조합 라이브러리의 생산을 입증하는 데 사용되었습니다. 따라서 이 플랫폼은 고처리량 방식으로 고유한 플러그 모집단의 조합 라이브러리를 빠르게 생성할 수 있습니다. 결과적으로, 이러한 기술은 환자 생검 샘플에 대한 조합 약물 스크리닝을 포함하되 이에 국한되지 않는 다양한 스크리닝 목적으로 사용될 수 있으며, 이로써 생검에서 회수된 소수의 세포를 다수의 액적에 분포시키고 항암제의 대규모 조합으로 처리하여 주어진 환자 샘플에 대한 개별 치료를 최적화할 수 있으며, 따라서 개인화된 암 치료를 가속화할 수 있다46, 48,55.
공개
F. E.는 TheraMe!의 프리랜서입니다. AG입니다. 저자는 경쟁하는 재정적 이익이 없다고 선언합니다.
감사의 말
HMDS 증착에 도움을 주신 NanoLab TuE의 Stacey Martina에게 감사드립니다. 이 연구는 TU/e의 ICMS(Institute for Complex Molecular Systems)와 네덜란드 NWO(Organization for Scientific Research)의 중력 프로그램 IMAGINE! (프로젝트 번호 24.005.009).
자료
| Name | Company | Catalog Number | Comments |
| 1,1,3,3 tetramethyldisiloxane | Merck Life Science NV | MFCD00008256 | |
| 4 channel digital input/output module | WAGO Kontakttechnik GmbH | 750-504 | |
| Acetone | Boom Labs | BOOMSKEUZW3 | |
| Analysis Software | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE | |
| AZ 40XT 11D | Merck Life Science NV | 212299 | Positive photoresist |
| AZ 726 MIF developer | Merck Life Science NV | 10055824960 | Developer for positive photoresist |
| Biopsy Punch, Rapid Core | World Precision Instruments Germany, GMBH | 504529 | 0.75 mm ID, W/Plunge |
| Blue food dye | PME | FC1036 | |
| Controller end module | WAGO Kontakttechnik GmbH | 750-600 | |
| Ethernet Controller | WAGO Kontakttechnik GmbH | 750-881 | |
| FC-40 | Merck Millipore | F9755-100ML | |
| Fluigent flow unit | Fluigent | FLU-S-D | |
| Fluigent pressure system | Fluigent | MFCS-EZ | 0 - 2 bar |
| Fluorescein | Merck Life Science NV | MFCD00005050 | |
| Hot plate | Torrey Pines Scientific | HP61 | |
| Inverted microscope | Nikon Instruments | Eclipse Ti-E | |
| Isopropanol | Boom Labs | BOOMSKEUZE3 | |
| LabVIEW (Software Version 20) | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/tree/main/LabVIEW_8_inlet_device_ VERSION_1 | All files have been saved for LabVIEW version 20. It is advised to use this version or higher to open the files. |
| Luer stubs | Instech Laboratories, Inc. | LS23 | 23 ga, 0.5" |
| Male Luer to barb connectors | Cole Parmer | 45505-32 | 3/32" ID |
| MasterFlex PTFE tubing | Avator/VWR | 48634 | |
| Microscope Slides | VWR | 470150-480 | |
| Microscope slides, Plain | Corning | 2947-75X50 | |
| Mineral Oil | Merck Millipore | 330760-1L | |
| mr DEV 600 | Micro resist Technology | R815100 | Developer for negative photoresist |
| Oven | Thermo Scientific | Heraeus T6P 50045757 | |
| Oxygen plasma asher | Quorum Technologies | K1050X | |
| Photomask | CAD/Art Services, Inc. | ||
| Photomask Design | Eindhoven University of Technology (Adapted from Merten Lab, EPFL) | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/blob/main/8_inlet_JoVE_device_design.dwg | |
| Pneumatic valve array | FESTO | 1x 8 valve array, Normally closed valves | |
| Silicon Wafers | Silicon Materials | <1-0-0>, 100 mm diameter, 525 μm thickness | |
| Single edge blades | GEM Scientific | ||
| Soft tubing | Fluigent | 1 mm ID, 3 mm OD | |
| Spin coater | Laurell Technologies Corporation | WS-650MZ-23NPPB | |
| Stereo microscope | Olympus Corporation | SZ61 | |
| SU-8 3050 | Kayakli Advanced Materials | Y311075 1000L1GL | Negative photoresist |
| Sylgard 184 Silicone Elastomer Kit (PDMS) | Dow | 1317318 | |
| Syringe | B Braun Injekt - F Fine Dosage Syringe | 10303002 | |
| UV-LED exposure system | Idonus | UV-EXP150S-SYS | |
| Vacuum pump | Vacuumbrand GmbH | MD1C | |
| Weighing scales | Sartorius | M-prove |
참고문헌
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Terry, S. C., Herman, J. H., Angell, J. B. A gas chromatographic air analyzer fabricated on a Silicon wafer. IEEE Transactions on Electron Devices. 26 (12), 1880-1886 (1979).
- Mellors, J. S., Gorbounov, V., Ramsey, R. S., Ramsey, J. M. Fully integrated glass microfluidic device for performing high-efficiency capillary electrophoresis and electrospray ionization mass spectrometry. Anal Chem. 80 (18), 6881-6887 (2008).
- Wlodarczyk, K. L., Hand, D. P., Maroto-Valer, M. M. Maskless, rapid manufacturing of glass microfluidic devices using a picosecond pulsed laser. Sci Rep. 9 (1), 20215 (2019).
- Nielsen, J. B., et al. Microfluidics: innovations in materials and their fabrication and functionalization. Anal Chem. 92 (1), 150-168 (2020).
- Nge, P. N., Rogers, C. I., Woolley, A. T. Advances in microfluidic materials, functions, integration, and applications. Chem Rev. 113 (4), 2550-2583 (2013).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288 (5463), 113-116 (2000).
- Oh, K. W., Ahn, C. H. A review of microvalves. Journal of Micromechanics and Microengineering. 16 (5), R13 (2006).
- Au, A. K., Lai, H., Utela, B. R., Folch, A. Microvalves and micropumps for BioMEMS. Micromachines. 2 (2), 179-220 (2011).
- Jerman, H. Electrically-activated, normally-closed diaphragm valves. J. Micromech. Microeng. 4 (4), 210 (1994).
- Neagu, C. R., Gardeniers, J. G. E., Elwenspoek, M., Kelly, J. J. An electrochemical microactuator: principle and first results. J microelectromechanical sys. 5 (1), 2-9 (1996).
- Gu, W., Zhu, X., Futai, N., Cho, B. S., Takayama, S. Computerized microfluidic cell culture using elastomeric channels and Braille displays. Proc Natl Acad Sci U S A. 101 (45), 15861-15866 (2004).
- Studer, V., et al. Scaling properties of a low-actuation pressure microfluidic valve. J Appl Phys. 95 (1), 393-398 (2004).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proc Natl Acad Sci U S A. 101 (40), 14431-14436 (2004).
- Ridgeway, W. K., Seitaridou, E., Phillips, R., Williamson, J. R. RNA-protein binding kinetics in an automated microfluidic reactor. Nucleic Acids Res. 37 (21), e142 (2009).
- Fu, A. Y., Chou, H. P., Spence, C., Arnold, F. H., Quake, S. R. An integrated microfabricated cell sorter. Anal Chem. 74 (11), 2451-2457 (2002).
- Liu, J., Enzelberger, M., Quake, S. A nanoliter rotary device for polymerase chain reaction. Electrophoresis. 23 (10), 1531-1536 (2002).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic large-scale integration. Science. 298 (5593), 580-584 (2002).
- Galas, J. C., Haghiri-Gosnet, A. M., Estévez-Torres, A. A nanoliter-scale open chemical reactor. Lab Chip. 13 (3), 415-423 (2013).
- Niederholtmeyer, H., Stepanova, V., Maerkl, S. J. Implementation of cell-free biological networks at steady state. Proc Natl Acad Sci U S A. 110 (40), 15985-15990 (2013).
- Yelleswarapu, M., et al. Sigma factor-mediated tuning of bacterial cell-free synthetic genetic oscillators. ACS Synth Biol. 7 (12), 2879-2887 (2018).
- van der Linden, A. J., et al. A multilayer microfluidic platform for the conduction of prolonged cell-free gene expression. J Vis Exp. (152), 59655 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging droplet microfluidics. Chem Rev. 117 (12), 7964-8040 (2017).
- Seemann, R., Brinkmann, M., Pfohl, T., Herminghaus, S. Droplet based microfluidics. Rep Prog Phys. 75, 016601 (2012).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab Chip. 12 (3), 422-433 (2012).
- Clausell-Tormos, J., et al. Droplet-based microfluidic platforms for the encapsulation and screening of mammalian cells and multicellular organisms. Chem Biol. 15 (5), 427-437 (2008).
- Umbanhowar, P. B., Prasad, V., Weitz, D. A. Monodisperse emulsion generation via drop break off in a coflowing stream. Langmuir. 16 (2), 347-351 (2000).
- Abate, A. R., Thiele, J., Weitz, D. A. One-step formation of multiple emulsions in microfluidics. Lab Chip. 11 (2), 253-258 (2011).
- Chen, Y., Gao, W., Zhang, C., Zhao, Y. Three-dimensional splitting microfluidics. Lab Chip. 16 (8), 1332-1339 (2016).
- Ahn, K., Agresti, J., Chong, H., Marquez, M., Weitz, D. A. Electrocoalescence of drops synchronized by size-dependent flow in microfluidic channels. Appl Phys Lett. 88 (26), 264105 (2006).
- Fidalgo, L. M., Abell, C., Huck, W. T. S. Surface-induced droplet fusion in microfluidic devices. Lab Chip. 7 (8), 984-986 (2007).
- Bernath, K., et al. In vitro compartmentalization by double emulsions: Sorting and gene enrichment by fluorescence activated cell sorting. Anal Biochem. 325 (1), 151-157 (2004).
- Aharoni, A., Amitai, G., Bernath, K., Magdassi, S., Tawfik, D. S. High-throughput screening of enzyme libraries: thiolactonases evolved by fluorescence-activated sorting of single cells in emulsion compartments. Chem Biol. 12 (12), 1281-1289 (2005).
- Deng, N. N., Yelleswarapu, M., Huck, W. T. S. Monodisperse uni- and multicompartment liposomes. J Am Chem Soc. 138 (24), 7584-7591 (2016).
- Deng, N. N., Yelleswarapu, M., Zheng, L., Huck, W. T. S. Microfluidic assembly of monodisperse vesosomes as artificial cell models. J Am Chem Soc. 139 (2), 587-590 (2016).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Shembekar, N., Chaipan, C., Utharala, R., Merten, C. A. Droplet-based microfluidics in drug discovery, transcriptomics and high-throughput molecular genetics. Lab Chip. 16 (8), 1314-1331 (2016).
- Wong, A. H., et al. Drug screening of cancer cell lines and human primary tumors using droplet microfluidics. Sci Rep. 7 (1), 9109 (2017).
- Jing, W., Han, H. Droplet microfluidics for high-resolution virology. Anal Chem. 94 (23), 8085-8100 (2022).
- Ding, Y., Choo, J., deMello, A. J. From single-molecule detection to next-generation sequencing: microfluidic droplets for high-throughput nucleic acid analysis. Microfluid Nanofluidics. 21 (3), 58 (2017).
- Nightingale, A. M., et al. A stable droplet reactor for high temperature nanocrystal synthesis. Lab Chip. 11 (7), 1221-1227 (2011).
- De Stefano, P., Bianchi, E., Dubini, G. The impact of microfluidics in high- throughput drug-screening applications. Biomicrofluidics. 16 (3), 031501 (2022).
- Tekin, E., et al. Prevalence and patterns of higher-order drug interactions in Escherichia coli. NPJ Syst Biol Appl. 4, 31 (2018).
- Eduati, F., et al. A microfluidics platform for combinatorial drug screening on cancer biopsies. Nat Commun. 9 (1), 2434 (2018).
- Utharala, R., et al. A microfluidic Braille valve platform for on-demand production, combinatorial screening and sorting of chemically distinct droplets. Nat Protoc. 17 (12), 2920-2965 (2022).
- Mathur, L., et al. Combi-seq for multiplexed transcriptome-based profiling of drug combinations using deterministic barcoding in single-cell droplets. Nat Commun. 13 (1), 4450 (2022).
- Dubuc, E., et al. Cell-free microcompartmentalised transcription–translation for the prototyping of synthetic communication networks. Curr Opin Biotechnol. 58, 72-80 (2019).
- Kulesa, A., Kehe, J., Hurtado, J. E., Tawde, P., Blainey, P. C. Combinatorial drug discovery in nanoliter droplets. Proc Natl Acad Sci U S A. 115 (26), 6685-6690 (2018).
- Tomasi, R. F. X., Sart, S., Champetier, T., Baroud, C. N. Individual control and quantification of 3D spheroids in a high-density microfluidic droplet array. Cell Rep. 31 (8), 107670 (2020).
- White, J. A., Streets, A. M. Controller for microfluidic large-scale integration. HardwareX. 3, 135-145 (2018).
- Brower, K., et al. An open-source, programmable pneumatic setup for operation and automated control of single- and multi-layer microfluidic devices. HardwareX. 3, 117-134 (2018).
- Gonzalez-Suarez, A. M., Long, A., Huang, X. H., Revzin, A. A Compact control system to enable automated operation of microfluidic bioanalytical assays. Biosensors. 12 (12), 1160 (2022).
- Mathur, L., Ballinger, M., Utharala, R., Merten, C. A. Microfluidics as an enabling technology for personalized cancer therapy. Small. 16 (9), e1904321 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유