Method Article
성장판 손상을 연구하기 위한 Tricolor Transgenic Murine 모델
요약
이 프로토콜은 청소년 뼈 성장판 손상에 대한 개선된 마우스 모델을 설명합니다. 성장판의 3개의 서로 다른 하층과 관련된 주요 매트릭스인 콜라겐 유형 I, II 및 X에 대한 삼계 형광 리포터가 있는 형질전환 마우스를 사용하여 현미경 아래의 기본 형광에 의해 손상 배치를 안내합니다.
초록
어린이의 뼈에 있는 연골 성장판은 사지를 늘릴 수 있지만 뼈에 비해 약하기 때문에 뼈에 과부하가 걸리면 골절되기 쉽습니다. 심하게 골절된 성장판에 대한 더 나은 치료가 필요한데, 부상에 대한 반응은 성장판을 조기에 융합시키는 뼈 다리와 같아서 발육이 부진하거나 구부러진 팔다리를 유발하기 때문입니다. 성장판 손상의 쥐 모델은 기계론적 연구에 유리하지만, 어린 쥐의 작은 성장판을 시각화하고 정확하게 손상시키기 어렵기 때문에 까다롭습니다. 여기에서는 콜라겐 유형 I, II 및 X에 대한 tri-lineage 형광 리포터와 함께 형질전환 마우스를 사용하여 개선된 성장판 손상 모델을 설명합니다.
이 마우스는 성장판의 3가지 주요 하부층과 관련된 기본 형광을 보여줍니다. Salter-Harris Type II 손상과 유사한 성장판 손상은 형광 실체 현미경 유도 하에 실시간 이미징 중에 성장 플레이트의 비대 부분을 기준으로 사용하는 bur로 재현성 있게 생성됩니다. 네이티브 형광의 동결 조직학 분석은 손상에 대한 세포 반응을 평가하는 것을 단순화합니다. 이 방법론은 성장판 손상 연구의 상당한 도약을 나타내며 병리학을 조사하고 새로운 치료 전략을 평가하기 위한 상세하고 재현 가능한 방법을 제공합니다.
서문
뼈성장판은 아동기와 청소년기에 장골의 종방향 성장에 중추적인 역할을 한다1. 긴 뼈의 끝에 위치한 성장판은 여러 구역으로 구성되어 있으며, 연골세포는 이 역동적인 성장 영역을 생성하고 유지하는 핵심 세포 구성 요소입니다. 성장판의 내연골 골화는 연골세포 증식, 비대, 세포자멸, 혈관 침범, 골전구세포 모집, 마지막으로 뼈 형성의 순차적인 진행을 통해 뼈를 늘리고 확장하는 것으로 발생한다2. 성장판은 뼈보다 상대적으로 부드럽기 때문에 스포츠나 기타 활동 중에 뼈에 과부하가 걸리면 골절에 매우 취약합니다. Salter-Harris 분류는 성장판 손상의 5가지 유형을 간략하게 설명합니다3. 성장판의 비후대와 인접한 하부 뼈 조직을 통한 II형 골절이 가장 흔하다4. 뼈 다리는 종종 비후대 또는 인접한 뼈의 손상에 대한 반응으로 형성되며, 인접한 긴 뼈 부분의 조기 융합을 유도한다5. 뼈 다리는 성장판의 정상적인 확장을 방해합니다. 현재로서는 골다리 형성에 대한 예방적 치료법이 없으며, 환자의 연령과 골다리 크기 및 위치에 따라 일부 치료가 이루어지지 않고 방치되고 있다6. 사지 기형이 심한 경우 수술 방법에는 제거 후 지방 또는 실리콘 고무와 같은 삽입 재료를 이식하거나 교정 절골술 및 뼈 연장 절차가 포함됩니다. 그러나 뼈가 굳은 다리는 여전히 개혁 될 수 있습니다6. 뼈 다리 형성을 예방하고 뼈 성장판 손상이 있는 어린이의 결과를 개선하기 위해서는 더 많은 연구가 필요합니다.
근본적인 메커니즘을 탐구하고 부상 후 성장판의 뼈 다리 손상을 예방하기 위한 새로운 전략을 개발하기 위해 여러 동물 모델이 확립되었습니다 7,8,9,10,11,12. 이러한 동물 모델은 근위 경골 성장판과 원위 대퇴골 성장판에 초점을 맞추는 경우가 많은데, 이는 일반적으로 인간의 부상이 발생하는 곳이라는 점을 감안할 때 주요 손상 부위입니다. 동물의 뼈 결손은 실제 골절 경로와 유사한 측면 접근 방식 또는 성장판의 중앙 드릴 구멍으로 이어지는 성장판 위 또는 아래에서 접근하는 방식으로 생성됩니다. 이전에 보고된 랫트 모델에서, 성장판 결손은 경골 중축의 피질 창을 통해 치아 버를 삽입하고 골수를 통해 무릎 관절을 향해 위쪽으로 드릴링하여 성장판 7,13을 중앙에 손상시킴으로써 생성된다. 대안적으로, 최근의 마우스 모델은 소구경 바늘을 이용한 측면 접근법을 사용하여 성장 플레이트(8)를 관통하는 평면 바늘 트랙을 생성한다. 널리 사용되는 랫트 모델에서, 결손은 과두(9,14) 사이의 관절 연골을 뚫음으로써 원위 대퇴골의 성장판에서 생성됩니다. 토끼와 양과 같은 더 큰 동물에서, 성장판 결손은 근위 경골과 원위 대퇴골에서 직접 측면으로 유도되었으며, 성장판에 구멍을 뚫거나 절단하거나 아래에서 접근하여 성장판의 가장자리를 변경하지 않고 중앙 결손을 생성함으로써 유발되었습니다 10,11,12,15.
성장판 손상에 대한 쥐 모델은 줄기세포 계통 추적 연구와 같은 유전자 변형 마우스로 수행할 수 있는 기계론적 연구에 유리하다8. 그러나 쥐 또는 쥐 동물 모델에서 중요한 과제는 성장판의 특정 하위 영역에 일관되고 정확한 손상을 입히는 것입니다. 성장판과 인접 뼈의 특정 부위의 손상은 Salter-Harris 분류에 의해 설명된 임상적으로 관련된 골절 경로 중 하나를 모방해야 합니다. 설치류 모델에서 현재까지의 도전은 주로 부상의 외과적 생성 중에 성장판의 하층을 식별할 수 있는 시각적 수단이 없기 때문입니다. 이 프로토콜은 콜라겐 I, II 및 X 형광 리포터(16,17,18)를 발현하는 삼중 형질전환 마우스를 활용하여 쥐 성장판의 표적 하층에서 성장판 결손을 생성하기 위한 정제된 기술을 설명합니다. 성장판의 각 1차 영역에서 이러한 콜라겐의 다양한 색상의 형광은 성장판 손상의 외과적 생성 중에 형광 실체 현미경으로 성장판의 다양한 부분을 시각적으로 구별할 수 있습니다. 이러한 형질전환 마우스의 사용은 부상당한 아이들과 유사한 발달 단계에 있는 어린 마우스에서 전례 없는 손상 정확도를 허용합니다.
프로토콜
연구는 기관 지침에 따라 수행되었습니다. 모든 동물 시술은 작업을 시작하기 전에 코네티컷 대학교 보건 센터 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았습니다. 프로토콜의 개요는 그림 1 회로도에 설명되어 있습니다.

그림 1: 삼색 콜라겐 리포터 마우스의 성장판 손상 프로토콜 개요. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 마우스 사육 및 수술 준비
- Col1a1-GFPTpz, Col2a1-CFP 및 Col10a1-mCherry 16,17,18,19,20,21을 발현하는 삼색 형질전환 콜라겐 리포터 마우스를 표준 사육 절차에 따라 번식시켜 2주령(± 1일)의 수술을 위한 새끼를 얻습니다. 형광 현미경으로 꼬리 끝 절편을 유전형 분석하여 삼중 전이유전자 발현을 확인합니다. 후속 조직학적 분석 중에 리포터 시스템의 이점을 극대화하기 위해 세 가지 색상 모두에 대해 양성인 마우스만 사용하십시오.
참고: 생후 2주(± 1일)의 이 연령은 뼈 성장판이 인간 청소년22세와 유사한 발달 단계에 있기 때문에 선택됩니다. 이 프로토콜은 생쥐의 남녀 모두에게 적용됩니다. - 수술 당일 또는 수술 하루 전날, 귀와 귀 펀치를 알코올 소독 패드로 소독한 후 이어 펀치를 사용하여 수술에 사용되는 각 마우스를 고유하게 식별하고 각 마우스의 무게를 측정하고 값을 기록합니다.
- 쥐가 이소플루란 마취의 영향을 받는 동안 전기 클리퍼로 오른쪽 뒷다리 전체를 면도합니다. 마우스의 마취를 유도하려면 이소플루란(2-3%)과 100% 산소의 혼합물을 사용하여 1-2L 유도 챔버 내에서 1L/min의 유속으로 투여합니다. 마우스를 제거하고 마우스가 움직이지 않도록 발가락 꼬집음으로 마취 깊이가 충분한지 확인합니다.
알림: 이 마취 깊이는 마취 노즈 콘 없이도 면도를 수행할 수 있을 만큼 충분히 오래 지속됩니다. - 26kV(800mA)의 전력 설정으로 X선 이미징을 사용하여 이소플루란 유도 마취 하에 있는 라이브 마우스의 경골 이미지를 캡처하여 초기 사지 길이를 기록합니다.
- 마우스를 X선 캐비닛에 넣기 전에 1-2L 유도 챔버 내에서 1L/min의 유속으로 투여되는 이소플루란(2-3%)과 100% 산소의 혼합물을 사용하여 깊은 마취 상태를 유도합니다.
- 마취된 쥐 3마리를 한 번에 평행하게 X-ray 캐비닛의 엎드린 위에 놓고 선반 높이로 놓으면 3마리의 쥐를 모두 포함하는 하나의 이미지를 얻을 수 있습니다. 경골 뼈가 마우스 아래로 가려지지 않도록 다리를 벌립니다. 측정 정확도를 높이려면 이미징 중에 마우스 근처에 방사선 불투과성 눈금을 배치하십시오(그림 2A).
- 준비된 마우스를 어미 마우스와 함께 하우징 케이지로 돌려 보내고 후속 수술 절차를 기다립니다.
2. 수술 용품 및 멸균 작업 영역 준비
- 10-20개의 거즈 패드, 솜 팁 어플리케이터 면봉, 치과용 버(직경 0.5mm), 치과용 핸드피스, Graefe 겸자, 곡선형 모기 지혈 겸자, 곡선형 미세 가위, 바늘 홀더, 치주 프로브 및 치아 클레오이드 원반형 조각기를 소독합니다.
- 부프레노르핀 주사 가능한 현탁액, 20G 바늘, 1mL 주사기, 수건 커튼, 5-0 염색되지 않은, 꼰, 코팅된, vicryl 봉합사, 포비돈-요오드, 인산염 완충 식염수, 알코올 소독 패드, #15 메스, 수술용 장갑, 환경 표면 장벽 튜브 삭스, 눈 윤활제, 70% 에탄올 스프레이. 수술 중 물품을 추가로 소독하기 위해 유리 구슬 소독기를 켜고 멸균된 침구가 있는 깨끗한 마우스 케이지 아래의 전기 가열 패드를 켭니다.
- 형광 실체현미경 스테이지, 인접 표면 및 수술 기구 스탠드를 70% 에탄올을 사용하여 청소하고 살균합니다. 수술 작업 공간이 될 이 부위를 멸균 수건 커튼으로 덮으십시오.
- 전자 고속 치과 드릴링 시스템을 조립합니다. 전자 풋 컨트롤러를 제어 장치에 연결하고 소독된 표면 차단 튜브 삭스로 핸드피스 코드를 덮습니다. 멸균 0.5mm 원형 치과용 버를 부착합니다. 컨트롤러를 켜고 구동 비율 1:1, 최대 30,000rpm으로 설정합니다.
- 형광 실체현미경 스테이지에서 소독된 표면 장벽 튜브 삭스로 덮인 노즈 콘으로 끝나는 유연한 이소플루란 기계 호스를 테이프로 고정합니다.
- 형광 실체현미경과 보조 장비의 전원을 켜고 이미지 획득 소프트웨어를 엽니다.
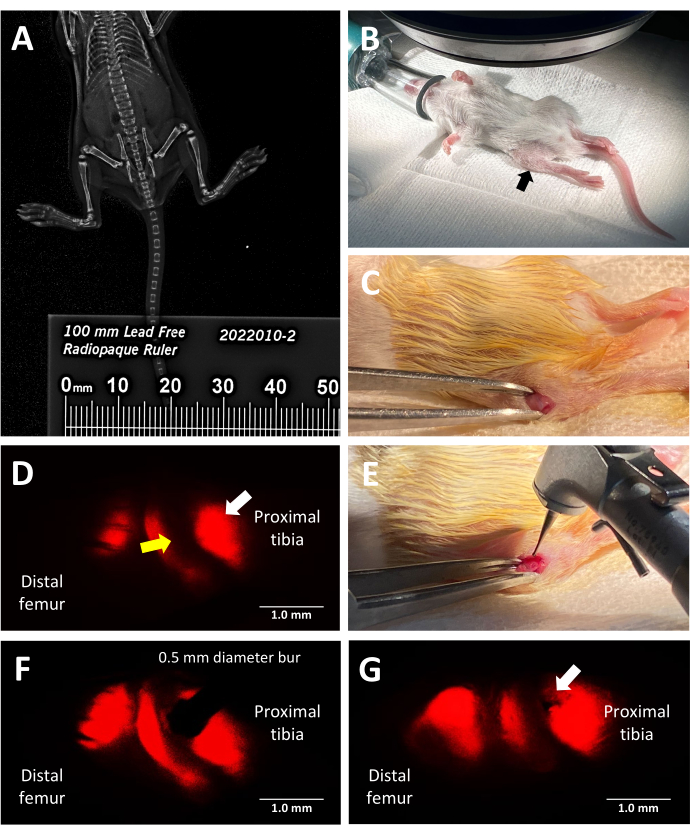
그림 2: trilineage fluorescent reporter murine growth plate injury procedure의 주요 단계. (A) X선 캐비닛의 마우스와 나란히 배치된 방사선 불투과성 자를 사용하여 팩스 X선 이미징으로 경골 길이를 측정합니다. (B) 형광 실체현미경으로 수술을 위해 마취된 마우스의 올바른 위치. 검은색 화살표로 표시된 근위 경골. (C) 성장판에 접근하기 위해 만들어진 절개의 예. (D) 성장판의 비대 영역을 조명하는 형광 입체 현미경(흰색 화살표). 인접한 증식 영역은 노란색 화살표로 표시됩니다. (E) 성장판에 0.5mm 치과용 버를 배치하는 외과의의 밝은 조명 조명. (F) 치과 버의 정확한 배치는 형광 입체 현미경에 의해 비대 영역으로 안내됩니다. (G) Salter-Harris Type II 유사 성장판 결손(흰색 화살표)의 예. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 근위 경골 성장판 손상 절차
- 이소플루란 마취실에서 마우스를 마취하고 이소플루란 농도를 2-3%로 조정하고 산소 유속을 1L/min으로 조정합니다. 발가락 꼬집기 검사와 호흡 패턴 관찰로 확인된 깊은 마취 상태의 유도를 기다립니다.
- 약실에서 마우스를 제거한 직후 처방된 용량의 절반의 부프레노르핀을 피하로 투여합니다. 부프레노르핀의 투여는 승인된 동물 프로토콜에 따릅니다.
- 수술 중 쥐의 눈이 건조해지는 것을 방지하기 위해 안구 윤활제를 바르고 쥐를 누운 자세로 실체현미경 스테이지의 이소플루란 기계 노즈 콘으로 옮깁니다(그림 2B). 콧방울을 통한 마취 흐름을 2%로 조정하고 산소 흐름을 1L/min으로 조정합니다.
- 오른쪽 뒷다리, 골반 부위, 왼쪽 뒷다리의 앞쪽, 꼬리를 포비돈-요오드로 순차적으로 소독한 후 70% 에탄올로 소독합니다.
- 수술 시작 전에 추가적인 발가락 꼬집기 검사와 호흡 패턴 관찰을 통해 마취 깊이가 지속적으로 안정적인지 확인합니다.
- 밝은 조명 아래에서 #15 메스를 사용하여 초기 길이가 약 5mm인 무릎 관절 바로 아래 피부를 절개하여 오른쪽 경골의 근위 끝을 드러냅니다(그림 2C). 필요한 경우 가위를 사용하여 절단을 확장하십시오. 왼쪽 반대측 경골을 다치지 않게 유지하여 내부 손상되지 않은 제어 장치 역할을 합니다.
- #15 메스의 뒷면을 사용하여 근위 경골의 위에 있는 근육을 통해 수직 둔부 절개를 수행하고 성장판이 명확하게 노출되도록 연조직을 제거합니다.
- 수술실 조명을 끄고 올바른 형광 채널을 선택하여 성장판의 원하는 영역을 비춥니다. 각 형광 콜라겐을 이미징하는 데 필요한 필터 세트는 Col 2 Cyan: ET436/20x(여기), ET480/40m(방출), Col 10mCherry: ET577/20x(여기), ET640/40m(방출), Col 1 Topaz: ET500/20x(여기), ET535/30m(방출)입니다. 마우스를 배치하여 근위 경골 성장판을 관찰합니다(그림 2D). 피부 개구부를 약간 더 근위부로 조정한 다음 원위부로 조정하여 대퇴골 성장판이 아닌 경골 성장판이 보이도록 합니다.
- 측면 접근 방식을 사용하여 비후성 성장판 영역의 중앙에 있는 경골 축과 평행한 0.5mm 치과 드릴 버를 배치하여 현미경 접안렌즈를 통해 보면서 Salter-Harris Type II와 같은 병변을 만듭니다(그림 2E,F). Salter-Harris Type II 병변을 모방한 결함을 재현성 있게 만들려면 bur entry pathway가 epiphysis로 각도를 이루지 않도록 사지를 작업 표면과 평행하게 유지하십시오. 드릴 페달에 압력을 가하여 버 회전을 시작하고 버를 성장판으로 부드럽게 눌러 결함이 버 직경보다 더 깊어지기 전에 멈춥니다(그림 2G).
알림: 마우스 팔다리를 안정화하는 데 도움이 되는 두 번째 손이 도움이 됩니다. - 이물질을 제거하기 위해 멸균 PBS 한 방울로 병변 부위를 세척합니다.
- 치주 프로브를 사용하여 0.5mm에서 결손 깊이를 확인합니다.
4. 부상 후 절차 및 폐쇄
- 시간 무결점 특성 분석을 위해 조직을 폐쇄하기 전에 손상된 뒷다리와 대조 다리를 채취합니다. 섹션 6의 후속 microcomputed tomography(microCT) 및 cryo-histology imaging을 위한 조직 채취 및 준비를 따릅니다.
참고: 성장판 결손에 치료 물질을 이식하는 실험의 경우, 결점 자체는 대략 구형이고 직경이 0.5mm 또는 부피가 0.082mm3(0.082μL)인 생체 재료 조각만 수용할 수 있습니다. - 현미경 시각화 하에 겸자를 사용하여 생체 재료를 삽입하거나 성장판 내의 결함에 액체 치료제를 주입합니다. 연구 설계에서 치료제가 결함에만 국한될 필요가 없는 경우 더 많은 양의 생체 재료 또는 주입된 물질을 사용하십시오.
- 피부 가장자리를 조심스럽게 재정렬하여 이식된 재료(있는 경우)가 결점 부위 내에 단단히 유지되도록 합니다.
- 피부 절개 부위를 효과적으로 봉합하기 위해 5-0 폴리글리콜산 봉합사와 함께 중단 봉합 기술을 사용합니다.
- 포비돈-요오드 잔류물이 있는 수술 부위 이외의 부위를 멸균수가 묻은 면봉을 사용하여 철저히 세척하고 상처 및 주변 부위에 닿지 않도록 주의하십시오.
- 현미경의 이소플루란 노즈 콘에서 마우스를 제거tage 회수 케이지로 옮기고 가열 패드 위의 새 침구 위에 측면으로 놓습니다.
- 약 5분 동안 쥐의 호흡수를 면밀히 관찰하고, 이소플루란 마취의 효과가 감소하고 호흡수가 증가하여 나타나는 것처럼 진통을 위해 남은 부프레노르핀 용량을 투여하지만 이동성이 시작되기 전에 투여합니다. 마우스가 완전한 보행 능력을 보일 때까지 격리된 회수 케이지에 유지한 후 어미 및 형제 자매와 재결합시킵니다.
- 수술 후 초기 48시간 동안 매일 검사를 실시한 후 안락사 시점까지 매주 평가를 실시합니다. 감염의 징후, 운동 효능, 음식에 대한 접근성 및 봉합사의 무결성에 중점을 둡니다.
- 표준 시간(즉, 생후 3주)에 쥐를 젖을 뗍니다.
5. 사지 길이 측정
- 실험적 가설 및 설계에 의해 결정된 시점을 기반으로 마우스를 이소플루란으로 마취하고 그림 2A 와 같고 섹션 1.4에 설명된 대로 손상된 경골과 손상되지 않은 경골의 전체 길이에 대한 X선 이미징을 수행합니다. 일관된 사지 길이 측정을 위한 적합한 랜드마크에는 그림 3과 같이 경골 골단(tibial epiphysis)의 상단과 경골 관절(tibiotalar joint)의 경골 말단부(distal end)가 포함됩니다.
참고: 이미징은 부상으로 인한 사지 길이와 사지 길이 불일치를 평가하는 데 사용되며, 수술 후 특정 간격으로 성장판 조직 내 뼈 브리지의 발달을 평가하는 데 사용됩니다.
6. 조직 절개, 고정, microCT 이미징 및 임베딩
- CO2 질식을 통해 마우스를 안락사시키며, 가급적이면 자궁경부 탈구와 같은 대체 방법으로 사망을 확인한 후 자동화된 CO2 유도 시스템을 사용하는 것이 좋습니다.
- 조직학 및 microCT 분석을 준비하기 위해 온전한 뒷다리를 모두 격리하고 뼈와 무릎 관절낭 영역에서 피부와 근육을 제거합니다.
- 뒷다리를 고정제에 넣기 전에 슬개골을 미세 절개 가위로 잘라내어 무릎강에 고정제가 쉽게 침투할 수 있도록 조심스럽게 절제합니다. 29G 인슐린 주사기를 사용하여 무릎강의 모든 부위에 차가운 10% 완충 포르말린을 완전히 분배합니다. 대퇴골과 경골의 골수 영역에 대한 고정 접근을 개선하기 위해 심증을 일으킵니다. 관절 조직을 거즈로 얇은 은못에 묶어 4 ° C에서 24-36 시간 동안 정착액 내에서 완전히 확장 된 위치로 유지하십시오.
주의: 포르말린은 독성이 있으므로 적절한 개인 보호 장비를 착용한 상태에서 흄 후드에서 취급해야 합니다.
- 뒷다리를 고정제에 넣기 전에 슬개골을 미세 절개 가위로 잘라내어 무릎강에 고정제가 쉽게 침투할 수 있도록 조심스럽게 절제합니다. 29G 인슐린 주사기를 사용하여 무릎강의 모든 부위에 차가운 10% 완충 포르말린을 완전히 분배합니다. 대퇴골과 경골의 골수 영역에 대한 고정 접근을 개선하기 위해 심증을 일으킵니다. 관절 조직을 거즈로 얇은 은못에 묶어 4 ° C에서 24-36 시간 동안 정착액 내에서 완전히 확장 된 위치로 유지하십시오.
- 4 °C에서 24-48 시간의 포르말린 고정 후, 뼈 다리 발달을 평가하기 위해 샘플을 PBS로 옮긴 후 microCT 이미징으로 반대쪽 및 손상 샘플의 고해상도 X-ray microCT를 수행합니다. 6.0 μm의 복셀 크기, 330,000 ms의 샘플 시간, 145 μA의 강도로 55,000 V의 에너지 설정을 사용합니다.
- microCT 이미징 및 4 ° C에서 24 시간의 포르말린 추가 고정 후 1X PBS에서 3 x 5 분 동안 샘플을 헹군 다음 1X PBS의 10 % 자당에 1 시간 동안, 1X PBS의 20 % 자당에 1 시간 동안, 1 시간 동안 30 % 자당에 밤새 담근다. 자당 용액으로 채워진 29G 인슐린 주사기를 사용하여 자당 용액이 모든 무릎 구멍 부위에 투과되도록 합니다. GFP 리포터 및 조직 효소 활성의 유지를 보장하기 위해 하룻밤 자당 침지 후 매립하지 않는 경우 -80 °C 냉동고로 옮깁니다.
- 삽입하기 전에 관절 부위에 남아 있는 근육 조직을 제거합니다. 하룻밤 동안 cryo-embedding medium으로 샘플을 평형화하여 medium이 무릎 구멍으로 쉽게 침투할 수 있도록 합니다.
- microCT 이미지를 보고 임베딩하기 전에 결손과 뼈 브리지의 위치를 확인합니다. cryo-embedding medium의 얇은 층을 cryomold에 적용하고 관심 영역이 embedding medium의 표면에 대해 90°를 향하도록 절개되고 여전히 연결된 경골/대퇴골/관절을 배치합니다.
참고: 이 방향을 사용하면 단면화가 측면으로 생성된 결함의 측면 보기를 캡처할 수 있습니다. 뼈 브리지가 결손의 가장자리 근처에 있는 경우 이 방향은 조직을 통해 취해진 첫 번째 두꺼운 부분 동안 관심 영역을 놓칠 가능성도 방지합니다. - 극저온 매립 매체가 응고되어 표본을 고정할 때까지 드라이오몰드를 드라이아이스 위에 놓습니다. 드라이 아이스 위에 유지하면서 cryomold를 매체로 계속 채우십시오.
- 표본을 고정한 후 드라이아이스로 냉각한 2-메틸-부탄에 크라이오몰드를 완전히 얼 때까지 담급니다. 냉동 후 과도한 2-메틸-부탄을 제거하고 극저온을 셀로판으로 싸서 -20°C 또는 -80°C에서 보관합니다.
알림: 극저온 매립 매체에서 1-2개월 이상 장기간 보관하려면 건조를 방지하기 위해 -80°C를 권장합니다. 테이프에 의한 극저절편 및 유리 슬라이드에 대한 단면의 접착은 앞서설명하였다 23.
7. 순차 이미징, 염색 및 재이미징
- 앞서 설명한 바와 같이 동일한 조직 섹션 내에서 여러 생물학적 신호의 검출 및 공동 국소화를 용이하게 하기 위해 이미징, 염색 및 재이미징의 순차적 절차를 구현합니다23. 특히 삼색 콜라겐 리포터 마우스의 성장판 절편의 경우 다음 단계를 수행하는 것이 좋습니다. 이 정렬된 접근 방식은 분자 신호와 구조적 세부 사항을 모두 포괄적으로 시각화합니다.
- 처음에는 첫 번째 이미징 라운드에서 3개의 콜라겐에 대한 내인성 형광 신호를 캡처합니다.
- 광물화된 조직23에 칼세인 블루 염색 및 이미지를 적용한 다음 주석산염 저항성 산 인산가수분해효소(TRAP) 효소 활성 염색 및 이미징23을 적용합니다.
참고: TRAP 효소 활성 염색 결과는 여기에 표시되지 않지만, 이 염색 단계는 대표 결과 섹션에 제시된 Safranin O/Fast Green 염색 결과 전에 미네랄 제거에 필수적이므로 수행됩니다. - 아래 설명된 대로 4',6-diamidino-2-phenylindole(DAPI) 핵 염색을 수행한 다음 이미지를 수행합니다.
- 사전 이미징을 거친 슬라이드를 1x PBS가 들어 있는 Coplin 병에 넣습니다. 커버슬립이 슬라이드에서 분리될 때까지 물에 담근 상태로 두십시오. 분리가 완료되면 커버슬립을 제거하고 완전히 말리십시오.
- 50% 글리세롤과 1x PBS의 혼합물에 DAPI를 1:1,000으로 희석하여 커버슬립에 DAPI 대조염색 용액을 바릅니다. 응용 프로그램 후 이미징 프로세스를 진행합니다.
- Safranin O/Fast Green 염색을 적용하여 조직 구조를 강조한 다음 이미지를 만드는 것으로 마무리합니다.
NOTE: 발색 이미지와 형광 신호의 상관 관계를 파악하기 위한 마지막 단계로 이 작업을 수행합니다.- Weigert의 철 헤마톡실린 용액을 준비합니다. 95% 에탄올 100mL에 헤마톡실린 1g을 용해시켜 용액 A를 제조하고 용액 B를 29% 염화철 용액 4mL, 탈이온수 95mL, 농축 HCl 1mL를 결합합니다. 용액 A와 B를 동일한 비율로 혼합하여 약 4주 동안 안정적인 Weigert의 작동 헤마톡실린 용액을 만듭니다.
- 슬라이드를 탈이온수에 2 x 2분 동안 담가 수분을 공급합니다.
- Weigert의 작용하는 헤마톡실린 용액을 5분 동안 바릅니다.
- 슬라이드를 수돗물로 5분 동안 세척한 다음 탈이온수에 1분 동안 잠시 세척합니다.
- 0.2% Fast Green 용액(탈이온수 0.2mL에 Fast Green FCF 100g)으로 2분 동안 염색합니다.
- 1% 아세트산으로 1분 동안 잠시 헹굽니다.
- 0.1% 사프라닌 O 용액(탈이온수 0.1mL에 사프라닌 O 100g)으로 1분 동안 염색합니다.
- 시각적으로 균형 잡힌 색상이 될 때까지 약 5분 동안 탈이온수로 헹굽니다.
- 탈이온수에 30% 글리세롤을 넣고 슬라이드를 장착하고(PBS 피) 조직에서 색상 확산을 방지하기 위해 즉시 이미징을 진행합니다. 성장판의 휴지 영역 세포를 강조하기 위해 Cy5 필터로 이미지를 전도합니다: ET640/30x(EX), ET690/50m(EM).
결과
이 프로토콜은 삼계통 형광 리포터 마우스를 사용하여 수술 지도를 위해 X형 콜라겐에서 방출되는 고유한 적색 형광을 활용하여 근위 경골의 측면 성장판 결손을 정밀하게 유도합니다. 외과의가 mCherry 필터 세트가 있는 실체현미경 접안렌즈를 통해 보는 동안 보이는 모습은 그림 2D에 나와 있습니다. 기본 X형 형광을 통해 외과의는 bur를 비대 영역에 배치하고 뼈 브리지로 이어지는 일반적인 유형의 성장판 손상을 모방한 부상을 생성할 수 있습니다(그림 2F). 적색 채널 아래의 형광이 가장 밝으므로 bur 배치 중에 사용하는 것이 좋습니다. 대안적으로, 실험의 목표가 비대 영역 및 인접한 석회화 영역보다 성장판의 다른 영역에 대한 손상을 연구하는 것이라면, 삼중 형질전환 마우스의 기본 형광의 다른 색상을 사용하여 결함 생성을 유도할 수 있습니다.
0.5mm 직경의 치과용 버를 사용하여 성장판의 비후대와 인접한 하부 뼈 조직에서 Salter-Harris Type II와 같은 결손의 생성은 N = 3 마우스의 손상되지 않은 측면 대조군과 비교하여 손상된(시간 0) 근위 경골의 microCT 및 냉동 조직학 이미징을 통해 검증되었습니다(그림 4). 결함은 3D microCT 이미지에서는 보기 어려웠지만 2D 단면에서는 감지할 수 있었습니다(그림 3A,B,E,F). 그림 3G는 I형 콜라겐 생성 뼈 세포(녹색 형광), II형 콜라겐 생성 증식성 연골세포(청록색 형광) 및 X형 콜라겐 생성 비대성 연골세포의 분포를 보여줍니다. 부상당한 쥐의 이미지(그림 4G)에서는 비대대(hypertrophic zone), 잠정적으로 석회화된 층, 그리고 증식 영역(proliferative zone)이 약간만 흐트러진 대조군에 비해 가장 최근에 형성된 뼈 중 일부가 파괴되어 있습니다. Safranin O/Fast Green 염색(그림 4H)은 모든 세포가 명확하게 보이기 때문에 손상된 성장판 내 결손의 위치를 가장 잘 보여줍니다.
X선 분석은 이러한 유형의 성장판 손상이 시간이 지남에 따라 경골 길이와 뼈 다리 형성에 미치는 영향에 대해 살아있는 쥐에 대한 통찰력을 제공합니다(그림 3). 수술 전과 수술 후 3주 동안 촬영한 비손상(그림 3A)과 부상(그림 3B) 경골을 비교 촬영한 결과, 사지 성장이 많이 진행되고 성장판이 얇아지며 3주에 손상된 성장판 부위에 뚜렷한 불투명 영역이 나타나는 것을 볼 수 있습니다. 성장판 내의 이러한 불투명도는 손상되지 않은 상대 개체나 수술 전의 마우스에서는 나타나지 않습니다. 따라서 Faxitron은 뼈 다리의 형성 및 사지 길이의 변화와 같은 살아있는 쥐의 부상으로 인한 병리학적 변화를 관찰하는 한 가지 방법입니다.
절개된 뼈의 MicroCT 영상은 수술 3주 후 손상된 성장판 내의 뼈 다리 형성을 자세히 시각화합니다 (그림 5). 그림 5에 표시된 6마리의 서로 다른 부상 마우스의 이미지에서 볼 수 있듯이, 모든 마우스에서 일관된 뼈 다리 발달이 있습니다. Scanco Medical 소프트웨어를 사용하여 근위 경골 성장판의 각 섹션을 검토하고 선택 도구로 뼈 브리지의 면적을 묘사한 다음 (그림 5B) 전체 성장판 부피에 걸쳐 각 절편 영역을 통합하여 총 부피24를 얻어 뼈 브리지 부피를 계산했습니다. 이 방법으로 계산 된 골격 브리지 부피는 0.0761 mm3 ± 0.0246 (평균 ± 표준 편차, N = 6)이었습니다. 대부분의 뼈 다리는 측면 접근에도 불구하고 성장판의 중앙 근처에 형성되며, 이는 성장판의 중심뿐만 아니라 바깥쪽 가장자리를 다치게 합니다. 이러한 현상은 골주위(perichondrium)가 아닌 골수(bone marrow)의 중간엽줄기세포(mesenchymal stem cells, MSCs)가 뼈 다리 형성을 담당한다는 사실에 기인할 수 있다25.
이러한 삼색 형질전환 마우스에서 손상된 성장판의 동결 조직학적 분석은 천연 콜라겐 형광에 의해 강화됩니다(그림 6). 이는 부상 부위에서 뼈 세포와 연골 세포의 복잡한 상호 작용을 보여줍니다. 그림 6J,K에 표시된 MicroCT 이미지는 임베딩 및 절편을 안내하기 위해 조직학 기술자에게 제공되었습니다. I형 콜라겐 생성 뼈 세포는 그림 6L,O,P(녹색 형광)에서 볼 수 있으며, II형 콜라겐 생성 증식 연골세포는 그림 6L,O,Q(청록색 형광)에서 볼 수 있습니다. X형 콜라겐 생성 비대성 연골세포는 그림 6L,O,R(적색 형광)에서 볼 수 있습니다. 이 다색 형광 접근법은 광물화된 조직을 배경으로 뼈 다리 영역 내에서 수술 후 연골 세포 분화를 자세히 검사할 수 있습니다. DAPI 염색을 사용하여 성장판 영역 내의 모든 세포 유형의 분포를 확인했습니다(그림 6M). Safranin O/Fast Green 염색은 손상된 성장판 내 연골과 뼈의 복합적이고 구조적인 조직을 보여줍니다(그림 6N). Cy5 필터 세트에서 이러한 염색된 부분을 이미징하면 골단골과 연골 사이의 계면에 있는 휴지 영역 세포가 눈에 띄게 밝아집니다.
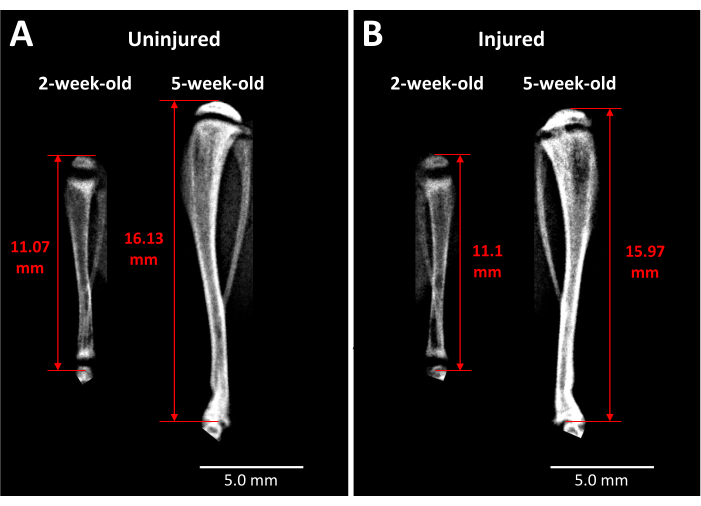
그림 3: 반대측 대조군과 손상된 쥐 경골의 X선 이미지. (A) 반대측 대조 경골의 X선 이미지는 생후 2주일 때 부상 직전과 생후 5주일 때 수술 후 3주에 촬영한 것으로, 이 기간 동안 발생하는 성장 정도를 보여줍니다. (B) (A)와 같은 시점에 동일한 마우스에서 손상된 경골. 경골 길이 측정에 사용되는 랜드마크는 근위 경골 머리의 정점에서 발목 관절의 경골 끝까지(빨간색 양두 화살표)입니다. 불투명한 뼈 브리지는 5주에 손상된 근위 경골 성장판에서 볼 수 있습니다. 축척 막대 = 5.00mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
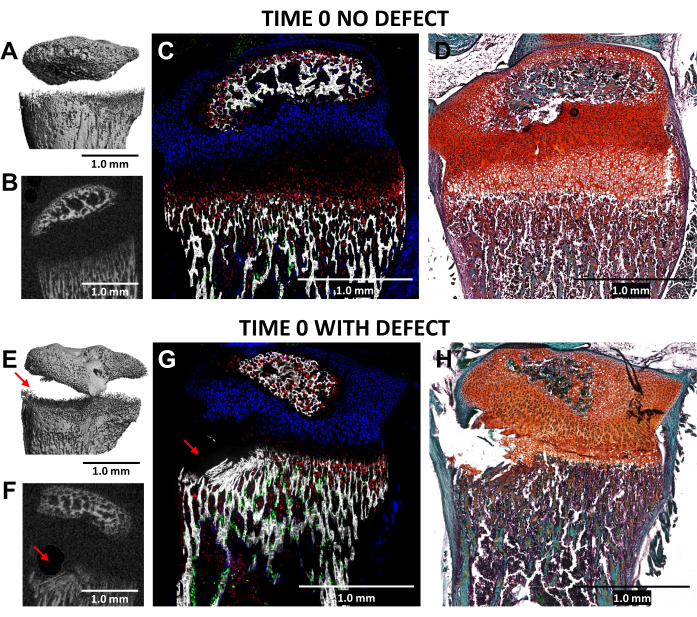
그림 4: Time Zero 반대측 대조군 및 손상된 마우스 근위 경골의 MicroCT 및 조직학적 이미지. (A,E) 및 (B,F)는 3D 및 횡방향 2D microCT 뷰를 나타내며 (E) 및 (F)에서 빨간색 화살표로 결함이 표시됩니다. (씨,지) 3개의 타고난 형광 층과 광물화된 조직 층을 병합한 복합 병합 cryo-histological image. 녹색 세포(Col3.6GFPtpz)는 I형 콜라겐 생성 뼈 세포, 청록색 세포(Col2A1GFPcyan)는 II형 콜라겐 생성 증식 연골 세포, 적혈구(Col10A1RFPchry)는 X형 콜라겐 생산 비대성 연골 세포입니다. (D,H) (C) 및 (G)와 동일한 영역의 Safranin O/Fast Green 염색. 축척 막대 = 1.0mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
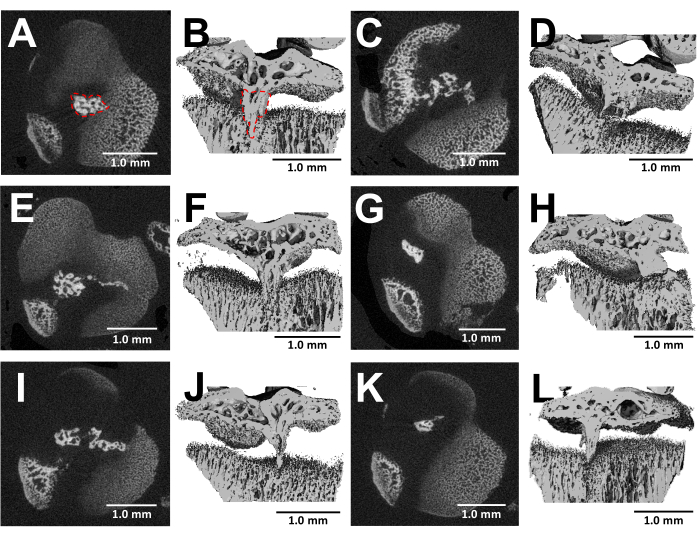
그림 5: 이 프로토콜에 의해 형성된 뼈 브리지의 MicroCT 이미지. (A,C,E,G,I,K) BUR 결손 생성 후 3주에 6마리의 다른 마우스의 근위 경골 성장판의 횡단 단면. (A)에서 빨간색 점선으로 윤곽선이 표시된 뼈 다리. (B,D,F,H,J,L) 세로 평면을 잘라낸 3D 재구성. (B)에서 빨간색 점선으로 윤곽선이 표시된 뼈 다리. 축척 막대 = 1.0mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
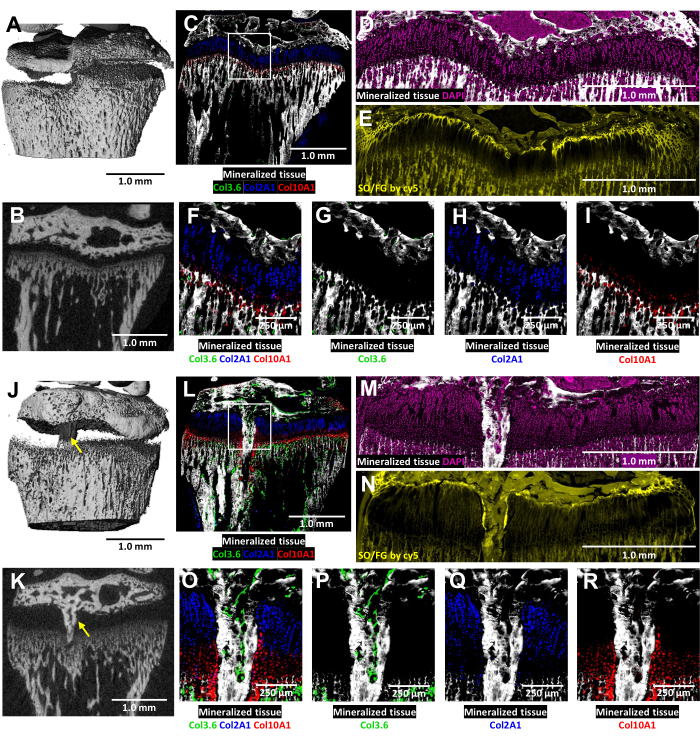
그림 6: 뼈 다리 형성이 있는 반대측 대조군 및 손상된 마우스 근위 경골의 MicroCT 및 조직학적 이미지. (A,J) 및 (B,K)는 3D 및 횡방향 2D microCT 뷰를 나타내며, (J)와 (K)에서 뼈 브리지는 노란색 화살표로 표시됩니다. (씨,엘) 3개의 타고난 형광 층과 광물화된 조직 층을 병합한 복합 병합 cryo-histological image. 녹색 세포(Col3.6GFPtpz)는 I형 콜라겐 생성 뼈 세포, 청록색 세포(Col2A1GFPcyan)는 II형 콜라겐 생성 증식 연골 세포, 적혈구(Col10A1RFPchry)는 X형 콜라겐 생산 비대성 연골 세포입니다. 흰색 상자는 패널 F 와 O에 표시된 더 높은 배율을 나타냅니다. (D,M) 패널 C 와 L의 성장판 영역에서 염색되는 광물화된 조직. (E,N) cy5 형광으로 스캔한 (D) 및 (M)과 동일한 영역의 Safranin O/Fast Green 염색. (에프,오) 패널 C 와 L의 병합된 이미지에서 성장판 영역의 더 높은 배율. (지-나,P-R) 천연 형광의 개별 채널은 광물화된 조직 배경으로 표시됩니다. 스케일 바 = 1.0mm(A-E) 및 (J-N), = 250μm(F-I) 및 (O-R). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
삼색 콜라겐 리포터 마우스의 혁신적인 사용은 미리 결정된 크기와 위치로 성장판 결손을 생성할 수 있게 하여 성장판 손상에 대한 쥐 실험 모델의 정확도를 크게 향상시킵니다. 생후 2주령 쥐의 작은 크기를 감안할 때, 사지가 약화되어 전층 골절이 발생하지 않도록 0.5mm의 작은 버를 사용하여 상처를 입히는 것이 중요합니다. 외과 의사는 또한 같은 이유로 뼈에 너무 깊게 구멍을 뚫지 않도록 결손을 만들 때 충분한 압력을 가해야 합니다. perioprobe의 사용은 일관된 부상 깊이를 확인하는 데 중요합니다.
여느 수술과 마찬가지로 적절한 마취 깊이를 확인하는 것이 중요하며, 가끔 발가락을 꼬집어 확인하고 무균 상태가 전체적으로 유지됩니다. 또 다른 중요한 외과적 요점은 조각가를 사용한 둔기 해부가 연조직 손상을 방지하고 마우스가 마취 회복 후 즉시 보행하여 영양과 편안함을 위해 어미 마우스에게 도달할 수 있도록 돕기 때문에 설명되었다는 것입니다. 우리의 경험에 따르면 봉합사로 봉합된 상처는 성공적으로 봉합된 상태로 유지되었으며 상처 클립이 필요하지 않습니다. 생후 2주에 생후 2주에 쥐를 대상으로 수술을 하는 것이 성장판 골절을 경험하는 어린 아이를 가장 잘 모방하기 위해 권장됩니다. 이 프로토콜의 한 가지 단점은 예측할 수 없는 출산의 특성을 감안할 때 이 마우스 모델을 사용하려면 단기간에 외과의가 사용할 수 있어야 한다는 것입니다.
결함을 생성하기 위한 bur의 위치와 관련하여, 프로토콜은 콜라겐 X 형광의 밝기 때문에 성장판 내의 비대 영역을 비추는 mCherry/Texas 적색 필터 세트를 사용하여 부상을 생성하는 방법을 설명합니다. 경골 성장판 내에 손상이 발생하도록 하려면 연조직 입구를 좌우로 약간 움직여 대퇴골이 아닌 근위 경골 성장판이 시야에 있는지 확인하는 것이 좋습니다. 증식성 연골세포 영역 또는 인접한 뼈 절편을 비추기 위해 필터 세트 채널 간 전환은 증식 연골 절편 및 인접 골 절편의 위치에 대한 정확한 배치를 확인하는 데 유용합니다.
증식성 연골 세포 영역과 epiphyseal 및 metaphyseal 뼈는 살아있는 마우스의 형광 현미경으로 구별 할 수 있지만 Type II 및 Type I 콜라겐 리포터의 실제 가치는 성장판의 조직 학적 분석 중에 실현됩니다. cryo-histological processes의 수성 특성을 감안할 때, 기존의 chromogenic dye precipitation protocol은 탈수 단계로 인한 형광 이미징과 색상의 잠재적인 불일치로 인해 적합하지 않습니다. 수성 프로토콜은 파라핀 절편에서와 유사한 염색 패턴을 생성하지만, 조직에서 염료가 확산되는 것을 방지하기 위해서는 신속한 염색 후 이미징이 필수적입니다. 증류수에 30% 글리세롤을 장착 매체로 사용하면 이러한 확산을 늦출 수 있으므로 Safranin O/Fast Green이 있는 연골을 포함하여 동일한 섹션에서 여러 발색 염색이 가능합니다.
내연골 골화 과정은 진화하는 뼈 다리를 감싸고 있는 붉은 연골세포와 함께 명확하게 볼 수 있습니다 (그림 6). 사용 가능한 많은 쥐 항체가 있는 면역조직화학 기술의 추가 사용은 이러한 형질전환 마우스에서 수행된 기계론적 연구를 더욱 향상시킬 수 있습니다. 이 형질전환 마우스 모델에서 팩스트론, 마이크로CT 및 냉동 조직학 이미징 기술의 조합은 성장판 손상에 대한 반응으로 발생하는 거시적 및 미시적 변화에 대한 포괄적인 이해를 제공하여 이러한 부작용을 완화하기 위한 향후 치료 개입을 위한 길을 닦습니다. 이러한 형질전환 마우스의 추가 유전자 조작을 수행하여 계통 추적 연구를 통해 시간적, 공간적으로 치유에 관여하는 세포의 기원을 이해할 수 있습니다. 추가 수정을 가한 쥐에 대한 실험은 성장판 근처의 연골과 뼈의 과잉 증식인 골연골종과 같은 연골 질환을 연구할 수 있게 해줍니다.
우리 모델의 일관성은 관절 연골 손상으로 인해 그룹에서 마우스를 버릴 필요 없이 모든 마우스에서 뼈 브리지의 재현 가능한 형성으로 입증됩니다. 이것은 성장판 아래의 피질 창에서 성장판에 접근하고 날카로운 도구나 굴을 성장판 쪽으로 위쪽으로 각도를 잡고 때때로 관절 연골로 오버슈트했던 이전 모델에 비해 개선된 것입니다. 관절 연골의 추가 손상은 어린이에서 일반적으로 발생하는 성장판 손상을 모방하지 않습니다. 이 동물 모델의 보다 정확한 손상은 실험당 필요한 마우스의 수를 줄이며 이는 또 다른 개선입니다. 형질전환 마우스를 사용하면 연구자는 관절 연골에 영향을 주지 않고 비대/임시로 석회화된 영역 또는 골단/휴식 영역/증식 영역 영역과 같은 성장판의 하위 섹션에 부상을 집중할 수 있습니다. 그러나 이 모델의 한계는 뼈 다리 부피의 변동성이며, 이는 부상당한 동물간에 최대 30%까지 차이가 날 수 있습니다. 결과적으로, 뼈 다리 형성에 대한 임상적으로 유의한 효과를 검출하기 위해서는 여전히 많은 수의 동물이 통계적 타당성을 달성해야 합니다.
7,9,10,14 이전에 발표된 랫트 또는 토끼 성장판 손상 모델과 비교하여 여기에 설명된 마우스 모델에 대한 이점에는 사용된 동물의 수 감소, 비용 절감, 재현 가능한 뼈 막대 형성으로 인한 효율적인 복제 크기, 더 짧은 연구 시간 프레임 및 삼중 형질전환 마우스의 실시간 이미징으로 인한 보다 정확한 손상 배치가 포함됩니다. 자세히 논의되지는 않았지만 이 마우스 모델은 조직 공학 임플란트 또는 성장 인자를 전달하는 생체 재료를 테스트하는 데 사용할 수 있습니다. 이 쥐 방법의 주목할만한 한계는 치료 약물 또는 세포를 전달하는 데 사용되는 임플란트의 크기가 대략 0.5mm 직경의 구의 결함 부피로 제한된다는 것입니다. 더 큰 동물 모델만이 인간 환자에게 사용될 수 있는 테스트 물질의 양을 수용할 수 있습니다. 이 프로토콜에서 생성된 bur 결함은 얇은 골절과 동일한 기하학적 구조가 아니므로 실제 인체 부상과 다릅니다. 그럼에도 불구하고 이 마우스 모델의 이점은 많으며 측면 접근 방식은 경골 장축을 따라 성장판 위 또는 아래에 맹목적으로 접근할 때 발생하는 관절 연골의 손상을 방지합니다. 이 방법론은 성장판 손상 연구의 상당한 도약을 나타내며 병리학을 조사하고 새로운 치료 전략을 평가하기 위한 상세하고 재현 가능한 방법을 제공합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health), 국립관절염 및 근골격계 및 피부질환 연구소(National Institute of Arthritis and Musculoskeletal and Skin Diseases, NIAMS) 1R21AR079153의 보조금과 코네티컷 대학교 연구 향상 프로그램(University of Connecticut Research Enhancement Program, REP)의 보조금으로 지원되었습니다. 저자들은 코네티컷 대학교 MicroCT 이미징 코어 시설의 Renata Rydzik의 도움에 감사를 표하고자 합니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-methyl-butane | Sigma Aldrich | M32631 | |
| Alcohol antiseptic pads | Acme United Corporation | H305-200 | |
| Axio Scan.Z1 | Carl Zeiss AG | Axio Scan.Z1 | |
| AxioVision software | Carl Zeiss AG | ||
| Betadine solution (10% povidone-iodine) | Avrio Health L.P. | 67618-150-01 | |
| Calcein | Sigma Aldrich | C0875 | |
| Calcein Blue | Sigma Aldrich | M1255 | |
| CFP filter set | Chroma Technology Corp. | 49001 | |
| Cryomatrix | Thermo Scientific | 6769006 | |
| Cryomolds | Fisher Scientific | Fisherbrand #22-363-554 | |
| Cryostat | Leica Biosystems | 3050s | |
| Cryostat blades | Thermo Scientific | 3051835 | |
| Cryotape | Section Lab | Cryofilm 2C | |
| Curved fine scissor | Fine Science Tools | 14061-11 | |
| Curved mosquito hemostatic forceps | HuFriedyGroup | H3 | |
| cy5 filter set | Chroma Technology Corp. | 49009 | |
| DAPI | ThermoFisher Scientific | 62247 | |
| DAPI filter set | Chroma Technology Corp. | 49000 | |
| Dental bur (0.5 mm diameter) | |||
| Dental cleoid discoid carver | ACE Surgical Supply Inc. | 6200097A-EA | |
| Dry glass bead sterilizer (Inotech Steri 350) | Inotech Bioscience, LLC | IS-250 | |
| Ear punch | Fine Science Tools | 24212-01 | |
| Electric heating pad | |||
| Electronic foot control | Nouvag AG | 1866nou | |
| Electronic motors 31 ESS | Nouvag AG | 2063nou | |
| Environmental surface barrier (3 x 12 inch tube sox) | Patterson Companies, Inc. | BB-0312H | |
| Ethanol (70%) | |||
| Ethiqa XR (buprenorphine extended-release injectable suspension) 1.3 mg/mL | Fidelis Animal Health | 86084-100-30 | |
| Faxitron x-ray cabinet | Kubtech Scientific | Parameter | |
| Fluorescence Stereomicroscope | Carl Zeiss AG | Lumar V12 | |
| GFP filter set | Chroma Technology Corp. | 49020 | |
| Glacial acetic acid | Sigma Aldrich | ARK2183 | |
| Glass microscope slides | Thermo Scientific | 3051 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Graefe forceps | Fine Science Tools | 11051-10 | |
| Handpiece (contra angle 32:1 push button) | Nouvag AG | 5201 | |
| Implantology/oral surgery system control unit (Straumann) | Nouvag AG | SEM | |
| Instant sealing sterilization pouch with dual internal/external process indicators (3 1/2 x 5 1/4 inch) | Fisher Scientific | 01-812-50 | |
| Instant sealing sterilization pouch with dual internal/external process indicators (5 4/1 x 10 inch) | Fisher Scientific | 01-812-54 | |
| Insulin syringe (29 G) | Exel International | 26028 | |
| Isoflurane | Dechra Pharmaceuticals plc | 17033-091-25 | |
| Isoflurane anesthetic system | |||
| mCherry filter set | Chroma Technology Corp. | 39010 | |
| Micro-dissecting scissor | Fine Science Tools | 14084-08 | |
| NaHCO3 | Sigma Aldrich | S5761 | |
| Needle (20 G) | Becton, Dickinson and Company | 305178 | |
| Needle holder | HuFriedyGroup | NHCW | |
| Neutral buffered formalin (10%) | Sigma Aldrich | HT501128-4L | |
| Non-sterile applicator swabs | Allegro Industries | 205 | |
| Non-woven gauze (3 x 3 inch) | Fisher Scientific | 22028560 | |
| Norland Optical Adhesive, 61 | Norland Optical | Norland Optical Adhesive, 61 | |
| Ophthalmic ointment (Optixcare eye lube) | CLC Medica | ||
| PBS | Sigma Aldrich | P5368 | |
| Periodontal probe | HuFriedyGroup | PQW | |
| Phosphate buffered saline (PBS) pH 7.4 (1x) | Gibco, by Life Technologies | 10-010-023 | |
| Plastic microscope slides | Electron Microscopy Sciences | 71890-01 | |
| Professional clipper/trimmer (Wahl Classic Peanut) | Wahl Clipper Corporation | 8685 | |
| Roller | Electron Microscopy Sciences | 62800-46 | |
| Scanco Medical software | SCANCO Medical | Scanco μCT 50 | |
| Sodium acetate anhydrous | Sigma Aldrich | S2889 | |
| Sodium nitrite | Sigma Aldrich | S2252 | |
| Sodium tartrate dibasic dihydrate | Sigma Aldrich | T6521 | |
| Specimen disc | Leica Biosystems | 14037008587 | |
| Stainless steel #15 surgical blade | Aspen Surgical Products, Inc. | 371615 | |
| Sterile surgical gloves | Cardinal Health, Inc. | 2D72PT65X | |
| Sterile towel drape (18 x 26 inch) | IMCO | 4410-IMC | |
| Sucrose | Sigma Aldrich | S9378 | |
| Syringe (1 mL) | Becton, Dickinson and Company | 309659 | |
| Undyed braided coated vicryl suture (5-0) | Ethicon Inc. | J490G | |
| UV black light | General Electric | F15T8-BLB |
참고문헌
- Iannotti, J. P. Growth plate physiology and pathology. Orthop Clin North Am. 21 (1), 1-17 (1990).
- Chung, R., Foster, B. K., Xian, C. J. Injury responses and repair mechanisms of the injured growth plate. Front Biosci (Schol Ed). 3 (1), 117-125 (2011).
- Salter, R. B., Harris, W. R. Injuries involving the epiphyseal plate. JBJS. 45 (3), 587-622 (1963).
- Cepela, D. J., Tartaglione, J. P., Dooley, T. P., Patel, P. N. Classifications in brief: Salter-harris classification of pediatric physeal fractures. Clin Orthop Relat Res. 474 (11), 2531-2537 (2016).
- Macsai, C. E., Hopwood, B., Chung, R., Foster, B. K., Xian, C. J. Structural and molecular analyses of bone bridge formation within the growth plate injury site and cartilage degeneration at the adjacent uninjured. Bone. 49 (4), 904-912 (2011).
- Shaw, N., et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev. 24 (2), 85-97 (2018).
- Xian, C. J., Zhou, F. H., Mccarty, R. C., Foster, B. K. Intramembranous ossification mechanism for bone bridge formation at the growth plate cartilage injury site. J Orthop Res. 22 (2), 417-426 (2004).
- Muruganandan, S., et al. A foxa2+ long-term stem cell population is necessary for growth plate cartilage regeneration after injury. Nat Commun. 13 (1), 2515 (2022).
- Coleman, R. M., et al. Characterization of a small animal growth plate injury model using microcomputed tomography. Bone. 46 (6), 1555-1563 (2010).
- Lee, E. H., Gao, G. X., Bose, K. Management of partial growth arrest: Physis, fat, or silastic. J Pediatr Orthop. 13 (3), 368-372 (1993).
- Planka, L., et al. Nanotechnology and mesenchymal stem cells with chondrocytes in prevention of partial growth plate arrest in pigs. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 156 (2), 128-134 (2012).
- Foster, B. K., et al. Reimplantation of growth plate chondrocytes into growth plate defects in sheep. J Orthop Res. 8 (4), 555-564 (1990).
- Erickson, C. B., et al. A rat tibial growth plate injury model to characterize repair mechanisms and evaluate growth plate regeneration strategies. J Vis Exp. (125), (2017).
- Coleman, R. M., Schwartz, Z., Boyan, B. D., Guldberg, R. E. The therapeutic effect of bone marrow-derived stem cell implantation after epiphyseal plate injury is abrogated by chondrogenic predifferentiation. Tissue Eng Part A. 19 (3-4), 475-483 (2013).
- Mccarty, R. C., Xian, C. J., Gronthos, S., Zannettino, A. C., Foster, B. K. Application of autologous bone marrow derived mesenchymal stem cells to an ovine model of growth plate cartilage injury. Open Orthop J. 4, 204-210 (2010).
- Chen, J., et al. Isolation and characterization of murine mandibular condylar cartilage cell populations. Cells Tissues Organs. 195 (3), 232-243 (2012).
- Clearfield, D. S., Xin, X., Yadav, S., Rowe, D. W., Wei, M. Osteochondral differentiation of fluorescent multireporter cells on zonally-organized biomaterials. Tissue Eng Part A. 25 (5-6), 468-486 (2019).
- Dyment, N. A., et al. Response of knee fibrocartilage to joint destabilization. Osteoarthritis Cartilage. 23 (6), 996-1006 (2015).
- Kalajzic, I., et al. Use of type i collagen green fluorescent protein transgenes to identify subpopulations of cells at different stages of the osteoblast lineage. J Bone Miner Res. 17 (1), 15-25 (2002).
- Maye, P., et al. Generation and characterization of col10a1-mcherry reporter mice. Genesis. 49 (5), 410-418 (2011).
- Chokalingam, K., et al. Three-dimensional in vitro effects of compression and time in culture on aggregate modulus and on gene expression and protein content of collagen type ii in murine chondrocytes. Tissue Eng Part A. 15 (10), 2807-2816 (2009).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sci. 152, 244-248 (2016).
- Dyment, N. A., et al. High-throughput, multi-image cryohistology of mineralized tissues. J Vis Exp. (115), (2016).
- Chavez, M. B., et al. Guidelines for micro-computed tomography analysis of rodent dentoalveolar tissues. JBMR Plus. 5 (3), e10474 (2021).
- Chung, R., Xian, C. J. Recent research on the growth plate: Mechanisms for growth plate injury repair and potential cell-based therapies for regeneration. J Mol Endocrinol. 53 (1), T45-T61 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유