쥐에서 정중선 개복술을 통한 가역적 내장 동맥 허혈, 정맥 울혈 및 결합 관류 장애 제어
요약
이 기사에서는 쥐 모델에서 내장 장기의 통제되고 가역적인 과관류를 위한 표준화된 절차를 소개합니다. 목표는 높은 수준의 방법론적 확실성과 통제력으로 이러한 관류 불량 상태를 유도하는 동시에 기술적 단순성과 오류 복원력을 유지하는 것입니다.
초록
패혈증 및 악성 종양 외에도 관류 불량은 조직 저하의 세 번째 주요 원인이며 다양한 의료 및 외과 질환의 주요 발병 기전입니다. 우회 수술, 혈관 내 시술, 체외 막 산소 공급 및 인공 혈액 대체와 같은 중요한 발전에도 불구하고 조직 관류, 특히 내장 장기의 관류는 환자 치료에서 시급한 문제로 남아 있습니다. 생물 의학 과정 및 가능한 중재에 대한 추가 연구에 대한 수요가 높습니다. 유효한 생물학적 모델은 이러한 종류의 연구를 가능하게 하는 데 가장 중요합니다. 세포 생물학뿐만 아니라 혈관 미세해부학 및 유변학을 포함하는 조직 관류 연구의 다요인 측면으로 인해 적절한 모델은 동물 모델만이 제공할 수 있는 어느 정도의 생물학적 복잡성을 필요로 하며, 설치류는 명백한 선택 모델입니다. 조직 관류 불량은 (1) 고립성 동맥 허혈, (2) 고립성 정맥 울혈, (3) 복합 관류 장애의 세 가지 뚜렷한 상태로 구별할 수 있습니다. 이 논문은 쥐의 복부 대동맥 및 기갑 정맥의 정중선 개복술 및 클램핑을 통해 이러한 세 가지 유형의 내장 관류 부전증의 제어 및 가역적 유도를 위한 자세한 단계별 프로토콜을 제시하고 균일하고 신뢰할 수 있는 결과를 보장하기 위한 정밀한 수술 방법론의 중요성을 강조합니다. 이 모델의 가능한 응용 사례로는 위장관, 부인과 및 비뇨기과 장기의 관류 불량을 객관적으로 시각화하고 구별하기 위한 HSI(Hyperspectral Imaging)와 같은 혁신적인 수술 중 이미징 양식의 개발 및 검증이 있습니다.
서문
국소 또는 전신 조직 관류 불량 상태의 형태로 조직 관류 박탈의 의미는 오랫동안 인식되어 왔지만, 이는 미국과 유럽 모두에서 이환율 및 사망률의 주요 원인 중 하나로 지속되고 있습니다1. 이러한 관류 불량 상태는 악성 종양과 패혈성 염증에 이어 조직 저하의 세 번째 주요 원인이지만, 후자의 두 가지에 비해 훨씬 더 넓은 기원 스펙트럼을 가지고 있습니다2.
이 스펙트럼은 혈전색전폐색을 동반한 심방세동, 혈관 수축, 의인성 또는 외상성 박리와 같은 국소적 기전부터 심부전 또는 쇼크, 패혈증, 저혈량혈증 및 도루 현상과 같은 전신 기전에 이르기까지 다양합니다. 이러한 다양한 메커니즘은 다양한 의료 및 외과 질환의 기초가 됩니다. 이러한 질환과 관련된 심각한 이환율과 사망률로 인해 수십 년 동안 괴사를 예방하고 장기 기능을 회복하기 위해 관류 불량 조직으로의 혈류를 복원하는 절차에 대한 의학적 관심이 높아졌습니다3.
이러한 연구 노력은 우회 수술4, 혈관 내 시술5, 체외막산소화6,7, 이식 중 장기 기계 관류8, 인공 혈액 대체물9의 발전을 포함하여 생리적 장기 관류를 복원하기 위한 다양한 제약, 의료 및 수술 솔루션으로 이어졌습니다.
그러나 이러한 중요한 발전에도 불구하고 특히 내장 장기의 관류 불량은 환자 치료에서 시급한 문제로 남아 있으며 생물 의학 과정 및 구조 전략에 대한 추가 연구에 대한 수요가 높습니다. 유효한 생물학적 모델은 이러한 종류의 연구를 가능하게 하는 데 가장 중요합니다. 세포 생물학뿐만 아니라 혈관 미세해부학 및 유변학을 포함하는 조직 관류 연구의 다요인 측면으로 인해 적절한 모델에는 완전한 모델 유기체만이 제공할 수 있는 정도의 생물학적 복잡성이 필요하므로 설치류는 명백한 선택 모델입니다.
조직 관류 장애는 고립성 동맥 허혈, 고립성 정맥 울혈, 복합 관류 장애의 세 가지 조건으로 구분할 수 있다10. 이러한 상태에 대한 임상적으로 관련된 시나리오는 다음과 같습니다: 동맥 허혈: 혈전 색전증을 동반한 심방세동, 패혈성 색전증, 혈관 수축, 의인성 또는 외상성 혈관 박리 또는 클램핑, 심장 기능 부전 또는 쇼크, 대동맥 박리, 패혈증 및 저혈량혈증, 외부 수축으로 인한 극심한 동맥 폐쇄, 폐동맥 색전증, 만성 동맥 혈관 폐색 질환 또는 스틸 현상; (2) 정맥 울혈 : 의인성 또는 외상성 혈관 박리 또는 클램핑, 심부전, 간 섬유증 또는 간경변, 외부 수축으로 인한 정맥 폐쇄, 정맥 혈전증, 정맥 부전 및 Budd-Chiari 증후군; (3) 복합 관류: 허혈성 염증(예: 허혈성 대장염)과 같은 특정 장기 상태뿐만 아니라 허혈성 섬유증으로 인한 이차성 정맥 울혈 또는 울혈로 인한 이차성 동맥 허혈과 같은 위와 앞서 언급한 상태의 진행된 단계의 조합11,12.
따라서 이 논문은 그림 1과 같이 생존 및 비생존 응용 프로그램 모두를 위해 쥐에서 정중선 개복술을 통한 통제되고 가역적인 내장 동맥 허혈, 정맥 울혈 및 복합 관류를 유도하기 위한 단계별 모델을 제공하는 것을 목표로 합니다. 실험 모델은 동맥 허혈, 정맥 울혈 및 이들의 결합된 후유증의 다면적 역학을 연구하기 위한 통제된 환경을 제공하며, 다양한 조건에서 발생하는 임상적으로 관련된 시나리오를 모방합니다.
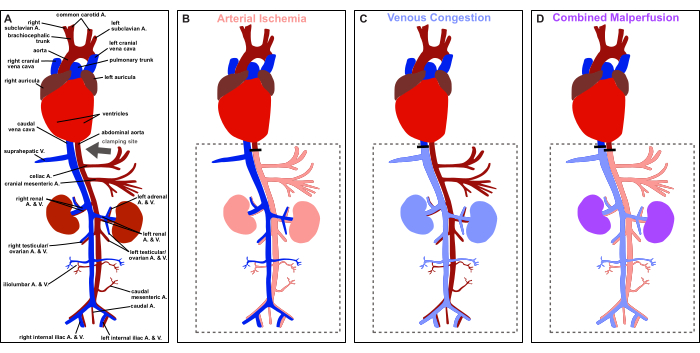
그림 1: 프로토콜 개요. 혈관 쥐의 해부학적 구조와 클램핑 부위의 묘사(회색 화살표)의 개략도. (A) 생리적 관류. (B) 동맥 허혈. (C) 정맥 울혈. (D) 복합 관류 부전. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
여기에 설명된 모든 동물 활동은 공인된 시설에서 수행되었으며 독일 카를스루에에 있는 바덴-뷔르템베르크 지역 위원회의 기관 동물 보호 및 사용 위원회(IACUC)의 승인을 받았습니다(35-9185.81/G-62/23). 실험동물은 제도적 기준, 동물사용 및 관리에 관한 독일법, 유럽공동체이사회(European Community Council, 2010/63/EU) 및 ARRIVE 가이드라인에 따라 관리되었다. 주문 중량이 400g인 수컷 Sprague Dawley 쥐를 일주일 동안 적응시킨 후 사용했습니다. 이 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 마취와 진통
- 기관 프로토콜에 따라 약물로 쥐를 마취하십시오. 이소플루란은 진정 유도 후 체중 100mg/kg 케타민과 체중 4mg/kg 자일라진의 i.p. 주사에 권장됩니다. 추가 진통은 5 mg/kg 체중 carprofen의 s.c. 주사로 달성될 수 있습니다. 자세한 내용은 Studier-Fischer et al.13을 참조하십시오.
- 눈의 건조를 방지하기 위해 안과 연고를 눈에 바르십시오.
- 수술용 집게를 사용한 발가락 꼬집 테스트를 사용하여 적절한 항문 깊이를 보장합니다.
- 수술 중 마취 깊이를 정기적으로 재평가하고 조정하십시오.
2. 절차 준비
- 분리 가능한 미세혈관 cl을 포함하여 필요한 모든 재료와 기구로 스크럽 테이블을 준비합니다.amps 및 애플리케이터(그림 2A-C), 뭉툭한 오버홀트 clamp, 미세 준비 가위 및 집게.
- 캐뉼라를 팁에서 1cm, 135° 각도로 접어 수술 준비 고리를 준비하고 수술용 모기 클램프를 사용하여 장력을 가할 준비가 된 Luer-lock을 통해 플라스틱 관류관에 연결합니다(그림 2D,E).
- Studier-Fischer et al.13에 명시된 대로 Y자형 고정 막대 및 가열 패드를 포함한 설치류 수술 노출 장치를 준비합니다.
- 신생아용 안면 마스크를 사용하여 100% 산소를 흡입 하여 적절한 산소 공급이 이루어지는지 확인합니다(그림 2F).
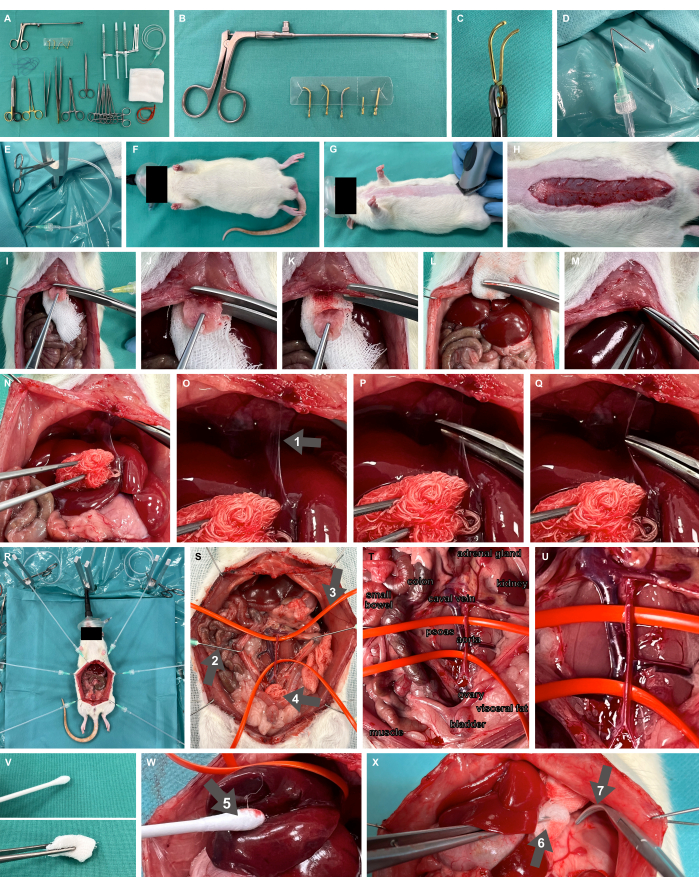
그림 2: 실험 및 동물 설정. (A) 필요한 수술 기구 및 재료. (나,씨) 분리 가능한 미세혈관 클램프 및 애플리케이터. (D,E) 관류관에 연결된 접힌 캐뉼러는 수술 준비 고리로 사용됩니다. (에프,지) 안면 마스크로 산소를 공급하고 면도한 쥐 모델. (H) 전체 복부 길이에 걸친 피부 절개. (I-M) xiphoid 절제 및 지혈. (N-Q) 팔시폼 인대의 간 동원 및 박리(화살표 1). (R) 개복술 후 장기의 노출을 나타내는 준비 후크 및 금속 스탠드의 적용. (S) 뭉툭한 갈고리(화살표 2), 실리콘 혈관 고리(화살표 3), 수술용 압박(화살표 4)을 사용하여 복부 주요 혈관을 완전히 내장 노출. (티,유) 복부 대동맥 및 기갑 정맥. (V) 비외상성 준비 도구. (W) 가습 면 교체(화살표 5). (X) 겸자(화살표 6) 및 뭉툭한 오버홀트 클램프(화살표 7)의 가습 압축. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 수술 준비
- 정중선 개복술을 위해 수술 접근 부위를 면도합니다(그림 2G). 원하는 복부 길이, 즉 약 7cm(그림 2H)에 걸쳐 피부 절개를 수행하고, 근막을 절개하여 개복술을 진행하고, 부착된 플라스틱 튜브와 수술용 모기 클램프가 있는 수술 준비 고리를 피부를 통해 꿰매십시오. 수술 준비 고리를 사용하여 수술 부위를 노출시키고 조직에 장력을 가합니다.
- 복막은 흉골 시작 부분에서 몇 밀리미터 아래까지만 두개골로 절제하고 복막의 일부는 그대로 두십시오. 흉골 아래에 수술용 압박의 일부를 놓고 (그림 2I) 강력한 재료 가위로 xiphoids를 절제합니다. 관류가 잘 된 이 부위의 충분한 지혈을 달성하기 위해 외과적 압박술을 사용하여 절제 부위에 압력을 가합니다(그림 2I-M).
- 간을 배꼬리로 동원하여 팔시형 인대를 노출시키고(그림 2N) 인대를 절개합니다(그림 2O-Q).
- 지혈 조절을 위해 주요 혈관의 클램핑을 수행해야 하는 위치에 따라 복부 주요 혈관(그림 2R)과 실리콘 혈관 고리로 매달린 혈관(그림 2S-U)을 완전히 내장 노출을 수행합니다. 가습 면봉(그림 2W), 겸자의 가습 압박 및 뭉툭한 오버홀트 클램프(그림 2X)와 같은 비외상성 준비 도구(그림 2V)만 사용해야 합니다.
4. 동맥 허혈에 대한 복부 대동맥의 준비 및 클램핑
- 좌측 부신 동맥에 접근하기 위해 비외상성 준비 도구를 사용하여 상복부 장기의 좌측 내측화를 수행합니다(그림 3A-D).
- 일반적으로 왼쪽 부신 동맥의 두개골 확장 내측에 있는 맥동 부위를 식별하여 대동맥의 경과를 나타냅니다(그림 3E). 복부 대동맥에 접근하기 위해 둔부 박리를 위한 오버홀트 클램프를 사용하여 연조직을 통해 전진합니다(그림 3F,G).
- 뭉툭한 오버홀트 클램프(그림 3H-L)를 사용하여 복부 대동맥을 가장 두개골 끝에서 터널링하고 실리콘 혈관 고리(그림 3M-T)를 사용하여 대동맥을 슬링합니다.
- 실리콘 루프를 사용하여 적절한 동맥류 미세혈관 클램프를 적용하여 대동맥을 복부로 약간 탈구시키고 동맥류 미세혈관 클램프를 실리콘 루프를 따라 안내하여 격리된 대동맥 클램핑을 보장합니다(그림 3U). 연구 질문에 따라 미세혈관 클램프가 다시 해제될 수 있습니다.
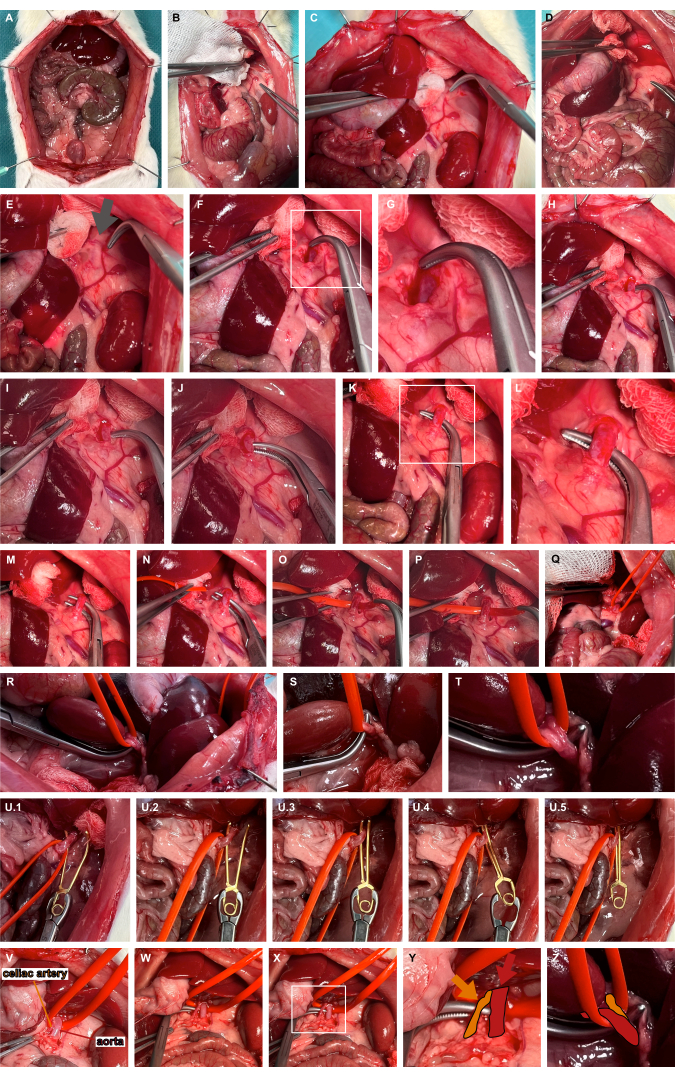
그림 3: 복부 대동맥의 준비 및 클램핑. (A) 내장 장기의 노출. (B-E) 좌측 부신 동맥에 접근하기 위해 비외상성 준비 도구를 사용하는 상복부 장기의 좌측 내측화. (에프,지) 복부 대동맥에 접근하기 위해 맥동 부위(회색 화살표)에서 왼쪽 부신 동맥의 내측을 둔하게 절개합니다. (H-L) 뭉툭한 오버홀트 클램프를 사용한 복부 대동맥 터널링. (엠티) 실리콘 혈관 고리를 사용하여 대동맥을 슬링합니다. (U) 실리콘 루프를 지침으로 사용하여 이완 가능한 동맥류 미세혈관 클램프를 적용합니다. (V-Z) 대동맥(빨간색)과 실리콘 혈관 루프를 기준으로 한 셀리악 동맥(주황색)의 시각화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 정맥 울혈에 대한 suprahepatic abdominal caval vein의 준비 및 클램핑
- 비외상성 준비 기구를 사용하여 간을 오른쪽으로 움직이고, 간 인대를 날카롭게 절개하고, 간을 더 측면화합니다(그림 4A-C).
- 뭉툭한 오버홀트 클램프를 사용하여 횡격막의 왼쪽 crus에 있는 후간 공간을 엽니다(그림 4D-G).
- 뭉툭한 오버홀트 클램프(그림 4H-K)를 사용하여 기골 정맥을 터널링하고 실리콘 혈관 고리(그림 4L-O)를 사용하여 기골 정맥을 슬링합니다.
- 실리콘 루프를 사용하여 적절한 동맥류 미세혈관 클램프를 적용하여 기갑 정맥을 복부로 약간 탈구시키고 동맥류 미세혈관 클램프를 실리콘 루프를 따라 안내하여 기갑 정맥의 격리된 클램핑을 보장합니다(그림 4R).
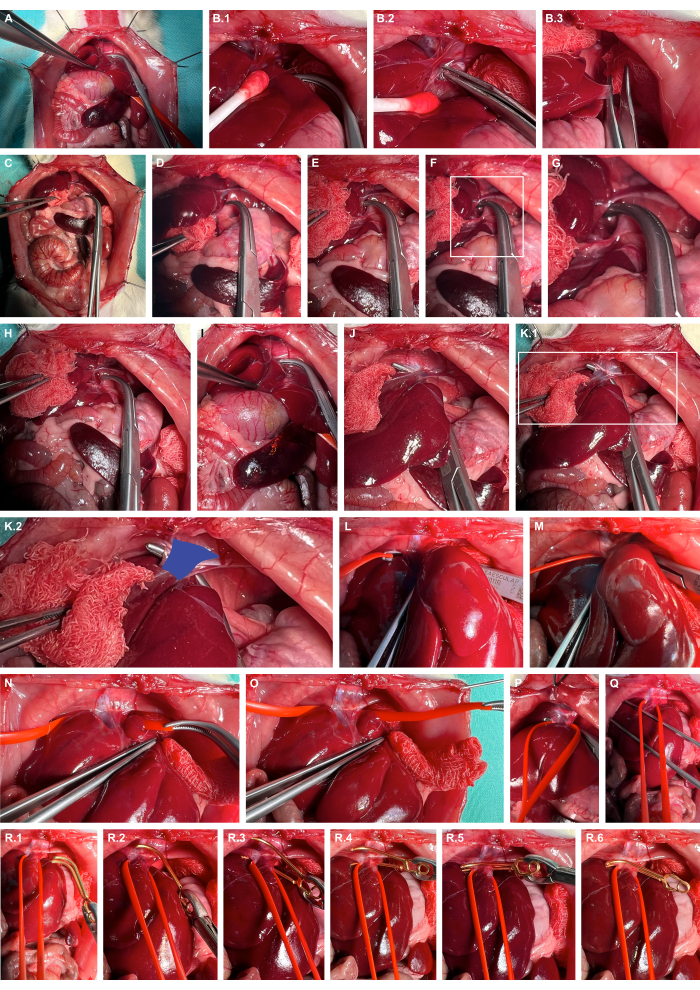
그림 4: suprahepatic abdominal caval vein의 준비 및 클램핑. (A) 두개골 내장 장기의 노출. (B) 비외상성 준비 기구를 사용한 간의 조직 보호 동원 및 간 인대의 날카로운 절개. (C) 간의 측면화. (D-G) 후간(retrohepatic space)의 개구부와 횡격막의 왼쪽 crus에서 준비. (H-K) 뭉툭한 오버홀트 클램프를 사용한 기갑맥(파란색)의 터널링. (L-O) 실리콘 혈관 고리를 사용하여 기갑 정맥을 슬링합니다. (피,큐) 기갑의 혈류를 잠정적으로 제한하기 위해 긴장을 가합니다. (R) 실리콘 루프를 지침으로 사용하여 이완 가능한 동맥류 미세혈관 클램프를 적용합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 복합 관류를 위한 복부 대동맥 및 복부 상부 정맥의 클램핑
- 대동맥과 기갑 정맥이 모두 실리콘 혈관 고리로 고정될 때까지 위의 단계를 수행합니다. 안내를 위해 실리콘 루프를 사용하여 두 혈관에 동맥류 미세혈관 클램프를 다시 적용하여 진행합니다. 먼저 대동맥을 클램핑하고 후속 대동맥 클램핑까지 필요한 시간을 몇 초로 최소화하는 것이 좋습니다.
참고: 원하는 시나리오와 연구 목적에 따라, 관류율은 계속 진행되거나 정해진 기간 후에 해제될 수 있으며, 동물은 비생존 신청을 위해 날카로운 심장 절제술(제도적으로 승인된 프로토콜에 따름)로 안락사시키거나, 계획된 추적 관찰 및 생존 실험의 경우 외과적 봉합사를 사용하여 단계적 복부 폐쇄를 받을 수 있습니다. 본 연구를 위해 동물들은 안락사되었다.
대표적 결과
이 프로토콜은 비생존 환경에서 10마리의 수컷 쥐(평균 체중 403g ± 26g)에서 수행되었습니다. 성공률은 동맥 클램핑, 정맥 클램핑, 5분 클램핑과 10분의 재관류 결합 후 20분 이상 생존율로 정의되었으며, 각각 100%였습니다. 피부 절개에서 두 혈관을 실리콘 루프로 매달릴 때까지의 평균 준비 시간은 11분 45초 ± 3분 23초였습니다.
4가지 다른 관류 상태의 검증을 위해 5개의 내장 기관에서 초분광 이미징(HSI)을 사용하여 산소화(StO2) 및 관류(NIR)에 대한 지수 매개변수를 측정했습니다(그림 5).
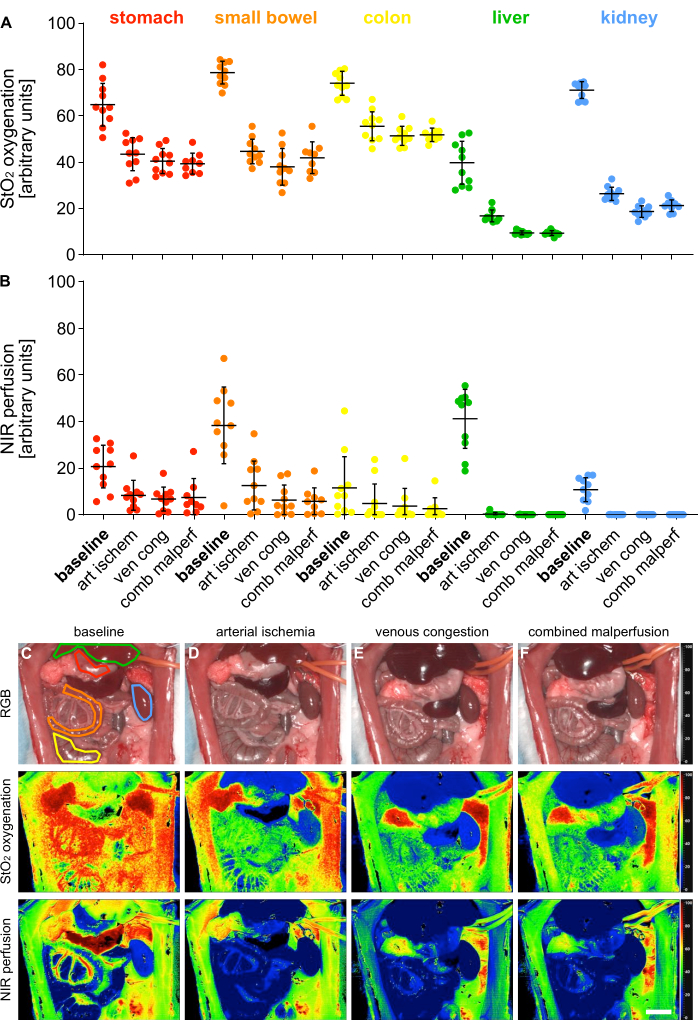
그림 5: 관류 불량 모델의 검증. (A,B) n = 10마리의 동물로 4개의 서로 다른 관류 상태와 5개의 서로 다른 내장 기관에 대한 HSI 산소화 및 관류 값의 정량화. (C-F) 4가지 다른 관류 상태에 걸쳐 내장 기관을 포함하는 HSI 녹음의 RGB 및 색상으로 구분된 인덱스 사진. 오차 막대는 표준 편차를 나타냅니다. 눈금 막대는 5cm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
값은 임의의 단위로 제공되었으며 생리적 장기 상태에 비해 관류 상태가 유의하게 감소한 것으로 나타났습니다(표 1). 초분광 결과는 이 연구에서 본 값과 일치하는 장기 특이적 HSI StO2 컷오프 값을 사용하여 조직의 생존력 및 관류를 평가할 수 있음을 나타내는 최근 간행물과 일치했습니다14,15. 위의 경우 생리관류가 64.1%(±9.4%), 동맥허혈이 43.1%(±7.4%), 정맥허혈이 40.5%(±5.4%), 복합관류가 39.3%(±4.5%)였다.
이것들은 비생존 실험이었기 때문에, 동물들의 장기적인 결과에 대한 실험 데이터는 없다. 그러나 다른 연구에서는 30분 및 60분 동안 상장간막 동맥 클램핑16,17을 겪은 쥐의 경우 24시간 동안 100% 및 57% 생존율을 보고하고 이를 열 충격 단백질 70의 혈청 수준과 성공적으로 연관시켰습니다. 결과적으로, 이것은 다양한 클램핑 시간에 따라 향후 생존 연구에서 결과를 평가할 수 있는 가능한 방법이 될 수 있습니다.
| 매개 변수 | 기관 | 기준선 | 동맥 허혈 | 정맥 울혈 | 복합 실류 |
| 스토2 | 위 | 64.1% (±9.4%) | 43.1% (±7.4%) | 40.5% (±5.4%) | 39.3% (±4.5%) |
| 소장 | 78.4% (±5.1%) | 44.8% (±5.5%) | 38.0% (±7.9%) | 41.9% (±6.9%) | |
| 콜론 | 74.6% (±5.0%) | 56.0% (±6.3%) | 51.3% (±4.1%) | 51.8% (±2.9%) | |
| 간 | 39.5% (±9.7%) | 16.9% (±2.6%) | 9.5% (±0.8%) | 9.3% (±1.1%) | |
| 신장 | 71.0% (±3.8%) | 26.3% (±3.0%) | 18.6% (±2.5%) | 21.2% (±2.6%) | |
| NIR (근적외선 분 | 위 | 20.0% (±9.3%) | 8.3% (±6.7%) | 6.8% (±5.1%) | 7.5% (±8.1%) |
| 소장 | 38.6% (±17.4%) | 12.9% (±11.0%) | 6.3% (±6.5%) | 5.7% (±5.9%) | |
| 콜론 | 12.6% (±13.7%) | 5.3% (±8.7%) | 3.8% (±7.5%) | 2.6% (±4.7%) | |
| 간 | 40.4% (±13.1%) | 0.3% (±0.7%) | 0.0% (±0.1%) | 0.0% (±0.0%) | |
| 신장 | 10.4% (±5.2%) | 0.0% (±0.0%) | 0.0% (±0.1%) | 0.0% (±0.0%) |
표 1: 조직 매개변수. HIS StO2 산소화 및 NIR 관류 값은 5개의 내장 기관과 4개의 서로 다른 관류 상태에 걸쳐 임의의 단위입니다.
토론
조직 관류 장애의 가장 두드러진 대표자인 말초 동맥 폐색 질환(PAOD)은 이미 약 7%의 유병률을 보이고 있으며, 미국에서만 약 850만 명의 성인에게 영향을 미치고 있습니다18 일반적으로 조직 관류는 대부분의 수술 및 의학적 상태에서 관련 병리 기전입니다. 결과적으로, 이 분야의 새로운 연구 질문을 해결하기 위해서는 적절하고 재현 가능한 동물 모델이 절대적으로 필요합니다.
뚜렷한 조사가 필요한 세 가지 혈관 역학 상황은 동맥 허혈, 정맥 울혈 및 복합 관류 불량입니다. 과학자들은 고립된 동맥 허혈을 유도함으로써 조직 저산소증의 시간적 및 공간적 진행을 정확하게 묘사할 수 있으며, 허혈 재관류 손상, 세포 사멸 및 염증 반응과 관련된 분자 캐스케이드를 조사할 수 있습니다. 과학자들은 혈관 병리학에서 종종 간과되는 측면인 정맥 배출을 손상시킴으로써 동맥 유입과 정맥 유출 불일치 사이의 상호 작용을 조사하여 정맥 혈전증, 울혈 관련 조직 부종 및 미세 순환 기능 장애의 병태 생리학을 밝힐 수 있습니다. 이 두 가지 병리학적 상황을 결합할 때, 급성 장간막 허혈 및 허혈성 대장염과 같은 임상 증후군에서 발생하는 복잡한 병태생리학을 반영하여 결합된 관류 장애의 시너지 효과 없는 환경을 조사할 수 있습니다.
근본적인 병태생리학적 기전을 규명하는 것 외에도, 쥐에서 내장 동맥 허혈, 정맥 울혈 및 복합 관류를 유도하는 능력은 약리학적 중재, 수술 기법, 새로운 치료 전략 및 특히 HSI 14,19,20,21,22와 같은 혁신적인 영상 양식의 효능을 평가하는 데 필수적인 플랫폼 역할을 합니다. 따라서 이 모델은 조직 평가 및 관류 상태 식별에서 HSI의 잠재력을 최대한 활용하는 데 필요한 생물학적 조직 실측 자료를 제공하는 데 필요한 핵심 구성 요소입니다. 이 실험 설정을 활용함으로써 연구자들은 전임상 결과를 임상적으로 실행 가능한 전략으로 신속하게 전환하여 궁극적으로 다양한 혈관 및 관류 장애와 관련된 이환율 및 사망률을 줄일 수 있습니다.
예를 들어, 연구자는 이 모델을 사용하여 항산화제, 항염증제 및 혈관 확장제와 같은 허혈 재관류 손상 경로를 표적으로 하는 약리학적 제제의 효능을 조사할 수 있으며, 이를 통해 임상 실습에서 잠재적인 유용성을 설명할 수 있습니다23,24. 또한 이 모델은 장간막 혈관 재생술 및 정맥 감압 절차와 같은 새로운 수술 접근법의 평가를 용이하게 하여 타당성, 안전성 및 장기 효능에 대한 귀중한 통찰력을 제공합니다25,26.
또한, 이 실험적 프레임워크를 통해 연구자들은 혈관 기능 장애와 당뇨병, 고혈압 및 죽상동맥경화증과 같은 전신 동반 질환 사이의 복잡한 상호 작용을 탐구할 수 있으며, 이를 통해 혈관 질환 진행을 조율하는 상호 연결된 병태생리학적 경로의 복잡한 그물망을 설명할 수 있습니다27,28.
쥐32,333에서 간 29,30,31 또는 신장과 같은 단일 장기의 선택적 관류에 관한 여러 간행물이 있지만, 쥐에서 전체 내장의 관류 부전을 다루는 과학 문헌이 부족하고 체계적인 프로토콜이 명시적으로 없습니다. 그러므로 이것이 이 사본의 주장이다. 제시된 기술의 한계는 주로 시술의 침습성을 포함하며, 관류 장애, 연속적인 장기 혈전증 및 기능 장애의 기간에 따라 다장기 부전 또는 복부 구획 증후군을 통한 수술 후 고통을 유발할 수 있다 34,35,36. 연구 질문에 따라 신중한 계획과 설계는 필요한 과관류 기간과 병태생리학적 결과의 균형을 맞추는 데 도움이 될 수 있습니다.
시술 중에 발생하는 일반적인 문제를 해결할 때 다음 사항과 권장 사항에 주의를 기울여야 합니다: (1) 시술 중 중단을 최소화하기 위해 사전에 장비와 약물을 철저히 준비하십시오. (2) 혈평면을 정중하게 준비하고 절개하여 지혈 조절을 꼼꼼하게 실시합니다. 가능한 경우 전기 지혈을 위해 양극성 지혈 겸자를 사용하는 것을 고려하십시오. (3) 간 실질과 접촉할 때 가습 면봉 또는 겸자를 이용한 가습 수술 압박과 같은 비외상성 기구를 사용하여 조직에 대한 외상을 최소화합니다. (4) 약 20%의 동물이 섬세한 조직 상태로 인해 미만성 표재성 간 실질 출혈을 경험했습니다. 그러나 모든 경우에 가벼운 압박과 인내심으로 출혈이 멈췄습니다. 이러한 권장 사항은 절차적 효율성을 높이고 쥐 모델에서 관류 불량을 유도하는 동안 합병증을 최소화하는 것을 목표로 합니다.
기갑 정맥에 대한 접근성을 개선하기 위해 시푸스를 절제할 때 시포체와 흉골 사이의 전이에 대한 등쪽 복막이 몇 밀리미터 이상 손상되지 않은 상태로 남아 있는지 확인하십시오. xiphoid의 절제 부위는 단단하고 날카로워서 표재성 간 실질에 외상을 유발할 수 있습니다. 따라서 후흉골 복막을 집게를 사용하여 꼬리 방향으로 움직이고 뼈 그루터기를 효과적으로 감싸서 뼈를 덮고 지혈을 지원하는 것이 좋습니다. 수술 준비 고리는 두개골 장력으로 두개골 복부 벽을 통해 꿰매어 xiphoid 그루터기의 복막 덮개가 제자리에 유지되도록 해야 합니다.
팔시형 인대를 절개할 때 동물에게 치명적일 수 있으므로 실수로 간 정맥에 의인성 손상을 입히지 않도록 주의해야 합니다. 혈관 준비 중 출혈의 위험이 높기 때문에 대부분의 수술 준비는 날카로운 해부 기구를 사용하는 것보다 뭉툭한 오버홀트 클램프로 펴서 수행하는 것이 좋습니다. 또한 실리콘 용기 루프는 표면 마찰을 줄이고 조직 외상의 위험을 최소화하기 위해 사용하기 전에 물을 적셔야 합니다.
동맥류 미세혈관 클램프를 적용할 때 정확한 혈관 해부학적 구조를 시각화하는 것이 중요합니다. 예를 들어, 복강 동맥은 복부 대동맥에서 매우 두개골 방향으로 시작됩니다. 간 관류 불량을 조사하기 위해 셀리악 폐색이 필요한 경우, 대동맥 및 실리콘 혈관 루프를 참조하여 셀리악 동맥을 시각화해야 합니다. 이렇게 하면 셀리악 동맥이 고정된 혈관 조직에 포함됩니다(그림 2V-Z). 클램프가 처음에 우연히 복강 동맥의 꼬리 부분에 배치된 경우가 있었습니다. 그러나 이는 StO2 간 값의 누락 된 강하로 인해 즉시 인식되었으며 적절한 재 클램핑이 성공적으로 수행되었습니다.
가장 위험한 준비 단계는 기갑 정맥을 터널링하는 것입니다. 이 단계는 부드러운 움직임과 인내가 필요하며 오버홀트 클램프는 기갑 정맥과 접촉이 없는 것이 확실할 때만 펴야 합니다. 이를 판단하는 것은 어려울 수 있는데, 약간의 압박이 가해지면 기갑 정맥이 얇은 무혈성 결합 조직으로 나타나 포함된 혈액이 양방향으로 사라지기 때문입니다. 또한 두개골 정맥을 너무 두개골로 터널링할 때 우발적인 흉막 개방 및 기흉이 발생할 위험이 있습니다. 이것은 특히 동물이 자발적으로 숨을 쉬고 침습적 호흡 조치를 취할 수 없기 때문에 심각하고 생명을 위협하는 합병증이 될 수 있습니다. 이러한 합병증을 피하기 위해 준비 도구를 약간 집어넣고 더 조심스럽게 계속하는 것이 도움이 되는 것으로 밝혀졌습니다. 혈역학적으로 관련되고 눈에 띄는 기흉이 있는 경우 간 횡격막이 부풀어 오르는 경우 30G 바늘과 작은 주사기를 사용하여 갇힌 공기를 한 번 경횡격막으로 찔러 흡인하는 구조 전략으로 권장될 수 있습니다. 이 기술은 수술 중 생명을 구하기 위해 한 동물에게 성공적으로 사용되었습니다.
마지막으로, 미세혈관 클램프를 적용할 때 원하는 혈관의 불충분한 폐색으로 이어질 수 있는 주변 결합 조직을 포함하지 않도록 특별한 주의를 기울여야 합니다.
이 프로토콜은 전반적 내장 관류 장애에 대한 단계별 가이드를 위한 것이지만, 그림 1T-V에 나타난 광범위한 혈관 준비 및 동원으로 인해 특정 연구 질문에 따라 클램핑 부위를 조정할 수 있습니다. 따라서, 장기 그룹 또는 단일 장기의 선별된 관류는 간 허혈을 위해 셀리악 줄기를 선택적으로 클램핑하는 것과 같이 혈관 나무를 따라 더 원위부로 클램핑 부위를 선택할 때 선택적인 옵션이기도 합니다. 이 프로토콜은 상세하고 재현 가능한 방법론을 제공함으로써 쥐 모델에서 제어된 가역적 동맥 허혈, 정맥 울혈 및 복합 관류 이상에 대한 표준화된 접근 방식을 용이하게 하여 향후 동물 연구 전반에 걸쳐 데이터 신뢰성, 견고성, 연구자 독립성 및 비교 가능성을 개선합니다. 결과적으로, 이는 생물 의학 연구 장비 내에서 없어서는 안될 도구이며, 혈관 손상, 조직 손상 및 치료 개입 간의 복잡한 상호 작용에 대한 통찰력을 제공합니다. 이 실험 설정의 다양성을 활용함으로써 연구자들은 혈관 병태 생리학을 둘러싼 미스터리를 조사하고, 중개 의학의 새로운 지평을 열고, 궁극적으로 혈관 건강 영역에서 환자 결과를 향상시킬 수 있습니다.
공개
없음.
감사의 말
저자들은 바덴뷔르템베르크 과학연구예술부(MWK)와 독일연구재단(DFG)이 INST 35/1314-1 FUGG 및 INST 35/1503-1 FUGG를 통해 지원SDS@hd 데이터 저장 서비스에 감사를 표한다. 또한 저자들은 NCT(National Center for Tumor Diseases in Heidelberg, Germany)의 구조화된 박사후 연구원 프로그램과 외과 종양학 프로그램을 통한 지원에 감사를 표합니다. 우리는 또한 바덴뷔르템베르크 주 의회가 Innovation Campus Health + Life Science Alliance Heidelberg Mannheim을 위해 승인한 주정부 기금을 통해 Alexander Studier-Fischer: Artificial Intelligence in Health (AIH) - DKFZ, EMBL, 하이델베르크 대학교, 하이델베르크 대학교 병원, 만하임 대학교병원, 중앙 정신 건강 연구소, 막스 플랑크 의학 연구소(Max Planck Institute for Medical Research)가 있습니다. 또한, 만하임 대학 의료 센터의 DKFZ 헥터 암 연구소(DKFZ Hector Cancer Institute)를 통한 지원에 감사드립니다. 출판 비용에 대해서는 "Open Access Publikationskosten"이라는 자금 지원 프로그램의 Deutsche Forschungsgemeinschaft와 하이델베르크 대학의 재정 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
참고문헌
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. 205, e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. 106908, (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유