JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포외 소포 격리를 위한 성공적인 분류 설정
요약
이 프로토콜은 중간엽 기질 세포에서 방출되는 세포외 소포체(EV)를 분류하는 방법에 대한 자세한 설명을 제공합니다. 특히 기기 설정 및 분류 조건의 최적화에 중점을 둡니다. 목표는 세포외 소포체의 특성을 보존하면서 분류하는 것입니다.
초록
중간엽 기질 세포(MSC)에서 방출되는 세포외 소포체(EV)에는 재생 및 항염증 역할을 하는 일련의 microRNA가 포함되어 있습니다. 따라서 정제된 MSC-EV는 다양한 질병에 대한 차세대 치료 옵션으로 구상되고 있습니다. 이 프로토콜에서는 정형외과 재생 의학 응용 분야에 자주 사용되는 지방 유래 MSC(ASC)의 상층액에서 EV를 성공적으로 분류하기 위한 전략을 보고합니다.
먼저, 형광 검출을 위해 카르복시플루오레세인 숙시니미딜 에스테르(CFSE)를 사용한 EV 분리 및 라벨링 단계에 중점을 두고 샘플 준비를 설명했습니다. 그 후, 우리는 프로토콜의 주요 부분을 구성하는 분류 프로세스에 대해 자세히 설명했습니다.
MISEV 2023 및 MIFlowCyt EV 가이드라인에 정의된 규칙 외에도 노즐 크기, 빈도 및 피복 압력에 관한 특정 실험 조건을 적용했습니다. 형태학적 매개변수는 EV 크기의 이론적 범위를 커버하기 위해 선택된 직경의 비드를 사용하여 설정됩니다. ASC-EV 분류 후 분류기로 재분석하고 나노입자 추적 분석 기법으로 EV 크기 분포를 확인하여 분류된 분획의 순도 검사를 수행했습니다.
EV의 중요성이 커짐에 따라 연구하고 특성화할 순수 인구를 확보하는 것이 중요해지고 있습니다. 여기에서는 이 목표를 달성하기 위해 정렬을 설정하는 승자 전략을 보여줍니다.
서문
세포외 소포체(EV)는 거의 모든 세포에서 방출되는 막 구조 소포의 이질적인 그룹으로, 지질 이중층으로 구분되어 자체적으로 복제할 수 없습니다1. 이들은 혈장, 혈청, 타액, 모유, 소변, 기관지 세척액, 양수, 뇌척수액 및 악성 복수와 같은 여러 생체 유체에서 발견될 수 있습니다2. EV의 주요 기능 중 하나는 핵산, 단백질, 지질 및 탄수화물을 포함한 다양한 분자를 기증자와 수용 세포 사이에서 운반하는 것입니다. 이는 직접 막융합(direct membrane fusion), 수용체-리간드 상호작용(receptor-ligand interaction), 세포내이입(endocytosis), 식세포작용(phagocytosis)과 같은 다양한 메커니즘을 통해 발생할 수 있습니다 3,4. 이러한 이유로, 그들은 많은 생리학적, 병리학적 과정에서 중요한 역할을 하는 것으로 입증되었으며, 질병의 새로운 바이오마커, 약물 전달 매개체, 치료제로서 상당한 가능성을 보여줍니다 5,6.
중간엽 기질 세포(MSC)는 지방 조직, 치수, 탯줄 혈액, 태반, 양수, 와튼 젤리, 심지어 뇌, 폐, 흉선, 췌장, 비장, 간 및 신장을 포함한 많은 조직에서 분리할 수 있는 다분화능 세포입니다. 최근 몇 년 동안 재생의학에 대한 관심이 크게 높아지고 있다7. 지방 유래 중간엽 줄기세포(ASC)는 골수와 같은 다른 공급원에 비해 덜 침습적인 절차를 통해 지방 조직에서 채취할 수 있으므로 심각한 합병증의 위험이 낮고 윤리적 문제를 피할 수 있습니다8.
또한 지방 조직에는 골수(1% 대 >0.01%) 및 진피, 치수, 탯줄, 태반과 같은 다른 공급원보다 훨씬 더 높은 농도의 MSC가 포함되어 있습니다. MSC는 분화 능력과 성장 인자, 케모카인 및 사이토카인의 광범위한 레퍼토리를 분비하기 때문에 손상된 조직과 세포의 재생에 중요합니다. 이러한 치료적 이점은 이들의 분화 능력에 기인할 뿐만 아니라 성장 인자, 케모카인 및 사이토카인의 광범위한 레퍼토리를 분비한다는 사실에 기인합니다. 정형외과 질환에 대한 MSC의 치료 잠재력이 눈에 띄는 예로, "근골격계 질환"이라는 용어가 clinicaltrials.gov(2024년 5 월 13일 접속)에 등록된 임상 연구 수가 더 많습니다.
또한, MSC는 손상된 세포나 조직에 정보를 전달하여 조직 재생에 참여하는 EV를 분비하고 모세포와 유사한 생물학적 활성을 발휘할 수 있습니다 9,10. 이러한 이유로, MSC-EV는 정형외과적 질환(NCT05261360 및 NCT04998058)에 대한 MSC-EV와 관련된 두 가지 임상 연구를 통해 무세포 접근법11을 달성하기 위한 세포 요법의 가치 있는 대체품이 될 수 있습니다. 그러나 EV의 임상 적용에는 여전히 몇 가지 과제가 있습니다. 예를 들어, EV 분리 기술에 대한 몇 가지 우려 사항이 있습니다: 대부분은 소포 순도 또는 무결성을 보장하지 않습니다. 더욱이, 일부 분리 기법은 복잡하고 시간이 많이 걸리며 반복성이 낮아 임상적으로 사용하기에 적합하지 않습니다12.
반면에, 세포 분류(Cell sorting)는 특정 형광 마커(specific fluorescent markers)를 사용하여 이질적인 세포 현탁액으로부터 단일 세포를 분리할 수 있도록 하는 일반적으로 사용되는 방법입니다13. 많은 응용 분야에 사용할 수 있으며 다양한 시료 유형에 맞게 조정할 수 있습니다. 그러나 세포 분류가 잘 정립되고 널리 사용되는 기술임에도 불구하고 대부분의 EV가 가장 민감한 유세포 분석기에 대한 최소 검출 임계값 미만이기 때문에 EV 분류는 여전히 매우 어렵습니다. 이 목적에 더 적합한 분류기를 만드는 몇 가지 기능이 있습니다. 우선, 입자를 부유시키는 흐름이 플로우 셀 내부가 아닌 공기 중의 레이저에 의해 조사되는 Jet-in-air 시스템을 사용합니다. 이 시스템은 샘플이 받는 응력을 줄여 샘플을 보존합니다. 두 번째 중요한 점은 스트림과 수집 렌즈 사이에 "obscuration" 막대가 있어 기기의 배경 광학 노이즈를 감소시킨다는 것입니다. 비록 그것이 낮지만, 배경 잡음이 완전히 제거되지는 않으며, 임계값 이하로 떨어지는 이벤트에 대한 부분적인 창을 제공하는 참조를 구성한다: 이는 기기(14)의 "검출 한계"에 가까운 이벤트의 분석을 위해 매우 중요하다. 마지막으로, 분류기는 두 개의 서로 다른 마스크가 있는 이중 경로 전방 산란(FSC)을 특징으로 하여 샘플의 작은 입자와 큰 입자를 더 잘 구별할 수 있습니다.
이를 바탕으로 고감도 세포 분류기를 사용하여 MSC-EV(carboxyfluorescein succinimidyl ester, CFSE) 표지를 가진 카르복시플루오레세인 숙시니미딜 에스테르(CFSE)를 분리하는 것을 목표로 하는 프로토콜을 개발했습니다. EV의 조작을 최소화하고 무결성과 수량을 보존하기 위해 샘플 준비 중에 초원심분리 단계를 피했습니다. 또한, 노즐 크기(35psi의 압력에 대한 70μm 노즐)를 줄여 기기를 추가로 최적화하는 등 소포에 가해지는 응력을 최소화하기 위해 분류 조건을 조정했습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
여기서 프로토콜은 (1) 시료 준비, (2) ASC-EV 특성화, (3) ASC-EV 분류, (4) 사후 분류 분석의 네 부분으로 구성됩니다. 워크플로우를 나타내는 회로도는 그림 1에 나와 있습니다.
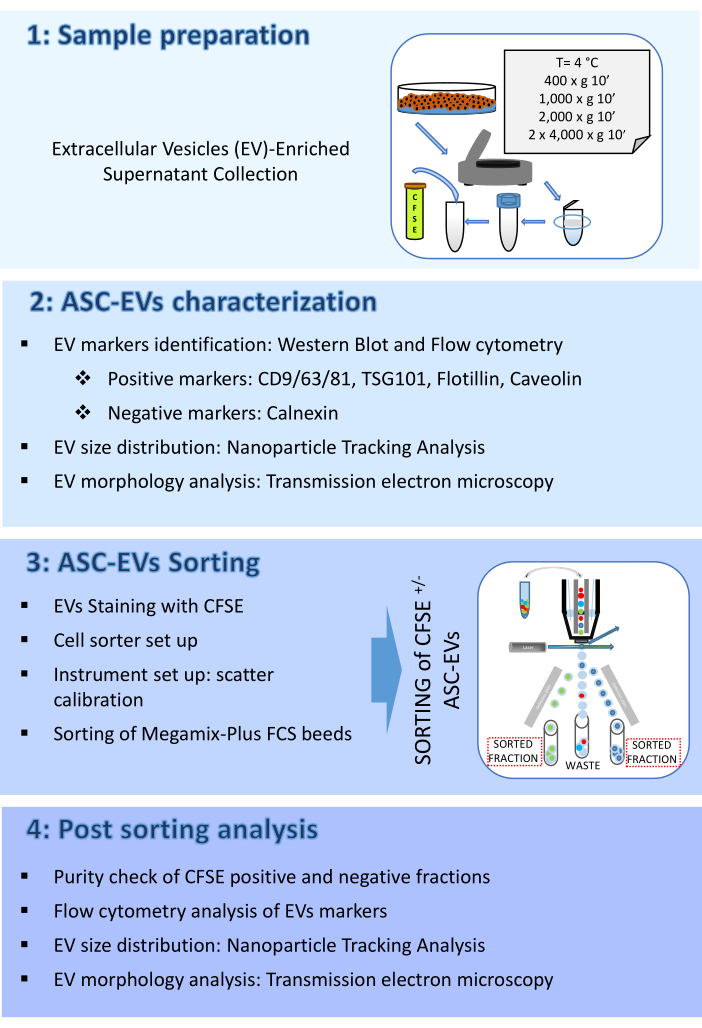
그림 1: 프로토콜 순서도. 순서도는 프로토콜과 관련된 단계를 보여줍니다. (1) 시료 준비, (2) 분류 전 소포의 특성화, (3) 분류, (4) 분류 후 소포 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 시료 준비
- 세포외 소포체(EV)가 풍부한 상층액 컬렉션
- EVs 수집 전 계대에서 배양된 지방-MSC(ASC)를 해동 또는 수집하고(일반적으로 1-5번 계대) 각 ASC당 시드를 통해 동일한 양의 세포를 분리합니다(예: 플라스크 표면 175cm2 당 100만 개의 세포는 약 60%-70% 합류).
- 요청된 프로토콜에 따라 EV가 없는 소 태아 혈청(FBS) 또는 인간 혈소판 용해물(hPL)이 보충된 적절한 배양 배지(이 프로토콜의 경우 DMEM-F12)에서 48-72시간 동안 ASC를 성장시킵니다.
- EV-free FBS 또는 hPL을 얻으려면 4°C에서 하룻밤 동안 120,000 x g 의 초원심분리기를 사용하고 상층액을 사용합니다.
참고: 이 시점부터 표시된 원심력은 항상 사용된 기기, 로터 및 튜브의 평균을 의미합니다. 다른 로터 또는 튜브는 rpm 및 k-factor당 가변 g-force를 가질 수 있습니다. 로터를 비교하고 g-force와 속도를 조정하는 쉬운 방법은 사용 가능한 변환 표 중 하나를 참조하십시오 https://www.beckman.it/centrifuges/rotors/calculator.
- EV-free FBS 또는 hPL을 얻으려면 4°C에서 하룻밤 동안 120,000 x g 의 초원심분리기를 사용하고 상층액을 사용합니다.
- 90% cell confluence에서 ASC를 분리 및 계수하고 적절한 부피의 무혈청 배지(이상적으로는 1 x 106 ASC당 1mL)에서 현탁합니다. 현탁액에 ASC를 Seed, 웰당 1mL의 24웰 플레이트에 주입합니다. 혈청이 없으면 세포는 현탁액을 유지하며 스페로이드를 형성합니다. 96 시간 후, 상층액을 수집하십시오.
- 4°C에서 연속 원심분리를 통해 부유 세포 및 잔여물을 제거합니다: 400 x g 에서 10분, 1,000 x g 에서 10분, 2,000 x g 에서 10분, 4,000 x g 에서 10분.
- 0.22μm 필터를 통해 상층액을 여과하여 220nm보다 큰 잔류 입자를 제거합니다.
알림: 다운스트림 응용 분야에 즉시 사용하거나 4°C에서 최대 1박 동안 보관하거나 24시간 이내에 추가 단계를 수행하지 않으면 -80°C에서 동결하십시오.
- 분류를 위한 EV 염색
- 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester(CFSE)의 5mM 용액을 준비합니다. 갓 준비한 상태로 사용하거나 -20 °C에서 냉동하여 빛으로부터 보호하십시오.
- 1.1.1-1.1.5단계(24시간 이내)에서 직접 진행하거나 -80°C에 저장된 EV 함유 상등액을 4°C에서 해동합니다.
- 염색하기 전에 상층액을 37°C에서 가열하고 CFSE를 첨가하여 최종 농도를 10μM(500배 희석)합니다. 어둠 속에서 37 ° C에서 1 시간 동안 배양하십시오.
- 배양 중에 PBS 2mL를 원심 농축기(재생 셀룰로오스 멤브레인, MWCO 100kDa), 캡 및 4,000 x g 의 원심분리기에 10분 동안 스윙 버킷 로터에서 추가합니다. 필터 장치 바닥에서 여과되지 않은 PBS를 제거하고 수집 튜브에서 여과액을 흡인합니다.
참고: 요약된 원심 한외여과 프로토콜은 최대 15mL의 시료(최대 부피) 처리를 기반으로 합니다. - 최대 15mL 샘플을 원심 농축기에 추가하고 장치를 닫습니다. 4,000 x g 에서 최대 30분 동안 원심분리기.
참고: 이렇게 하면 평균 500μL의 최종 샘플이 생성됩니다. 그러나 샘플의 특성 및 유속과 같은 요인에 따라 원하는 농도를 달성하는 데 필요한 원심분리 시간이 달라질 수 있습니다. - 원심분리기에서 장치를 제거하고 수집 튜브를 비웁니다. 필터 장치에 PBS 14mL를 추가합니다. 4,000 x g 에서 최대 30분 동안 원심분리기.
- 1.2.6단계를 반복합니다.
- 필터 장치에서 농축된 CFSE 염색 EV 샘플(약 500μL)을 회수하고 100μL를 어두운 곳에서 4°C에 보관하면서 나머지 샘플의 분류를 진행합니다.
2. ASC-EV 특성화
- EV 마커의 웨스턴 블롯 분석
- 376 x g에서 실온에서 5분 동안 ASC(1 x 10,6)를 펠렛화하고 프로테아제 억제제가 보충된 적절한 용해 완충액에 현탁합니다. 선택한 어세이로 단백질 정량화를 수행합니다.
참고: 이 연구에서 경험한 바와 같이 Bicinchoninic acid assay technique을 사용하여 최상의 정량화 결과를 얻을 수 있습니다. - Bradford 기법을 사용하여 1 x 106 ASC에 해당하는 ASC 농축 상등액 또는 100,000 x g에서 100,000 x g, 1시간 동안 1 x 106 ASC에 해당하는 펠릿 EV를 정량화하고 프로테아제 억제제가 보충된 적절한 용해 완충액에 현탁합니다. 선택한 어세이로 단백질 정량화를 수행합니다.
참고: 이 연구에서 경험한 바와 같이 EV 펠릿에 대한 최상의 정량화 결과는 Bicinchoninic acid 분석 기술을 사용하여 얻을 수 있습니다. - 정제된 EV 대신 농축된 상등액을 사용하는 경우 샘플을 5% 2-메르캅토에탄올 및 2x Laemmli 완충액에 용해시킵니다.
참고: 이 연구에서 경험한 바와 같이 농축된 상층액 EV와 정제된 EV는 모두 양성 및 음성 EV 마커에 대해 유사한 결과를 제공합니다. - 샘플(1-10μg)을 10% 폴리아크릴아미드 겔에 넣고 110V에서 90분 동안 로드합니다.
- 250mA에서 120분 동안 니트로셀룰로오스 멤브레인으로 이동합니다.
- Ponceau S를 사용한 염색막을 사용하여 시료 및 래더 이동을 시각화합니다. PBS가 있는 Ponceau S를 부드럽게 흔든 후 제거합니다.
- PBS에서 5% 무지방 분유와 0.1% 트윈으로 멤브레인을 60분 동안 차단합니다.
- 밤새 4°C에서 양성(예: 이 작업에서는 CD9, CD81, TSG101 및 Flotillin) 및 음성(예: 이 작업에서는 Calnexin) EV 마커를 포함한 작업 희석에서 적절한 항체로 멤브레인을 프로브합니다.
- PBS에서 0.1% Tween으로 세척하고 선택한 ECL 시스템으로 밴드를 드러내기 전에 RT에서 45분 동안 적절한 과산화효소 접합 2차 항체로 배양합니다. 사용 가능한 이미징 시스템으로 이미지를 획득합니다(그림 2A).
- 376 x g에서 실온에서 5분 동안 ASC(1 x 10,6)를 펠렛화하고 프로테아제 억제제가 보충된 적절한 용해 완충액에 현탁합니다. 선택한 어세이로 단백질 정량화를 수행합니다.
- EV 마커의 유세포 분석 분석: 표면 염색
- 사용하기 전에 각 단클론 항체(mAb)를 15,000-17,000 x g 에서 4°C에서 30분 동안 원심분리하여 거짓 양성 신호를 유발할 수 있는 응집체를 제거합니다. 또한 모든 혼합물이 필터를 통과하고 필터 표면에 항체 액체가 남아 있지 않을 때까지 4°C에서 1,000 x g 의 별도의 0.22μm 원심 필터 튜브에 mAb를 여과합니다. mAb는 4°C에서 보관하십시오.
- 0.22μm 여과된 PBS에서 CFSE 염색 EV(1.2.1-1.2.8단계 참조)를 1:10 희석하여 준비합니다.
- 이전에 적정된 EV 특이적 mAb(anti-CD9/63/81) 또는 MSC 특이적 mAb(anti-CD44)를 사용하거나 사용하지 않고 100μL 샘플 또는 0.22μm 필터링된 PBS를 배양합니다. 4°C의 어두운 곳에서 30분 동안 배양을 수행합니다.
참고: 일반적인 EV 및 MSC 계통 마커를 검출하기 위해 개발된 이 프로토콜은 다른 모든 세포 계통 또는 EV 하위 유형별 표면 마커로 확장될 수 있습니다. EV의 CFSE 염색과 중복되지 않도록 플루오레세인 이소티오시아네이트(FITC) 채널에 떨어지는 형광 색소를 사용하지 마십시오. 하나의 형광 색소와 결합된 각 mAb(예: 알로피코시아닌(APC))를 사용하여 단일 염색을 수행합니다. 다색 염색이 가능하지만 잠재적인 항체 입체 방해 문제를 해결하기 위해 대조군이 포함되어야 합니다. 개별 항체를 단독으로 또는 믹스 내에서 테스트하고 신호가 유사한지 확인해야 합니다. 또한 FMO는 컨트롤에 포함되어야 합니다. - 3.2단계에서 설명한 대로 산란 보정을 설정합니다.
- FITC 로그 스케일과 사이드 스캐터(SSC) 로그 스케일의 점도표를 만들고 0.22μm 여과된 PBS 또는 염색되지 않은 EV의 튜브를 실행합니다. FITC 채널의 임계값을 설정하고 대부분의 배경 노이즈를 제외하는 가장 높은 값으로 조정합니다. CFSE 양성 이벤트를 식별하는 영역을 그립니다.
- CFSE 양성 이벤트 영역에 대한 게이트가 있는 APC 히스토그램 플롯을 생성하고 0.22μm 필터링된 PBS 또는 염색되지 않은 EV의 튜브를 실행합니다.
참고: APC 게인의 경우 기기 QC로 설정된 게인을 사용하되 기기 성능을 최적화하기 위해 특정 게인테이션을 수행하는 것이 좋습니다. - 염색된 샘플에 200μL의 0.22μm 여과된 PBS를 추가하고 획득합니다. 수집 및 기록을 위해 낮은 유속(분당 10μL)을 사용합니다. 가능하면 FITC positive gate에 최소 5,000개의 이벤트를 기록합니다.
- mAb 염색 PBS 컨트롤을 사용하여 mAb의 가능한 비특이적 신호를 검출할 수 있습니다. 실행 간 일관성을 보장하기 위해 동일한 유속으로 모든 샘플 튜브를 판독합니다.
- 시료 교차 오염을 방지하려면 분석된 각 튜브 사이에 세제를 10초 동안 사용한 다음 탈이온수(DI)를 10초 동안 돌립니다(그림 2B).
알림: 유체 기기 불안정을 방지하려면 샘플을 10초 동안 수집한 다음 녹음을 시작합니다.
- EV 마커의 유세포 분석 분석: 세포 내 염색
참고: 세포 내 염색의 경우 고정 및 투과화 시약이 포함된 특정 키트를 사용하십시오. Anti-Caveolin mAb는 Alexa 488과 결합됩니다. IC 염색은 CFSE가 없는 상태에서 수행되었습니다.- 사용하기 전에 앞서 설명한 대로 mAb를 원심분리합니다(단계 2.2.1).
- 세포 내 염색의 경우 제조업체의 지침을 따르십시오(그림 2C).
- 나노입자 추적 분석(NTA)을 통한 EV 농도 및 크기 특성화
- 샘플을 적절하게 희석하여 NTA 기기 디스플레이의 보기 프레임에서 20-120개의 이벤트를 얻습니다.
- 1mL 인슐린 주사기를 사용하여 NTA 기기 샘플 챔버에 샘플을 주입합니다.
- 기록을 위해 NTA 소프트웨어를 다음과 같이 설정합니다: 5개의 표준 측정, 각각 60초, 유량 펌프는 30으로 설정합니다.
- 광도를 적절한 값으로 설정하여 입자와 배경을 명확하게 구별하고 NTA 소프트웨어에서 캡처 스크립트를 실행할 수 있습니다.
참고: 카메라 레벨 설정은 입자 감지에 영향을 줄 수 있습니다. 값이 너무 높으면 유백색 배경과 강한 입자 광 산란이 나타나 대부분의 입자 신호를 덮습니다. 값이 너무 낮으면 더 어두운 배경을 얻을 수 있지만 대부분의 덜 밝은 이벤트가 누락될 수 있습니다. 최적의 설정을 위해 각 샘플을 모니터링해야 합니다. - 프레임당 입자가 20 미만 또는 80 이상인 경우 희석 계수를 조정합니다.
- 임계값을 4로 설정하여 상층액의 평균 모드 크기와 입자 농도를 분석합니다. 초기 희석 요인을 고려하십시오.
- 교차 오염을 방지하기 위해 각 시료 후에 탈이온수로 기기 챔버를 청소하십시오.
- NTA 분석 소프트웨어를 열고 희석 계수를 고려하여 획득한 샘플에 대한 분석을 수행합니다(그림 2D).
- 투과 전자 현미경(TEM)에 의한 EV 형태 특성화
- ASC 농축 상등액을 수집하거나 초원심분리(4°C에서 1시간 동안 100,000 x g )로 EV를 분리한 다음 동일한 부피의 PBS에서 펠릿 현탁액을 주입합니다.
- 5μL의 농축된 상등액 또는 EV가 탄소 코팅된 그리드에 10분 동안 흡수되도록 합니다. 여과지로 여분의 액체 방울을 닦아냅니다.
- 동일한 부피의 샘플 드롭(5μL)을 사용하여 10분 동안 수성 현탁액에서 2% 우라닐 아세테이트로 음성 염색을 수행합니다. 여과지로 그리드를 터치하여 여분의 우라닐 아세테이트를 제거합니다.
- 그리드를 실온(RT)에서 건조하고 120kV에서 투과 전자 현미경으로 검사합니다(그림 2E).
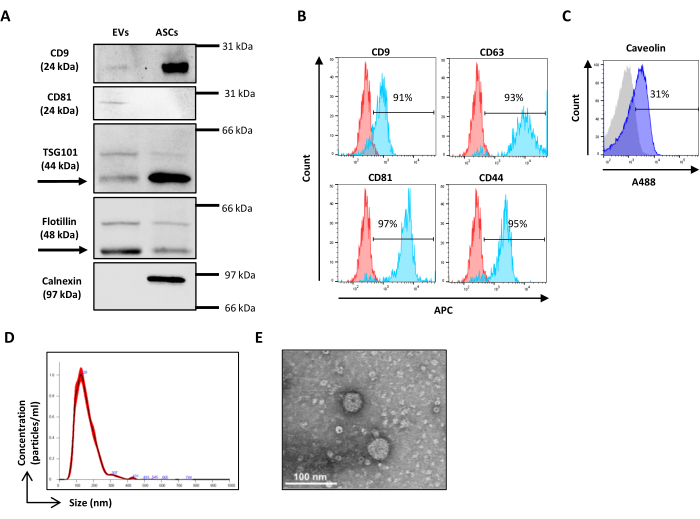
그림 2: ASC-EV 특성화. (A) EV의 포지티브(CD9, CD81, TSG101, 플로틸린) 및 마이너스(칼넥신) 마커의 대표적인 웨스턴 블롯. 해당 분자량이 보고되고 ASC 용해물이 대조군으로 사용되었습니다. (B) EV 마커의 유세포 분석 분석. CD9, CD63, CD81 및 CD44 마커의 발현을 분석했습니다. 마커 발현을 위해 CFSE 양성 ASC-EV만 분석했습니다. 히스토그램은 염색되지 않은(빨간색 히스토그램) 및 염색된(파란색 히스토그램) ASC-EV를 나타냅니다. (C) EV 마커 Caveolin의 유세포 분석 내 분석. 히스토그램은 염색되지 않은(회색 히스토그램) 및 염색된(파란색 히스토그램) ASC-EV를 나타냅니다. (D) NTA에 의한 ASC-EV의 특성화. 히스토그램은 샘플의 농도(입자수/mL)/크기(nm)를 나타냅니다. (E) TEM에 의한 ASC-EV의 시각화. 스케일 바 = 100nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. ASC-EV 분류
- 셀 분류기 설정
참고: cell sorter는 이질적인 시작 샘플에서 순수한 집단을 분리할 수 있는 유세포 분석기입니다. Cell sorter는 고주파에서 압전으로 스트림을 진동시켜 이벤트를 포함하는 방울을 생성함으로써 대상 입자를 분리합니다. 세포나 소포와 같은 관심 입자를 포함하는 방울은 금속 편향판을 통해 전하되고 편향됩니다. 정렬된 부분은 다운스트림 분석을 수행하는 데 사용됩니다.- 압력 라인을 열고 진공 청소기로 청소하십시오.
참고: 일부 분류기는 자동 시작 기능이 있는 반면 다른 분류기는 수동 시작 기능이 있습니다. 수동 시동이 가능한 분류기가 선호되는데, 이는 주파수, 압력 및 노즐 팁 선택과 같은 일부 기술적 기능을 최적화할 수 있기 때문입니다. 특히 66,000Hz의 주파수, 35psi의 압력 및 70μm 노즐로 작업하는 것이 좋습니다. - 기기를 켜고 생물 안전 캐비닛을 연 다음 분류기 소프트웨어를 실행합니다.
- 유체 공학에 압력을 가한 다음 유체 시스템을 켭니다.
- Drop Drive를 활성화, 노즐의 압전 결정이 진동하여 물방울을 갖도록 합니다.
- 거품 제거 절차를 수행하여 시스템에 기포가 있는지 제거한 다음 높은 차압에서 5분 동안 5mL 세척 용액 튜브를 실행하고 5분 동안 DI 물 5mL 튜브를 실행합니다.
- 수동 시작 절차를 수행합니다.
- Laser Control 탭에서 Laser Power 버튼을 눌러 레이저 전원을 켭니다.
알림: 모든 레이저(청색 488nm, 황록색 561nm, 보라색 405nm 및 적색 640nm)에 대해 이 절차를 반복합니다. - 하천의 수직 정렬을 검사합니다.
참고: 필요한 경우 노즐 어셈블리 단계, 특히 전면 및 후면 마이크로미터, 좌우 마이크로미터 및 짐벌을 이동하여 수직 정렬을 조정하고 위아래 마이크로미터로 수직 스트림을 확인합니다. 최상의 정렬을 위해 스트림은 각 레이저에서 수직이어야 합니다. 특정 노즐을 처음 사용하는 경우 Laser Delay 를 수행해야 합니다. 터치 스크린 패널의 Laser and Stream Intercept 탭에서 올바른 노즐 크기를 선택하고 Laser Delay 버튼을 누른 다음 레이저 지연 지침에 따라 레이저 지연 절차를 수행합니다. 일반적으로 피복 압력과 그에 따른 노즐 팁을 변경할 때 정렬을 찾기 전에 Laser Delay Determination 이 실행됩니다. Laser Delay 절차가 끝나면 배경 신호를 최소화하기 위해 화면의 지시에 따라 Background Image Subtraction Procedure를 수행하는 것이 좋습니다. - Laser Stream Intercept 탭, 녹색 화살표 버튼을 누르고 터치 스크린 모니터의 지시에 따라 Laser Spot Determination을 수행합니다.
- Laser Control 탭에서 Laser Power 버튼을 눌러 레이저 전원을 켭니다.
- Intellisort를 초기화합니다. 드롭 구동 주파수와 기본 진폭 값을 설정하여 스트림이 드롭릿을 형성하도록 합니다.
- 이 단계가 수행되면 저장된 구성을 로드합니다. 저장된 설정 구성을 로드하려면 분류기 소프트웨어 도구 모음에서 Load Sort Setting(정렬 설정 로드 )을 선택합니다. 다양한 주파수와 진폭을 확인한 후 최상의 낙하 안정성을 보장하는 최상의 주파수와 진폭을 선택하십시오. 66,000Hz의 주파수와 약 40-45V의 진폭에서 작업합니다.
- 미세 레이저 정렬 절차를 수행합니다.
- 샘플러에 QC 정렬 비드의 5mL 튜브를 로드하고 실행합니다. Fine Alignment 탭에서 X 및 Y 축에서 원하는 매개변수를 선택하여 잘 압축되고 시준된 비드를 시각화합니다. 데이터 표시 영역에서 Y축 매개변수에 대해 488 - 513/26-H 중 먼저 선택하고 X축 매개변수에 대해 488-FSC1-H를 선택합니다. 그런 다음 모든 레이저를 미세 조정하려면 Y축 매개변수로 405-488/59-H를 선택하고 X축 매개변수로 640-795/70-H를 선택합니다.
참고: 선택한 매개변수는 분류기의 레이저 구성에 따라 다릅니다. 기기 수동 제안은 핀홀 스트립에서 공간 분리가 가장 큰 레이저를 선택하는 것입니다. 이를 위해 바이올렛 레이저(405nm)와 적색 레이저(640nm)를 사용하십시오. - 분류기 전문가가 수동 정렬을 확인하면 자동 QC를 수행합니다. QC 비드의 직경을 선택합니다: 직경 3μm.
참고: 이 절차가 끝나면 QC가 통과되지 않았거나 QC가 통과되지 않았습니다. QC가 실패하는 경우 정렬을 수동으로 최적화해야 합니다. - 소프트웨어 얼라인먼트 프로토콜에 QC 획득을 저장합니다.
- 샘플러에 QC 정렬 비드의 5mL 튜브를 로드하고 실행합니다. Fine Alignment 탭에서 X 및 Y 축에서 원하는 매개변수를 선택하여 잘 압축되고 시준된 비드를 시각화합니다. 데이터 표시 영역에서 Y축 매개변수에 대해 488 - 513/26-H 중 먼저 선택하고 X축 매개변수에 대해 488-FSC1-H를 선택합니다. 그런 다음 모든 레이저를 미세 조정하려면 Y축 매개변수로 405-488/59-H를 선택하고 X축 매개변수로 640-795/70-H를 선택합니다.
- Intellisort 프로시저 완료
- 분류기에서 편향판을 올바른 위치에 배치하고 전압을 켭니다(편향판에 3,000V 충전이 권장됨).
- 6 Tube Holder 정렬 출력을 선택하고 Stream Indicator에서 선택한 스트림을 활성화한 다음 Test Stream을 수행합니다.
알림: 스트림이 명확하게 분리 및 정의되지 않은 경우 충전 단계를 조정하거나 defanning 또는 다른 매개변수를 수정하여 명확하게 정의되고 진동하지 않는 스트림을 얻으십시오. - Intellisort Automatic Drop Delay Determination 버튼을 활성화합니다. 이 단계를 통해 올바른 드롭 지연을 설정할 수 있습니다. 이 단계가 끝나면 스트림을 다시 확인합니다.
- Intellisort 유지 관리 모드를 활성화합니다. Drop Delay(삭제 지연)를 수동으로 확인합니다.
- 분류기 소프트웨어에 수동 Drop Delay 프로토콜을 로드합니다. 형광 조절 비드를 획득합니다.
- 올바른 슬라이드 홀더를 삽입하십시오. 분류기 소프트웨어에서 Sort > Drop Delay Wizard(지연 삭제 마법사)를 선택합니다. 정렬 논리를 선택합니다.
- 형광 현미경으로 다섯 번째 웅덩이에 97%의 형광 구슬이 있는지 확인합니다.
- 압력 라인을 열고 진공 청소기로 청소하십시오.
- 기기 설정: 산란 보정
참고: 산란 보정은 Verity Shells 비드(이하 중공 유기 실리카 비드라고 함)를 사용하여 수행됩니다. 이러한 유기 실리카 비드는 폴리스티렌 비드보다 EV에 더 가까운 굴절률 분포 및 광 산란 특성을 특징으로 하므로 SSC 및 FSC 전압을 설정하여 EV와 같은 이벤트와 전자 노이즈를 더 잘 구별할 수 있습니다. 유기 실리카 비드는 비드 혼합물인 VER01A(189nm 비드) 및 VER01B(374nm 비드)가 있는 두 개의 바이알로 구성됩니다. 각 바이알에는 속이 빈 유기 실리카 비드와 참조 비드라고 하는 380nm 녹색 형광 비드의 혼합물이 포함되어 있습니다. 속이 빈 유기 실리카 비드의 농도는 1 x 108 beads/mL입니다.- 0.22μm로 여과된 PBS 1mL에 각각 1방울(50μL)을 5,000 beads/μL의 최종 농도로 희석하여 VER01A 및 VER01B 비드 샘플을 준비합니다.
알림: 사용하기 전에 구슬을 5초 동안 볼텍스하십시오. - SSC 로그 척도 대 FITC 로그 척도의 점도표를 생성합니다.
- VER01B 비드를 획득하고 볼륨을 조정합니다.tage는 SSC/FITC 도트 플롯의 오른쪽 상단 부분에 있는 참조 비드를 잘 구별합니다(그림 3A).
- 이 구슬 개체군 주위에 영역을 설정합니다.
- SSC 로그 척도와 FSC 로그 척도의 점도표를 만듭니다. reference bead와 VER01B beads population을 식별합니다. VER01B 비드 모집단 주변의 영역을 설정합니다(그림 3B).
- VER01A 비드를 획득하고 이 비드 개체군 주위에 영역을 생성합니다(그림 3C).
참고: 이 비드 모집단은 악기의 배경 소음과 부분적으로 겹칩니다. - 0.22μm 필터링된 PBS를 획득하고 임계값을 조정하여 가장 작은 비드의 시각화를 잃지 않고 기기의 배경 노이즈를 줄입니다.
참고: 산란 보정은 100nm, 300nm, 500nm 및 900nm 직경의 형광 비드 혼합물인 FSC Megamix 비드(이하 FSC 폴리스티렌 비드라고 함)를 사용하여 수행할 수 있습니다. 중공 유기 실리카 비드의 사용은 EV와 유사한 굴절률 분포 및 광 산란 특성을 가지고 있기 때문에 FSC 폴리스티렌 비드보다 선호되어야 합니다. 300nm FSC 폴리스티렌 비드의 모집단은 중공 유기 실리카 비드의 참조와 겹칩니다. 따라서 속이 빈 유기 실리카 비드를 기반으로 하는 게이트는 유세포 분석기에서 유사한 크기의 EV를 선택합니다.
- 0.22μm로 여과된 PBS 1mL에 각각 1방울(50μL)을 5,000 beads/μL의 최종 농도로 희석하여 VER01A 및 VER01B 비드 샘플을 준비합니다.
- 샘플 수집
- SSC 로그 스케일과 FITC 로그 스케일의 점도표를 생성하고, 0.22μm 필터링된 PBS를 획득하고, 기준 배경 잡음을 정의합니다(그림 4A).
참고: 세포분석기의 유속을 낮음으로 설정하고 유속을 제어합니다. 초당 이벤트 수는 2,000개 이하여야 합니다. 유량이 낮다는 것은 차압이 낮다는 것을 의미합니다. - 대조군 샘플(염색되지 않은 EV)을 획득하고 유속을 확인합니다. 초당 이벤트 수가 약 5,000개의 이벤트인지 확인합니다.
참고: 이벤트 수가 제안된 수를 초과하면 샘플을 희석하십시오. - 염색된 PBS를 획득하고 CFSE 샘플로 처리하여 양성 반응이 보이지 않는지 확인합니다(그림 4B).
- CFSE 염색 샘플을 획득합니다. 유속에 따라 희석하십시오. CFSE 긍정적 이벤트를 식별하는 영역과 CFSE 부정적 이벤트를 식별하는 영역을 그립니다. 염색되지 않은 샘플을 대조군으로 사용합니다(그림 5A, B). 이것이 정렬 영역입니다.
- SSC 로그 스케일과 FITC 로그 스케일의 점도표를 생성하고, 0.22μm 필터링된 PBS를 획득하고, 기준 배경 잡음을 정의합니다(그림 4A).
- 시료 선별
- 정렬기 소프트웨어에서 새 프로토콜을 엽니다(도구 모음에서 파일 > 프로토콜 > 새로 만들기 선택).
- 분류기 소프트웨어에서 Data Acquisition Setting을 클릭합니다. 창에서 Acquisition Parameter, 관심 채널을 선택하고 다른 채널은 비활성화합니다. 이 특정 패널의 경우 사용할 수 있는 신호는 488-FSC1, 488-FSC2, 488-SSC 및 488-513/26 (CFSE 신호용)입니다.
- 샘플러에서 5mL 샘플의 튜브를 찾습니다. 터치 스크린에서 Load(로드 ) 버튼을 클릭하고 분류기 소프트웨어 도구 모음에서 Acquisition > Start(시작 )를 선택합니다(또는 F2 버튼을 누릅니다). 샘플 속성 창이 나타납니다. 샘플의 이름을 삽입하고 확인을 클릭합니다.
- 관심 있는 플롯이 있는 패널을 만들고 게이팅 전략을 만듭니다.
- 정렬기 소프트웨어 도구 모음에서 히스토그램 > 히스토그램 생성을 선택합니다.
- 작업 공간에서 세 개의 점 플롯을 생성하는데, 첫 번째는 x축에 488-FSC1 Height-Log 매개변수와 y축에 488-SSC Height-Log가 있고, 두 번째는 x축에 488-FSC2 Height-Log 매개변수와 y축에 488-SSC Height-Log가 있고, 세 번째는 x축에 488-513/26 CFSE Height-Log 매개변수와 y축에 488-SSC Height-Log가 있습니다.
- Sort Tab(정렬) 탭에서 정렬할 지역을 식별합니다. 분류기 소프트웨어에서 정렬 설정을 클릭합니다. Sort Logic and Statistic(정렬 로직 및 통계) 창에서 로직 빌더에서 정렬할 리전을 선택합니다.
참고: 정렬 결정을 내리려면 Sort Logic, Sort Mode 및 Drop Envelope와 같은 다양한 설정을 고려해야 합니다. 정렬 논리 는 게이팅 전략을 참조합니다. 선택한 게이트 밖에 있는 이벤트는 정렬되지 않습니다. 정렬 모드는 최종 출력과 관련이 있습니다. Purify 모드에서 작업하면 이러한 방식으로 정렬된 모든 드롭에는 원하는 positive 이벤트만 포함됩니다. Drop Envelope 는 포지티브 이벤트의 드롭에 있는 위치와 관련하여 얼마나 많은 드롭이 청구되고 정렬되는지를 정의합니다: 모든 포지티브 이벤트가 정렬되었는지 확인하기 위해 1-2개의 드롭을 선택합니다. - 유속이 안정되면 수집을 중지합니다(분류기 소프트웨어의 도구 모음에서 수집 > 중지 를 선택하거나 F2 버튼을 다시 누름). 정렬을 시작합니다(정렬 소프트웨어의 도구 모음에서 정렬 > 시작을 선택하거나 F4 버튼을 누름).
참고: 정렬을 시작하기 전에 테스트 스트림을 확인하십시오. 분류된 분획이 수집 튜브에 올바르게 떨어지는지 확인합니다. - 정렬 설정을 저장합니다. 분류기 소프트웨어의 도구 모음에서 Sort(정렬) > Save Sort Settings(정렬 설정 저장)를 선택합니다.
- 분류된 모집단의 순도 검사
- 높은 차압에서 5mL 세척 용액 튜브를 10분 동안 사용하고 5mL DI 물 튜브를 10분 동안 사용하여 기기를 세척합니다.
- 0.22μm 필터링된 PBS를 획득하고 CFSE 양성 이벤트가 없는지 확인합니다.
- 분류된 시료 5μL를 0.22μm 여과된 PBS 100μL에 희석합니다.
- 모든 샘플 부피를 획득하고 기록합니다(그림 5C, D).
참고: CFSE 포지티브 및 네거티브 정렬 EV의 재분석이 보고되었습니다.
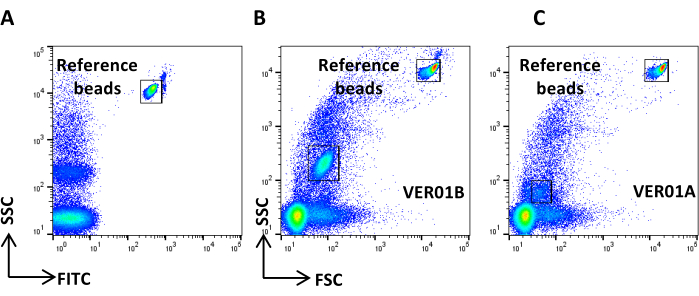
그림 3: 속이 빈 유기 실리카 비드를 사용한 물리적 매개변수 설정. (A) SSC/FITC 도트 플롯: SSC 매개변수를 설정하기 위해 참조 녹색, 형광 비드가 사용되었습니다. (B) VER01B 및 (C) VER01A 비드의 SSC/FSC 점도표. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 4: 참조 배경 잡음. (A) PBS 샘플의 SSC/CFSE 점도표. (B) PBS + CFSE 샘플의 SSC/CFSE 점도표. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
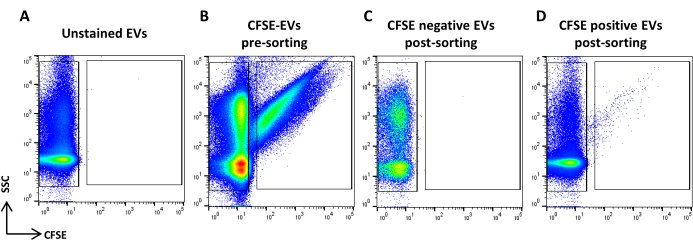
그림 5: CFSE 염색 ASC-EV 분류. (A) UNSTAINED EV의 SSC/CFSE 점도표, (B) CFSE 염색 EV, (C) CFSE 음성 EVs 분류 후, (D) CFSE positive EV 분류 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 사후 분류 분석
참고: 분류 후 재료의 양이 제한되어 있기 때문에 모든 분석을 수행하지 못할 수 있습니다. 얻은 양으로 다음을 수행합니다.
- 유세포 분석에 의한 EV 특성화: 표면 염색(2.2단계 참조)
참고: 샘플 준비를 제외한 사전 분류 샘플에 대해 이전에 설명한 바와 같습니다. 분류 후 샘플은 희석되지 않은 상태로 사용할 수 있습니다.- 희석되지 않은 분류된 샘플을 사용하고 2.2.3단계에 따라 진행합니다. (그림 6A)
- NTA에 의한 EV 농도 및 크기 특성화(2.4단계 참조)
참고: 샘플 준비를 제외한 사전 분류 샘플에 대해 이전에 설명한 바와 같습니다. 분류 후 샘플은 희석되지 않은 상태로 사용할 수 있습니다.- 희석되지 않은 분류된 샘플을 사용하고 2.4.2단계에 따라 진행합니다. (그림 6B)
- TEM에 의한 EV 형태학의 특성화(2.5단계 참조)
참고: 샘플 준비를 제외한 사전 분류 샘플에 대해 이전에 설명한 바와 같습니다.- PBS 2mL를 원심 농축기(재생 셀룰로오스 멤브레인, MWCO 100kDa), 캡 및 4,000 x g 의 원심분리기에 10분 동안 스윙 버킷 로터에 추가합니다. 필터 장치 하단에서 필터링되지 않은 PBS를 제거합니다.
- 수집 튜브에서 여과액을 흡입합니다. 요약된 원심 한외여과 프로토콜은 최대 15mL의 시료(최대 부피) 처리를 기반으로 합니다.
- AU-15 필터에 최대 15mL 샘플을 추가하고 장치를 닫습니다. 4,000 x g 에서 최대 30분 동안 원심분리기. 장치가 허용하는 최소 부피(약 100-150μL)까지 농축합니다.
- 필터 장치에서 농축된 분류된 EV 샘플을 회수하고 사전 분류 샘플 TEM에 대해 이전에 설명한 대로 진행합니다(단계 2.5.2)( 그림 6C).
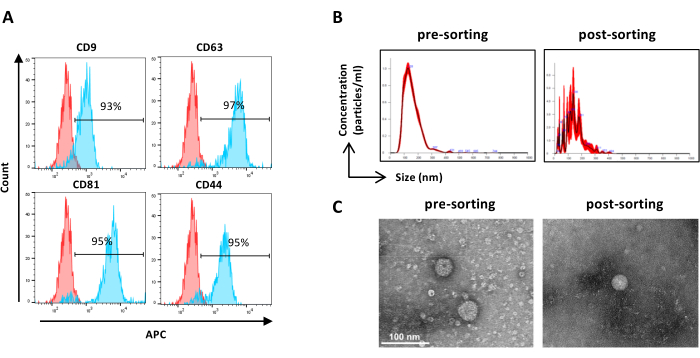
그림 6: 정렬된 ASC-EV의 특성화. EV 마커의 유세포 분석 분석. CD9, CD63, CD81 및 CD44 마커의 발현을 분석했습니다. 마커 발현을 위해 CFSE 양성 ASC-EV만 분석했습니다. (A) 히스토그램은 염색되지 않은(빨간색 히스토그램) 및 염색된(파란색 히스토그램) ASC-EV를 나타냅니다. (B) NTA에 의한 ASC-EV의 특성화. 히스토그램은 사전 분류(왼쪽) 및 사후 분류(오른쪽) 샘플의 농도(입자수/mL)/크기(nm)를 나타냅니다. (C) 사전 정렬(왼쪽) 및 사후 정렬(오른쪽) 샘플의 TEM에 의한 ASC-EV 시각화. 스케일 바 = 100nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
FSC 폴리스티렌 비드는 기기 설정 및 분류 조건을 검증하기 위해 분류되었습니다. FSC 폴리스티렌 비드는 100nm, 300nm, 500nm 및 900nm 범위의 형광 비드의 혼합물이며 FITC 채널에서 볼 수 있습니다. 그림 7A 는 정렬 전에 4개의 비드 모집단이 있는 SSC 로그 척도 대 FITC 로그 척도 점도를 보여줍니다. 100 nm, 300 nm 및 500 nm의 형광 집단을 게이트하고 분류했습니다...
Access restricted. Please log in or start a trial to view this content.
토론
EV를 분석하고 분류하는 것은 크기가 작고 대부분의 유세포 분석기의 검출 한계에 가깝기 때문에 까다롭습니다. 우리의 목표는 CFSE로 라벨링된 AMSC에서 파생된 EV를 분리하기 위한 프로토콜을 개발하는 것이었습니다. CFSE는 항체에 의해 제공된 단백질 응집체와 같은 원치 않는 입자가 형성되지 않고 높은 EV 라벨링 효율(≥90%)이 보고되었기 때문에 염색 방법으로 선택되었?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 내용이 없습니다.
감사의 말
기술 지원에 대해 Emanuele Canonico에게 감사드립니다. 이 작업의 일부는 IRCCS Ospedale San Raffaele과 Università Vita-Salute San Raffaele이 설립한 고급 현미경 실험실인 ALEMBIC에서 수행되었습니다. 엔리코 라그니(Enrico Ragni)와 로라 데 지롤라모(Laura de Girolamo)의 연구는 이탈리아 보건부 "Ricerca Corrente"의 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
참고문헌
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유