적응 염화칼슘 절차를 이용한 E.coli 세포의 형질변환
Overview
출처: 나탈리아 마틴1,앤드류 J. 반 알스트1,리안논 M. 레베크1,빅터 J. 디리타1
1 미시간 주립 대학 미생물학 및 분자 유전학학과
박테리아는 수평 유전자 전달로 알려진 과정에서 유전 물질(DeoxyriboNucleic acid, DNA)을 교환할 수 있는 능력을 갖는다. 외인성 DNA를 통합하는 것은 박테리아가 자연적인 서식지에서 발견되는 항생제 또는항체(1)또는 분자의 존재와 같은 변화하는 환경 조건에 적응할 수 있는 새로운 유전적 특성을 획득할 수 있는 메커니즘을제공한다(2). 수평 유전자 전달의 세 가지 메커니즘이 있다: 변환, 변환, 및 컨쥬게이션(3). 여기에서 우리는 변화, 박테리아가 환경에서 무료 DNA를 취할 수있는 능력에 초점을 맞출 것입니다. 실험실에서, 변환 과정은 네 가지 일반적인 단계를 갖는다: 1) 유능한 세포의 준비, 2) DNA를 가진 유능한 세포의 배양, 3) 세포의 회수, 및 4) 변압제의 성장을 위한 세포의 도금 (도 1).

그림 1: 변환 프로세스의 일반적인 단계입니다. 변형 과정에는 4가지 일반적인 단계가 있습니다: 1) 유능한 세포의 준비, 2) DNA를 가진 배양, 3) 세포의 회수 및 4) 변압제의 성장을 위한 도금 세포.
변환이 발생하기 위해, 받는 사람 박테리아는 능력으로 알려진 상태에 있어야합니다. 일부 박테리아는 특정 환경 조건에 대 한 응답으로 자연스럽 게 유능 될 수 있는 능력. 그러나, 많은 다른 박테리아 자연스럽 게 유능한 되지 않습니다., 또는이 과정에 대 한 조건은 아직 알 수 없습니다. 박테리아에 DNA를 소개하는 기능은 연구 응용 프로그램의 범위가 있다: 관심있는 DNA 분자의 여러 사본을 생성, 단백질의 많은 양을 표현하기 위해, 복제 절차의 구성 요소로, 그리고 다른 사람. 분자 생물학으로의 변환의 가치 때문에, 자연적인 역량을 위한 조건이 알려지지 않은 때 세포를 인위적으로 유능하게 하기 위한 몇몇 프로토콜이 있습니다. 두 가지 주요 방법은 인위적으로 유능한 세포를 준비하는 데 사용됩니다 : 1) 세포의 화학 적 처리를 통해 2) 전기 펄스 (전기 포기)에 세포를 노출. 전자는 DNA와 세포 표면 사이 매력을 만들기 위하여 절차에 따라 다른 화학제품을 이용하고, 후자는 DNA 분자가 입력할 수 있는 세균성 세포막에 있는 기공을 생성하기 위하여 전기장을 이용합니다. 화학적 역량에 대한 가장 효율적인 접근법은 이산양이양해, 특히 칼슘(Ca2+)(4,5)칼슘 유도 능력은 여기에 기재될 절차이다(6). 이 방법은 주로 그람 음성 박테리아의 변환에 사용되며, 그것은이 프로토콜의 초점이 될 것입니다.
화학 적 변환의 절차는 세포가 화학 적 능력을 유도하기 위해 양이온에 노출되는 일련의 단계를 포함한다. 이러한 단계는 이어서 온도 변화-열 충격-유능한 세포에 의해 외국 DNA의 섭취를 선호(7). 세균세포 봉투는 음전하로 충전됩니다. 대장균과같은 그람 음성 박테리아에서, 외부 막은 리포폴리사카라이드(LPS)(8)의 존재로 인해음전하된다. 이것은 유사하게 부정적인 충전된 DNA 분자의 반발 귀착됩니다. 화학적 능력 유도에서 양전하 칼슘 이온은 이 전하 반발을 중화시켜 세포 표면에 DNA 흡광도를 가능하게한다(9). DNA를 가진 칼슘 처리 그리고 잠복은 얼음에서 행해지습니다. 그 후, 더 높은 온도 (42°C)에서 인큐베이션, 열 충격이 수행됩니다. 이 온도 불균형은 DNA 섭취를 더 선호합니다. 세균 세포는 열 충격 처리를 견딜 수 있는 중간 기하급수적인 성장 단계에 있을 필요가 있습니다; 다른 성장 단계에서 세균 세포는 열에 너무 민감하여 생존율이 저하되어 변환 효율이 크게 감소합니다.
다른 DNA 소스는 변환을 위해 사용될 수 있습니다. 전형적으로, 플라스미드, 작은 원형, 이중 좌초 DNA 분자는 대장균의대부분의 실험실 절차에서 변형에 사용됩니다. 플라스미드가 변형 후 세균 세포에서 유지되려면 복제의 기원을 포함해야 합니다. 이것은 그(것)들이 세균성 염색체에서 독립적으로 세균성 세포에서 복제될 수 있습니다. 모든 세균 세포가 변형 절차 중에 변형되는 것은 아닙니다. 따라서, 변환은 변형된 세포와 비변형 세포의 혼합물을 산출한다. 이들 두 집단을 구별하기 위해 플라스미드를 획득한 세포를 식별하는 선택 방법이 사용된다. 플라스미드는 일반적으로 성장에 대한 이점을 부여하는 특성을 코딩하는 유전자인 선택 가능한 마커를 포함합니다(즉, 항생제 또는 화학 물질또는 성장 보조요법으로부터의 구조). 변환 후, 세균 세포는 변형 된 세포의 성장을 허용하는 선택적 매체에 도금됩니다. 주어진 항생제에 대한 내성을 부여하는 플라스미드로 변형된 세포의 경우, 선택적 미디어는 그 항생제를 함유하는 성장 매체가 될 것이다. 선택적 매체에서 자란 식민지가 변압제(즉, 플라스미드를 통합한 경우)임을 확인하는 몇 가지 다른 방법을 사용할 수 있다. 예를 들어, 플라스미드는 플라스미드 제제방법(10)을이세포로부터 회수하고 플라스미드 크기를 확인하기 위해 소화될 수 있다. 대안적으로, 콜로니 PCR은 관심의 플라스미드(11)의존재를 확인하는 데 사용할 수 있습니다.
본 실험의 목적은 대장균 DH5α가 화학적으로 유능한 세포를 준비하고, 염화칼슘시술(12)의적응을 이용하여, 플라스미드 pUC19로 변환하여 변환 효율을 결정하는 것이다. 대장균 균주 DH5α는 분자 생물학 응용 분야에서 일반적으로 사용되는 변형입니다. 그것의 유전자형 때문에, 특히 recA1 및 endA1,이 긴장은 증가한 삽입 안정성을 허용하고 후속 준비에 있는 plasmid DNA의 질을 향상합니다. DNA의 크기가 증가함에 따라 변환 효율이 감소하기 때문에, 플라스미드 pUC19는 작은 크기(2686 bp)로 인해 이 프로토콜에 사용되었다(벡터 맵에 대한 https://www.mobitec.com/cms/products/bio/04_vector_sys/standard_cloning_vectors.html 참조). pUC19는 암피실린에 대한 내성을 부여하므로, 이것은 선택에 사용되는 항생제였다.
Procedure
본 프로토콜은 염화칼슘절차(12)의적응을 이용하여 유능한 대장균 DH5α의 제조 및 변형을 설명한다.
1. 셋업
-
설비
- 분광광계
- 소발 원심분리기 (또는 이에 상응하는)
- 벤치탑 원심분리기
- 열 블록 또는 수조
- 궤도 셰이커
- 고정 인큐베이터
- 젤 캐스팅 트레이
- 잘 빗
- 전압 소스
- 젤 박스
- UV 광원
- 마이크로파
-
솔루션 및 시약
- 루리아 베르타니 (LB) 국물 (10 g 카제인 효소 가수 분해제, 효모 추출물 5g, 염화 나트륨 5 g H2O 1000mL)
- 카타볼라이트 억압(SOC)을 함유한 슈퍼 최적 국물: (2% (w/v) 트라이프톤, 0.5% (w/v) 효모 추출물, 10mM NaCl, 2.5mM KCl, 10mM MgCl2,10mM MgSO4,20mM포도당)
- CaCl2-MgCl2 (80 mM MgCl2,20 mM CaCl2)용액.
- M CaCl2 용액(세포가 즉시 변형되는 경우) 또는 10% (v/v) 글리세롤을 함유하는 0.1M CaCl2 용액(향후 사용을 위해 세포가 동결되는 경우).
- LB 한천 플레이트
- LB agar 선택적 플레이트 (이 실험을 위해, 플라스미드가 콩퍼 암피실린 저항을 사용했기 때문에, 암피실린 100 μg/mL을 포함하는 LB 한천 판이 사용되었다)
- 대장균 DH5α 균주
- 플라스미드 pUC19 DNA (100 pg/μl)
- QIAprep 스핀 미니프렙 키트 (키아겐)
- 힌드 (주) III 제한 효소
- 1 kb 플러스 DNA 사다리
- 낮은 융점 아가로즈
- 1X TAE 버퍼 (40m 트라이베이스, 20m 아세트산 및 1mM EDTA)
- 에티듐 브로마이드 (10mg/mL)
-
일반 안전 노트
대장균 DH5α는 생물안전 수준 1(BSL1)으로 분류됩니다. 이 범주에 있는 세균은 건강한 성인에 있는 감염의 거의 또는 전혀 위협을 제기합니다. 그러나 미생물을 신중하게 조작해야 합니다.
중요한 이 프로토콜의 모든 단계는 표시되지 않는 한 무균 기술과 얼음 또는 4°C 온도에서 수행해야 합니다.
2. 프로토콜
- 대장균 DH5α의 냉동 육수에서 (LB에서 자란 하룻밤 문화에서 20 % 글리세롤로 냉동) LB 한천 판에 격리박테리아를 줄입니다. 하룻밤 사이에 37°C에서 배양(16-20시간).
- 튜브에 있는 LB 국물의 3mL로 단일 식민지를 접종합니다. 하룻밤 사이에 37°C에서 210rpm에서 흔들리며 성장합니다(16-20시간).
- 하룻밤 문화의 OD600을 측정합니다. 하룻밤 문화를 사용하여 1리터 플라스크에서 LB 국물의 100mL를 OD600=0.01로 접종한다. 문화가 OD600=0.35(약 3시간)에 도달할 때까지 15-20분마다 분광계에서 37°C 모니터링 OD600에서 활발하게 흔들리는 배양(210rpm)을 배양한다.
참고: 변환이 효율적이기 위해서는 세균 세포가 중간 기하급수적인 성장 단계에 있어야 합니다. 세포의 최대 수는 108 세포/mL이어야 하며, 이는 대부분의 대장균균의 경우 OD600=0.4에 해당합니다. 분광계를 사용하면 OD600을 측정할 수 있으며, 이는 세포가 적절한 성장 단계에 있는지 확인할 수 있습니다. 이 프로토콜이 박테리아의 다른 균주에 사용되는 경우, 특정 OD600 값에서 단위를 형성하는 식민지수를 결정하기 위해 교정이 이 상관 관계를 결정하는 데 필요합니다. - 문화의 50mL를 각각 2개의 얼음 냉간 폴리프로필렌 원심분리기 병으로 옮춥니다. 병을 얼음 위에 20분 동안 놓아 식힙니다.
- 4°C에서 10분 동안 2700g(소발 GSA 로터의 4100rpm)에서 원심분리로 세포를 회수합니다.
- 상부체를 제거합니다. 병을 패드 나 종이 타월에 거꾸로 놓아 미디어의 마지막 흔적을 빼내십시오.
- 각 세균성 펠릿을 CaCl 2-MgCl 2(80m MgCl2, 20mM CaCl2)얼음냉용액의 30mL로 재보종한다. 먼저 5mL의 용액을 추가하고 펠릿이 완전히 용해될 때까지 조심스럽게 소용돌이쳐 남은 25mL의 용액을 추가합니다.
- 2.4 단계를 반복합니다.
- 2.5 단계를 반복합니다.
- 유능한 세포가 직접 변형될 경우 각 세균성 펠릿을 CaCl 2(0.1 M) 얼음 냉용액의 2mL로 조심스럽게 소용돌이치게 한다. 펠릿이 이 방법으로 다시 중단되지 않으면 위아래로 부드럽게 피펫팅하여 다시 중단하십시오(거품 형성을 피하십시오).
대안적으로, 유능한 세포는 동결및 나중에 사용하기 위해 저장될 수 있다. 유능한 세포의 냉동 된 주식을 준비하려면, 10 %(v /v) 글리세롤을 포함하는 0.1M CaCl2 용액의 2 ml에서 펠릿을 다시 놓습니다. 이 솔루션은 얼음차가운 것이어야 합니다. 얼음 감기 1.5 mL 폴리 프로필렌 튜브 (튜브 당 160 μl)로 알리 쿼트 셀 서스펜션. 마른 얼음/에탄올 욕조에서 유능한 세포를 즉시 동결하십시오. 튜브를 -70°C 냉동고로 옮춥춥시다. - CaCl2-처리된세포를 변환하기 위하여는, 2 1.5 ml polypropylene 관의 각으로 유능한 세포의 50 의 침을 전송합니다. pUC19 플라스미드 DNA의 1 μl(100 pg)을 튜브 중 하나에 추가하고 DNA(음성 제어)없이 두 번째 튜브를 둡니다. 부드럽게 섞으세요(거품 형성을 피하십시오). 얼음에 30 분 동안 배양.
참고: 10 μL 이하의 부피에서 DNA의 50 ng 이하는 변환에 사용되어서는 안됩니다. - 튜브를 열 블록으로 옮기고 42°C에서 45s의 배양을 정확하게 전달합니다.
참고: 열 충격은 중요한 단계입니다. 온도 또는 잠복기 시간을 초과하지 마십시오. - 튜브를 얼음으로 쉽게 옮기십시오. 2 분 동안 인큐베이션.
- SOC 매체의 950 μL을 추가하고 37°C에서 1시간 동안 튜브를 배양하여 박테리아가 플라스미드에서 인코딩된 항생제 내성 마커를 회수하고 표현할 수 있도록 합니다.
- SOC(1/100 희석)에서 1000 μL및 SOC(1/10 희석)에서 셀 서스펜션의 10μL을 희석시 1000 μL으로 희석한다. 희석제의 100 μl을 플레이트, 뿐만 아니라 컨트롤, 선택적 플레이트에, 주걱을 사용하여 확산. 일반적으로 1/100 및 1/10 희석의 100 μL을 도금하면 플레이트 당 충분한 수의 콜로니 성형 유닛(cfu)이 생성됩니다. 이상적으로, 이 숫자는 충분한 식민지가 있지만 서로 분리되도록 30-300 cfu 사이의 범위해야합니다. 그러나 cfu 수는 변환 효율성에 따라 달라집니다(데이터 분석 및 결과 섹션 참조).
- 플레이트를 37°C에서 배양합니다. 변형된 식민지는 12-16시간 동안 나타나야 합니다(이 범위는 세포 변형 및 선택 방법에 따라 달라집니다). 어떤 식민지도 부정적인 통제에서 성장해서는 안됩니다.
- 변환을 위해 얻은 cfu/플레이트를 계산합니다(표1).
- 변압제를 확인하기 위해 pUC19 플라스미드를 수용하고, 플라스미드 제제와 후속 소화가 수행됩니다. 이를 위해 단일 콜로니를 튜브에 3 ml의 LB 국물에 접종하십시오. 하룻밤 사이에 37°C에서 210rpm에서 흔들리며 성장합니다(16-20시간).
- 제조업체의 지시에 따라 QIAprep 스핀 미니프렙 키트를 사용하여 플라스미드 준비를 준비하십시오.
- 1시간 동안 37°C에서 제한 효소 힌dIII로 정제된 pUC19의 1 μg를 소화한다.
참고: pUC19 다중 복제 부위에서 절단하는 모든 효소는 이 단계에 사용할 수 있습니다.
| 구성 요소 | 분량 |
| 10X 제한 다이제스트 버퍼 | 2.5 μl |
| 플라스미드 pUC19 | 1 μg |
| 힌드 (주) III | 1 μl |
| H2O | 20.5 μl (25 μl까지) |
- 분자량 사다리, 소화된 pUC19 DNA 및 소화되지 않은 pUC19 DNA를 95V에서 1시간 동안 1 μg/mL 에티듐 브로마이드1%를 함유한 1% 아가로즈 젤로 실행한다.
참고: 사용 장비에 따라 시간과 전압이 달라집니다. - 자외선 아래에서 젤을 시각화합니다. 소화 및 소화되지 않은 pUC19 DNA의 크기를 비교합니다(그림2)(데이터 분석 및 결과 섹션 참조).
각 특정 변환 실험의 목표에 따라 변환을 확인하는 데 필요한 단계를 진행합니다.
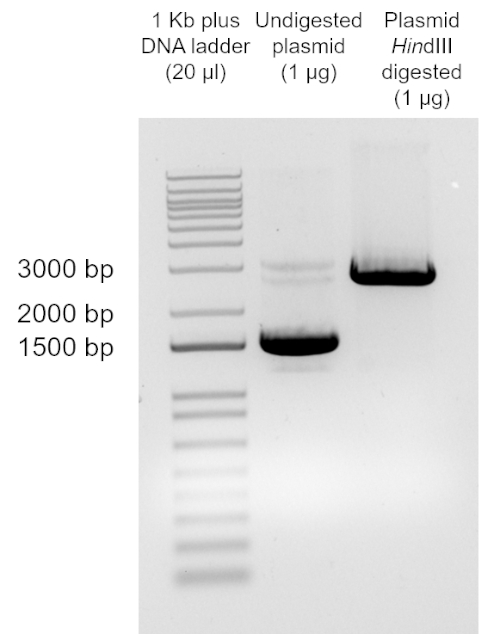
그림 2: 변형된 DH5α 세포에서 회수된 플라스미드 DNA의 소화. 플라스미드 DNA는 힌dIII로 소화된 변형된 DH5α 세포로부터 회수되었고, 1% 아가로즈 젤로 실행하고 UV 소스(단계 2.19 ~ 2.22)로 시각화하였다.
3. 데이터 분석 및 결과
변환 효율을 계산하기 위하여는, 세포가 세포외 DNA를 얼마나 잘 차지했는지의 표시기, 변환에서 얻은 식민지는 계산될 필요가 있습니다:
| 희석 | 쿠어 (주) |
| 1/100 | 34 |
| 1/10 | 246 |
표 1: 변환 실험에서 계산된 콜로니 성형 유닛(cfu).
변환 효율(TE)은 플라스미드 1μg을 유능한 셀의 지정된 부피로 변환하여 발생하는 cfu 수의 척도이다. 많은 파라미터는 플라스미드 크기, 세포 유전자형, 역량 준비 중 성장 단계, 변환 방법 등 변환 효율에 영향을 미칩니다. TE를 계산할 때 도금 전에 수행된 희석(있는 경우)을 고려하고 총 cfu 수의 계산에 통합하는 것이 중요합니다. 변환 효율(TE)은 다음 방정식으로 계산됩니다.
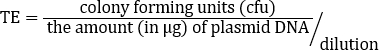
먼저 cfu를 DNA의 μg로 분할하여, 이 예에서 0.0001μg. 그런 다음 결과를 희석 계수로 나눕니다. 이 예에서, 1/10 희석이 사용되었고 1ml 용액의 100μL이 도금되었다(희석: 1/10 × 100 μL/1000 μL=0.01).
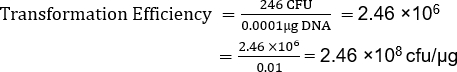
Results
TE는 많은 요인에 의존하지만, 비상업적 유능한 세포 제제는 이것과 같이 일반적으로 플라스미드의 마이크로그램당 106 내지 107변혁제를 산출합니다. 따라서 TE = 2.46 x 108 cfu/μg를 가진 이 제제는 예상 범위를 훨씬 초과하여 TE를 산출했습니다. 주어진 응용프로그램(13)에대해 더 높은 변환 효율성이 필요할 때 초능력 세포를 만들기 위한 추가 프로토콜을 사용할 수 있습니다.
변형된 세포로부터 회수된 플라스미드 DNA의 소화를 분석한 결과, 이 플라스미드는 pUC19 DNA(2686bp)의 예상 크기를 가지고 있음을 나타냈다.
Application and Summary
변환은 실험실에서 많은 분자 생물학 응용 프로그램의 핵심인 세균 세포에 외인성 DNA를 소개하는 강력한 방법입니다. 추가적으로, 그것은 세균세포가 증가한 유전 변이귀착될 수 있는 유전 물질을 교환하고 조건의 넓은 범위에서 생존을 위한 다른 유익한 특성의 취득을 허용해서 자연에 있는 중요한 역할을 합니다. 많은 세균성 균주는 자연적인 역량을 위해 요구되는 유전자를 인코딩합니다. 그러나, 이 유전자가 유도되는 조건은 아직도 알려지지 않습니다. 추가 연구는 이러한 조건을 결정 하는 데 필요한.
References
- Croucher, N. J. et al. Rapid pneumococcal evolution in response to clinical interventions. Science. 331 (6016):430-434. (2011)
- Borgeaud, S. et al. The type VI secretion system of Vibrio cholerae fosters horizontal gene transfer. Science. 347(6217):63-67. (2015)
- Burmeister, A. R. Horizontal Gene Transfer. Evol Med Public Health. 2015 (1):193-194. (2015)
- Weston A, Brown MG, Perkins HR, Saunders JR, Humphreys GO. Transformation of Escherichia coli with plasmid deoxyribonucleic acid: calcium-induced binding of deoxyribonucleic acid to whole cells and to isolated membrane fractions. J Bacteriol. 145 (2):780-7. (1981)
- Dagert M, Ehrlich SD. Prolonged incubation in calcium chloride improves the competence of Escherichia coli cells. Gene. 6 (1):23-8. (1979)
- Asif A, Mohsin H, Tanvir R, and Rehman Y. Revisiting the Mechanisms Involved in Calcium Chloride Induced Bacterial Transformation. Front Microbiol. 8:2169. (2017)
- Panja S, Aich P, Jana B, Basu T. How does plasmid DNA penetrate cell membranes in artificial transformation process of Escherichia coli? Mol Membr Biol. 25 (5):411-22. (2008)
- Silhavy, TJ, Kahne D, Walker S. The Bacterial Cell Envelope. Cold Spring Harb Perspect Biol. 2 (5): a000414. (2010)
- Panja S, Aich P, Jana B, Basu T. (2008) Plasmid DNA binds to the core oligosaccharide domain of LPS molecules of E. coli cell surface in the CaCl2-mediated transformation process. Biomacromolecules. 9 (9):2501-9.
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Plasmid Purification. JoVE, Cambridge, MA. (2018)
- Bergkessel M and Guthrie C. Colony PCR. Methods in Enzymology. 529: 299-309. (2013)
- Sambrook J and Russell DW. Molecular Cloning A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.Protocol 25 (1.116-118). (2001)
- Wirth R, Friesenegger A, Fiedler S. Transformation of various species of gram-negative bacteria belonging to 11 different genera by electroporation. Molecular & General Genetics. 216 (1): 175-7. (1989)
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
적응 염화칼슘 절차를 이용한 E.coli 세포의 형질변환
Microbiology
87.1K Views

위노그라드스키 칼럼 생성: 퇴적물 검체에서 미생물 종을 풍부하게하는 방법
Microbiology
129.9K Views

연속 희석 및 플레이팅: 미생물 나열
Microbiology
317.1K Views

농축 배양: 선택 및 차동 매체에서 호기성 및 혐기성 미생물 배양
Microbiology
132.2K Views

순수 배양 및 줄무늬 평판배양: 혼합 검체에서 단일 박테리아 군집 분리
Microbiology
166.4K Views

16S rRNA 시퀀싱: 박테리아 종 식별을위한 PCR 기반 기술
Microbiology
189.7K Views

성장 곡선: 군집 형성 단위 및 광학 밀도 측정을 사용하여 성장 곡선 생성
Microbiology
297.9K Views

항생 물질 감수성 시험: 두 항생제의 MIC 값을 결정하고 항생 시너지를 평가하기 위한 Epsilometer 검사
Microbiology
93.9K Views

현미경 및 염색: 그램, 캡슐 및 내생포자 염색
Microbiology
364.1K Views

플라크 분석: 플라크 형성 단위(PFU)로서 바이러스 역가를 결정하는 방법
Microbiology
186.5K Views

접합: 공여 E.coli에서 수용 E.coli로 암피실린 내성을 전달하는 방법
Microbiology
38.4K Views

파지 형질도입: 공여 E.coli에서 수용 E.coli로 암피실린 내성을 전달하는 방법
Microbiology
29.1K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유