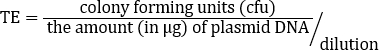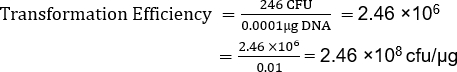적응 염화칼슘 절차를 이용한 E.coli 세포의 형질변환
Overview
출처: 나탈리아 마틴1,앤드류 J. 반 알스트1,리안논 M. 레베크1,빅터 J. 디리타1
1 미시간 주립 대학 미생물학 및 분자 유전학학과
박테리아는 수평 유전자 전달로 알려진 과정에서 유전 물질(DeoxyriboNucleic acid, DNA)을 교환할 수 있는 능력을 갖는다. 외인성 DNA를 통합하는 것은 박테리아가 자연적인 서식지에서 발견되는 항생제 또는항체(1)또는 분자의 존재와 같은 변화하는 환경 조건에 적응할 수 있는 새로운 유전적 특성을 획득할 수 있는 메커니즘을제공한다(2). 수평 유전자 전달의 세 가지 메커니즘이 있다: 변환, 변환, 및 컨쥬게이션(3). 여기에서 우리는 변화, 박테리아가 환경에서 무료 DNA를 취할 수있는 능력에 초점을 맞출 것입니다. 실험실에서, 변환 과정은 네 가지 일반적인 단계를 갖는다: 1) 유능한 세포의 준비, 2) DNA를 가진 유능한 세포의 배양, 3) 세포의 회수, 및 4) 변압제의 성장을 위한 세포의 도금 (도 1).

그림 1: 변환 프로세스의 일반적인 단계입니다. 변형 과정에는 4가지 일반적인 단계가 있습니다: 1) 유능한 세포의 준비, 2) DNA를 가진 배양, 3) 세포의 회수 및 4) 변압제의 성장을 위한 도금 세포.
변환이 발생하기 위해, 받는 사람 박테리아는 능력으로 알려진 상태에 있어야합니다. 일부 박테리아는 특정 환경 조건에 대 한 응답으로 자연스럽 게 유능 될 수 있는 능력. 그러나, 많은 다른 박테리아 자연스럽 게 유능한 되지 않습니다., 또는이 과정에 대 한 조건은 아직 알 수 없습니다. 박테리아에 DNA를 소개하는 기능은 연구 응용 프로그램의 범위가 있다: 관심있는 DNA 분자의 여러 사본을 생성, 단백질의 많은 양을 표현하기 위해, 복제 절차의 구성 요소로, 그리고 다른 사람. 분자 생물학으로의 변환의 가치 때문에, 자연적인 역량을 위한 조건이 알려지지 않은 때 세포를 인위적으로 유능하게 하기 위한 몇몇 프로토콜이 있습니다. 두 가지 주요 방법은 인위적으로 유능한 세포를 준비하는 데 사용됩니다 : 1) 세포의 화학 적 처리를 통해 2) 전기 펄스 (전기 포기)에 세포를 노출. 전자는 DNA와 세포 표면 사이 매력을 만들기 위하여 절차에 따라 다른 화학제품을 이용하고, 후자는 DNA 분자가 입력할 수 있는 세균성 세포막에 있는 기공을 생성하기 위하여 전기장을 이용합니다. 화학적 역량에 대한 가장 효율적인 접근법은 이산양이양해, 특히 칼슘(Ca2+)(4,5)칼슘 유도 능력은 여기에 기재될 절차이다(6). 이 방법은 주로 그람 음성 박테리아의 변환에 사용되며, 그것은이 프로토콜의 초점이 될 것입니다.
화학 적 변환의 절차는 세포가 화학 적 능력을 유도하기 위해 양이온에 노출되는 일련의 단계를 포함한다. 이러한 단계는 이어서 온도 변화-열 충격-유능한 세포에 의해 외국 DNA의 섭취를 선호(7). 세균세포 봉투는 음전하로 충전됩니다. 대장균과같은 그람 음성 박테리아에서, 외부 막은 리포폴리사카라이드(LPS)(8)의 존재로 인해음전하된다. 이것은 유사하게 부정적인 충전된 DNA 분자의 반발 귀착됩니다. 화학적 능력 유도에서 양전하 칼슘 이온은 이 전하 반발을 중화시켜 세포 표면에 DNA 흡광도를 가능하게한다(9). DNA를 가진 칼슘 처리 그리고 잠복은 얼음에서 행해지습니다. 그 후, 더 높은 온도 (42°C)에서 인큐베이션, 열 충격이 수행됩니다. 이 온도 불균형은 DNA 섭취를 더 선호합니다. 세균 세포는 열 충격 처리를 견딜 수 있는 중간 기하급수적인 성장 단계에 있을 필요가 있습니다; 다른 성장 단계에서 세균 세포는 열에 너무 민감하여 생존율이 저하되어 변환 효율이 크게 감소합니다.
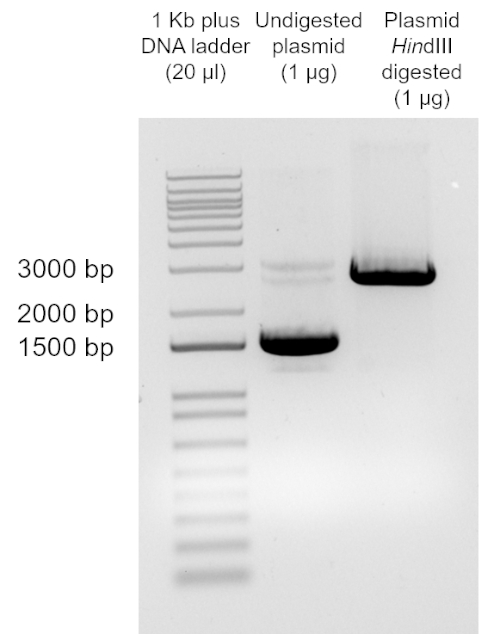
다른 DNA 소스는 변환을 위해 사용될 수 있습니다. 전형적으로, 플라스미드, 작은 원형, 이중 좌초 DNA 분자는 대장균의대부분의 실험실 절차에서 변형에 사용됩니다. 플라스미드가 변형 후 세균 세포에서 유지되려면 복제의 기원을 포함해야 합니다. 이것은 그(것)들이 세균성 염색체에서 독립적으로 세균성 세포에서 복제될 수 있습니다. 모든 세균 세포가 변형 절차 중에 변형되는 것은 아닙니다. 따라서, 변환은 변형된 세포와 비변형 세포의 혼합물을 산출한다. 이들 두 집단을 구별하기 위해 플라스미드를 획득한 세포를 식별하는 선택 방법이 사용된다. 플라스미드는 일반적으로 성장에 대한 이점을 부여하는 특성을 코딩하는 유전자인 선택 가능한 마커를 포함합니다(즉, 항생제 또는 화학 물질또는 성장 보조요법으로부터의 구조). 변환 후, 세균 세포는 변형 된 세포의 성장을 허용하는 선택적 매체에 도금됩니다. 주어진 항생제에 대한 내성을 부여하는 플라스미드로 변형된 세포의 경우, 선택적 미디어는 그 항생제를 함유하는 성장 매체가 될 것이다. 선택적 매체에서 자란 식민지가 변압제(즉, 플라스미드를 통합한 경우)임을 확인하는 몇 가지 다른 방법을 사용할 수 있다. 예를 들어, 플라스미드는 플라스미드 제제방법(10)을이세포로부터 회수하고 플라스미드 크기를 확인하기 위해 소화될 수 있다. 대안적으로, 콜로니 PCR은 관심의 플라스미드(11)의존재를 확인하는 데 사용할 수 있습니다.
본 실험의 목적은 대장균 DH5α가 화학적으로 유능한 세포를 준비하고, 염화칼슘시술(12)의적응을 이용하여, 플라스미드 pUC19로 변환하여 변환 효율을 결정하는 것이다. 대장균 균주 DH5α는 분자 생물학 응용 분야에서 일반적으로 사용되는 변형입니다. 그것의 유전자형 때문에, 특히 recA1 및 endA1,이 긴장은 증가한 삽입 안정성을 허용하고 후속 준비에 있는 plasmid DNA의 질을 향상합니다. DNA의 크기가 증가함에 따라 변환 효율이 감소하기 때문에, 플라스미드 pUC19는 작은 크기(2686 bp)로 인해 이 프로토콜에 사용되었다(벡터 맵에 대한 https://www.mobitec.com/cms/products/bio/04_vector_sys/standard_cloning_vectors.html 참조). pUC19는 암피실린에 대한 내성을 부여하므로, 이것은 선택에 사용되는 항생제였다.
Procedure
본 프로토콜은 염화칼슘절차(12)의적응을 이용하여 유능한 대장균 DH5α의 제조 및 변형을 설명한다.
1. 셋업
-
설비
- 분광광계
- 소발 원심분리기 (또는 이에 상응하는)
- 벤치탑 원심분리기
- 열 블록 또는 수조
- 궤도 셰이커
- 고정 인큐베이터
- 젤 캐스팅 트레이
- 잘 빗
- 전압 소스
- 젤 박스
- UV 광원
- 마이크로파
-
솔루션 및 시약
- 루리아 베르타니 (LB) 국물 (10 g 카제인 효소 가수 분해제, 효모 추출물 5g, 염화 나트륨 5 g H2
Results
TE는 많은 요인에 의존하지만, 비상업적 유능한 세포 제제는 이것과 같이 일반적으로 플라스미드의 마이크로그램당 106 내지 107변혁제를 산출합니다. 따라서 TE = 2.46 x 108 cfu/μg를 가진 이 제제는 예상 범위를 훨씬 초과하여 TE를 산출했습니다. 주어진 응용프로그램(13)에대해 더 높은 변환 효율성이 필요할 때 초능력 세포를 만들기 위한 ...
Application and Summary
변환은 실험실에서 많은 분자 생물학 응용 프로그램의 핵심인 세균 세포에 외인성 DNA를 소개하는 강력한 방법입니다. 추가적으로, 그것은 세균세포가 증가한 유전 변이귀착될 수 있는 유전 물질을 교환하고 조건의 넓은 범위에서 생존을 위한 다른 유익한 특성의 취득을 허용해서 자연에 있는 중요한 역할을 합니다. 많은 세균성 균주는 자연적인 역량을 위해 요구되는 유전자를 인코딩합니다. 그?...
References
- Croucher, N. J. et al. Rapid pneumococcal evolution in response to clinical interventions. Science. 331 (6016):430-434. (2011)
- Borgeaud, S. et al. The type VI secretion system of Vibrio cholerae fosters horizontal gene transfer. Science. 347(6217):63-67. (2015)
- Burmeister, A. R. Horizontal Gene Transfer. Evol Med Public Health. 2015 (1):193-194. (2015)
- Weston A, Brown MG, Perkins HR, Saunders JR, Humphreys GO. Transformation of Escherichia coli with plasmid deoxyribonucleic acid: calcium-induced binding of deoxyribonucleic acid to whole cells and to isolated membrane fractions. J Bacteriol. 145 (2):780-7. (1981)
- Dagert M, Ehrlich SD. Prolonged incubation in calcium chloride improves the competence of Escherichia coli cells. Gene. 6 (1):23-8. (1979)
- Asif A, Mohsin H, Tanvir R, and Rehman Y. Revisiting the Mechanisms Involved in Calcium Chloride Induced Bacterial Transformation. Front Microbiol. 8:2169. (2017)
- Panja S, Aich P, Jana B, Basu T. How does plasmid DNA penetrate cell membranes in artificial transformation process of Escherichia coli? Mol Membr Biol. 25 (5):411-22. (2008)
- Silhavy, TJ, Kahne D, Walker S. The Bacterial Cell Envelope. Cold Spring Harb Perspect Biol. 2 (5): a000414. (2010)
- Panja S, Aich P, Jana B, Basu T. (2008) Plasmid DNA binds to the core oligosaccharide domain of LPS molecules of E. coli cell surface in the CaCl2-mediated transformation process. Biomacromolecules. 9 (9):2501-9.
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Plasmid Purification. JoVE, Cambridge, MA. (2018)
- Bergkessel M and Guthrie C. Colony PCR. Methods in Enzymology. 529: 299-309. (2013)
- Sambrook J and Russell DW. Molecular Cloning A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.Protocol 25 (1.116-118). (2001)
- Wirth R, Friesenegger A, Fiedler S. Transformation of various species of gram-negative bacteria belonging to 11 different genera by electroporation. Molecular & General Genetics. 216 (1): 175-7. (1989)
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
적응 염화칼슘 절차를 이용한 E.coli 세포의 형질변환
Microbiology
87.0K Views

위노그라드스키 칼럼 생성: 퇴적물 검체에서 미생물 종을 풍부하게하는 방법
Microbiology
129.7K Views

연속 희석 및 플레이팅: 미생물 나열
Microbiology
316.6K Views

농축 배양: 선택 및 차동 매체에서 호기성 및 혐기성 미생물 배양
Microbiology
132.1K Views

순수 배양 및 줄무늬 평판배양: 혼합 검체에서 단일 박테리아 군집 분리
Microbiology
166.3K Views

16S rRNA 시퀀싱: 박테리아 종 식별을위한 PCR 기반 기술
Microbiology
189.3K Views

성장 곡선: 군집 형성 단위 및 광학 밀도 측정을 사용하여 성장 곡선 생성
Microbiology
297.1K Views

항생 물질 감수성 시험: 두 항생제의 MIC 값을 결정하고 항생 시너지를 평가하기 위한 Epsilometer 검사
Microbiology
93.9K Views

현미경 및 염색: 그램, 캡슐 및 내생포자 염색
Microbiology
363.7K Views

플라크 분석: 플라크 형성 단위(PFU)로서 바이러스 역가를 결정하는 방법
Microbiology
186.4K Views

접합: 공여 E.coli에서 수용 E.coli로 암피실린 내성을 전달하는 방법
Microbiology
38.3K Views

파지 형질도입: 공여 E.coli에서 수용 E.coli로 암피실린 내성을 전달하는 방법
Microbiology
29.1K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유