11.10 : Epoksydacja Sharplessa
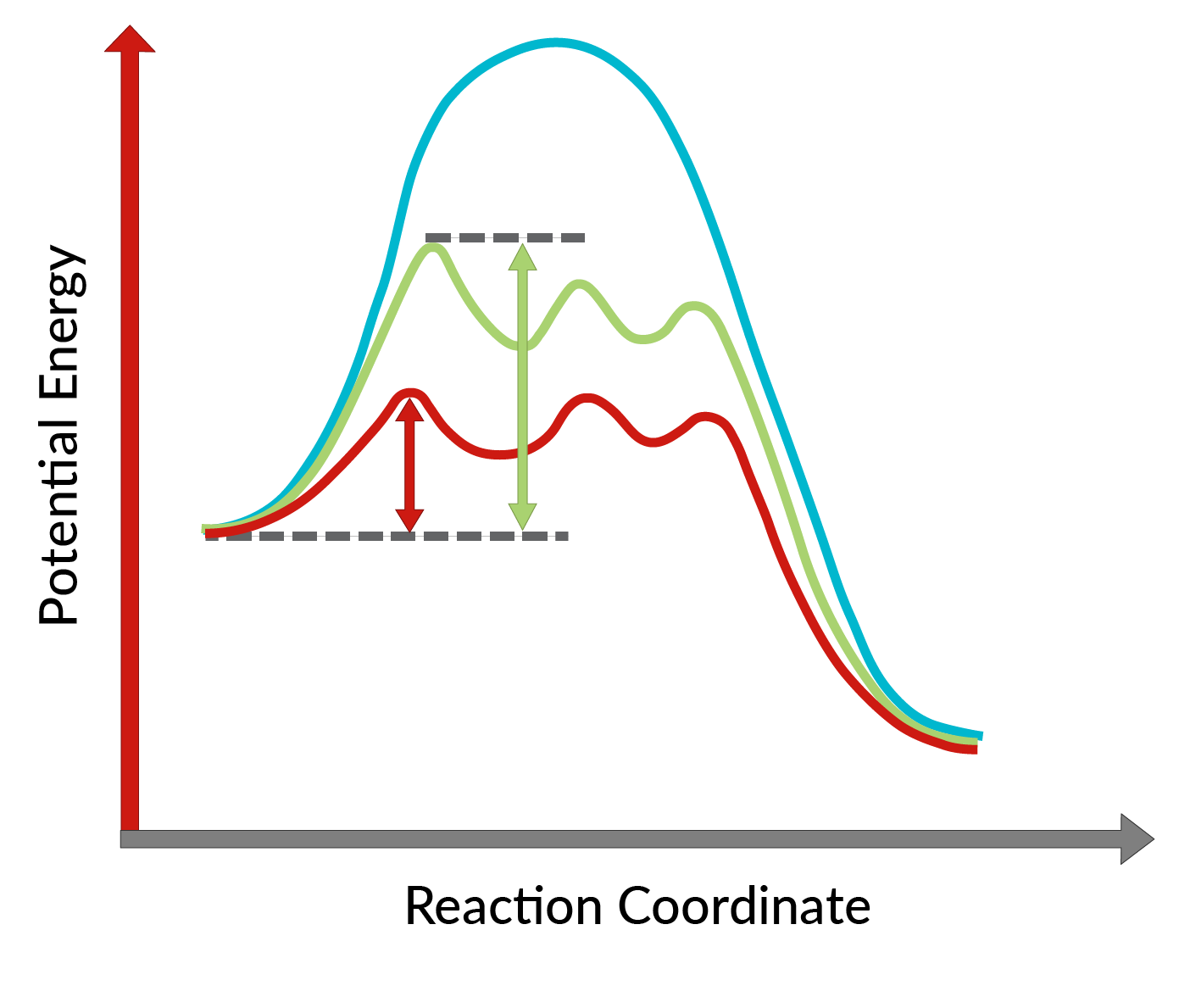
Przekształcenie alkoholi allilowych w epoksydy przy użyciu chiralnego katalizatora odkrył K. Barry Sharpless i jest znane jako epoksydacja Sharplessa. Zastosowanie katalizatora chiralnego umożliwia utworzenie jednego enancjomeru produktu w nadmiarze. Ten chiralny katalizator składa się głównie z chiralnego kompleksu tetraizopropanolanu tytanu i estru winianowego (specyficzny stereoizomer). Stereoizomer zastosowany w chiralnym katalizatorze decyduje o tworzeniu się enancjomeru produktu. Innymi słowy, zastosowanie winianu L-(+)-dietylu prowadzi do enancjomerów mających pierścień epoksydowy poniżej płaszczyzny, natomiast w przypadku winianu D-(-)-dietylu do enancjomerów z pierścieniem epoksydowym powyżej płaszczyzny. Wysoką enancjoselektywność reakcji można wyjaśnić biorąc pod uwagę energie aktywacji wymagane do tego, aby reakcja przebiegała w kierunku do przodu w obecności chiralnego katalizatora. Jak pokazano na rysunku 1, w porównaniu z reakcją niekatalizowaną (niebieska krzywa), energia aktywacji reakcji drastycznie spada po dodaniu chiralnego katalizatora (krzywe czerwona i zielona). Co więcej, energia aktywacji tworzenia jednego enancjomeru (czerwona krzywa) jest obniżona bardziej niż innego enancjomeru (zielona krzywa), co prowadzi do powstania jednego enancjomeru w nadmiarze. Zatem reakcję epoksydacji Sharplessa można zastosować do syntezy pożądanych enancjomerów produktu.
Stereochemię produktu powstałego, gdy dowolny alkohol allilowy poddaje się epoksydacji Sharplessa, można przewidzieć, po prostu ustawiając cząsteczkę alkoholu allilowego w płaszczyźnie z grupami hydroksylowymi skierowanymi w stronę prawego dolnego rogu, jak pokazano na rysunku 2. Na tej płaskiej strukturze, Winian D-(-)-dietylu dostarcza tlen z górnej powierzchni alkenu, umożliwiając tworzenie epoksydu znad płaszczyzny, podczas gdy winian L-(+)-dietylu dostarcza tlen z dolnej powierzchni alkenu, w ten sposób montaż pierścienia epoksydowego od spodu płaszczyzny.
Z rozdziału 11:

Now Playing
11.10 : Epoksydacja Sharplessa
Ethers, Epoxides, Sulfides
3.8K Wyświetleń

11.1 : Struktura i nomenklatura eterów
Ethers, Epoxides, Sulfides
11.1K Wyświetleń

11.2 : Właściwości fizyczne eterów
Ethers, Epoxides, Sulfides
6.9K Wyświetleń

11.3 : Etery z alkoholi: odwadnianie alkoholu i synteza eteru Williamsona
Ethers, Epoxides, Sulfides
10.1K Wyświetleń

11.4 : Etery z alkenów: dodatek alkoholu i alkoksymerkuracja-odmerkurowanie
Ethers, Epoxides, Sulfides
7.7K Wyświetleń

11.5 : Etery do halogenków alkilowych: rozszczepienie kwasowe
Ethers, Epoxides, Sulfides
5.6K Wyświetleń

11.6 : Autooksydacja eterów do nadtlenków i wodoronadtlenków
Ethers, Epoxides, Sulfides
7.4K Wyświetleń

11.7 : Etery koronowe
Ethers, Epoxides, Sulfides
5.1K Wyświetleń

11.8 : Struktura i nazewnictwo epoksydów
Ethers, Epoxides, Sulfides
6.3K Wyświetleń

11.9 : Przygotowanie epoksydów
Ethers, Epoxides, Sulfides
7.4K Wyświetleń

11.11 : Katalizowane kwasem otwieranie pierścieni epoksydów
Ethers, Epoxides, Sulfides
7.1K Wyświetleń

11.12 : Katalizowane zasadą otwieranie pierścieni epoksydów
Ethers, Epoxides, Sulfides
8.3K Wyświetleń

11.13 : Struktura i nomenklatura tioli i siarczków
Ethers, Epoxides, Sulfides
4.6K Wyświetleń

11.14 : Przygotowanie i reakcje tioli
Ethers, Epoxides, Sulfides
5.9K Wyświetleń

11.15 : Otrzymywanie i reakcje siarczków
Ethers, Epoxides, Sulfides
4.7K Wyświetleń
Copyright © 2025 MyJoVE Corporation. Wszelkie prawa zastrzeżone