11.10 : Époxydation sans tranchant
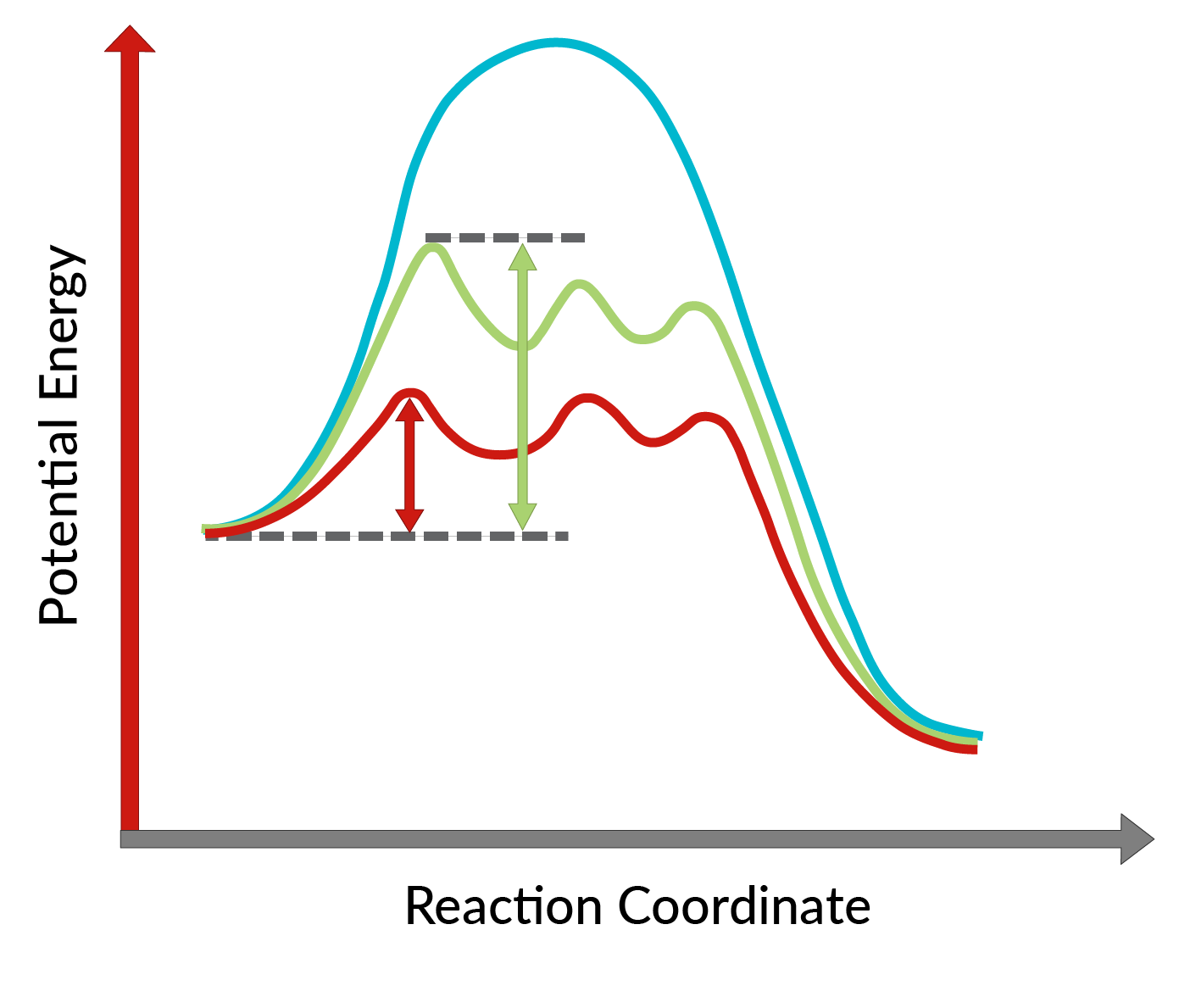
La conversion des alcools allyliques en époxydes à l'aide du catalyseur chiral a été découverte par K. Barry Sharpless et est connue sous le nom d'époxydation Sharpless. L'utilisation d'un catalyseur chiral permet la formation d'un énantiomère du produit en excès. Ce catalyseur chiral est principalement un complexe chiral de tétraisopropoxyde de titane et d'ester tartrique (stéréoisomère spécifique). Le stéréoisomère utilisé dans le catalyseur chiral dicte la formation de l'énantiomère du produit. En d'autres termes, l'utilisation du tartrate de L-(+)-diéthyle conduit à des énantiomères ayant le cycle époxyde en dessous du plan, tandis qu'avec le tartrate de D-(−)-diéthyle, des énantiomères ayant le cycle époxyde au-dessus du plan. La forte énantiosélectivité de la réaction peut s'expliquer en considérant les énergies d'activation nécessaires pour que la réaction se déroule dans le sens direct en présence du catalyseur chiral. Comme le montre la figure 1, par rapport à la réaction non catalysée (courbe bleue), l'énergie d'activation de la réaction diminue considérablement avec l'ajout du catalyseur chiral (courbes rouge et verte). De plus, l’énergie d’activation pour la formation d’un énantiomère (courbe rouge) est plus réduite que celle d’un autre énantiomère (courbe verte), conduisant à la formation d’un énantiomère en excès. Par conséquent, la réaction d’époxydation Sharpless peut être utilisée pour la synthèse des énantiomères souhaités du produit.
La stéréochimie du produit formé lorsqu'un alcool allylique est soumis à une époxydation Sharpless peut être prédite en orientant simplement la molécule d'alcool allylique dans un plan avec les groupes hydroxyle pointant vers le coin inférieur droit, comme le montre la figure 2. Sur cette structure planaire, Le tartrate de D-(−)-diéthyle délivre l'oxygène de la face supérieure de l'alcène, rendant la formation d'époxyde possible depuis le dessus du plan, tandis que le tartrate de L-(+)-diéthyle délivre l'oxygène de la face inférieure de l'alcène, permettant ainsi installer l'anneau époxy par le dessous de l'avion.
Du chapitre 11:

Now Playing
11.10 : Époxydation sans tranchant
Ethers, Epoxydes, sulfures
3.8K Vues

11.1 : Structure et nomenclature des éthers
Ethers, Epoxydes, sulfures
11.2K Vues

11.2 : Propriétés physiques des éthers
Ethers, Epoxydes, sulfures
6.9K Vues

11.3 : Déshydratation d'un alcool et synthèse de Williamson : formation d'un éther
Ethers, Epoxydes, sulfures
10.2K Vues

11.4 : Un éther à partir d'un alcène : addition d'alcool et démercuration-oxymercuration
Ethers, Epoxydes, sulfures
7.7K Vues

11.5 : Clivage acide d'un éther : obtention d'un halogénure d'alkyle
Ethers, Epoxydes, sulfures
5.6K Vues

11.6 : Auto-oxydation des éthers en peroxydes et hydroperoxydes
Ethers, Epoxydes, sulfures
7.4K Vues

11.7 : Éthers couronnes
Ethers, Epoxydes, sulfures
5.1K Vues

11.8 : Structure et nomenclature des époxydes
Ethers, Epoxydes, sulfures
6.3K Vues

11.9 : Préparation d'époxydes
Ethers, Epoxydes, sulfures
7.4K Vues

11.11 : Ouverture de l'anneau d'époxyde initiée par un acide
Ethers, Epoxydes, sulfures
7.1K Vues

11.12 : Ouverture de l'anneau d'époxyde initiée par une base
Ethers, Epoxydes, sulfures
8.3K Vues

11.13 : Structure et nomenclature des thiols et des sulfures
Ethers, Epoxydes, sulfures
4.6K Vues

11.14 : Préparation et réactions des thiols
Ethers, Epoxydes, sulfures
6.0K Vues

11.15 : Préparation et réactions des sulfures
Ethers, Epoxydes, sulfures
4.7K Vues