Através de experiências, os cientistas estabeleceram as relações matemáticas entre pares de variáveis, tais como pressão e temperatura, pressão e volume, volume e temperatura, volume e moles, que se mantêm para um gás ideal.
Pressão e Temperatura: Lei de Gay-Lussac (Lei de Amontons)
Imagine encher um recipiente rígido preso a um manómetro de pressão com gás e, em seguida, vedar o recipiente de modo a que nenhum gás possa sair. Se o recipiente for arrefecido, o gás no interior fica do mesmo modo mais frio e observa-se que a sua pressão diminui. Uma vez que o recipiente é rígido e bem vedado, tanto o volume como o número de moles de gás permanecem constantes. Se a esfera for aquecida, o gás no interior fica mais quente e a pressão aumenta.
A temperatura e a pressão estão relacionadas linearmente, e essa relação é observada para qualquer amostra de gás confinada em um volume constante. Se a temperatura estiver na escala de kelvin, então P e T são diretamente proporcionais (mais uma vez, quando o volume e moles de gás são mantidos constantes); se a temperatura na escala de kelvin aumentar por um determinado factor, a pressão do gás aumenta pelo mesmo factor.
Esta relação de pressão-temperatura para os gases é conhecida como lei de Gay-Lussac. A lei afirma que a pressão de uma determinada quantidade de gás é diretamente proporcional à sua temperatura na escala de kelvin quando o volume é mantido constante. Matematicamente, isto pode ser escrito como:

onde k é uma constante de proporcionalidade que depende da identidade, quantidade, e volume do gás. Para um volume constante e confinado de gás, a relação P/T é então constante (ou seja, P/T = k). Se o gás estiver inicialmente na ‘Condição 1’ (com P = P1 and T = T1) e mudar para a ‘Condição 2’ (com P = P2 and T = T2), então
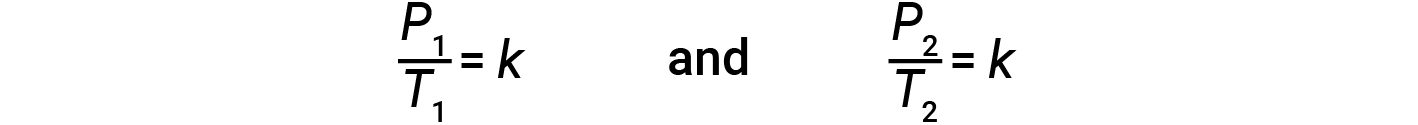
Por conseguinte,
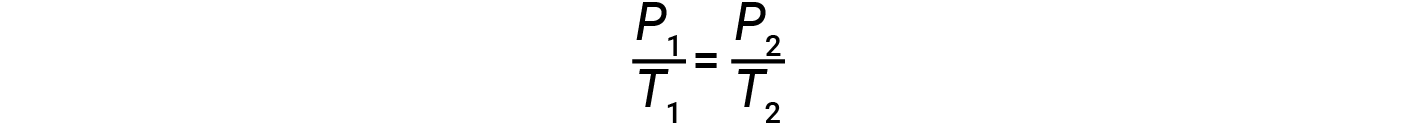
Note que para qualquer cálculo de lei de gases, as temperaturas devem estar na escala de kelvin.
Volume e Temperatura: A Lei de Charles
Se um balão estiver cheio de ar e selado, o balão contém uma quantidade específica de ar à pressão atmosférica (1 atm). Se o balão for colocado em um frigorífico, o gás de dentro fica frio, e o balão encolhe (embora a quantidade de gás e a sua pressão permaneçam constantes). Se o balão ficar muito frio, ele irá encolher muito. Quando é aquecido, o balão irá expandir-se novamente.
Este é um exemplo do efeito da temperatura no volume de uma determinada quantidade de gás confinado a uma pressão constante. O volume aumenta à medida que a temperatura aumenta e o volume diminui à medida que a temperatura diminui.
A relação entre o volume e a temperatura de uma determinada quantidade de gás a uma pressão constante é conhecida como lei de Charles. A lei afirma que o volume de uma determinada quantidade de gás é diretamente proporcional à sua temperatura na escala de kelvin quando a pressão é mantida constante.
Matematicamente, isto pode ser escrito como:
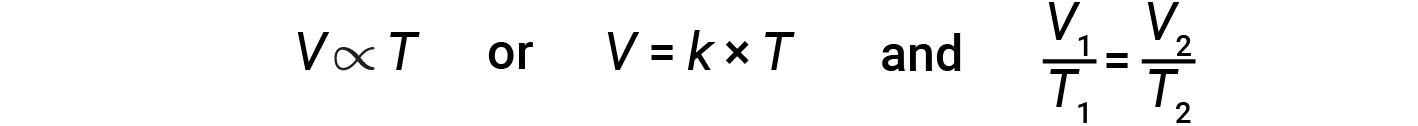
onde k é uma constante de proporcionalidade que depende da quantidade e pressão do gás. Para um gás confinado com uma pressão constante, a relação V/T é constante.
Volume e Pressão: A Lei de Boyle
Se uma seringa hermética estiver parcialmente cheia de ar, a seringa contém uma quantidade específica de ar a uma temperatura constante, por exemplo 25 °C. Se o êmbolo for pressionado lentamente enquanto a temperatura permanece constante, o gás da seringa é comprimido em um volume mais pequeno e a sua pressão aumenta. Se o êmbolo for extraído, o volume do gás aumenta e a pressão diminui.
Diminuir o volume de um gás contido aumentará sua pressão, e aumentar o seu volume diminuirá sua pressão. Se o volume aumentar por um determinado factor, a pressão diminui pelo mesmo factor e vice-versa. Portanto, a pressão e o volume apresentam proporcionalidade inversa: Aumentar a pressão resulta na diminuição do volume do gás. Matematicamente isto pode ser escrito:
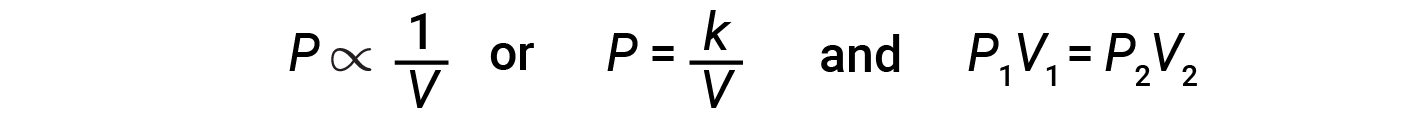
onde k é uma constante. Um gráfico de P versus V exibe uma hipérbole. Gráficos com linhas curvas são difíceis de ler com precisão a valores baixos ou altos das variáveis, sendo mais difíceis de usar na adaptação de equações teóricas e parâmetros aos dados experimentais. Por essas razões, os cientistas muitas vezes tentam encontrar uma maneira de “linearizar” os seus dados. Graficamente, a relação entre a pressão e o volume é mostrada pela apresentação inversa da pressão versus o volume, ou o inverso do volume versus a pressão.
A relação entre o volume e a pressão de uma determinada quantidade de gás a uma temperatura constante é dada pela lei de Boyle: O volume de uma determinada quantidade de gás mantido a uma temperatura constante é inversamente proporcional à pressão sob a qual é medida.
Moles de Gás e Volume: A Lei de Avogadro
O cientista Italiano Amedeo Avogadro avançou uma hipótese em 1811 para explicar o comportamento dos gases, afirmando que volumes iguais de todos os gases, medidos nas mesmas condições de temperatura e pressão, contêm o mesmo número de moléculas. Ao longo do tempo, esta relação foi apoiada por muitas observações experimentais expressas pela lei de Avogadro: Para um gás confinado, o volume (V) e o número de moles (n) são diretamente proporcionais se a pressão e a temperatura se mantiverem constantes.
Na forma de equação, isto é escrito como:
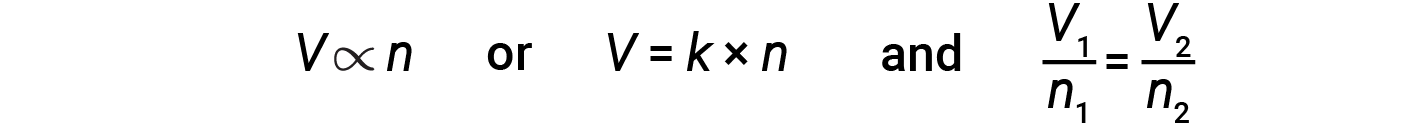
Os relacionamentos matemáticos também podem ser determinados para os outros pares de variáveis, como P versus n e n versus T.
A Lei de Gás Ideal
A combinação destas quatro leis produz a lei de gás ideal, uma relação entre a pressão, o volume, a temperatura, e o número de moles de um gás:
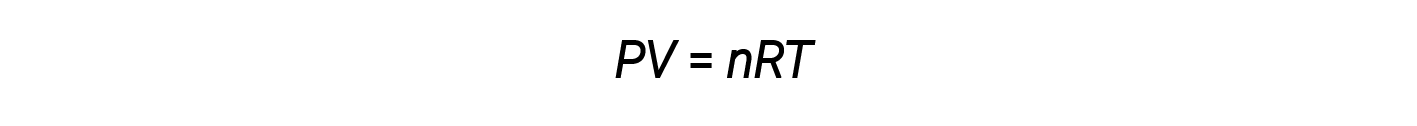
Aqui, R é uma constante chamada de constante de gás ideal ou constante de gás universal. As unidades usadas para expressar pressão, volume, e temperatura determinam a forma adequada da constante de gás conforme exigido pela análise dimensional. Os valores mais comuns de R são 0,08206 L⋅atm mol–1⋅K–1 e 8,314 kPa⋅L mol–1⋅K–1.
Diz-se que os gases cujas propriedades de P, V e T são descritas com precisão pela lei de gás ideal (ou outras leis de gases) apresentam comportamento ideal ou aproximam-se das características de um gás ideal. Um gás ideal é uma construção hipotética que só é razoável para gases sob condições de pressão relativamente baixa e temperatura elevada.
A equação de gás ideal contém cinco termos, a constante de gás R e as propriedades variáveis P, V, n e T. A especificação de quaisquer quatro destes termos permitirá o uso da lei de gás ideal para calcular o quinto termo.
Se o número de moles de um gás ideal for mantido constante sob dois conjuntos diferentes de condições, obtém-se uma relação matemática útil chamada lei de gás combinada (usando unidades de atm, L, e K):
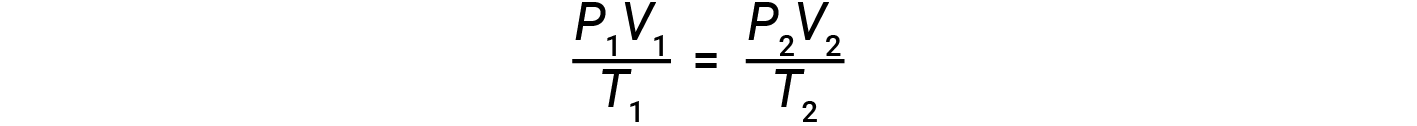
Ambos os conjuntos de condições são iguais ao produto de n × R (em que n é o número de moles do gás e R é a constante da lei de gás ideal).
Este texto é adaptado de Openstax, Chemistry 2e, Section 9.2: Relating Pressure, Volume, Amount, and Temperature: The Ideal Gas Law.
Do Capítulo 5:

Now Playing
5.2 : Leis dos Gases
Gases
64.9K Visualizações

5.1 : Pressão e Medição da Pressão
Gases
35.2K Visualizações

5.3 : Aplicações da Lei dos Gases Ideais: Massa Molar, Densidade, e Volume
Gases
55.9K Visualizações

5.4 : Mistura de Gases - Lei de Dalton das Pressões Parciais
Gases
38.7K Visualizações

5.5 : Estequiometria Química e Gases
Gases
24.2K Visualizações

5.6 : Teoria Cinética Molecular: Postulados Básicos
Gases
33.1K Visualizações

5.7 : Teoria Cinética Molecular e as Leis dos Gases
Gases
32.0K Visualizações

5.8 : Velocidades Moleculares e Energia Cinética
Gases
27.0K Visualizações

5.9 : Efusão e Difusão
Gases
28.3K Visualizações

5.10 : Gases Reais - Desvio da Lei dos Gases Ideais
Gases
34.2K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados