6.10 : Lei de Hess
Há duas formas de determinar a quantidade de calor envolvido em uma alteração química: medi-la experimentalmente, ou calcular a mesma a partir de outras alterações de entalpia determinadas experimentalmente. Algumas reações são difíceis, se não impossíveis, de investigar e fazer medições precisas experimentalmente. E mesmo quando uma reação não é difícil de realizar ou medir, é conveniente poder determinar o calor envolvido em uma reação sem ter de executar uma experiência.
Esse tipo de cálculo geralmente envolve o uso da lei de Hess, que afirma: Se um processo pode ser escrito como a soma de vários processos por passos, a alteração de entalpia do processo total iguala a soma das alterações de entalpia dos vários passos. A lei de Hess é válida porque a entalpia é uma função de estado: As alterações de entalpia dependem apenas de onde um processo químico começa e termina, mas não do caminho que leva do início ao fim. Por exemplo, a reação do carbono com oxigénio para formar dióxido de carbono ocorre diretamente ou através de um processo com dois passos. O processo direto é escrito como:
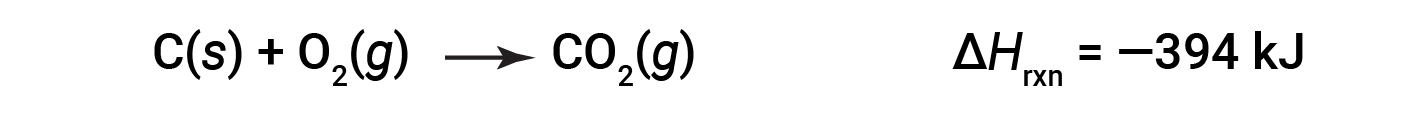
No processo com dois passos, o monóxido de carbono é formado primeiro:
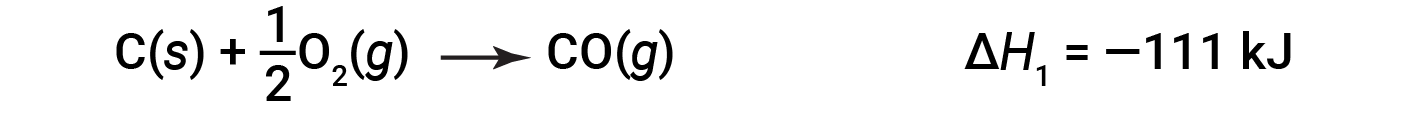
Em seguida, o monóxido de carbono reage ainda mais para formar dióxido de carbono:
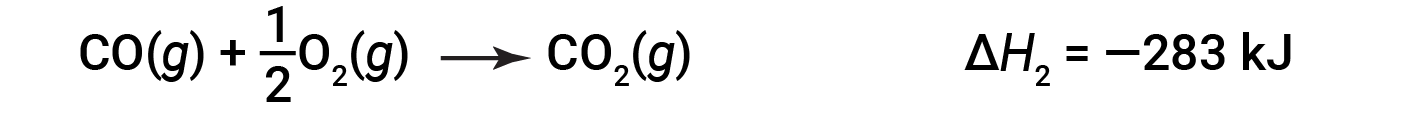
A equação que descreve a reação global é a soma destas duas alterações químicas:
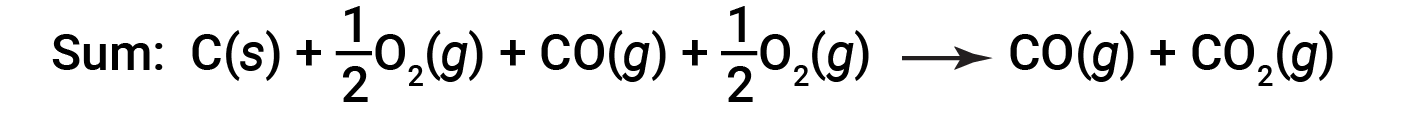
Uma vez que o CO produzido no Passo 1 é consumido no Passo 2, a alteração líquida é:

De acordo com a lei de Hess, a alteração da entalpia da reação equivalerá à soma das alterações da entalpia dos passos.

A ΔH da reação geral é a mesma, independentemente de ela ocorrer em um ou dois passos. Esta descoberta (ΔH geral para a reação = soma dos valores de ΔH para os “passos” da reação na reação geral) é no geral verdadeira para processos químicos e físicos.
Existem duas características importantes da ΔH que se revelam úteis ao mesmo tempo que resolvem problemas com a lei de Hess. Isto baseia-se no facto de que a ΔH é diretamente proporcional às quantidades de reagentes ou produtos, e alterar a reação (ou a equação termoquímica) de maneiras bem definidas altera a ΔH da mesma forma.
Por exemplo, a alteração da entalpia para a reação que forma 1 mole de NO2 (g) é de +33,2 kJ:
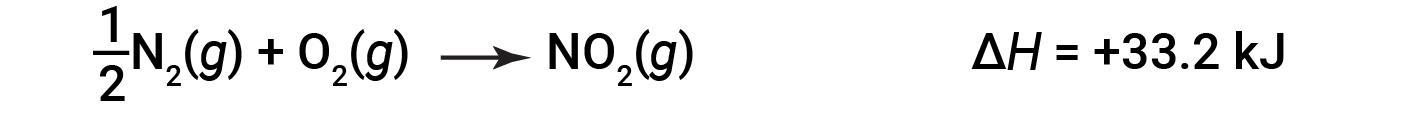
Quando 2 moles de NO2 (duas vezes mais) são formados, a ΔH é duas vezes maior:
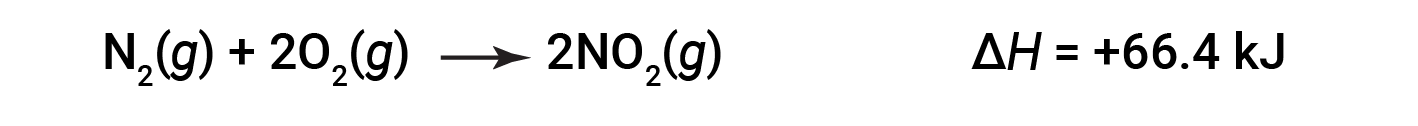
No geral, ao multiplicar ou dividir uma equação química, a alteração na entalpia deve também ser multiplicada ou dividida pelo mesmo número.
A ΔH para uma reação em uma direção é igual em magnitude e oposta em sinal da ΔH para a reação na direção inversa. Por exemplo:
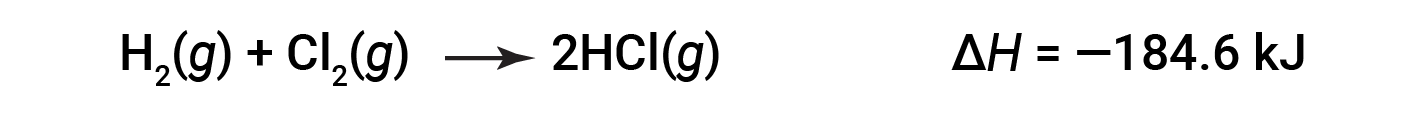
Então, para a reação inversa, a alteração da entalpia também é revertida:
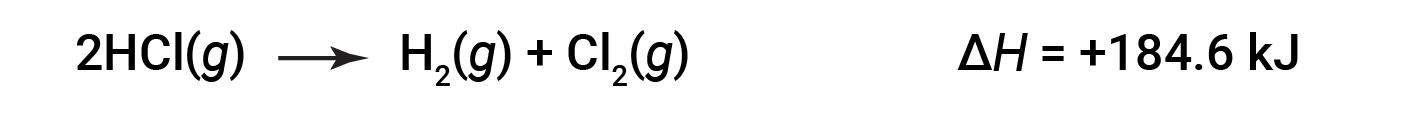
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.3: Enthalpy.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados