6.12 : Entalpias de Reações
A lei de Hess pode ser usada para determinar a alteração da entalpia de qualquer reação se as correspondentes entalpiaa de formação dos reagentes e produtos estiverem disponíveis. A reação principal pode ser dividida em reações por passos : (i) decomposições dos reagentes nos seus elementos componentes, para os quais as alterações da entalpia são proporcionais ao negativo das entalpias de formação dos reagentes, −ΔHf°(reagentes), seguida de (ii) recombinações dos elementos (obtidos no passo 1) para originar os produtos, com as alterações de entalpia proporcionais às entalpias de formação dos produtos, ΔHf° (produtos). A alteração da entalpia padrão da reação global é portanto igual a: (ii) soma das entalpias padrão de formação de todos os produtos mais (i) soma dos negativos das entalpias padrão de formação dos reagentes, tal como indicado pela equação seguinte, onde ∑ representa “a soma de” e n representa os coeficientes estequiométricos.
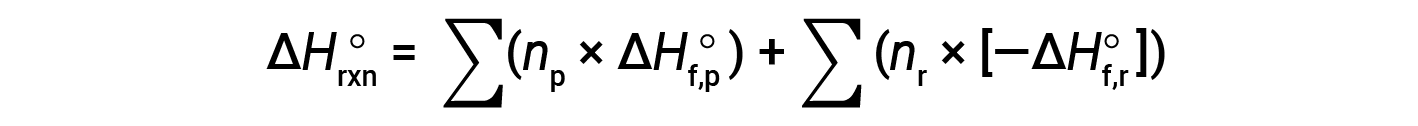
A equação é geralmente rearranjada ligeiramente para ser escrita como se segue:
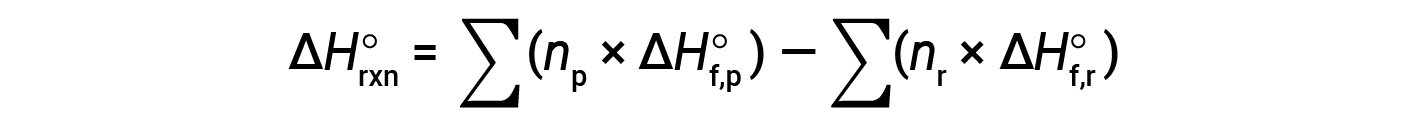
O exemplo a seguir mostra em detalhes por que esta equação é válida e como usá-la para calcular a alteração da entalpia padrão para uma reação:

Aqui, utiliza-se a forma especial da lei de Hess e os valores de formação de calor para os reagentes e produtos: ΔHf° (HNO3) = −206,64 kJ/mol; ΔHf° (NO) = +90,2 kJ/mol; ΔHf° (NO2) = +33 kJ/mol; ΔHf° (H2O) = −285,8 kJ/mol.


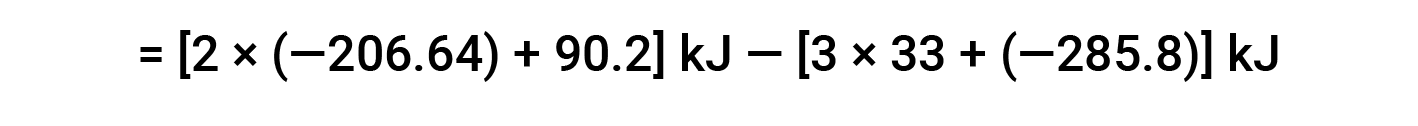
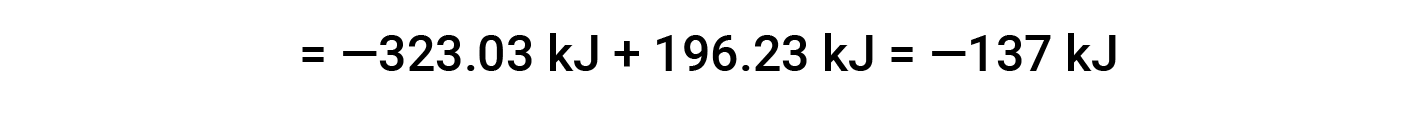
Este texto é adaptado de Openstax, Chemistry 2e, Section 5.3: Enthalpy.
Do Capítulo 6:

Now Playing
6.12 : Entalpias de Reações
Termoquímica
31.4K Visualizações

6.1 : Princípios Básicos de Energia
Termoquímica
36.9K Visualizações

6.2 : Primeira Lei da Termodinâmica
Termoquímica
31.4K Visualizações

6.3 : Energia Interna
Termoquímica
28.7K Visualizações

6.4 : Quantificação do Calor
Termoquímica
53.8K Visualizações

6.5 : Quantificação do Trabalho
Termoquímica
19.0K Visualizações

6.6 : Entalpia
Termoquímica
34.7K Visualizações

6.7 : Equações Termoquímicas
Termoquímica
28.2K Visualizações

6.8 : Calorimetria de Pressão Constante
Termoquímica
84.6K Visualizações

6.9 : Calorimetria de Volume Constante
Termoquímica
26.8K Visualizações

6.10 : Lei de Hess
Termoquímica
44.4K Visualizações

6.11 : Entalpia de Formação Padrão
Termoquímica
41.0K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados