7.4 : Efeito Fotoelétrico
Quando luz de um comprimento de onda específico atinge uma superfície metálica, são emitidos eletrões. Isto é chamado de efeito fotoelétrico. A frequência mínima de luz que pode causar essa emissão de eletrões é denominada frequência limite, que é específica do metal. A luz com uma frequência inferior à frequência limite, mesmo que seja de alta intensidade, não pode iniciar a emissão de eletrões. No entanto, quando a frequência é superior ao valor limite, o número de eletrões ejetados é diretamente proporcional à intensidade do feixe.
De acordo com a teoria clássica da onda, a energia de uma onda depende da sua intensidade (que depende da sua amplitude), e não da sua frequência. Uma parte destas observações foi que se viu que o número de eletrões ejetados em um determinado período de tempo aumentava à medida que o brilho aumentava. Em 1905, Albert Einstein foi capaz de resolver o paradoxo ao incorporar as descobertas de quantização de Planck na visão particular desacreditada da luz.
Einstein argumentou que as energias quantizadas que Planck tinha postulado poderiam ser aplicadas à luz no efeito fotoelétrico. A luz que embate na superfície metálica não deve ser vista como uma onda, mas deve ser vista em vez disso como um fluxo de partículas (mais tarde chamadas fotões) cuja energia depende da sua frequência. A quantidade de energia (E) em um pacote luminoso depende da sua frequência (ν), de acordo com a seguinte equação:
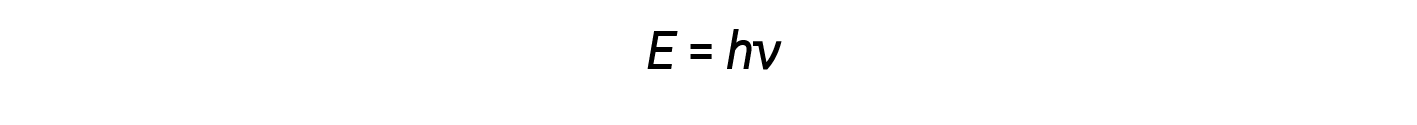
onde h é a constante de Planck.
O efeito fotoelétrico pode ser descrito assumindo que a luz é quantizada. É necessária uma determinada energia mínima para ultrapassar a energia de ligação (Φ) experienciada por um eletrão. Isto também é conhecido como a função de trabalho (W) do metal.
Como os eletrões no metal têm uma certa quantidade de energia de ligação que os mantém lá, a luz incidente precisa de ter mais energia para libertar os eletrões. Os fotões de luz de baixa frequência não contêm energia suficiente para ejetar eletrões do metal. Mesmo que o metal seja exposto a tal luz por um longo período de tempo, não é observada emissão de eletrões. Um eletrão só pode ser emitido quando um fotão com energia superior à função de trabalho atinge o metal.

A energia em excesso do fotão é convertida em energia cinética do eletrão emitido.
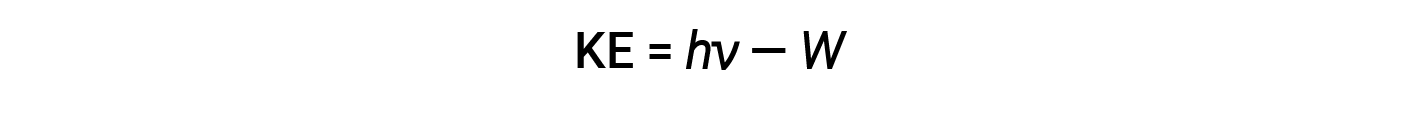
Portanto, os eletrões são ejetados quando são atingidos por fotões com energia suficiente (uma frequência superior ao limite). Quanto maior a frequência da luz incidente, maior a energia cinética transmitida pelas colisões para os eletrões que escapam. Einstein também argumentou que a intensidade da luz não dependia da amplitude da onda de entrada, mas sim do número de fotões que batem na superfície dentro de um determinado período de tempo. O número de eletrões ejetados aumenta com o brilho. Quanto maior for o número de fotões de entrada, maior será a probabilidade de colidirem com alguns dos eletrões.
O efeito fotoelétrico sugere fortemente o comportamento particular da luz. Einstein ganhou o Prémio Nobel de Física em 1921 pela sua explicação do efeito fotoelétrico. Embora muitos fenómenos de luz possam ser explicados tanto em termos de ondas como de partículas, certos fenómenos, como os padrões de interferência obtidos quando a luz passa por uma fenda dupla, eram completamente contrários a uma visão particular da luz, enquanto que outros fenómenos, como o efeito fotoeléctrico, eram completamente contrários a uma visão ondulatória da luz. De algum modo, a um nível fundamental profundo ainda não totalmente compreendido, a luz é ao mesmo tempo ondulatória e particular. Isto é conhecido como dualidade onda-partícula.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 6.1: Electromagnetic Energy.
Do Capítulo 7:

Now Playing
7.4 : Efeito Fotoelétrico
Estrutura Eletrônica dos Átomos
29.1K Visualizações

7.1 : A Natureza Ondulatória da Luz
Estrutura Eletrônica dos Átomos
48.1K Visualizações

7.2 : O Espectro Eletromagnético
Estrutura Eletrônica dos Átomos
52.3K Visualizações

7.3 : Interferência e Difração
Estrutura Eletrônica dos Átomos
30.5K Visualizações

7.5 : O Modelo de Bohr
Estrutura Eletrônica dos Átomos
49.8K Visualizações

7.6 : Espectros de Emissão
Estrutura Eletrônica dos Átomos
49.4K Visualizações

7.7 : O Comprimento de Onda de De Broglie
Estrutura Eletrônica dos Átomos
25.2K Visualizações

7.8 : O Princípio da Incerteza
Estrutura Eletrônica dos Átomos
22.9K Visualizações

7.9 : O Modelo Mecânico-Quântico de um Átomo
Estrutura Eletrônica dos Átomos
41.7K Visualizações

7.10 : Números Quânticos
Estrutura Eletrônica dos Átomos
34.1K Visualizações

7.11 : Orbitais Atômicos
Estrutura Eletrônica dos Átomos
32.9K Visualizações

7.12 : O Princípio da Exclusão de Pauli
Estrutura Eletrônica dos Átomos
33.7K Visualizações

7.13 : As Energias das Orbitais Atômicos
Estrutura Eletrônica dos Átomos
23.6K Visualizações

7.14 : O Princípio de Aufbau e a Regra de Hund
Estrutura Eletrônica dos Átomos
43.6K Visualizações

7.15 : Configuração Eletrônica de Átomos com Múltiplos Elétrons
Estrutura Eletrônica dos Átomos
37.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados