Ser capaz de calcular concentrações de equilíbrio é essencial para muitas áreas de ciência e tecnologia, por exemplo, na formulação e dosagem de produtos farmacêuticos. Depois de um fármaco ser ingerido ou injetado, é envolvido tipicamente em diversos equilíbrios químicos que afetam a sua concentração final no sistema de interesse no corpo. O conhecimento dos aspectos quantitativos desses equilíbrios é necessário para calcular uma quantidade de dosagem que irá fornecer o efeito terapêutico desejado.
Um tipo mais desafiante de cálculo de equilíbrio pode ser aquele em que as concentrações de equilíbrio são derivadas das concentrações iniciais e de uma constante de equilíbrio. Para esses cálculos, uma abordagem de quatro passos é normalmente útil:
- Identificar a direção na qual a reação irá avançar para atingir o equilíbrio.
- Desenvolver uma tabela ICE.
- Calcular as alterações de concentração e, posteriormente, as concentrações de equilíbrio.
- Confirmar as concentrações de equilíbrio calculadas.
Cálculo das Concentrações de Equilíbrio
Em determinadas condições, a constante de equilíbrio Kc para a decomposição de PCl5(g) em PCl3(g) e Cl2(g) é 0,0211. O procedimento acima pode ser utilizado para determinar as concentrações de equilíbrio de PCl5, PCl3, e Cl2 em uma mistura que inicialmente continha apenas PCl5 a uma concentração de 1,00 M.
Passo 1. Determinar a direção em que a reação prossegue.
A equação equilibrada para a decomposição de PCl5 é
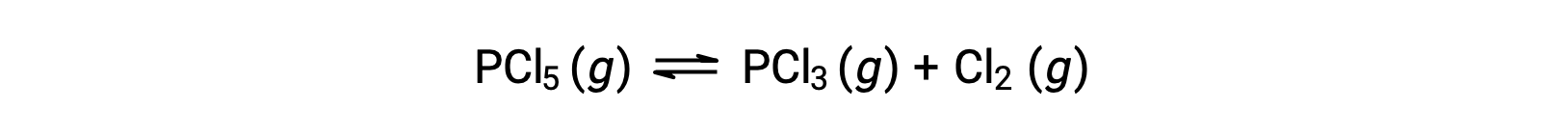
Como apenas o reagente está presente inicialmente, Qc = 0, e a reação irá prosseguir para a direita.
Passo 2. Desenvolver uma tabela ICE.
| PCl5 (g) | PCl3 (g) | Cl2 (g) | |
| Concentração Inicial (M) | 1,00 | 0 | 0 |
| Alteração (M) | −x | +x | +x |
| Concentração em Equilíbrio (M) | 1,00 − x | x | x |
Passo 3. Resolver para a alteração e as concentrações de equilíbrio.
Substituir as concentrações de equilíbrio na equação da constante de equilíbrio dá
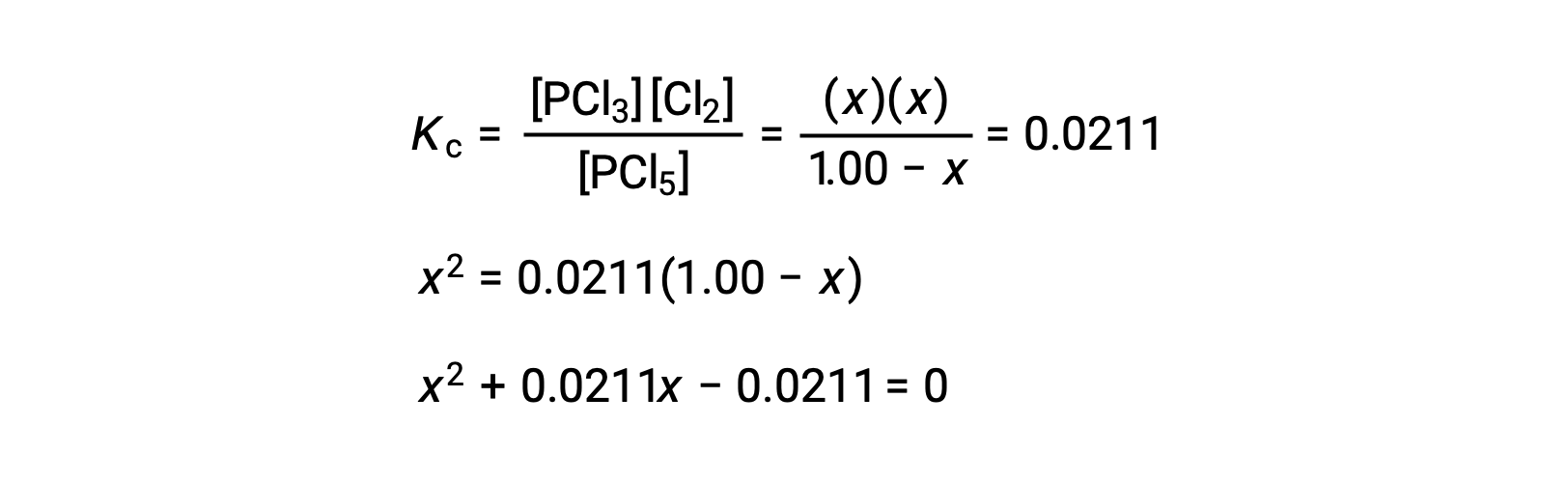
Uma equação do formato ax2 + bx + c = 0 pode ser rearranjada para resolver para x:
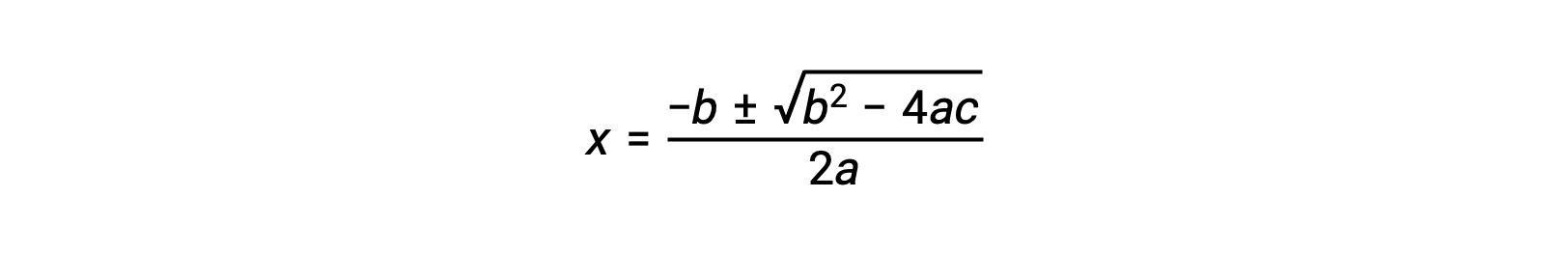
Neste caso, a = 1, b = 0,0211, e c = −0,0211. Substituir os valores apropriados para a, b, e c produz:
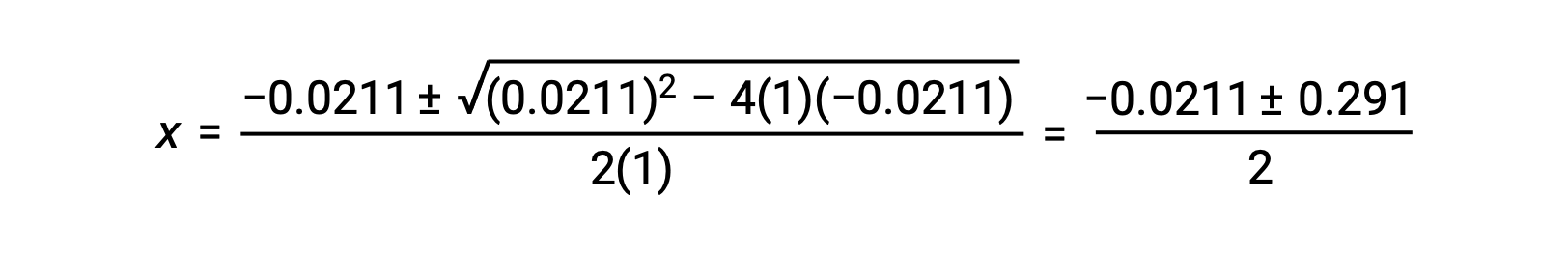
As duas raízes da quadrático são, portanto,
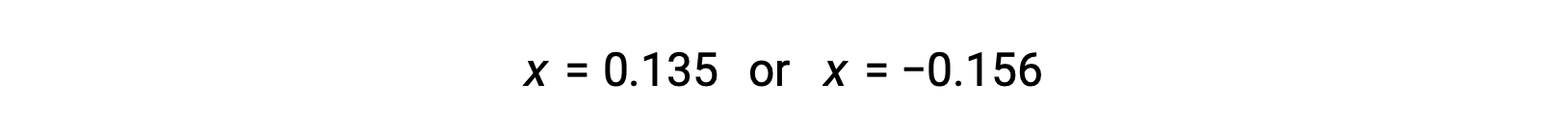
Para este cenário, apenas a raiz positiva é fisicamente significativa (as concentrações são zero ou positivas), e por isso x = 0,135 M. As concentrações de equilíbrio são
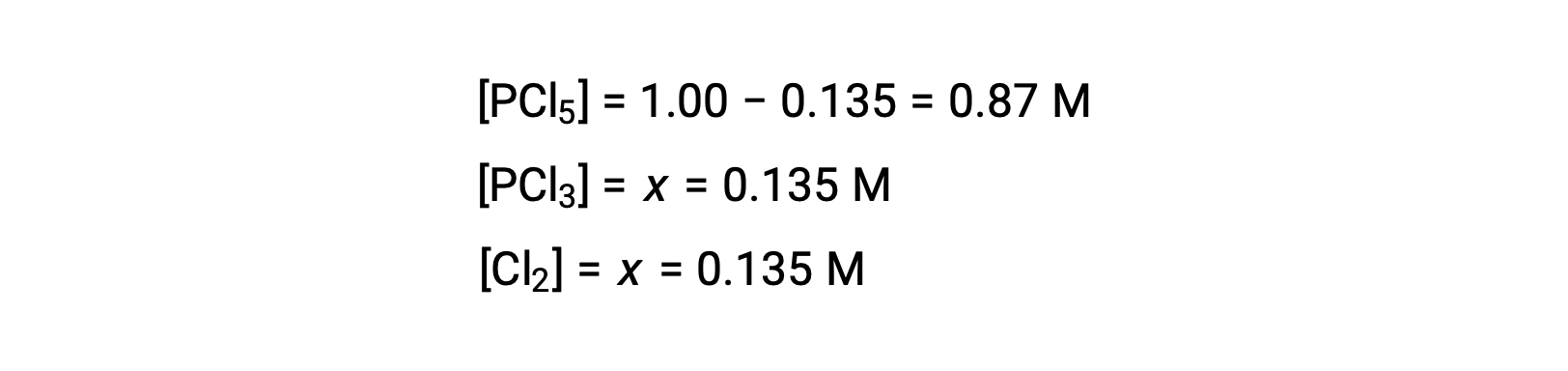
Passo 4. Confirmar as concentrações de equilíbrio calculadas.
A substituição na expressão para Kc (para verificar o cálculo) dá
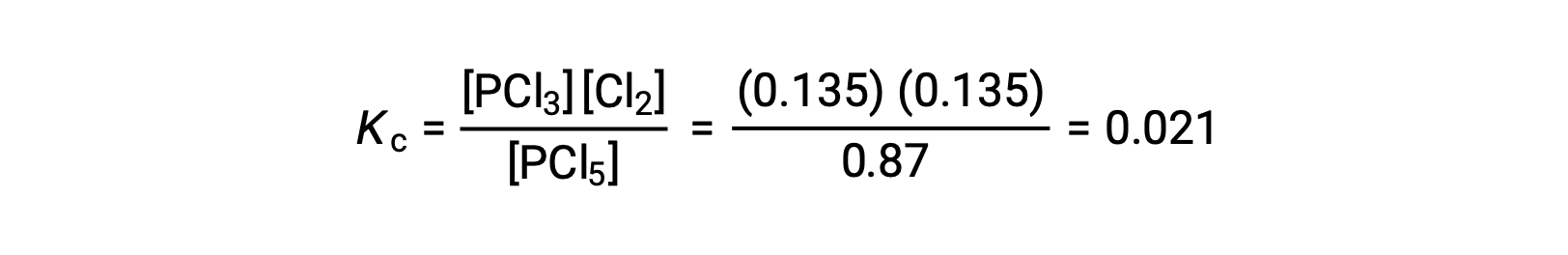
A constante de equilíbrio calculada a partir das concentrações de equilíbrio é igual ao valor de Kc dado no problema (quando arredondado para o número adequado de valores significativos).
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
Tags
Do Capítulo 14:

Now Playing
14.6 : Cálculo das Concentrações de Equilíbrio
Equilíbrio Químico
46.5K Visualizações

14.1 : Equilíbrio Dinâmico
Equilíbrio Químico
49.0K Visualizações

14.2 : A Constante de Equilíbrio
Equilíbrio Químico
45.6K Visualizações

14.3 : Equilíbrio para Reações Gasosas e Reações Heterogêneas
Equilíbrio Químico
23.7K Visualizações

14.4 : Cálculo da Constante de Equilíbrio
Equilíbrio Químico
30.2K Visualizações

14.5 : Quociente da Reação
Equilíbrio Químico
47.4K Visualizações

14.7 : O Princípio de Le Chatelier: Alteração da Concentração
Equilíbrio Químico
56.8K Visualizações

14.8 : O Princípio de Le Chatelier: Alteração do Volume (Pressão)
Equilíbrio Químico
33.5K Visualizações

14.9 : O Princípio de Le Chatelier: Alteração da Temperatura
Equilíbrio Químico
28.5K Visualizações

14.10 : A Aproximação do x Pequeno
Equilíbrio Químico
45.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados