É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Exocitose imagem em células da retina com Bipolar Microscopia TIRF
Resumo
Neste vídeo, demonstramos como rotular e visualizar exocitose das vesículas sinápticas única e tráfico de células da retina goldfish bipolar usando reflexão interna total de fluorescência microscopia (TIRF).
Resumo
Refletância interna total de fluorescência microscopia (TIRF) é uma técnica que permite o estudo dos eventos que acontecem na membrana celular, pela imagem seletiva de moléculas fluorescentes que são mais próximos a uma substância de alto índice de refração, como vidro
Protocolo
Parte 1: Dissecção e isolamento de células Bipolar
- Preparar soluções listadas na Tabela 2; O pH de toques "(externa) de soluções deve ser ajustado para 7,4 com NaOH e do pH da solução interna deve ser ajustado para 7,2 com CsOH. Proteger a solução interna da luz com papel alumínio e mantenha-o a 4 ° C até o uso;
- Dark-se adaptar um peixinho dourado, pelo menos, 30 minutos antes da dissecção;
- Enquanto o animal se adapta-escuro, preparar 5 mL de hialuronidase (V tipo hialuronidase, 1100 unidades / mL em baixo Ca 2 + Ringer; Sigma, St. Louis, MO) e 10 mL de L-cisteína (0,5 mg / mL em Ca 2 + baixo) da campainha as soluções e pesar os papaína (pó liofilizado, 40 unidades / mL; Sigma, St. Louis, MO) por 5 mL da solução de digestão;
- Euthanize o goldfish por decapitação rápida com uma tesoura cirúrgica e destruir o cérebro ea medula espinhal com uma lâmina de bisturi # 11;
- Remove os olhos, destruindo os músculos extra-oculares com a ajuda de uma pinça # 7 curvas Dumont e cortar o nervo óptico com tesoura de íris;
- Lugar lâmpada um olho em um pedaço de papel de filtro e punção do limbo escleral com a ponta de uma lâmina de bisturi # 11;
- Introduzir a lâmina de uma tesoura Vannas dentro do todo perfurado e cortar todo o segmento anterior de distância;
- Coloque um pequeno pedaço de papel de filtro em cima do copo restante óptica e exercer alguma pressão, a fim de ter o papel de absorver com humor vítreo;
- Levante o papel de filtro com a retina ligado a ele e cortar o nervo óptico com um par de tesouras Vannas;
- Coloque o papel de filtro contendo a retina em um prato de 35 milímetros de plástico cultura com solução de hialuronidase e descolar a retina do papel de filtro com a ajuda de uma pinça # 7 Dumont;
- Cortar a retina em 4-6 pedaços com metade de uma lâmina de aço carbono industrial único gumes e deixe descansar na solução de hialuronidase por 20 minutos;
- Enquanto espera por hialuronidase para entrar em vigor, adicionar 5 mL da solução de L-cisteína ao papaína e deixe descansar até que o líquido se torna transparente (aproximadamente 5-10 minutos);
- Lave os pedaços de retina 3x de baixa Ca 2 + Ringer e deixá-los sentar-se na solução de papaína por 30-35 minutos;
- Lave os pedaços de retina 3x de baixa Ca 2 + Ringer e armazená-los até o uso a 4 ° C em um prato de cultura 35 milímetros de plástico contendo Ca 2 + baixo de Ringer;
- Dissociar as células, coloque um pedaço de retina em um tubo de microcentrífuga contendo 500 mL de baixo Ca 2 + Ringer e lentamente triturar a retina pipetando cima e para baixo com uma dissociação de vidro pipeta, cuidadosamente para não produzir quaisquer bolhas de ar. Pipetas dissociação são fabricados por aquecimento até a ponta de uma pipeta Pasteur de vidro com um bico de Bunsen e ligeiramente dobrá-la com a ajuda de uma pinça anatômica;
- A placa de células isoladas, adicionando uma gota da suspensão da retina a um home-made câmara de gravação previamente preenchidos com 2 mL de Ca 2 + baixo Ringer. A câmara consiste na metade inferior de uma placa de cultura de 35 mm de plástico com um todo circular no meio e uma lamela de vidro circular de 1,78 do índice de refração (PlanOptik, Alemanha), colado ao fundo com um elastômero de silicone (Sylgard 184; Dow Corning , Midland, MI).
Parte 2: Bipolar Carregando Celular e Wash Out
TIRF imagens das vesículas sinápticas é melhor realizado através de um microscópio TIRFM objetivo do tipo com um objetivo NA muito alta e uma câmera sensível. Para nossos experimentos, optamos por usar um 1,65 NA objetivo (x100 Apo O HR, NA 1,65, Olympus, Japão) com um EMCCD (Cascade 512B, Roper Scientific, Tucson, AZ). O uso do objectivo NA muito elevado exige a utilização de lamínulas de vidro de alta refração e fluido de imersão (di iodometano com enxofre). Nas nossas condições, luz de excitação está limitado a um campo de decaimento exponencial com um comprimento constante de aproximadamente 50 nm.
- Adicionar uma gota de líquido de alta índice de refração (série M, índice de refração = 1,7800, Cargille Labs, Cedar Grove, NJ) para a objetiva do microscópio;
- Coloque a câmara de gravação cuidadosamente em cima da objetiva do microscópio e cuidadosamente montagem eletrodo terra e tubo de saída para superfusão câmara;
- Deixe câmara de sentar-se no microscópio por 10-20 minutos para permitir que as células a afundar e aderir ao fundo;
- Nesse meio tempo, preparar 5 mL de uma trolox 1mM ® ácido ((±)- 6-hidroxi-2 ,5,7,8-tetramethylchromane-2-carboxílico; Sigma, St. Louis, MO solução) em alta K + Ringer . Sonicate até à dissolução;
- Prepare 15 mL de solução ADVASEP-7 lavagem: 1 mM ADVASEP-7 (Sigma, St. Louis, MO) em baixo Ca 2 + Ringer. Note-se que ADVASEP-7 uso é opcional e pode ser omitido, se desejar;
- Purgar o li superfusãones e adicione solução ADVASEP-7 de lavar roupa, Ca 2 + baixo toque e controle de campainha para o sistema superfusão;
- Puxar carga pipetas de paredes finas de vidro de borosilicato (Kwik-Fil ® TW150-3; WPI, Sarasota, FL). Resistências Puffer pipeta estão na faixa de 1,5-2,5 mohms;
- Prepare o FM1-43 ® (N-(3-triethylammoniumpropyl) -4 - (4 - (dibutylamino) styryl) pyridinium dibrometo ", embalagens especiais"; Invitrogen, Carlsbad, CA) soluções. Primeiro, faça um estoque de 1 mm, adicionando 160 mL de água destilada para um frasco (100 mg) de FM1-43 ®. Este estoque pode ser mantido a 4 ° C por até uma semana. Em seguida, adicionar 5 mL de FM1-43 ® a 1 mL de alto K + + Ringer 1mM trolox ®. Proteger a solução da luz com papel alumínio e mantenha-o a 4 ° C até o uso;
- Ligue o microscópio de luz brilhante em campo e procurar células intactas bipolar. Ligeiramente toque no microscópio para se certificar de que os neurônios estão firmemente ligado ao fundo da câmara;
- Posição da caneta superfusão próximo à célula de interesse e de forma contínua perfundir a preparação com baixo Ca 2 + Ringer;
- Desligue as luzes da sala e adicionar um longo vermelho filtro passa (isto é, RG630, Schott, Alemanha) para o caminho óptico para minimizar a excitação do corante FM;
- Preencha uma pipeta de carga com 10 mL da solução corante FM, montar a pipeta na micromanipulador e inferior da pipeta sobre o preparo, sem sobrepressão até que esteja no mesmo plano focal como a célula bipolar você deseja carregar. Certifique-se de ter pelo menos dois titulares eletrodo: o utilizado para o corante FM não pode ser usado para patch clamping, ou então ele pode contaminar a solução intracelular;
- Posição da abertura do soprador a uma distância de cerca de 10 mM do terminal axônio, por sua vez o sistema superfusão off e puff a solução corante por 10 segundos girando a sobrepressão pipeta sobre;
- Vire a sobrepressão fora e, sem mover a pipeta, aguarde 30 segundos;
- Vire o superfusão e tomar banho na câmara em ADVASEP-7 solução por 5 minutos. Nesse meio tempo, retire a pipeta puffer do banho;
- Depois de cinco minutos, mude para baixo Ca 2 + campainha e perfundir a câmara por 25-30 minutos para permitir a remoção de corante em excesso.
Parte 3: Patch de fixação e TIRFM Imagem
- Enquanto a preparação é lavar para fora, puxe pipetas patch da espessura de paredes de vidro de borosilicato (B150-86-10; Sutter Instrument Company, Novato, CA). Resistências remendo pipeta estão na faixa de 80-10 mohms;
- Depois de lavar estiver concluída, coloque o axônio terminal no centro do campo de visão;
- Preencha uma pipeta patch com 7μL de solução interna, toque a pipeta para se livrar de bolhas de ar, revestimento da pipeta com cera dental fundido (cera pegajosa; Kerr Corporation, Orange, CA) e montá-la na micromanipulador;
- Vire a sobrepressão pipeta sobre e inferior a pipeta lentamente sobre a preparação. Verifique a resistência da pipeta no amplificador e deslocamentos pipeta correto e capacitância com os controles do amplificador respectivos;
- Mudar o superfusão para controlar Ringer. Para criar um gigaseal entre a pipeta ea célula, ligeiramente tocar a ponta do eletrodo contra o corpo da célula e ligue a sobrepressão pipeta off, enquanto gentilmente a aplicação de pressão negativa para o eletrodo;
- Enquanto fechado, escolha "toda célula" modo no amplificador e definir a cela potencial de -60 mV;
- Escolha uma região de interesse com o software de imagem que engloba o axônio terminal inteiro, ligar a luz de campo claro off e, por breves instantes, expondo (30 ms) do terminal para o laser nm 488, encontrar o plano certo para TIRF focal de imagem;
- Invadir a célula usando o "zap" comando do amplificador ao aplicar pressão ligeiramente negativa para a pipeta;
- Correto para capacitância da célula e resistência em série, e depois aplicar o protocolo de tensão de interesse, enquanto movimento de imagens de vesículas sinápticas. É nesta fase importante ter o protocolo de tensão sincronizada com a taxa de quadros da câmera. No nosso caso, cada quadro é de 30 ms de comprimento, de modo a variações de tensão ocorrem em múltiplos desse valor (ou seja, a cada 300 ms ou 10 quadros);
- Espere pelo menos 40 segundos entre ensaios para permitir a recuperação;
- Para verificar a posição de fitas sinápticas, tirar fotos ao girar o laser nm em 561.
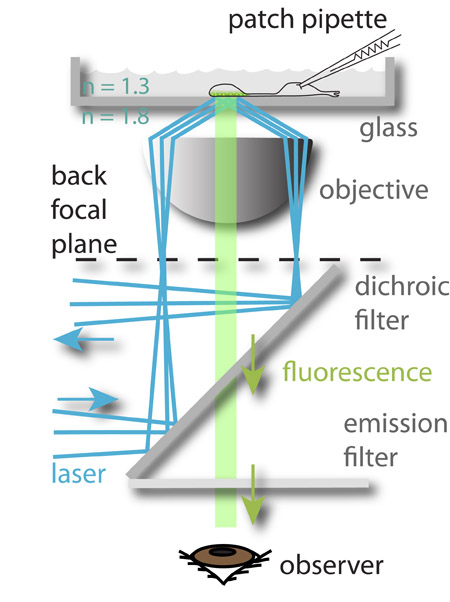
Figura 1: A configuração experimental. Um laser de 488 nm (azul) é voltado para a periferia do plano focal posterior da objetiva e sofre reflexão interna total quando ele atinge o vidro aquoso interface de médio porte. O campo eletromagnético gerado pelo feixe refletido excita o fluoróforo carregado no vesículas sinápticas mais próximo do bottom da câmara de vidro, que então fluorescência (verde). A luz fluorescente é então guiado ao olho do observador (representado) ou a uma câmera CCD. O potencial de membrana das células imaged é controlado simultaneamente por patch-aperto-los. Esta abordagem permite o estudo da relação entre os sinais de entrada (a tensão de membrana) ea saída neuronal (exocitose).

Figura 2: Resultados típicos. Esquerda: Imagem de campo claro de uma célula isolada goldfish bipolar. Superior direito: image TIRF das vesículas sinápticas no terminal axonal célula bipolar carregado com FM 1-43 ® e fotografada com o laser de 488 nm (FM corante). Parte inferior direita: imagem do terminal mesmo depois remendar o celular e as imagens do terminal axonal com o laser nm 561. Fitas sinápticas são rotulados pela rodamina baseado em peptídeo de ligação de olho de lombo (Rpep_rhod).
Tabela 1: Reagentes e equipamentos específicos.
Nome | Tipo | Fabricante | Catálogo | Comentário |
| - | Air Tabela | Newport Corporation | - | - |
| IX70 | Microscópio invertido | Olimpo | - | Equipado com uma lâmpada de tungstênio para campo claro e uma porta de abertura lateral para TIRF |
| TH4-100 | Fonte de energia da lâmpada | Olimpo | - | - |
| FF498_581-DI01 | Dichroic Filtro | Semrock | - | - |
| NF01-405_488_568 | Filtro de emissão | Semrock | - | - |
| X100 Apo O HR | Objetivo | Olimpo | - | NA 1,65 |
| RG630 | Red Filtro de Vidro | Schott | - | - |
| - | Laser 488 nm | Coerente | - | Use o mínimo de energia |
| - | Obturador | Uniblitz | - | - |
| VMM-D1 | Driver de obturador | Uniblitz | - | - |
| - | Laser 561 nm | Melles Griot | - | - |
| - | Obturador | Uniblitz | - | - |
| VMM-D3 | Driver de obturador | Uniblitz | - | - |
| Kit de pressão de perfusão | Sistema superfusão | Automatizar Scientific | 04/09 | - |
| Pen perfusão | Sistema superfusão | Automatizar Scientific | - | - |
| ValveLink 8 | Controlador do Sistema superfusão | Automatizar Scientific | - | - |
| Cascade 512B | EM CCD Camera | Roper Scientific | - | - |
| Metamorph 7,1 | Software de imagem | Os dispositivos moleculares | - | - |
| EPC-9 | Amplificador de patch clamp | Heka Elektronik | - | - |
| Pulso | Software amplificador | Heka Elektronik | - | - |
| MP-285 | Micromanipulador | Instrumento Sutter | - | - |
| - | Titular eletrodo | Heka Elektronik | - | Por 1,5 mm de diâmetro externo de vidro, 2 unidades |
| Kwik-Fil ® TW150-3 | Capilar de vidro de borosilicato | WPI | - | Sem filamento |
| B150-86-10 | Capilar de vidro de borosilicato | Instrumento Sutter | - | Com filamento |
| P-97 | Puller microeletrodo | Instrumento Sutter | - | Equipado com filamento caixa 3x3 e câmara ambiental |
| - | Pressão da bomba de ar de vácuo | Thomas Scientific | 7893B05 | Cria vácuo para remover líquidos de câmara e sobrepressão para pipetas |
| MatLab R2008a | Software de análise | MathWorks | - | - |
| 353001 | 35 milímetros de plástico Pratos Cultura | Falcão | - | - |
| - | Vidro alto índice de refração | PlanOptik | - | Índice de refração 488 nm = 1,78 |
| Série M | Líquido de elevado índice de refração | Cargille Labs | - | Índice de refração = 1,78 |
| Sylgard 184 | Kit de silicone elastômero | Dow Corning | - | - |
| Glutationa | Tripeptídeo | Merck Química | Radica livrescavenger l | |
| Hialuronidase | Enzima | Sigma | H6254 | Tipo V |
| L-cisteína | Aminoácidos | Fluka | 30090 | Ativa papaína |
| Papaína | Enzima | Fluka | 76220 | De Carica papaya |
| Trolox ® | Vitamina E solúvel | Sigma | 56510 | Scavenger de radicais livres |
| ADVASEP-7 | Sulfonado B-Ciclodextrina Derivativos | Sigma | A3723 | Reduz FM 1-43 ® fluorescência de fundo |
| FM 1-43 ® | Corante fluorescente | Invitrogen | T35356 | "Embalagem Especial" |
| Cera pegajosa | Pipeta agente de revestimento | Kerr Corporação | - | Diminui a capacitância pipeta |
Tabela 2: soluções fisiológicas utilizadas neste estudo.
Substância | Ca 2 + baixo Ringer | Controle de Ringer | Alto K + Ringer | Solução interna |
| NaCl | 120 mM | 120 mM | 97,5 mM | - |
| KCl | 2,5 mM | 2,5 mM | 25 mM | - |
| MgCl 2 | 1 mM | 1 mM | 1 mM | 4 mM |
| CaCl 2 | 0,5 mM | 2,5 mM | 2,5 mM | - |
| HEPES | 10 mM | 10 mM | 10 mM | 10 mM |
| EGTA | 0,75 mM | - | - | 0,5 mM |
| Glicose | 10 mM | 10 mM | - | - |
| Glutationa | 2 mM | 2 mM | - | 1 mM |
| * CH 3 CSO 3 S | - | - | - | 100 mM |
| TEACl | - | - | - | 10 mM |
| ATP-Mg | - | - | - | 10 mM |
| GTP-Li | - | - | - | 1 mM |
| Rpep-Rhod ** | - | - | - | 5 mM |
| Volume | 200 mL | 100 mL | 5 mL | 100 L |
* Metanossulfonato Césio.
** Peptídeo de olho de lombo de ligação: rodamina + EQTVPVDLSVARDR-COOH (mw 1.997,75).
Access restricted. Please log in or start a trial to view this content.
Discussão
As vantagens do objectivo do tipo de microscopia TIRF são que 1) ele fornece seccionamento óptico excelente restringindo luz de excitação a uma estreita região dentro do plano focal da objetiva, minimizando assim o fora-de-foco de luz, 2) já que a luz cai exponencialmente com a distância , o movimento em uma direção vertical pode ser monitorado como uma mudança na intensidade de fluorescência, 3) a coleta de luz eficiente através do objectivo de alta abertura numérica 1,5.
A principal desvantagem da técnica ...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Este trabalho foi financiado pelo NIH Grant EY 14.990.
Access restricted. Please log in or start a trial to view this content.
Referências
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Traffic. 2, 764-774 (2001).
- Zenisek, D., Steyer, J. A., Almers, W. Transport, capture and exocytosis of single synaptic vesicles at active zones. Nature. 406, 849-854 (2000).
- Zenisek, D. Vesicle association and exocytosis at ribbon and extraribbon sites in retinal bipolar cell presynaptic terminals. Proc. Natl. Acad. Sci. U. S. A. 105, 4922-4927 (2008).
- Zenisek, D., Horst, N. K., Merrifield, C., Sterling, P., Matthews, G. Visualizing synaptic ribbons in the living cell. J. Neurosci. 24, 9752-9759 (2004).
- Axelrod, D. Selective imaging of surface fluorescence with very high aperture microscope objectives. J. Biomed. Opt. 6, 6-13 (2001).
- Rouze, N. C., Schwartz, E. A. Continous and transient vesicle cycling at a ribbon synapse. J. Neurosci. 18, 8614-8624 (1998).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados