Method Article
Imagem óptica de neurônios no gânglio de Caranguejo Stomatogastric com Tensão sensível Corantes
Neste Artigo
Resumo
Aqui apresentamos a metodologia para a rápida e de alta resolução de imagem sensíveis à voltagem corante fluorescente de atividade detalhada de neurônios no gânglio stomatogastric caranguejo.
Resumo
Sensíveis à voltagem de imagens de corante de neurônios é uma metodologia chave para a compreensão de como as redes neuronais são organizados e como a atividade simultânea de neurônios participantes ocasiona o surgimento da funcionalidade integrante da rede. Aqui apresentamos a metodologia de aplicação desta técnica para os neurônios padrão identificado gerando no gânglio caranguejo stomatogastric. Nós demonstramos o carregamento desses neurônios com a fluorescente sensíveis à voltagem corante Di-8-ANEPPQ e mostramos como a imagem da atividade de corante neurônios carregados usando a velocidade MiCAM02 alta e alta resolução da câmera CCD do sistema de imagem. Nós demonstramos a análise dos dados de imagem gravados usando o software de imagem BVAna associado com o sistema de imagem MiCAM02. As imagens sensíveis à voltagem simultânea de corantes da atividade detalhada de múltiplos neurônios no gânglio de caranguejo stomatogastric aplicada juntamente com as técnicas tradicionais de eletrofisiologia (gravações intracelular e extracelular) abre radicalmente novas oportunidades para a compreensão de como padrão de trabalho gerador central de redes neurais.
Protocolo
1. Preparação do Caranguejo Sistema Nervoso Stomatogastric
Adulto Cancer pagurus L. foram obtidas de fontes locais (Newcastle University, Dove Marine Laboratories) e mantidos em filtrada, a água do mar aerada (10-12 ° C). Animais foram anestesiados por embalagem-las em gelo por 20-40 min antes da dissecção. Usamos isolado stomatogastric sistemas nervoso (STNS) 1. O STNS foi preso em um elastômero de silicone revestido (ELASTOSIL RT-601, Wacker, Munique, Alemanha), placa de Petri e continuamente superfused (7-12 mL / min) com solução salina refrigerada (10-13 ° C). Soro fisiológico consistiam (mMol * l-1): NaCl, 440; MgCl 2, 26; CaCl 2, 13; KCl, 11; trisma base, 10; ácido maleico, 5. Salina foi mantido a uma temperatura constante de 11-13 ° C e em pH 7,4-7,6.
As etapas detalhadas da dissecção STNS e preparação, incluindo a desheathing do gânglio stomatoastric (STG), são apresentados no artigo JOVE por Guttierez e Grashow 1. Todos os experimentos foram realizados em conformidade com a Directiva Europeia Conselho das Comunidades, de 24 de Novembro de 1986 (86/609/CEE). Figura 1A mostra um diagrama esquemático do STNS e Figura 1B mostra um típico STG desheathed ter seus neurônios dispostos como um semicírculo plana na parte posterior do gânglio.
Placa de Petri com o STNS é fixo para a plataforma operacional do microscópio de imagem (BW51 WI; Olympus, Tokyo, Japan), com massa de modelar. Ambos, o estágio do microscópio e do microscópio são montados sobre uma mesa de vibração isolada (Scientifica, Uckfield, UK) para evitar artefatos movimento durante a gravação óptica. Os padrões motores gerados no gânglio stomatogastric (STG) são monitorizados usando gravações extracelular 2-4. Isto é feito através dos seguintes passos:
- Um compartimento vaselinas baseado cilíndrica é construído em torno de uma secção do nervo motor principal (lvn) para isolar eletricamente o nervo do banho (isto é feito no palco antes da dissecção placa de Petri é colocado sobre a plataforma operacional do microscópio de imagem ).
- Um dos dois fios de aço inoxidável eletrodo é colocado neste compartimento, o outro no banho como um eletrodo de referência.
- O sinal diferencial é gravado, filtrado e amplificado com um amplificador diferencial AC (Univ. Kaiserslautern, Alemanha).
- A atividade motora do gânglio é monitorado usando um osciloscópio (DL708E; Yokogawa, Tóquio, Japão) e, adicionalmente, é gravado usando uma placa de aquisição de dados (Power CED, 1401, Cambridge Electronic Design, Cambridge, UK) e os de Spike 2 v6.10 software (Electronic Design Cambridge, Cambridge, UK). Os arquivos são analisados de Spike 2 v6.10 (Electronic Design Cambridge, Cambridge, UK).
2. Preparação da solução corante
Usamos o fluorescente sensíveis à voltagem corante Di-8-ANEPPQ (Cambridge Bioscience) 5, que tem uma carga positiva dupla que facilita o carregamento do corante através de microeletrodos usando pulsos de corrente positiva. A solução corante deve ser protegido da luz, tanto quanto possível. A solução corante é preparada como segue:
- 5 mg de corante é misturado com 1 mL de ácido F-127 PLURONIC em DMSO solução (Invitrogen).
- O frasco de plástico contendo o corante dissolvido é centrifugado por 20 minutos a 12.000 rotação / minuto em microcentrífuga Sigma 14/01 (Sigma, Osterode, Alemanha) para separar as partículas maiores corante que pode obstruir os microeletrodos.
- O sobrenadante (200 mL em cima) da solução de corante é separada usando uma pipeta e armazenado em um frasco plástico separado. Ambos os frascos estão envoltos em papel alumínio para evitar exposição à luz.
- A solução corante é congelado a -20 ° C.
- Antes de usar a solução de tintura é derretida, colocando o frasco fechado e envolto em água morna (25 ° C) de água por 10-15 minutos.
3. Corante por injeção intracelular utilizando Microeletrodos da Sharp
Usamos microeletrodos afiada para carregar os neurônios com o corante. Para verificar a carga de corante que usamos o sistema de imagem MiCAM02 (SciMedia, Tóquio, Japão) 6. O sistema de imagem tem duas câmeras CCD: a câmera de RH tem um chip sensor maior (6,4 mm x 4,8 mm) proporcionando uma melhor resolução espacial com a melhor resolução temporal sendo 1,4 ms, a câmera HS tem um menor (2,9 mm x 2,1 mm), mas mais rápido do chip sensor de imagem mais rápido permitindo ter 0,7 ms como a sua melhor resolução temporal. As etapas do processo de carga de corantes são os seguintes:
- Microeletrodos são puxados com um P-97 Flaming - Brown (Sutter Instruments, Novato, CA, EUA) extrator utilizando eletrodo 10 cm de comprimento, 1 mm tubos de diâmetro externo de vidro com filamento (GB100TF 8P, Produtos Ciência, Hofheim, Alemanha). Os eletrodos são puxados para ter uma resistência nofaixa de 25-40 MOhm em KCl 3M (para ajustes de parâmetros apropriados puxando seguir o livro de receitas pipeta fornecido pelo fabricante do extrator eletrodo).
- A solução corante congelado é fundido e uma quantidade muito pequena do que é sugado para dentro de uma agulha Microfil (Microfil - 34G, instrumentos de precisão Mundial, Sarasota, FL, EUA) - o corante sugado enche cerca de 2 / 3 º da agulha Microfil .
- A solução corante na agulha Microfil é injetado na ponta de um microeletrodo. O microeletrodo é colocado em uma caixa escura por 15 minutos.
- O microeletrodo é backfilled com solução de KCl 3M. O eletrodo é então colocado de volta em uma caixa escura eletrodo de armazenamento para outro 10-20 minutos para permitir que a solução corante para alcançar a ponta fina do eletrodo pela sucção da força capilar atuando no microeletrodos.
- O microeletrodo pronto é colocado em um porta-eletrodo e fixada na headstage do amplificador intracelular (IA-251A, Warner Instruments Corporation, Hamden, CT, EUA).
- O amplificador intracelular está ligado à placa de aquisição de dados que fornece um sinal de pulso para conduzir pulsos de corrente para o microeletrodo.
- O microeletrodo é colocado delicadamente na membrana de um neurônio STG usando um manipulador de microeletrodos (PatchStar, Scientifica Ltd, Uckfield, UK). Como a distância de trabalho da objetiva de 10x (UMPLFL10XW, NA 0,30, WD 3,3 milímetros; Olympus Corporation, Tokyo, Japan) do microscópio de imagem é muito pequena, o microeletrodo deve ser posicionado em posição oblíqua (em torno de 30 °) eo movimento do microeletrodo na posição correta requer várias etapas de re-focalização da objetiva do microscópio e movendo o microeletrodo. Para iniciar o microeletrodo é movido em uma posição tal que sua ponta está acima da STG. A objetiva do microscópio é abaixado até a ponta do eletrodo aparece em foco. Então é ainda mais reduzido, mas não tanto para tocar o microeletrodo. O microeletrodo é reduzida até que reaparece no foco do objetivo. Estes passos são repetidos até que os neurônios aparecem claramente no plano de foco do objetivo. Em seguida, o microeletrodo é abaixada até tocar suavemente e perfura a membrana do neurônio STG selecionado. Este é monitorado usando o osciloscópio.
- O eletrodo intracelular é usado para registrar a atividade do neurônio STG selecionados a fim de identificar o neurônio dado o seu perfil de atividade e da relação entre sua atividade ea atividade STG gravado a partir do eletrodo extracelular 2,3,7.
- O amplificador intracelular está ligado em modo de injeção de corrente e é usado por 30 minutos para injetar 10 nA passos positivos atual no microeletrodo que duram um segundo e estão separados por um segundo, sem lacunas injetadas na corrente de microeletrodos. As unidades de corrente injetada as moléculas com carga positiva corante no neurônio gravado. Se o equipamento está disponível múltiplos neurônios podem ser injetadas simultaneamente.
- Dez minutos para o período de injeção e após o final da injeção de corante a propagação dentro do neurônio está marcada. Para fazer isso usamos o sistema de imagem MiCAM02 (SciMedia Ltd, Tóquio, Japão) com o objetivo de 10x e iluminação pela ultra-low fonte de luz halógena ripple (HL-151; Moritex, Tóquio, Japão), através da MSWG2 cubo de filtro (com 480-550 nm de excitação do filtro; Olympus Corporation, Tokyo, Japan). O sistema de imagem está configurado para usar a câmera de RH com 192 pixels de resolução x 128, 40 ms de tempo de imagem, modo 'hbin', e 10 frames por sessão de imagem. Se o enchimento da tintura for bem sucedida a imagem deve mostrar um patch tingida na neurônio ao redor do local do microeletrodo, e este patch tingido deve crescer entre as imagens tiradas depois de 10 minutos e após 30 minutos. Se a difusão do corante é insuficiente após 30 min, mais tempo de injeção é concedido. Alternativamente, um eletrodo novo corante podem ser usados.
- O eletrodo é puxado para fora do neurônio eo neurônio é deixado para descansar por pelo menos 20-30 minutos. Dentro deste tempo, o neurônio seguinte pode ser injetada com corante.
4. Imagem de Neurônios Pintado
A atividade dos neurônios só podem ser visualizados após o procedimento de corante de enchimento. Alternativamente dois ou mais neurônios podem ser preenchidos para a imagem da atividade simultânea de vários neurônios STG. Em princípio, muitas e, possivelmente, todos os neurônios STG pode ser preenchido com corante. A imagem dos neurônios é feito com o sistema Micam 02 imagens usando a câmera de RH. O procedimento da imagem é a seguinte:
- A objetiva do microscópio é alterado e uma alta eficiência na transmissão da luz 20x objetivo (XLUMPLFL20XW/0.95, NA 0,95, WD 2,0 milímetros; Olympus Corporation, Tokyo, Japan) é utilizado para a coleta de dados de imagem. Este objectivo recolhe muito mais luz que a objetiva de 10x e também dá maior ampliação oferecendo uma imagem mais detalhada dos neurônios. Bein g mais luz meio eficiente que a pequena quantidade de corante já é visível com este objetivo e também que podemos usar menor intensidade de luz para a imagem reduzir o dano potencial de fotos que podem ser causados aos neurônios pelo corante.
- Estágio do microscópio de operação é posicionada de tal forma que os neurônios que se destinam a ser trabalhada estão no campo de visão do objetivo eo objetivo é focada neles.
- Os dados de gravação extracelular também é alimentado no sistema de imagem Micam 02 através do seu canal de entrada analógica. Isto permite o fácil relativamente relativas de sinais ópticos e padrões motores correspondente ou extracelularmente picos registrados na fase de análise.
- A Micam sistema 02 é configurado para usar 96 x 64 pixels de resolução com 2,2 ms de tempo de imagens ou 48 x 32 pixels de resolução com 1,5 ms de tempo de imagens. Em ambos os casos o "hbin" configuração pode ser usado se o tingimento dos neurônios não é muito forte.
- O nível de luz é definida o mais baixo possível (ou seja, a tintura nos neurônios deve gerar ainda fluorescência suficiente para a imagem) para evitar a foto de modulação e danos foto dos neurônios registrados.
- A iluminação da sala e todas as fontes de luz restantes estão desligados. Além disso, uma cortina preta pode ser fechado em torno da plataforma de gravação para evitar exposição à luz de fontes externas.
- As sessões de imagem são ajustados para ser entre 4-16 segundos de duração.
- A atividade espontânea dos neurônios tingido é gravado em sessões de imagens diversas.
5. Análise dos dados de imagem óptico
Para analisar os dados de imagem foi utilizado o software BVAna (versão 10,08; SciMedia Ltd, Tóquio, Japão) associado com o sistema de imagem Micam 02. O software suporta a visualização dos dados de imagem e oferece uma gama de ferramentas de análise também. Os passos da análise e interpretação dos dados são os seguintes:
- Uma região apropriada circular de interesse é selecionado em cada neurônios registrados. Normalmente usamos 2-3 regiões de pixel raio de interesse para a investigação de neurônios na 48 pixels de resolução x 32, e 6-8 regiões de pixel raio de interesse para a investigação de neurônios na resolução 96 x 64.
- A suavização temporal dos dados pode ser necessário, especialmente se o corante gera valor relativamente baixo de fluorescência valor de fundo (baixo nos dados indica isso, que pode ser devido ao nível de pouca luz que é usado ou carregamento de corante de baixo nível, por exemplo em uma neurite do neurônio gravado). Normalmente, nesses casos, usamos suavização temporal com 3-5 unidades de tempo.
- Além das gravações ópticas também mostrar a gravação extracelular selecionando para exibir a entrada analógica do sistema de imagens.
- Os parâmetros para a visualização dos dados ópticos e de entrada analógica deve ser definida de forma adequada, a fim de ver todas as gravações na tela do computador.
- Considerando-se as gravações ópticas dos neurônios, o registro extracelular do lvn, ea classificação do neurônio com base na gravação anterior intracelular, é possível determinar a identidade de um neurônio e relacionar sua atividade com as atividades neurais gravados a partir do nervosas.
- Espera-se que as gravações ópticas mostram claramente, e sem a necessidade de uma média de mais vários eventos similares, as atividades neurais correspondentes aos picos registrados extracelularmente e também eventos subliminares tais como inibidores potenciais pós-sinápticos causados pela atividade de outros neurônios.
- As características dos dados de exportação do software BVAna pode ser usado para exportar as gravações ópticas calculadas para as regiões selecionadas de interesse e também a entrada analógica que contém a gravação do lvn. Os dados exportados podem ser processados e analisados utilizando o software de análise ainda outros dados, bem como (por exemplo, no caso mais simples Microsoft Excel (Microsoft, Redmond, WA, EUA) pode ser usado para visualização e processamento de dados adicionais).
6. Resultados representante
A Figura 2 mostra a gravação simultânea de dois neurônios (LP, lateral pilórica neurônio; PD, pyloric dilatador neurônio) no gerador de padrão pilórica central de um caranguejo STG juntamente com a gravação do lvn. As gravações ópticas dos neurônios LP e PD identificados com base em suas gravações intracelular mostram que na verdade correspondem a estas bem com as gravações extracelular correspondentes aos neurônios LP e PD. Há uma consistente 12 ms de atraso entre as gravações ópticas e lvn de picos de pico (veja inset da Figura 2) devido ao atraso de transmissão axonal entre o gânglio e no site a gravação extracelular. Os dados apresentados também mostra que a atividade neural na soma que corresponde aos picos dos neurônios gravado é facilmente detectável.
s/ftp_upload/2567/2567fig1.jpg "alt =" Figura 1 "/>
Figura 1. Um diagrama) esquemático do sistema nervoso stomatogastric (STNS). CoG gânglio, comissural; OG, gânglio de esôfago; gânglio STG, stomatogastric; stn, nervo stomatogastric; lvn, nervo ventricular lateral. B) O gânglio caranguejo stomatogastric (STG) - a imagem mostra o arranjo semicircular posterior de neurônios STG.
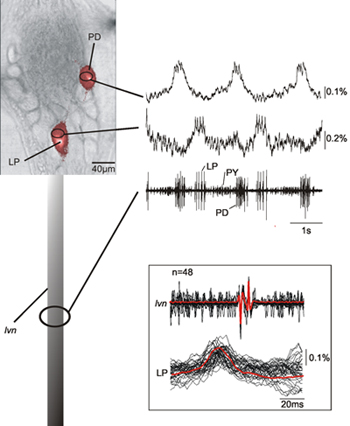
Figura 2. Varredura de gravação única simultânea de uma PD e um neurônio LP juntamente com a gravação do lvn. Os dados mostram que que as gravações óptico e nervo jogo muito bem e que podemos identificar as atividades neurais correspondentes aos picos registrados formam o nervo. A inserção mostra uma sobreposição de várias varreduras de potenciais de ação LP - tanto opticamente e eletricamente gravado - e sua média demonstrando a correspondência entre oticamente e atividades eletricamente gravado. Devido ao fato de que o nosso método de gravação óptica não filtrar os componentes de baixa freqüência dos dados que também são capazes de registrar alterações de membrana lento potencial característica para PD e LP neurônios 14.
Discussão
O corante de tensão sensíveis imagem de 8,9 STG neurônios em combinação com os métodos tradicionais de eletrofisiologia (gravações eletrodo intra e extracelulares) permite uma melhor compreensão de como este pequeno e bem conhecido e ainda complexo funcionamento do sistema neural. O STG é um protótipo de gerador central de padrão (CPG) redes neuronais (que inclui as redes moinho gástrico pilórica e ritmo) 10, 11, assim, uma melhor compreensão das propriedades emergentes funcional do STG também ajudará a entender como, em geral, redes CPG gerar sua funcionalidade em nível de rede. CPG redes desempenham um papel crítico no controle motor 12 e também nas funções cognitivas superiores 13, conseqüentemente, a melhor compreensão de suas propriedades emergentes podem ter um grande impacto em muitas áreas da neurociência.
Divulgações
Agradecimentos
Reconhecemos o apoio da Escola de Ciência da Computação e Faculdade de Ciências, Agricultura e Engenharia da Universidade de Newcastle, pela Universidade Ulm, e pelo SciMedia Ltd (Tóquio, Japão).
Materiais
| Name | Company | Catalog Number | Comments |
| MiCAM02 | SciMedia | Imaging system | |
| BVAna v.10.08 | SciMedia | Data analysis software for the MiCAM 02 imaging system | |
| HL-151 | Moritex, Tokyo, Japan | Ultra-low ripple halogen light source | |
| BX51 WI | Olympus Corporation | Upright microscope for epifluorescence imaging | |
| 20x imaging objective | Olympus Corporation | XLUMPLFL20XW/0.95 | NA 0.95, WD 2.0mm |
| 10x imaging objective | Olympus Corporation | UMPLFL10XW | NA 0.30, WD 3.3mm |
| Filter cube with 480-550 nm excitation filter and 590nm emission filter | Olympus Corporation | MSWG2 | |
| Antivibration table | Scientifica Ltd | 63-534 | |
| PatchStar electrode manipulator | Scientifica Ltd | PS-7000C | Micro-electrode manipulator |
| CED Power 1401 | Cambridge Electronic Design | Data acquisition board | |
| DL708E Oscilloscope | Yokogawa | Intracellular amplifier | |
| AC differential amplifier | University of Kaiserslautern, Germany | Extracellular amplifier | |
| P-97 Flaming – Brown type electrode puller | Sutter Instrument Co. | Electrode puller | |
| Sigma Microcentrifuge 1-14 | Sigma-Aldrich | Centrifuge | |
| Genex Pipettors Mline | Scientific Laboratory Supplies LTD | PIP7774 | PIP7774 |
| Glass micropipette with filament | Science Products | GB100TF 8P | Glass for micr–lectrodes |
| MicroFil – 34G | World Precision Instruments, Inc. | Microfil needle | |
| Spike 2 v6.10 | Cambridge Electronic Design | Electrophysiology software | |
| Di-8-ANEPPQ | Cambridge BioScience | BT61014 | Fluorescent voltage sensitive dye |
| F-127 Pluronic Acid, DMSO | Invitrogen | P-3000MP | Solvent |
| NaCl | Sigma-Aldrich | S9888 | Crab saline component |
| CaCl2 . 2H2O | Sigma-Aldrich | C3881 | Crab saline component |
| KCl | Sigma-Aldrich | P3911 | Crab saline component, electrolyte solution |
| MgCl2 . 6H2O | Sigma-Aldrich | M9272 | Crab saline component |
| Trizma base | Sigma-Aldrich | T1503 | Crab saline component |
| Maleic acid | Sigma-Aldrich | M0375 | Crab saline component |
| Elastosil RT-601 | Wacker, Munich, Germany | Lining of Petri dishes |
Referências
- Gutierrez, G. J., Grashow, R. G. Cancer borealis stomatogastric nervous system dissection. J Vis Exp. , (2009).
- Bartos, M., Nusbaum, M. P. Intercircuit control of motor pattern modulation by presynaptic inhibition. J. Neurosci. 17, 2247-2256 (1997).
- Blitz, D. M., Nusbaum, M. P. Motor pattern selection via inhibition of parallel pathways. J Neurosci. 17, 4965-4975 (1997).
- Stein, W., Smarandache, C. R., Nickmann, M., Hedrich, U. B. Functional consequences of activity-dependent synaptic enhancement at a crustacean neuromuscular junction. J Exp Biol. 209, 1285-12300 (2006).
- Loew, L. Potentiometric dyes: Imaging electrical activity of cell membranes. Pure & Appl Chem. 68, 1405-1409 (1996).
- Tominaga, T., Tominaga, Y., Yamada, H., Matsumoto, G., Ichikawa, M. Quantification of optical signals with electrophysiological signals in neural activities of Di-4-ANEPPS stained rat hippocampal slices. J Neurosci Meth. 102, 11-23 (2000).
- Heinzel, H. G., Weimann, J. M., Marder, E. The behavioral repertoire of the gastric mill in the crab, Cancer pagurus: an in situ endoscopic and electrophysiological examination. J Neurosci. 13, 1793-1803 (1993).
- Zecevic, D., Wu, J. -. Y., Cohen, L. B., London, J. A., Höpp, H. P., Falk, C. X. Hundreds of neurons in the Aplysia abdominal ganglion are active during the gill-withdrawal reflex. J Neurosci. 9, 3681-3689 (1989).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. J Neurosci. 26, 10925-10933 (2006).
- Nusbaum, M. P., Beenhakker, M. P. A small-systems approach to motor pattern generation. Nature. 417, 343-350 (2002).
- Marder, E., Bucher, D. Understanding circuit dynamics using the stomatogastric nervous system of lobsters and crabs. Ann Rev Physiol. 69, 291-316 (2007).
- Grillner, S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 52, 751-766 (2006).
- Yuste, R., MacLean, J. N., Smith, J., Lansner, A. The cortex as a central pattern generator. Nat Rev Neurosci. 6, 477-483 (2005).
- Stein, W. Modulation of stomatogastric rhythms. J Comp Physiol A. 195, 989-1009 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados