É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Rastreamento Crawling neutrófilos Intraluminal, migração transendotelial e Quimiotaxia em tecido por Microscopia intravital Vídeo
Neste Artigo
Resumo
Nós descrevemos um protocolo de brightfield microscopia intravital para medir a dinâmica interações neutrófilos-célula endotelial durante o recrutamento de neutrófilos em resposta à fonte de um chemoattractant neutrófilos in vivo. Neutrófilos rastejando intraluminal, a migração transendotelial e quimiotaxia em tecido muscular do rato cremaster são visualizados com o tempo decorrido, fotografia, vídeo e rastreados com ImageJ.
Resumo
O recrutamento de leucócitos circulantes do fluxo de sangue para o tecido inflamado é um processo crucial e complexa de 1,2 inflamação. No vênulas pós-capilares do tecido inflamado, leucócitos inicialmente tether and roll na superfície luminal da parede venular. Rolando prisão leucócitos no endotélio e passam por adesão firme em resposta a quimiocina ou quimioatrativos outros na superfície venular. Muitos leucócitos aderentes mudar a partir do site inicial de adesão ao site extravasamento juncional no endotélio, um processo denominado intraluminal rastejando 3. Após rastreamento, os leucócitos movem-se através do endotélio (transmigração) e migrar no tecido extravascular em direção à fonte de chemoattractant (quimiotaxia) 4. Microscopia intravital é uma ferramenta poderosa para a visualização de interações leucócito-endotélio celular in vivo e revelando os mecanismos celulares e moleculares do recrutamento de leucócitos 2,5. Neste relatório, nós fornecemos uma descrição completa do uso de microscopia intravital brightfield de visualizar e determinar os processos detalhados de recrutamento de neutrófilos em camundongos músculo cremaster em resposta ao gradiente de uma chemoattractant neutrófilos. Para induzir o recrutamento de neutrófilos, um pequeno pedaço de gel de agarose (~ 1-3 mm de tamanho) contendo chemoattractant neutrófilos MIP-2 (CXCL2, uma quimiocina CXC) ou WKYMVm (Trp-Lys-Tyr-Val-Met-D, um análogo sintético de peptídeo bacteriana) é colocado no tecido muscular adjacente à vênula observado postcapillary. Com o tempo decorrido, fotografia, vídeo e computador software ImageJ, neutrófilos no endotélio rastejando intraluminal, a migração de neutrófilos e transendotelial a migração e quimiotaxia em tecido são visualizados e monitorados. Este protocolo permite a análise quantitativa confiável e de muitos parâmetros, tais como o recrutamento de neutrófilos velocidade rastejando intraluminal, o tempo de transmigração, tempo de descolamento, a velocidade de migração, a velocidade de quimiotaxia e índice de quimiotaxia em tecido. Nós demonstramos que a utilização deste protocolo, estes parâmetros recrutamento de neutrófilos pode ser determinado e de forma estável a locomoção única célula convenientemente monitorados in vivo.
Protocolo
1. Preparação de quimioatraente em gel de agarose
- Pipeta de 10 mL de 2 × PBS em um tubo cônico de 50 ml, e aquecer o tubo colocando-o em um copo contendo água quente.
- Pipetar 10 mL de água destilada e adicionar 0,4 g de pó de agarose em outro tubo cônico de 50 mL (com a tampa ligeiramente soltos) e aquecer a mistura ferver até ficar em um forno de microondas (por 1 min ~ em um forno de microondas 700-watt) .
- Adicione o aquecido 2 × PBS para a solução de agarose tubo, redemoinho solução mista e mantê-lo aquecido no copo de água quente.
- Micropipeta solução chemoattractant (por exemplo, 10 ml de 0,5 mg de CXC quimiocinas MIP-2 ou 12 mL de uma WKYMVm mM) na tampa de um tubo Eppendorf de 1,5 mL contendo 3 mL de tinta da Índia e misture bem por aspiração utilizando uma micropipeta (evitar bolha de ar).
- Corte a extremidade da ponta de uma pipeta de 200 mL e 110 mL micropipeta de agarose solução (42 ° C) na tampa e imediatamente misture bem utilizando outra ponta da pipeta (evitar bolhas de ar).
- Armazenar o gel chemoattractant contendo a +4 ° C.
2. Preparação de músculo Cremaster para Microscopia intravital (Figura 1)
- Anestesiar um rato macho adulto por uma injeção ip de uma mistura de xilazina 10 mg / kg e 200 mg de cloridrato / kg cetamina.
- Raspar a área ao longo da veia jugular externa direita e face anterior do escroto com um barbeador elétrico. Após a anestesia, é importante dar atenção e cuidados especiais para o rato anestesiado. A lâmpada de calor pode ser usado para impedir o mouse de hipotermia. O mouse deve estar livre de dor reflexa.
- Faça uma incisão horizontal, encontrar e cateterização da veia jugular utilizando um tubo PE-10 preenchido com solução salina com heparina 100 U / mL. Cateterismo da veia jugular é necessário para a administração de anestésicos e medicamentos adicionais, quando necessário.
- Fixar as pernas traseiras do mouse com fita umbilical com o mouse deitado de barriga para cima em um home-made bordo do músculo cremaster (Figura 1).
- Conectar a placa para um circulador de água 37 ° C para manter o músculo cremaster eo corpo do mouse quente.
Nota: Todos os procedimentos 2,6-2,14 deve ser realizada muito gentilmente 5.
- Faça uma incisão na pele escrotal para expor o músculo cremaster esquerda. Dissecar cuidadosamente o músculo da fáscia associados.
- Superfuse o músculo cremaster com 37 ° C-aquecido bicarbonato-buffered saline (131,9 NaCl, 4,7 KCl, 1,2 MgSO 4, 20 NaHCO 3, em mM, pH 7,4) usando uma bomba peristáltica.
- Amarre uma sutura 4-0 para a extremidade distal do músculo cremaster para segurá-la para baixo sobre o pedestal de vidro clara visualização da placa do músculo cremaster.
- Cauterizar o músculo cremaster longitudinalmente. Com sutura 4-0, mantenha o plano muscular e fixá-lo ao longo das bordas sobre o pedestal. Separar o testículo e epidídimo do músculo subjacente e movê-los para dentro da cavidade abdominal.
- Superfuse o músculo em ~ 0,6 ml / min com o tampão de perfusão 37 ° C-aquecido e cobrir o músculo exposto com uma lamela de vidro 22 × 22 mm.
- Coloque a placa do músculo cremaster no palco microscópio, examine o músculo sob o microscópio, encontrar uma vênula adequado postcapillary (Selecione a vênula que é reto e não ramificados e tem taxa de cisalhamento normal e um diâmetro de 25-40 mm) e ajustar a câmera de vídeo para permitir a vênula para ser visualizado em uma posição vertical em ambos os lados esquerdo ou direito do monitor de TV.
- Após 30 min de equilíbrio, a gravar as imagens de vídeo da vênula selecionados postcapillary por 5 min como dados de base de controle utilizando um gravador de vídeo.
- Parar o superfusão e retire a lamínula sobre o músculo.
- Coloque um ~ 1-3 mm de tamanho gel chemoattractant contendo na superfície do músculo cremaster em uma área pré-selecionadas 350 mM de e paralela à vênula observado postcapillary, adicione lamela para segurar o gel no local e superfuse o tecido muscular em muito ritmo lento (≤ 10 mL / min) para permitir o estabelecimento de um gradiente de chemoattractant que é liberada lentamente e formado a partir do gel.
- Gravar a imagem de vídeo de 90 min após a adição do gel contendo chemoattractant. Durante a gravação, ajustar e manter o foco microscópio sobre a aderir, rastejando, transmigrando e chemotaxing leucócitos dentro da vênula e no tecido muscular.
- Após a experiência, importe o arquivo de vídeo para um computador para análise.
3. Rastreamento de células Usando ImageJ
- Em um computador, extrair e converter o vídeo para o formato AVI (por exemplo, use software livre bitRipper computador para converter vídeo de DVD para arquivos AVI).
- Use software de edição de vídeo para gerar o filme tempo decorrido. Por exemplo, use o Windows Movie Maker para fazer um filme tempo decorrido (até 1 / 512 ou 1 / 1024 tempo-lapsot taxa de 30 fps) a partir do original, vídeo em tempo real. Converter e salvar o filme tempo decorrido sem compressão de DV-AVI formato.
- Gravar as imagens de um micrômetro de calibração sob o microscópio mesma configuração, importar imagens para o computador, abra as imagens com ImageJ. No ImageJ, o total de pixels aparecem no canto superior esquerdo da tela (por exemplo, 720 × 480 pixels). Medir o tamanho da tela em ambos os eixos X e Y (por exemplo, 200 × 150 mm). A partir daí, calcular o número de pixels por M (por exemplo, x = 720 / 200 = 3,6 pixels / M, e y = 480 / 150 = 3,2 pixels / mm).
- Para importar o filme, abra ImageJ novamente, clique em "File-Import-Usando Movies Quicktime Plug-in", selecionar o filme a ser analisado e clique em "OK" na interface de "abridor de Filme QT".
- Clique em "Rastreamento Plugins-Manual" para rastrear células. Preencha as informações relevantes para os campos no fundo antes de iniciar o rastreamento. Brevemente,
- Intervalo de tempo (em seg) = fold-time-lapse/30 (Por exemplo, um 1020 × lapso de tempo seria 1020-1030 = 34 intervalo de seg / frame).
- x / y = calibração da medição M / pixel usando a calibração da imagem do micrômetro.
- z = 0 calibração (como o mouse músculo cremaster é uma camada extremamente fina de tecidos e células rastejando e migração são aproximadamente 2D sob brilhante-campo transiluminação).
- Pesquisa tamanho quadrado para centrar = 1.
- Dot size / Linha de largura / Tamanho da fonte: eles podem ser ajustados se necessário.
- Selecione um ponto estável e claro como um ponto de referência. Este ponto de referência pode ser qualquer ponto claro e pequenas estruturais que permanece inalterado e estável durante todo o experimento. Clique em "Add Track" para rastrear o ponto de referência do primeiro ao último frame e clique em "Track End". Os dados aparecem na tabela de resultados automaticamente.
- Acompanhar o rastreamento ea migração de neutrófilos, um por um: clique em "Add Track" para rastrear o celular de sua aparência no tecido ao seu desaparecimento em cada quadro e clique em "Track End" para finalizar e salvar os resultados no Microsoft Excel.
4. Análise dos Parâmetros recrutamento de neutrófilos
- Abra o arquivo de resultados no Microsoft Excel, e analisar os dados (se as mudanças de ponto de referência em análise).
- Rastejando intraluminal
- Rastreamento de distância: a distância total da célula rasteja no lúmen do site inicial aderente ao site a transmigração ideal (m).
- Crawling velocidade: rastreamento de distância / tempo (mM / min).
- Migração transendotelial
- Transmigração tempo: a partir do momento da célula começa a transmigrar através do endotélio ao tempo em que o corpo da célula toda é apenas fora da vênula e nenhum corpo celular pode ser visto no lúmen (min ou seg.)
- Tempo de descolamento: a partir do momento em que o corpo da célula toda é apenas fora da vênula (imediatamente após a transmigração) para o ponto no tempo quando a célula perde o contato com a vênula (o retrai cauda) (min ou seg.)
- Quimiotaxia em tecido
- Distância de migração: a soma da distância da célula se move a partir do ponto inicial ao ponto final da migração no tecido (mm).
- Velocidade de migração: a distância de migração no tecido / hora (mM / min).
- Quimiotaxia distância: a soma de células a distância migra no eixo-x no tecido (mm).
- Velocidade de quimiotaxia: quimiotaxia distância / tempo (mM / min).
- Quimiotaxia índice: a taxa de dividir a distância quimiotaxia pela distância de migração no tecido.
5. Resultados representativos:
Embora bightfield microscopia intravital é utilizado para o estudo das interações leucócito-endotélio celular e não podem ser necessariamente para os neutrófilos, que confirmou que, por nossos estudos de histologia, mais de 95% das células recrutadas em neutrófilos tratados com músculos chemoattractant cremaster foram de fato neutrófilos . Neste relatório, usando neutrófilos seletivo quimioatrativos, apresentamos os procedimentos de monitoramento do recrutamento de neutrófilos in vivo. Especificamente, nós descrevemos um protocolo de rastreamento rastreamento de neutrófilos intraluminal, a migração transendotelial, e quimiotaxia em cremaster tecido muscular em ratos anestesiados com lapso de tempo de microscopia intravital de vídeo e ImageJ. O chemoattractant contendo gel agarose no músculo cremaster libera lentamente chemoattractant e permite um gradiente chemoattractant a ser estabelecida no tecido. Chemoattractant neutrófilos induz interações neutrófilos-célula endotelial em cremastérico vênulas pós-capilares em camundongos. Todo o experimento é visualizado sob um microscópio de campo claro vertical intravital com imagens de vídeo projetadas por uma câmera de vídeo de cor para um monitor de TV e gravado por um gravador de vídeo. Nós determinamos os neutrófilosrastejando intraluminal, a migração transendotelial e migração e quimiotaxia em tecido muscular em resposta à neutrófilos chemoattractant MIP-2 e WKYMVm preparada em gel de agarose (Figura 2). Descobrimos que MIP-2 (0,5 mM) e WKYMVm (0,1 mM) provocou rastejando intraluminal de neutrófilos em velocidade similar, a migração de neutrófilos transendotelial e desprendimento da vênula de comprimento comparável de tempo, a migração de neutrófilos e quimiotaxia no tecido muscular em quase a mesma velocidade e com índices similares quimiotaxia de neutrófilos (P> 0,05, teste t de Student).
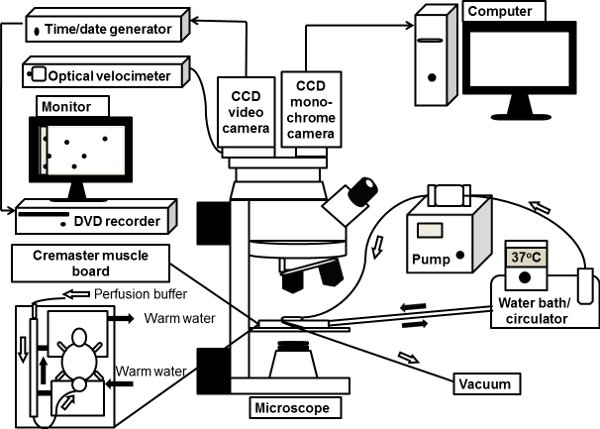
Figura 1. A ilustração esquemática de um sistema de microscópio intravital. O mouse músculo cremaster é exteriorizado no pedestal visualização clara de cremaster bordo muscular no palco microscópio e superfused com 37 ° C-aquecido bicarbonato tampão salina. O microscópio na posição vertical é conectado com uma câmera de vídeo CCD de cor para brightfield microscopia intravital. A profunda monocromática CCD refrigerado a câmera digital também é conectado à porta microscópio de fluorescência para microscopia intravital, as imagens a partir do qual são diretamente processados por um computador.
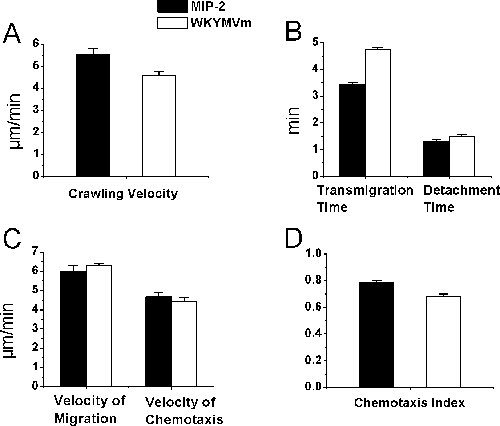
Figura 2. Neutrófilos parâmetros recrutamento de brightfield microscopia intravital. Recrutamento de neutrófilos foi induzida pela liberação gradual de chemoattractant neutrófilos MIP-2 ou WKYMVm na preparação gel agarose colocados 350 mM adjacente à vênula postcapillary. Tempo decorrido dados de vídeo foram analisadas pelo ImageJ após o processamento da gravação de vídeo em tempo real do experimento. Neutrófilos rastejando intraluminal (A), o tempo de transmigração e tempo de descolamento (B), velocidade de migração e velocidade de quimiotaxia em tecido (C), e índice de quimiotaxia em cremaster muscular (D) foram determinados após a administração de MIP-2 ou agarose gel em WKYMVm cremaster muscular em camundongos C57BL / 6 (n = 3, # de células rastreado = 22 (em A e B) e 27 (em C e D), respectivamente, para MIP-2, e = 26 (em A e B) e 44 ( em C e D), respectivamente, para WKYMVm).
Discussão
Microscopia intravital é a ferramenta essencial para revelar os mecanismos celulares e moleculares do recrutamento de leucócitos durante a inflamação. Visualização quantitativa para a determinação das interações leucócito-endotélio celular na microvasculatura de tecidos translúcido como o músculo cremaster e mesentério continua sendo o padrão ouro para a aplicação da técnica 1,5. A microscopia intravital convencionais brightfield tem muitas características únicas técnicas e os mecanismos...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por uma bolsa de investigação da Canadian Institutes of Health Research (CIHR, MOP-86749). L. Liu é um receptor de CIHR New Investigator Award (MSH-95374).
Materiais
Tabela: materiais, reagentes e equipamentos específicos
| Nome do reagente / equipamentos | Companhia | Número de catálogo | Comentários |
| Tubos de polietileno, PI10 | Becton Dickinson | 427401 | ID 0,28 milímetros × 0,61 milímetros OD |
| Nanquim | Speedball Art | Super Preto | Pigmentos de carbono não 100% preto corantes |
| Cautério | Aaron Medical | AA03 | |
| Xilazina | Bayer HealthCare, Bayer Inc. | DIN 02169592 | |
| Cloridrato de cetamina | Bioniche Animal Health Canada, Inc. | DIN 01989529 | |
| MIP-2 recombinante murino | R & D Systems | 452-M2 | |
| WKYMVm | Phoenix Pharmaceuticals, Inc. | 072-12 | |
| Agarose | Invitrogen | 15510-027 | Ultrapura |
| Heparina | Sigma | H-3393 | |
| Microscópio vertical | Olimpo | BX61WI | |
| Câmera de vídeo 3CCD cor | SONY | DXC-990 | |
| HD-DVD gravador de vídeo | LG Electronics Inc. | RH398H-M | |
| Monitor de TV | LG Electronics Inc. | 22LG30 | |
| Circulador de água | Thermo Scientific | DC10 HAAKE | |
| Bomba peristáltica | Gilson; Pharmacia | Gilson MINIPULS 3; Pharmacia P-3 | |
| Cremaster bordo muscular | Universidade de Saskatchewan | Home-made |
Referências
- Liu, L., Kubes, P. Molecular mechanisms of leukocyte recruitment: organ-specific mechanisms of action. Thromb. Haemost. 89, 213-220 (2003).
- Petri, B., Phillipson, M., Kubes, P. The physiology of leukocyte recruitment: an in vivo perspective. J. Immunol. 180, 6439-6446 (2008).
- Phillipson, M. Intraluminal crawling of neutrophils to emigration sites: a molecularly distinct process from adhesion in the recruitment cascade. J. Exp. Med. 203, 2569-2575 (2006).
- Wong, C. H., Heit, B., Kubes, P. Molecular regulators of leucocyte chemotaxis during inflammation. Cardiovasc. Res. 86, 183-191 (2010).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Bullen, A. Microscopic imaging techniques for drug discovery. Nat. Rev. Drug Discov. 7, 54-67 (2008).
- Hazelwood, K. L. Entering the Portal: Understanding the Digital Image Recorded Through a Microscope. Imaging Cellular and Molecular Biological Functions. , 3-43 (2007).
- Hickey, M. J. L-selectin facilitates emigration and extravascular locomotion of leukocytes during acute inflammatory responses in vivo. J. Immunol. 165, 7164-7170 (2000).
- Cara, D. C., Kubes, P. Intravital microscopy as a tool for studying recruitment and chemotaxis. Methods Mol. Biol. 239, 123-132 (2004).
- Liu, L. LSP1 is an endothelial gatekeeper of leukocyte transendothelial migration. J. Exp. Med. 201, 409-418 (2005).
- Heit, B. PI3K accelerates, but is not required for, neutrophil chemotaxis to fMLP. J. Cell Sci. 121, 205-214 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados