Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Отслеживание нейтрофилов внутрипросветный Crawling, трансэндотелиальной миграции и Хемотаксис в ткани Прижизненное микроскопии видео
В этой статье
Резюме
Мы опишем протокол светлое прижизненной микроскопии для измерения динамических нейтрофилы, эндотелиальные клетки при взаимодействии нейтрофилов вербовки в ответ на источник нейтрофилов хемоаттрактант в естественных условиях. Нейтрофилов внутрипросветный ползать, трансэндотелиальной миграцию и хемотаксис в мышечной ткани мышей кремастер визуализируются с временем истек фотографии видео и отслеживается с ImageJ.
Аннотация
Вербовки циркулирующих лейкоцитов из крови к воспаленной ткани является важным и сложным процессом воспаления 1,2. В посткапиллярных венул воспаленных тканей, лейкоцитов первоначально троса-н-ролл на просвета поверхности венул стене. Роллинг лейкоцитов ареста на эндотелий и пройти фирмы адгезии в ответ на хемокинов или других хемоаттрактантов на венул поверхности. Многие приверженцем лейкоцитов переселиться из начальном участке адгезией к соединительного сайт кровоизлияние в эндотелия, процесс, который называют внутрипросветный ползком 3. После сканирования, лейкоциты перемещаются по эндотелия (переселение) и мигрировать в ткани внесосудистое к источнику хемоаттрактант (хемотаксис) 4. Прижизненные микроскопия является мощным инструментом для визуализации лейкоцитов эндотелиальных взаимодействий клетка в естественных условиях и выявление клеточных и молекулярных механизмов лейкоцитов вербовки 2,5. В этом докладе, мы предоставляем полное описание использования светлого прижизненной микроскопии для визуализации и определяет конкретные процессы нейтрофилов набора мышечной мыши кремастер в ответ на градиент нейтрофилов хемоаттрактант. Для стимулирования нейтрофилов найма, небольшой кусок геля агарозы (~ 1 мм, 3 размера), содержащие нейтрофилов хемоаттрактант MIP-2 (CXCL2, хемокинов CXC) или WKYMVm (Trp-Lys-Tyr-Val-D-Met, синтетический аналог бактериальных пептид) помещается на мышечной ткани, прилегающих к наблюдали посткапиллярных венулы. С течением времени, истек фотографии видео-и компьютерные программы ImageJ, нейтрофилов внутрипросветный ползет по эндотелия, нейтрофилов трансэндотелиальной миграция и миграция и хемотаксис в ткани визуализируются и отслеживаться. Этот протокол позволяет надежно и количественного анализа многих нейтрофилов параметры набора таких как внутрипросветный скорость сканирования, переселение время, отряд время миграция скорости, хемотаксис скорости и хемотаксис индекса в ткани. Мы показываем, что с помощью этого протокола, эти параметры набора нейтрофилов может быть стабильно и определяется одним передвижения ячейки удобно отслеживать в естественных условиях.
протокол
1. Подготовка хемоаттрактант в агарозном геле
- Внесите 10 мл 2 х PBS в 50-мл коническую трубку, и согреться трубке, поместив его в стакан с горячей водой.
- Внесите 10 мл дистиллированной воды и добавляют 0,4 г порошка агарозы в другой 50-мл коническую трубку (с ее вершины слегка ослаблены) и нагревайте смесь до кипения только в микроволновой печи (в течение ~ 1 мин в 700-Вт микроволновая печь) .
- Добавить нагревается 2 × PBS в агарозном решение трубки, вихревые смешанный раствор и держать его в теплой стакан горячей воды.
- Микропипетки хемоаттрактант решения (например, 10 мкл 0,5 мкг CXC хемокинов MIP-2 или 12 мкл 1 мМ WKYMVm) в крышку 1,5 мл Eppendorf пробирку, содержащую 3 мкл тушью и хорошо перемешать стремлением использовании микропипетки (избегайте воздушный пузырь).
- Отрежьте кончик конце 200-мкл кончика пипетки и микропипетки 110 мкл агарозном решение (42 ° С) в крышке и сразу хорошо перемешать с использованием другого кончика пипетки (избегайте воздушных пузырей).
- Магазин хемоаттрактант содержащих гель при температуре +4 ° С.
2. Подготовка мышц Кремастер для Прижизненное микроскопии (рис. 1)
- Обезболить взрослого самца мыши, IP-инъекция смеси 10 мг / кг ксилазина и 200 мг / кг кетамина гидрохлорид.
- Бритье области за правой наружной яремной вены и передняя поверхность мошонки с электрической бритвой. После анестезии, очень важно уделять особое внимание и заботу к анестезии мыши. Тепло лампы может быть использован для предотвращения мышь от переохлаждения. Мышь должна быть свободна от боли рефлекс.
- Сделать горизонтальный надрез, найти и катетеризации яремной вены использованием ПЭ-10 трубки заполнены 100 ЕД / мл гепарина физиологического раствора. Катетеризация яремной вены необходимо для управления дополнительными анестетиков и наркотиков, когда это требуется.
- Fix мыши задние ноги с пупочной лента с мышью лежал лицом вверх на самодельных кремастер мышц плате (рис. 1).
- Подключение платы к 37 ° С воды циркуляционный держать мышцы кремастер и мышь тело в тепле.
Примечание: Все процедуры от 2,6 до 2,14 должны выполняться очень нежно 5.
- Сделайте разрез на мошонке кожи подвергать мышцу левого кремастер. Осторожно рассекают мышцы от связанных фасции.
- Переливать мышц кремастер с 37 ° C-нагревается гидрокарбонатно-солевой буфер (131,9 NaCl, 4,7 KCl, 1,2 MgSO 4, 20 NaHCO 3, в мМ, рН 7,4) с помощью перистальтического насоса.
- Tie 4-0 шва до дистального конца мышцы кремастер провести его на пьедестал ясно стекла просмотра борту мышцы кремастер.
- Cauterize мышц кремастер продольно. С 4-0 шва, удерживайте мышцы плоскими и закрепите его по краям на пьедестале. Отдельные яичка и придатка из основных мышц и переместить их в брюшной полости.
- Переливать мышц при ~ 0,6 мл / мин при 37 ° С разогреть перфузии буфера и крышки подвергаются мышцы с 22 × 22 покровного стекла мм.
- Место борту кремастер мышцы на столике микроскопа, исследовать мышцы под микроскопом, найти подходящую посткапиллярных венулы (Выберите венулы, что прямая и неразветвленные и нормальной скоростью сдвига и диаметром 25-40 мкм) и настроить видеокамеру чтобы венулы, чтобы быть визуализированы в вертикальном положении на левой или правой части телевизора.
- После 30 мин равновесия, записать видео-изображения выбранного посткапиллярных венулы в течение 5 мин в качестве базовых контроль данных с использованием видеомагнитофона.
- Стоп superfusion и удалить покровное на мышцы.
- Место ~ 1 мм, 3 размера хемоаттрактант-геля на поверхности мышц кремастер в заданный район 350 мкм от и параллельно наблюдается посткапиллярных венулы, добавьте покровное провести гель на месте и переливать мышечной ткани в очень медленно (≤ 10 мкл / мин), чтобы позволить создание градиента хемоаттрактант, который медленно освобождается и формируется из геля.
- Запись видеоизображения в течение 90 мин после добавления хемоаттрактант содержащего геля. Во время записи, настроить и сохранить микроскопом сосредоточиться на соблюдении, ползание, переселяющимся и chemotaxing лейкоцитов в венулы и в мышечной ткани.
- После эксперимента, импортировать видео файл на компьютер для анализа.
3. Сотовые Отслеживание Использование ImageJ
- На компьютере, извлекать и конвертировать видео в AVI-формате (например, использование свободных bitRipper компьютерного программного обеспечения для преобразования DVD видео в файл AVI).
- Используйте программное обеспечение для редактирования видео, для создания временных истек кино. Например, можно использовать Windows Movie Maker, чтобы времени истек фильм (до 1 / 512 или 1 / 1024 покадровойт 30-кадр ставка) от оригинала, в реальном времени видео. Преобразование и сохранение несжатых времени истек фильм DV-AVI формате.
- Запись изображения калибровки микрометра под микроскопом же настройки, импорт изображений в компьютер, откройте изображение с ImageJ. В ImageJ, общее число пикселей на верхней левой части экрана (например, 720 × 480 пикселей). Измерьте размер экрана в обоих X и Y осей (например, 200 × 150 мкм). Исходя из этого, подсчитать количество пикселей в мкм (например, х = 720/200 = 3,6 пикселей / мкм, а у = 480/150 = 3,2 пикселей / мкм).
- Чтобы импортировать кино, открытые ImageJ еще раз, нажмите "Файл-Импорт-Использование Quicktime фильмы Плагин", выбрать фильм, которые будут проанализированы и нажмите кнопку "OK" на стыке "QT фильм открывалка".
- Нажмите кнопку "Плагины-Ручной отслеживания", чтобы отслеживать клеток. Заполните соответствующую информацию в поля, на дне до начала отслеживания. Короче говоря,
- Временной интервал (в секундах) = fold-time-lapse/30 (например, 1020 × покадровой будет 1020/30 = 34 сек / кадр интервала).
- х / у = калибровки мкм / пиксел измерения с использованием калибровки образ микрометра.
- г калибровка = 0 (как мышцы мыши кремастер является чрезвычайно тонкий слой ткани и клеточных ползать и миграции примерно 2D при ярком поле просвечивание).
- Поиск квадратных размеров для центрирования = 1.
- Dot размер / Line ширина / Размер шрифта: они могут быть скорректированы в случае необходимости.
- Выберите стабильные и четкие точки, точки отсчета. Эта контрольная точка может быть любой четкие и небольшие структурные такой степени, что остается неизменным и стабильным на протяжении всего эксперимента. Нажмите кнопку "Добавить трек", чтобы отслеживать точки отсчета от первого до последнего кадра и нажмите кнопку "Конец пути". Данные появляются на таблицу результатов автоматически.
- Трек ползать и миграции нейтрофилов один за другим: нажмите кнопку "Добавить трек", чтобы отслеживать клетки от ее появления в ткани к его исчезновению в каждом кадре и нажмите кнопку "Конец пути", чтобы закончить и сохранить результаты в Microsoft Excel.
4. Анализ нейтрофилов Параметры Набор
- Откройте файл результатов в Microsoft Excel, а также анализировать данные (принять изменения точкой отсчета в анализе).
- Внутрипросветный сканирование
- Сканирование расстояние: общее расстояние клетка ползет в просвете от начальной приверженцем сайт оптимального места переселения (мкм).
- Сканирование Скорость: ползком расстояние / время (мкм / мин).
- Трансэндотелиальной миграции
- Переселение время: с того времени, клетка начинает переселяться через эндотелий в то время, когда все тело ячейка находится совсем рядом с венулы и не тело клетки можно увидеть на просвет (мин или сек).
- Отряд время: с того времени, все тело ячейка находится совсем рядом с венулы (сразу после переселения) в момент времени, когда клетка теряет контакт с венулы (хвост втягивается) (мин или сек).
- Хемотаксис в ткани
- Миграция расстояние: сумма расстояния клетка переходит от начальной точки до конечной точки миграции в ткани (мкм).
- Скорость миграции: миграция в тканях расстояние / время (мкм / мин).
- Хемотаксис расстояние: сумма расстояния клетка мигрирует в оси Х в ткани (мкм).
- Скорость хемотаксис: хемотаксис расстояние / время (мкм / мин).
- Хемотаксис индекс: отношение деления хемотаксис расстояния миграции расстояние в ткани.
5. Представитель Результаты:
Хотя bightfield прижизненной микроскопии для исследования лейкоцитов эндотелия взаимодействия клеток и, возможно, не обязательно для нейтрофилов, мы подтвердили, что, по нашим исследования гистологии, более 95% от набранных клетки нейтрофилов хемоаттрактант обработанных мышцы кремастер действительно нейтрофилов . В этом докладе, используя нейтрофилов-селективные хемоаттрактантов, мы представляем процедуры отслеживания набора нейтрофилов в естественных условиях. В частности, мы описываем протокол отслеживания нейтрофилов внутрипросветный ползать, трансэндотелиальной миграцию и хемотаксис в кремастер мышечной ткани у мышей под наркозом использованием покадровой прижизненной микроскопии видео и ImageJ. Хемоаттрактант содержащих агарозном гель на мышцы кремастер медленно выпускает хемоаттрактант и позволяет хемоаттрактант градиент, который будет создан в тканях. Нейтрофилов хемоаттрактант побуждает нейтрофилы, эндотелиальные взаимодействия ячейку в cremasteric посткапиллярных венул у мышей. Весь эксперимент визуализируется при вертикальном светлое прижизненной микроскоп с видео-изображения, проецируемые на цветная камера видео на экран телевизора и записаны видеомагнитофон. Мы определили нейтрофиловвнутрипросветный ползать, трансэндотелиальной миграция и миграция и хемотаксис в мышечной ткани в ответ на нейтрофилов хемоаттрактант MIP-2 и WKYMVm подготовлен в агарозном геле (рис. 2). Мы обнаружили, что MIP-2 (на 0,5 мкМ) и WKYMVm (на 0,1 мм) вызвал нейтрофилов внутрипросветный ползком на аналогичных скоростей, нейтрофилов трансэндотелиальной миграции и отрыва от венулы за сопоставимый период времени, миграцию нейтрофилов и хемотаксис в мышечной ткани почти той же скоростью и с аналогичными хемотаксис нейтрофилов индексы (Р> 0,05, студент т теста).
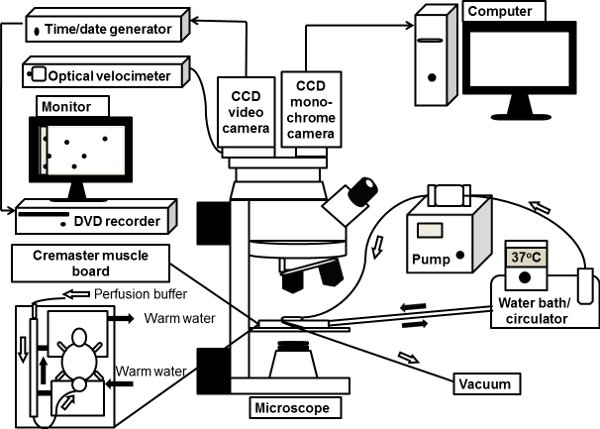
Рисунок 1. Схематическое изображение прижизненной системы микроскопа. Мышцы мыши кремастер является экстериоризируется на пьедестал ясно просмотра кремастер мышц доску на столик микроскопа и superfused с 37 ° C-нагревается гидрокарбонатно-солевой буфер. Прямой микроскоп связано с видео CCD цветная камера для микроскопии светлого прижизненной. Монохромный глубокого охлаждения CCD цифровой камеры также связан с микроскопом порт для флуоресцентной прижизненной микроскопии, изображения с которых непосредственно обработан на компьютере.
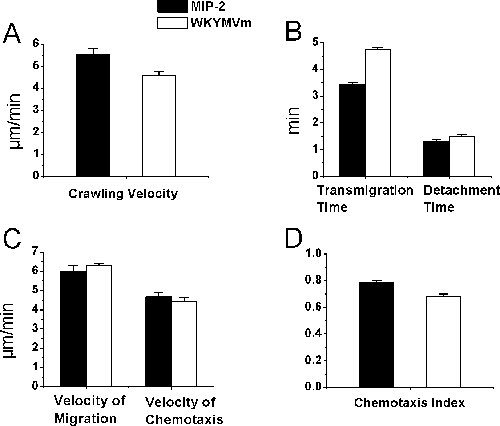
Рисунок 2. Нейтрофилов набора параметров светлое прижизненной микроскопии. Нейтрофилов набора было вызвано постепенное высвобождение нейтрофилов хемоаттрактант MIP-2 или WKYMVm в подготовке агарозном геле размещены 350 мкм, прилегающих к посткапиллярных венулы. Времени истек видео данных были проанализированы ImageJ после обработки записи в реальном времени видео эксперимента. Нейтрофилов внутрипросветный ползком (), время переселения и отряд времени (В), скорость миграции и хемотаксиса скорость в ткань (C), и хемотаксис индекс в кремастер мышцы (D) были определены после введения MIP-2 или WKYMVm агарозном гель на кремастер мышцы в C57BL / 6 мышей (п = 3, # гусеничных клетки = 22 (в А и В) и 27 (на С и D), соответственно, для MIP-2, а = 26 (в А и В) и 44 ( в С и D), соответственно, для WKYMVm).
Обсуждение
Прижизненные микроскопия является существенным инструментом для выявления клеточных и молекулярных механизмов лейкоцитов вербовки во время воспаления. Количественные визуализации для определения лейкоцитов эндотелиальных клеток взаимодействий в микроциркуляторном русле полупр?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана исследовательский грант Канадского института исследований в области здравоохранения (CIHR, СС-86749). Л. Лиу является получателем CIHR Новая премия следователя (MSH-95374).
Материалы
Таблица: Материалы, специальные реагенты и оборудование
| Название реагента / оборудование | Компания | Номер в каталоге | Комментарии |
| Полиэтиленовые трубы, PE10 | Becton Dickinson | 427401 | ID × 0,28 мм OD 0.61mm |
| Тушь | Speedball искусства | Super Black | 100% углерода черного пигмента-нет красителей |
| Прижигание | Аарон Медицинские | AA03 | |
| Ксилазин | Bayer HealthCare, Bayer ООО | DIN 02169592 | |
| Кетамин гидрохлорид | Bioniche здоровья животных Канаде, Inc | DIN 01989529 | |
| Мышей рекомбинантным MIP-2 | R & D Systems | 452-М2 | |
| WKYMVm | Phoenix Pharmaceuticals, Inc | 072-12 | |
| Агароза | Invitrogen | 15510-027 | Ultrapure |
| Гепарин | Сигма | H-3393 | |
| Вертикальный микроскоп | Олимп | BX61WI | |
| 3CCD цветная видеокамера | SONY | DXC-990 | |
| HD-DVD, видеомагнитофон | LG Electronics ООО | RH398H-М | |
| Экран телевизора | LG Electronics ООО | 22LG30 | |
| Вода циркулятор | Thermo Scientific | Haake DC10 | |
| Перистальтический насос | Gilson; Pharmacia | Gilson MINIPULS 3; Pharmacia С-3 | |
| Кремастер мышц борту | Университет Саскачевана | Самодельный |
Ссылки
- Liu, L., Kubes, P. Molecular mechanisms of leukocyte recruitment: organ-specific mechanisms of action. Thromb. Haemost. 89, 213-220 (2003).
- Petri, B., Phillipson, M., Kubes, P. The physiology of leukocyte recruitment: an in vivo perspective. J. Immunol. 180, 6439-6446 (2008).
- Phillipson, M. Intraluminal crawling of neutrophils to emigration sites: a molecularly distinct process from adhesion in the recruitment cascade. J. Exp. Med. 203, 2569-2575 (2006).
- Wong, C. H., Heit, B., Kubes, P. Molecular regulators of leucocyte chemotaxis during inflammation. Cardiovasc. Res. 86, 183-191 (2010).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Bullen, A. Microscopic imaging techniques for drug discovery. Nat. Rev. Drug Discov. 7, 54-67 (2008).
- Hazelwood, K. L. Entering the Portal: Understanding the Digital Image Recorded Through a Microscope. Imaging Cellular and Molecular Biological Functions. , 3-43 (2007).
- Hickey, M. J. L-selectin facilitates emigration and extravascular locomotion of leukocytes during acute inflammatory responses in vivo. J. Immunol. 165, 7164-7170 (2000).
- Cara, D. C., Kubes, P. Intravital microscopy as a tool for studying recruitment and chemotaxis. Methods Mol. Biol. 239, 123-132 (2004).
- Liu, L. LSP1 is an endothelial gatekeeper of leukocyte transendothelial migration. J. Exp. Med. 201, 409-418 (2005).
- Heit, B. PI3K accelerates, but is not required for, neutrophil chemotaxis to fMLP. J. Cell Sci. 121, 205-214 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены